Method Article
AAV2'nin Subaraknoid Enjeksiyonu ile Fare Neokortikal Nöronlarının Yaygın Transdüksiyonu
Bu Makalede
Özet
Subaraknoid virüs infüzyonu kullanan adeno ilişkili virüsün yaygın olarak verilmesi için yeni bir teknik tanımlanmıştır. Bu yöntem sadece fare neokortikal nöronlarının yüzeysel katmanlarda yaygın olarak transdüksiyonunu sağlamakla kalmaz, aynı zamanda seçici olmayan bir promotör kullanıldığında bile beşinci katman piramidal nöronlarında transgenin seçici ekspresyonu ile sonuçlanır.
Özet
Rekombinant adeno ile ilişkili virüsler, deneysel biyolojinin birçok alanında, özellikle sinirbilimde ilgilenilen çeşitli genlerin verilmesi ve ekspresyonu için esnek ve güçlü bir araçtır. Belirli bir beyin bölgesinde istenen bir transgenin ekspresyonunu sağlamak için en popüler yöntem, bir AAV vektörünü doğrudan beyin parankimine enjekte etmektir. Bununla birlikte, bu yöntem, bazı in vivo deneyler için gerekli olan yaygın nöronal transdüksiyona izin vermez. Bu makalede, beynin subaraknoid boşluğuna viral infüzyona dayalı olarak fare neokorteksinde yaygın gen ekspresyonu için yeni bir teknik sunuyoruz. Bu nöronal etiketleme yöntemi, yalnızca yetişkin fare yüzeysel neokortikal tabakalarında nöronların yaygın olarak transdüksiyonunu sağlamakla kalmaz, aynı zamanda CAG gibi güçlü bir seçici olmayan promotör kullanıldığında bile yüksek özgüllüğe sahip beşinci katman piramidal nöronların geniş bir popülasyonunda transgenin ekspresyonu ile sonuçlanır. Ayrıca, hücre transdüksiyonu enjeksiyon bölgesinden önemli bir mesafede gerçekleştiğinden, bu yöntem nöronal aktivitenin sonraki optik veya elektrofizyolojik kayıtları için beyin dokusunun korunmasına yardımcı olabilir.
Giriş
Memeli beyni, trilyonlarca sinaps ile devrelere bağlı birçok inhibitör, uyarıcı ve modülatör hücreden oluşur1. Sinirbilimin temel zorluklarından biri, beyin devrelerinin ve davranışlarının organizasyonu ve işlevinde farklı hücre tiplerinin rolünü çözmektir. Beyindeki genetik olarak tanımlanmış hücreleri manipüle etmek, transgenleri tanıtmak ve ifade etmek için yöntemler gerektirir. Viral tabanlı gen dağıtım sistemleri, merkezi sinir sistemine gen iletimi için açık ara en etkili ve basit yöntemdir2. Viral dağıtım sistemleri, genetik bilgiyi bir konakçı hücreyeiletme yeteneğine sahip virüslerin (adenovirüsler, adeno-ilişkili virüsler (AAV'ler), lentivirüsler ve retrovirüsler) replike edilmesine dayanır 2,3.
AAV tabanlı vektörler, hem temel sinirbilim araştırmaları hem de nörolojik hastalıklar için gen terapisi geliştirmek amacıyla, istenen transgenlerin beyindeki hücrelere iletilmesi için en yaygın kullanılan araçlardan biri haline gelmiştir. Diğer virüslerle karşılaştırıldığında, replikasyon kusurlu AAV'ler, onları bu amaçlar için ideal vektörler yapan birçok özelliğe sahiptir. En önemlisi, AAV vektörleri, nöronlar ve glial hücreler gibi bölünmeyen (terminal olarak farklılaşmış) hücreleri verimli bir şekilde dönüştürür ve bu da in vivo2'de yüksek seviyelerde transgen ekspresyonu ile sonuçlanır. Vektörler, in vivo kullanımauygun yüksek fonksiyonel bir titrede kolayca üretilebilir 3,4,5. Daha da önemlisi, adeno ilişkili virüs aracılı gen iletimi in vivo histopatolojik değişiklikler ve vektörle ilişkili toksisite üretmez6. Adenoviral vektörlerin aksine, hayvan modellerinde AAV vektörlerinin in vivo uygulaması genellikle transdüksiyonlu hücrelere karşı konakçı bağışıklık tepkileri ortaya çıkarmaz, bu da beyin parankimi içinde uzun süreler boyunca stabil transgen ekspresyonunu mümkün kılar 2,7,8.
AAV vektörlerinin popülaritesinin bir başka nedeni, benzersiz doku ve hücre tipi tropizmlerine sahip geniş AAV serotipleridizisidir 9,10,11,12,13,14. Farklı AAV serotipleri tarafından eksprese edilen farklı kapsid proteinleri, hücre girişi için farklı hücre yüzeyi reseptörlerinin kullanılmasına ve dolayısıyla spesifik tropizmlereneden olur 10,14.
AAV tropizmi sadece kapsid proteinleri tarafından değil, diğer birçok faktör tarafından da belirlenir14. AAV serotipleri 1, 2, 6, 7, 8 ve 9'un primer kültürde 15,16 hem nöronları hem de astrositleri transdüksiyona uğrattığı, ancak intraparankimal beyin enjeksiyonunu takiben güçlü nöronal tropizm sergilediğigösterilmiştir 17,18. AAV vektör hazırlığı için kullanılan yöntem, aynı serotip için bile sinir hücresi tropizmini etkileyebilir. Örneğin, CsCl ile saflaştırılmış AAV8, intraparankimal beyin enjeksiyonunu takiben güçlü astroglial tropizme sahipken, aynı koşullar altında enjekte edilen iyodiksanol ile saflaştırılmış AAV8, sadece nöronları19 transdüksiyona tabi tuttu. AAV tropizmi, enjekte edilen doz ve hacim14'ten de etkilenebilir. Örneğin, yüksek titreli rAAV2/1, hem kortikal uyarıcı hem de inhibitör nöronları verimli bir şekilde transdüksiyon etti, ancak daha düşük titrelerin kullanılması, kortikal inhibitör nöronların transdüksiyonu için güçlü bir tercihi ortaya çıkardı20.
Bu nedenle, yalnızca kapsid serotipine dayalı olarak sağlam hücre tipi özgüllüğü elde etmek mümkün değildir. Hücre tipine özgü promotörler, AAV kapsidinin geniş doğal tropizminin üstesinden gelmek için kullanılabilir. Örneğin, insan sinapsin I, nöronları21 hedeflemek için kullanılır, CaMKII promotörü, yüksek özgüllüklü20 glutamaterjik uyarıcı nöronlarda transgen ekspresyonunu yönlendirebilir, ppHcrt promotörü, lateral hipotalamus22'deki hipokretin (HCRT) eksprese eden nöronları hedefler, PRSx8 promotörü, dopamin beta-hidroksilaz23'ü eksprese eden noradrenerjik ve adrenerjik nöronları hedefler ve GFAP promotörü, astrosite özgü ekspresyon24'ü çalıştırabilir. Bununla birlikte, bazı hücreye özgü promotörler zayıf transkripsiyonel aktiviteye sahiptir ve yeterli düzeyde transgen ekspresyonusağlayamaz 25. Ayrıca, AAV viral vektörlerine uyan kısa promotörler genellikle hücre tipi özgüllüğünü 1,26 korumaz. Örneğin, bir CaMKII yapısının aynı zamanda inhibitör nöronlarıda dönüştürdüğü gösterilmiştir 12.
Hücre tipi özgüllüğünün (tropizm) yanı sıra, AAV'lerin bir diğer önemli özelliği de transdüksiyon verimliliğidir. Çeşitli AAV serotipleri farklı difüzyon özelliklerine sahiptir. AAV2 ve dört viral vektör beyin parankimi boyunca daha az kolay yayılır ve bu nedenle daha küçük bir alanda transdüksiyona aracılık eder17,27. En yaygın nöronal transdüksiyon AAV serotipleri 1, 9 ve rh.10 11,17,18,19,28 ile gözlenir.
Belirli bir beyin bölgesinde istenen bir transgenin ekspresyonunu sağlamak için en popüler yöntem, AAV vektörünü doğrudan ilgilenilen beyin bölgesine (parankim) enjekte etmektir3. İntraparankimal enjeksiyonu takiben, beyin yoluyla daha etkili difüzyona sahip AAV serotipleri bile tipik olarak enjeksiyon bölgesi 12 çevresinde sadece lokal bir alanı dönüştürür. Ayrıca, intraparankimal enjeksiyon invaziv bir prosedürdür ve ilgilenilen bölgeye bitişik doku hasarına yol açar. Bu nedenle, bu virüs enjeksiyon yöntemi bazı deneysel görevler için uygun değildir. Örneğin, bir veya iki foton mikroskobunun kullanımı da dahil olmak üzere, serbestçe hareket eden hayvanlarda kortikal nöron fonksiyonlarını incelemeyi amaçlayan deneylerde hücrelerin kapsamlı bir şekilde etiketlenmesi oldukça arzu edilir 29,30,31,32.
Burada, yetişkin farelerde neokortikal nöronların yaygın transdüksiyonunu sağlamak ve nöronal aktivitenin müteakip optik veya elektrofizyolojik kayıtları için beyin dokusunu korumak için subaraknoid virüs infüzyonunu kullanan yeni bir adeno-ilişkili virüs enjeksiyon tekniğini açıklıyoruz. Bu yöntem sadece yüzeysel neokortikal katmanlarda nöronların yaygın transdüksiyonunu sağlamakla kalmadı, aynı zamanda CAG gibi güçlü bir seçici olmayan promotör kullanıldığında bile yüksek özgüllüğe sahip beşinci katman piramidal nöronların geniş bir popülasyonunda transgenin ekspresyonu ile sonuçlandı.
Protokol
Deneyler, her iki cinsiyetten 2-4 aylık yetişkin C57Black/6 fareleri üzerinde gerçekleştirildi (Pushchino Yetiştirme Merkezi, RAS Shemyakin-Ovchinnikov Biyoorganik Kimya Enstitüsü Şubesi). Fareler, yiyecek ve su ad libitum ile sıcaklık kontrollü bir vivaryumda (22 ° C ± 2 ° C, 12 saat aydınlık / karanlık döngüsü, ışıklar 08.00 saatte açık) barındırıldı. Tüm deneysel prosedürler, hayvan deneyleri için ARRIVE yönergelerine ve 2010/63/EU Direktifine uygun olarak yürütülmüştür. Çalışma protokolü, IHNA RAS Etik Kurulu tarafından onaylanmıştır (01.02.2022 tarihli protokol N1). Hayvanların çektiği acıyı en aza indirmek ve sonuçların güvenilirliğini sağlamak için her türlü çaba gösterildi.
1. Ameliyat için hazırlık
- Ameliyata başlamadan önce tüm cerrahi aletleri sterilize edin. Ameliyat bölgesini %70 etanol kullanarak temizleyin.
- Anestezi sistemindeki izofluran seviyesini kontrol edin ve gerekirse doldurun. İndüksiyon odasının altına temiz bir kağıt havlu yerleştirin.
- Stereotaksik çerçeveye bir ısıtma yastığı yerleştirin. Pedi temiz bir kağıt havluyla örtün.
- Mikropipet uçlarını, tüpleri, pamuklu çubukları ve virüsle temas eden diğer öğeleri toplamak için %2 çamaşır suyu içeren bir şişe hazırlayın.
- -80 °C dondurucudan bir AAV alikotunu çıkarın ve çözülmesi için buzun üzerine koyun.
2. Şırınga hazırlama
- 5 μL'lik bir Hamilton mikroşırıngasını 33G künt RN iğnesi ile temizleyin. Aspire edin ve ardından% 70 etanol dağıtın. Taze etanol ile 3x tekrarlayın. Fazla etanolü çıkarmak için şırıngayı damıtılmış suyla durulayın. 3x tekrarlayın.
- Pistonu çıkarın ve bir insülin şırıngası kullanarak namluyu flanştan Vazelin yağı ile doldurun. Mikroşırıngada hava kabarcığı olmadığından emin olun.
NOT: Sıkışan hava sıkıştırılabilir ve şırınganın doğruluğunu ve hassasiyetini etkiler. - Pistonu mikroşırıngaya geri koyun ve bir damla yağ dağıtın. Şırıngayı, dağıtılan çözeltinin hacmini izlemek için ölçek görünecek şekilde stereotaksik enjektöre yerleştirin.
3. Farelerin ameliyat için hazırlanması
- Bir fareyi tartın. Fareyi izoflurana bağlı anestezi indüksiyon odasına yerleştirin. %5'e ayarlanmış izofluran buharlaştırıcıyı açın ve akış hızını 250 mL/dk'ya ayarlayın. 5 ila 7 dakika içinde yeterli anestezi derinliğine ulaşılır.
- Cerrahi anestezi seviyesini doğrulamak için, arka pençe ağrılı bir tutam sırasında çırpma ve geri çekilme refleksinin olmadığını ve göz temasında göz kırpma olmadığını kontrol edin.
- Buharlaştırıcı çıkış valfini indüksiyon odasından stereotaksik maskeye geçirin. İzofluranı %1.8-%2.0'ya düşürün ve akış hızını fare ağırlığına göre ayarlayın (25 ila 35 g ağırlığındaki fareler için 70-90 mL / dak).
- Cerrahi anestezi sırasında hipotermiyi önlemek için fareyi indüksiyon odasından çıkarın ve bir ısıtma yastığının (37 °C) üzerindeki stereotaktik aparata yerleştirin. Ön dişleri diş çubuğuna yerleştirin ve ardından hayvan maskesini monte edin.
- Hayvanı dikkatlice kulak çubuklarının üzerine yerleştirin. Stereotaktik aparattaki doğru baş pozisyonu, başın dikey hareketine izin verir, ancak yanal hareketine izin vermez. Hayvanın konumunun sıkıntıya neden olmadığından emin olun. Operasyon boyunca anestezi derinliğini, hayvan solunumunu ve vücut ısısını dikkatlice izleyin.
- Kafayı gözlerden kulakların arkasına doğru tıraş edin. Başın traşlı yüzeyini% 70 etanol ile temizleyerek temizleyin, ardından% 5 alkol iyot çözeltisi ile temizleyin.
- Göz kurumasını önlemek için oftalmik jel uygulayın. Ameliyata bağlı ağrıyı önlemek ve olası inflamatuar yanıtı azaltmak için topikal olarak% 4 lidokain solüsyonu ve deksametazon (4 mg / mL'de 0.02 mL) deri altına uygulayın.
- Steril bir neşter bıçağı ve makasla, kafa derisini açmak için başın orta hattı boyunca 4-5 mm uzunluğunda bir kesi yapın. Kulaklar arasında küçük bir kesi ile başlayın ve ardından kafatasına zarar vermemek için makas kullanarak genişletin.
- Stereotaksik yer işaretlerini görselleştirmek için kafatasının yüzeyini az miktarda% 3 hidrojen peroksit ile temizleyin: bregma ve lambda. % 0.9 NaCl salin ile reaksiyonu hemen durdurun. Kafatasının üstündeki dokuları bir kemik kazıyıcı ile kazıyın.
- Önceden hazırlanmış motorlu enjektörü Hamilton şırınga ile stereotaksik kol üzerine monte edin. Açıkta kalan kafatasına cerrahi bir ışık kaynağı yönlendirin ve mikroskobu bregma üzerine odaklayın.
- Mikroskoptan bakarak, iğnenin üst kısmını doğrudan bregma üzerinde ortalamak için stereotaktik aparatın kolunu manipüle edin.
- İğnenin ucunu kullanarak bregma ve lambda'yı yatay olarak hizalayın ve ardından kolu tekrar bregma'ya getirin ve koordinatları kaydedin. Hedeflenen alanın göreli koordinatlarını hesaplamak için bu bregma koordinatlarını ve ilgilenilen bölgenin atlas koordinatlarını kullanın.
- İğneyi hedeflenen bölgeye hareket ettirin. İğneyi yeni koordinatlarda indirin ve bu konumu işaretleyin. Virüsün yayılmasını göz önünde bulundurarak hedef bölgeye yakın viral mikroenjeksiyon bölgesini seçin.
NOT: Bu, ilgilenilen bölgedeki dokuya zarar vermekten kaçınacaktır. İlgilenilen bölge için aşağıdaki koordinatları kullandık: AP-3.4, ML -2.0 ve viral mikroenjeksiyon için: AP-2.0, ML -1.4. Birincil görsel korteks nöronlarının enfekte olması durumunda yukarıdaki koordinatlar en uygunudur. - Mümkünse, büyük kan damarlarının bulunduğu bölgelerden kaçının. Cerrahi mikroskop, parlak, soğuk ışık aydınlatması ve% 0.9 NaCl salin daldırması altında, kafatasındaki ve beyin yüzeyindeki büyük kan damarları belirgin hale gelmelidir.
4. Virüs enjeksiyonu
- Steril bir diş frezi alın (0,5 - 0,8 mm çapında). Kafatasının yüzeyini cerrahi mikroskopla görüntülerken, manuel olarak (elle) veya bir mikromatkap kullanarak küçük bir kraniyotomi delin. Kafatasına aşırı baskı uygulamamaya özen gösterin.
- Kraniotominin (delik) delinmesi sırasında mikroşırınga iğnesinin hasar görmesini önlemek için kolu yoldan çekin. % 0.9 NaCl tuzlu su daldırması uygulayın ve kemiğin ısınmasını ve dura materyaline zarar vermesini önlemek için aralıklı olarak duraklatın. Kemik tozunu üflemek için basınçlı hava kullanın.
NOT: Aşağıdaki karbür diş frezleri uygundur: armut biçimli (tercihen), yuvarlak silindir ve yuvarlak.- Kemiği frez ile inceltirken, inceltmenin tüm çevre boyunca eşit olduğundan emin olun. Bu, dura materyale zarar vermeden kemiğin çıkarılmasını kolaylaştıracaktır. Bunu yapmak için, başlangıçta yuvarlak uçlu bir frez ve ardından düz uçlu bir frez kullanın. Frezi kemiğe dik tutun; Aksi takdirde, bir taraf diğerinden daha ince olacaktır.
NOT: Ek olarak, frezin boyutu ne kadar küçükse ve gerçekleştirilen kraniyotomi ne kadar küçükse, manipülasyon o kadar karmaşık olacaktır. Hayvanı in vivo çalışma için daha fazla kullanırken daha küçük çaplı (0.5-0.6 mm) bir kraniyotomi yapılması önerilir. Hayvanın beynini ex vivo çalışma için kullanmayı planlıyorsanız, prosedürü basitleştirmek için daha büyük bir kraniyotomi çapı kabul edilebilir.
- Kemiği frez ile inceltirken, inceltmenin tüm çevre boyunca eşit olduğundan emin olun. Bu, dura materyale zarar vermeden kemiğin çıkarılmasını kolaylaştıracaktır. Bunu yapmak için, başlangıçta yuvarlak uçlu bir frez ve ardından düz uçlu bir frez kullanın. Frezi kemiğe dik tutun; Aksi takdirde, bir taraf diğerinden daha ince olacaktır.
- İnceltilmiş kemik yumuşak ve şeffaf olduğunda, delmeyi bırakın. Kemikte yeterince büyük bir girinti oluştuğunda, rotasyonu sık sık durdurun ve kemiğin kalınlığını izleyin. Kemikte çatlakların ortaya çıkması incelmenin yeterli olduğunu gösterir.
- Deliği steril tuzlu su ile yıkayın ve ardından fazla tuzlu suyu pamuklu çubukla çıkarın. Kanca şeklinde uçlu 27G'lik bir iğne ve/veya ince uçlu cımbız kullanarak kalan kemik tabakasını çıkarın. Duraya zarar vermekten kaçının.
- Kafatasının yüzeyini tuzlu suyla nemlendirilmiş steril bir kağıt havlu parçasıyla örtün. Kağıdın üzerindeki fare kafatası yüzeyine temiz, şeffaf bir film parçası yerleştirin.
- Stereotaksik kolu geri hareket ettirin ve mikroşırınga iğnesini doğrudan filmin üzerine yerleştirin. Fazla yağı 2 μL'lik bir hacme ulaşılana kadar dağıtın.
NOT: Yağın nihai hacmi, mikro şırınganın hacmine göre değişebilir. 5 μL 75-RN Hamilton mikro şırınga kullandık. - Enjekte edilen hacim + 2 μL'ye eşit bir virüs hacmini bir parça şeffaf film üzerine pipetleyin.
- Cerrahi mikroskoptan bakarak, iğnenin ucu virüs damlasının merkezinde olana kadar kolu aşağı indirin. Motorlu bir enjektör kullanarak virüsü mikroşırıngaya yükleyin. Mikropipetin ucunu ve şeffaf filmi %2 ağartıcı ile şişeye atın.
- Tuzlu su ile nemlendirilmiş kağıdı kafatasının yüzeyinden çıkarın ve kafatasını pamuklu çubukla kurulayın. İğneyi yerleştirme bölgesinin üzerine yerleştirmek için stereotaksik kolu kullanın.
- İğnenin tıkalı olmadığından emin olmak için bir damla virüs verin. Kanca şeklinde uçlu 30 G'lik bir iğne kullanarak durada küçük bir yarık açın.
NOT: Dura mater içinde mümkün olan en küçük yarığı yapmak önemlidir, böylece iğne ile dura mater arasında virüsün sızabileceği bir boşluk bırakmadan iğnenin girmesine izin verilir. - Şırınganın iğnesini duraya kadar indirin ve derinlik için uygun hesaplamaları yapın. İğnenin korteksin yüzeyine ilk temas ettiği noktaya göre yerleştirmenin kortikal derinliğini tahmin edin.
- İğne ucunu yavaşça kortekse 300 μm derinliğe kadar sokun. Duranın iğneye yapışmasını sağlamak için 2-3 dakika bekleyin ve ardından iğneyi yavaşça 200 μm derinliğe kadar geri çekin. Beyin dokusunun oturması için 2-3 dakika daha bekleyin. Bu, iğnenin durayı yukarı çekmesine ve virüsün yayılması için subdural bir alan yaratmasına neden olur.
NOT: Kortikal hasarı en aza indirmek için 33 G'lik bir iğne veya daha düşük G iğneleri kullanın. Ucun iç çapı ne kadar küçükse, doku geri akışının onu tıkama şansının o kadar yüksek olduğunu unutmayın. Eğimli yerine künt bir iğne kullanmak önemlidir, çünkü künt bir iğne daha kontrollü bir viral çözelti damlasını dışarı atar.- İğne 150-200 μm'ye indirildiğinde dura materden geçmezse ve bunun yerine bükülürse, indirmeyi bırakın. İğneyi kaldırın ve dura materyalinde biraz daha büyük bir kesi yapın, ardından iğneyi tekrar indirmeyi deneyin.
- İğneyi indirirken beyin omurilik sıvısı kesiden aktif olarak sızmaya başlarsa, sızıntısı durana kadar bekleyin; Aksi takdirde, duradan geçen iğneyi kontrol etmek zordur. Fazla beyin omurilik sıvısını bir doku ucuyla kurulayın. Sıvı akışı durduğunda iğneyi kaldırın ve tekrar deneyin.
- Dağıtılan hacmi izlerken viral süspansiyonu 0.06 μL / dak hızında enjekte etmeye başlayın. 1 μL virüs enjekte edin. İğne ve korteks dokusu arasındaki contayı kırmamak için virüsü tek bir derinlikte enjekte edin.
- Sorun Giderme: Enjeksiyonun başlangıcında, beyin yüzeyine virüs geri akışı meydana gelebilir. Enjekte etmeyi durdurun, 2-3 dakika bekleyin ve ardından virüs enjeksiyonuna devam edin. Virüs geri akışı durana kadar bu eylemleri (adımları) tekrarlayın. Virüs ve beyin omurilik sıvıları iğneye yapışacak ve geri akışı önleyecektir.
- Virüsün geri akışını durdurmanın başka bir yolu, korteksin yüzeyine az miktarda agaroz koymaktır. Korteksin nabzını bastıracak ve ayrıca iğneyi kapatmaya yardımcı olacaktır. Ancak pipetin agaroz tarafından tıkanmadığından emin olun.
- İğne indirildiğinde dura materinden tam olarak geçemeyebileceğinden, ancak sadece kısmen, iğnenin bir tarafı duraya sıkıca oturmayabilir ve bu da virüsün geri akışına neden olabilir. Bu durumda, iğneyi dokudan yavaşça çekin ve tekrar indirmeyi deneyin.
- İnfüzyon tamamlandıktan sonra, iğneyi 10 dakika daha hedef yerde tutun. Bu, virüsün enjeksiyon bölgesinden uzağa dağılmasını sağlar. Virüsün iğne yolundan geri akmasını önlemek için iğneyi beyinden yavaşça geri çekin.
- İğne çekme işlemi tamamlandıktan sonra, küçük bir damla virüs vererek tıkalı olmadığını kontrol edin. Cilt kesisini 5-0 emilebilir veya emilmeyen dikişler kullanarak kapatın.
5. Ameliyat sonrası bakım
- Kesi işlemini kapattıktan sonra, topikal olarak antibakteriyel merhem uygulayın. Dehidrasyonu önlemek ve anestezi sonrası iyileşmeyi kolaylaştırmak için deri altına salin (5 mL / kg) ve% 5 glikoz (5 mL / kg) karışımı enjekte edin. Ağrıyı azaltmak için ketoprofen'i kas içine (2.5 mg / kg) enjekte edin.
- Hayvanı bir ısıtma yastığının üzerine yeni bir kafese koyun ve anesteziden çıkana kadar izleyin. Fare reaktif olduktan sonra, hayvanı ev kafesine yerleştirin.
6. Histoloji
- Virüs enjeksiyonundan en geç 21 gün sonra, fareleri adım 3'te tarif edildiği gibi izofluran ile derinlemesine anestezi altına alın.
- Dar bir makas kullanarak göğüs bölgesi boyunca orta hat kesisi (10 -15 mm) yapın ve göğüs boşluğunu ortaya çıkarın. Diyaframı dikkatlice ayırın ve makas kullanarak göğsü açın.
- Sol ventriküle 22G 1 1/2 iğne sokun ve sağ atriyumda makasla bir kesi yapın. 50 mL önceden soğutulmuş 100 mM Fosfat Tamponlu Salin (PBS) ve ardından 100 mL önceden soğutulmuş %10 tamponlu formalin ile perfüz.
- Tüm fare beynini dikkatlice çıkarın. Bunu yapmak için, makas kullanarak kafa derisinin merkezi boyunca sagital bir kesi yapın. Daha sonra, sagital ve lambdoid dikişlerin kesişme noktasından başlayarak burun kemiğine doğru ilerleyerek düz uçlu kemik pense kullanarak kafatası kemiğini parça parça çıkarın. Beyin açıkta kaldığında, koku alma ampullerini kesin, kavisli bir spatula ile beyni rahatlatın ve% 10 tamponlu formalin içeren 50 mL'lik bir tüpe bırakın.
- Beyni bir gecede düzeltin. Doku yapıştırıcısı kullanarak beyin dokusunu bir Vibratomun metal bir platformuna monte edin. Karbon çelik bıçaklar kullanarak ön kısımları 50 μm kalınlığında kesin.
7. İmmün boyama
- 1. Gün
- Beyin dilimlerini 3x 5 dakika boyunca her biri% 0.3 Triton X-100 (PBS-T) içeren 1x PBS ile yıkayın. Bölümleri PBS-T'de oda sıcaklığında (RT) 20 dakika inkübe edin.
- 1x PBS'de% 5 Normal Keçi Serumu (NGS) ve% 0.3 Triton X-100'den oluşan bir bloke edici tampon kullanarak RT'de 1 saat boyunca spesifik olmayan bağlanmayı bloke edin.
- Blokaj tamponunda 1:500 oranında seyreltilmiş parvalbümin veya kalbindin'e karşı birincil antikorlarla bölümleri gece boyunca 4 ° C'de inkübe edin (1x PBS'de% 5 NGS ve% 0.3 Triton X-100).
- 2. Gün
- Bölümleri PBS-T'de 3x 10 dakika yıkayın. Bloke edici tamponda 1:500 oranında seyreltilmiş ikincil antikorlarla (Keçi anti-Tavşan IgG (H + L) Çapraz Adsorbe Edilmiş İkincil Antikor, Alexa Fluor 546) ile RT'de karanlıkta 2 saat inkübe edin (% 5 NGS ve% 0.3 Triton X-100 1x PBS'de).
- Bölümleri 3x PBS'de her biri 5 dakika boyunca 1x yıkayın. Beyin dilimlerini yumuşak bir fırça kullanarak cam slaytlara aktarın.
- Hemen her bölüme 0.1 mL antifade montaj ortamı ekleyin. Dilimleri 22 mm x 50 mm lamel ile örtün.
- Konfokal mikroskobu 20x veya 60x büyütme (A/1.4, yağ) ile yapılandırın. İlgilenilen beyin bölgelerinin çok kanallı görüntülerini elde etmek için 488 nm ve 594 nm dalga boylu lazerler kullanın.
Sonuçlar
Bir pilot deney serisinde, CaMKII promotörü altında EGFP floresan proteini ile kaynaşmış hızlı channelrhodopsin (oChIEF) genini taşıyan AAV2 ile fare neokorteksindeki beşinci katman piramidal nöronları dönüştürmek için geleneksel intrakortikal enjeksiyon yöntemini kullandık. AAV212'nin karakteristik özelliği ile tutarlı olarak, genişliği 1 mm'yi geçmeyen nispeten küçük bir enfeksiyon alanı elde ettik (Şekil 1A). Bununla birlikte, bazı deneylerde, bazı durumlarda beyin yarımküresinin yarısından fazlasının neokorteksini kaplayan AAV2'nin alışılmadık derecede büyük yayıldığını gözlemledik (Şekil 1B). Bu kadar yaygın virüs dağılımının, virüs subaraknoid boşluğa girdiğinde ve beyin omurilik sıvısı (BOS) akımı viral vektörü beyin yüzeyine yaydığında meydana gelebileceğini varsaydık. Bunun, enjeksiyon iğnesi yerleştirme derinliği küçük olduğunda (<200 μm) ve dura materdeki deliğin boyutu iğnenin çapıyla tam olarak eşleştiğinde ve viral partiküllerin geri akışından süspansiyonunu önlediğinde meydana geldiğini belirttik. Bu işlemi görselleştirmek için, viral partiküllerin enjekte edilen süspansiyonuna (n = 3 fare) kırmızı floresan nanopartiküller ekledik. Enjeksiyondan 3 hafta sonra, fareler% 10 tamponlu formalin ile transkardiyal olarak perfüze edildi ve beyinler dura materyale zarar vermeden kafatasından dikkatlice çıkarıldı. Epifloresan binoküler mikroskop altında tüm beyinlerin incelenmesi, yeşil floresan kanalında görülebilen nöronal enfeksiyon alanını hafifçe aşan kırmızı floresan parçacıklarının yaygın dağılımını ortaya çıkardı (Şekil 2). Bu farelerin beyinlerinden alınan sagital kesitlerin analizi, floresan parçacıkların beyin parankimine derinlemesine nüfuz etmeden, pia mater boyunca ince bir tabaka halinde yerleştirildiğini, Venüs eksprese eden nöronların ise önceki deneylerde olduğu gibi 2/3 ve 5. katmanlarda çok sayıda bulunduğunu gösterdi.
AAV2_CaMKII_oChIEF EGFP virüsüne (1.49 x 1012 vg/mL konsantrasyonda kullanılır) ek olarak, AAV2_CaMKII_Venus (7.31 x 1012 vg/mL) ve AAV2_CAG_GCamp6s (7.3 x 1013 vg/ml) virüslerinin subaraknoid uygulamasını da gerçekleştirdik ve benzer sonuçlar elde ettik. Bu önemlidir, çünkü gösterildiği gibi, aynı serotipteki virüsler, kullanılan promotör ve hedef gene bağlı olarak farklı boyutlarda transdüksiyon alanı sağlayabilir12.
Virüslerin geleneksel ve subaraknoid uygulamasından sonra transdüksiyon alanlarını sistematik olarak karşılaştırmak için, beyinlerin seri 50 μm kalınlığındaki bölümlerinde mediolateral ve rostrokaudal yönlerde enfeksiyon alanının boyutunu hesapladık. Virüsün subaraknoid uygulamasının, intraparankimal uygulama (1.7 ± 0.52 mm (n = 15 fare) ile karşılaştırıldığında enfeksiyon alanında neredeyse dört kat artışa yol açtığı bulundu ± 0.46 0.22 mm (n = 6 fare), p < .00001, mediolateral yönde t-testi ve 2.35 ± 0.8 mm (n = 14 fare) 0.84 ± 0.29 mm (n = 6 fare) p < .0003, rostrokaudal yönde t-testi; Şekil 3A).
Subaraknoid virüs enjeksiyonu ile transdüksiyon yapılan farelerden alınan beyin dilimlerinin mikroskobik gözlemi, 2/3 ve 5. tabakalarda çok yaygın transdüksiyon olduğunu ortaya çıkarırken, 4. ve 6. tabakalarda neredeyse hiç transdüksiyon hücresi yoktu (Şekil 3B). 4. katmanda, 5. katman piramitlerinin sadece floresan dendritleri açıkça görülebiliyordu (Şekil 3B). Floresan aksonlar tabaka 6 ve beyaz cevherde izlendi (Şekil 3C). Subaraknoid enjeksiyondan sonra böyle bir transdüksiyon paterni, subaraknoid boşluktan korteksin 1. katmanına (belki daha derin) virüs difüzyonuna bağlı olabilir, burada nöronal dendritler onu yakalar. Böylece, sadece üst katmanlarda kuvvetli dallanmaya sahip nöronlar enfekte olur. GABAerjik internöronların ağırlıklı olarak lokal olarak dallandığı bilinmektedir. Hipotezimiz doğruysa, virüsün subaraknoid uygulaması, subgranüler tabakalarda değil, supragranüler tabakalarda internöronların transdüksiyonuna yol açmalıdır. Hipotezi test etmek için, AAV2_CaMKII_Venus virüsünün subaraknoid enjeksiyonundan sonra farelerden alınan beyin bölümlerinin iki farklı fonksiyonel GABAerjik internöron sınıfının belirteçlerine antikorlarla immünokimyasal boyama gerçekleştirdik: parvalbümin ve calbindin.
Virüsün subaraknoid enjeksiyonu ile transdüksiyona uğrayan internöronların sayısını belirlemek için, transdüksiyona uğrayan toplam hücre sayısını (yeşil boyama), immünopozitif nöronların sayısını (kırmızı boyama) ve 750 x 750 μm'lik bir kesitte (50 μm kesit kalınlığı) çift etiketli hücrelerin sayısını sayan bir morfometrik analiz gerçekleştirdik.
Parvalbumine karşı antikorlarla boyanmış beyin dilimlerinde, supragranüler tabakalarda, yeşil etiketli nöronların sayısı ortalama 57.4 ± 9.8, kırmızı etiketli parvalbümin pozitif internöronlar 9.6 ± 3.8, bunların 4.1 ± 2.4'ü (% 42.7) çift etiketliydi (n = 10 preparat). Buna karşılık, neokorteksin 5. katmanında 14 ± 4.8 virüs ile transdüksiyonlu nöron ve 19.1 ± 4.5 parvalbümin pozitif nöron saydık ve herhangi bir çift etiketli hücre tespit etmedik (n = 10 preparat).
Kalbindin için immünokimyasal olarak boyanmış bölümleri incelediğimizde, supragranülüler tabakalarda ortalama 21.1 ± 4.5 viral olarak transdüksiyona uğramış nöron ve 6.1 ± 2.6 kalbindin pozitif hücre olduğunu bulduk, bunların 4.2 ± 1.9 hücresi her iki etiketi de taşıyordu (% 69.1; n = 10 preparat). 5. tabakada 19 ± 2.1 transdüksiyonlu nöron, 15.9 ± 5.7 calbindin internöron saydık, bunların 1.1 ± 1.5'i (%6.9) çift lekelenme gösterdi. Bununla birlikte, 5. katmandaki çift etiketli nöronların %100'ünün, kalbindin pozitif piramidal nöronların varlığını veya antikorların bazı spesifik olmayan özelliklerini gösterebilecek, açıkça görülebilen bir piramidal şekle sahip olduğuna dikkat edilmelidir. Bu nedenle, 5. katmanda virüsün subaraknoid enjeksiyonu ile transdüksiyona uğrayan gerçek bir kalbindin internöronu gözlenmedi.
Bu nedenle, 2/3. tabakada transdüksiyona uğrayan nöronlar arasında parvalbumin ve kalbindin pozitif hücreler gerçekten mevcutken (Şekil 4A,C), 5. tabakada transdüksiyonlu internöron tespit edilmedi ve tüm EGFP eksprese eden hücreler görsel olarak piramidal nöronlar olarak tanımlandı (Şekil 4B,D).

Şekil 1: Konvansiyonel intrakortikal ve subaraknoid viral enjeksiyonlardan sonra AAV2 transdüksiyon alanının karşılaştırılması. (A) CaMKII_oChieff_EGFP yayılması, beyin parankimine enjeksiyondan 21 gün sonra 500-600 μm derinliğe kadar oluşur. (B) Subaraknoid uygulamayı takiben aynı hayvanın diğer yarım küresinde CaMKII_oChieff_EGFP yayılması. Enjeksiyon bölgesinden rostrokaudal yönde 200-300 μm mesafedeki ön bölümler gösterilmiştir. Ölçek çubuğu - 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Subaraknoidal olarak enjekte edilen AAV2_CaMKII_Venus virüslerinin ve kırmızı FluoSpheres'in yayılmasını gösteren bozulmamış dura maddesi ile tüm bir beynin fotoğrafı. (A) Enjekte edilen virüs süspansiyonuna eklenen kırmızı nanopartiküllerin floresansı, enjekte edilen hacmin subaraknoid boşlukta fiziksel yayılımını gösterir. (B) Yeşil floresan kanalındaki aynı beyin yarım küresi Venüs ekspresyon alanını gösterir. Enjeksiyon bölgesi oklarla gösterilir. Ek olarak, lambdanın yeri işaretlenir. Ölçek çubuğu - 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Virüsün subaraknoid enjeksiyonu, neokorteksin 2/3 ve 5 numaralı katmanlarındaki nöronların yaygın enfeksiyonuna neden olur. (A) İntrakortikal (I) ve subaraknoid (S) virüs enjeksiyonu sonrası transdüksiyon alanlarının (mediolateral (m/l) ve rostrokaudal (r/k) yönlerde) karşılaştırılması. Çubuklar ortalamayı temsil eder; Bıyıklar standart sapmayı gösterir (**** - p < 0.0001; *** - p < 0.001; t-testi). (B) AAV2_CaMKII_Venus virüslerinin subaraknoid enjeksiyonundan sonra fare neokorteksinde Venüs ekspresyonunu gösteren konfokal mikrograf. Katman sınırları şematik olarak gösterilmiştir (L1 - L6). (C) Katman 6 boyunca hareket eden floresan aksonları ve beyaz maddeyi (WM) göstermek için farklı parlaklık ve kontrast ayarlarıyla gösterilen bir görüntü (B) parçası. Ölçek çubuğu 100 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
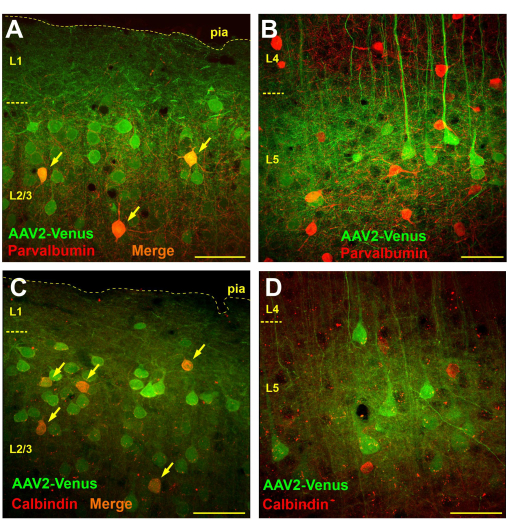
Şekil 4: Subaraknoid virüs enjeksiyonu, neokorteksin subgranüler katmanlarında değil, supra- internöronların transdüksiyonu ile sonuçlanır. (A, B) Parvalbumine (Alexa594-konjuge ikincil antikorlar) karşı antikorlarla AAV2_CaMKII_Venus virüsünün subaraknoid enjeksiyonu ile transdüklenen bir fareden beyin bölümlerinin immünokimyasal boyanması. Hem yeşil hem de kırmızı etiketler taşıyan nöronlar turuncu görünür (oklarla gösterilir). (C, D) Calbindin'e karşı antikorlarla boyanmış AAV2_CaMKII_Venus subaraknoid enjeksiyonundan sonra bir farenin beyin bölümünün mikrografları. L5'te çift etiketli nöronların yokluğuna dikkat edin. Ölçek çubuğu 50 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Beynin subaraknoid boşluğuna AAV2 viral partiküllerinin bir süspansiyonunu enjekte ederek fare neokortikal nöronlarını dönüştürmek için yeni bir yöntem geliştirdik. Bu, aynı miktarda virüs doğrudan beyin parankimine enjekte edildiğinde enfekte olan doku hacminden neredeyse dört kat daha büyük olan yaygın virüs dağılımı sağlar.
Virüs vektörlerinin farklı yollarla (örneğin, intraserebroventriküler, intratekal veya intrasisternal) doğrudan beyin omurilik sıvısına (BOS) enjeksiyonu, CNS 33,34,35 boyunca yaygın gen iletimi için popüler bir stratejidir. Bununla birlikte, yetişkin beyninde AAV2 vektörlerinin intraserebroventriküler veya intratekal uygulaması, ependimal hücrelere olan yüksek afiniteleri nedeniyle sınırlı beyin transdüksiyonu ile sonuçlanır 28,33,36,37. Ependimal hücreler, üçüncü ve dördüncü ventrikülleri ve omuriliğin merkezi kanalını kaplayan tek tabaka olarak bulunur38. Ventriküldeki ependimal hücreler arasında sıkı bağlantıların varlığı, bazı AAV serotipleri için önemli bir engeldir ve bu serotiplerin intraparankimal yayılıma sahip olması için bu hücrelerden ventrikülden geçmesi gerekir39.
Çalışmamızda, AAV2 viral vektörünün beyin yüzeyi boyunca subaraknoid boşluğa enjeksiyonu, yetişkin farelerde neokortikal nöronların yaygın olarak transdüksiyonu ile sonuçlandı. Pia maddesinin CNS'nin farklı bölgelerinde farklı yapılara sahip olduğuna dair kanıtlar var. Spinal pia materindeki zar (omuriliği çevreleyen), pia zarının40 iki katmanlı doğası nedeniyle kraniyal pia materinden (beyni çevreleyen) çok daha kalındır. Ayrıca ventriküler BOS'un beyin parankimine minimal olarak girdiği, subaraknoid BOS'un ise paravasküler boşluklar boyunca beyin parankimine hızla girdiği gösterilmiştir41. Bu nedenle, viral vektörün BOS'a farklı dağıtım yollarının farklı sonuçlar vermesi muhtemeldir.
Bazı AAV varyantlarının BOS içi enjeksiyonlarının belirli yan etkilerle ilişkili olduğu unutulmamalıdır. AAV9'un intratekal veya intraserebroventriküler iletiminin sadece CNS'de değil, aynı zamanda periferik organlarda da gen ekspresyonuna neden olduğu gösterilmiştir42,43. Beyindeki nöronların daha verimli bir şekilde transdüksiyonu için yüksek vektör dozları gereklidir. Örneğin, yetişkin Sprague-Dawley sıçanları, üç dozda lateral ventriküle tek taraflı bir AAV9 enjeksiyonu aldı: 3.1 μL, 15.5 μL ve 77.5 μL42. Fareler, cisterna magna43'te toplam 10 μL hacminde AAV9 aldı. Virüs enjeksiyon yöntemimizin yararı, AAV'nin intratekal veya intraserebroventriküler iletimi için kullanılanlardan daha düşük bir vektör hacmi (1 μL) kullanmamızdır. Virüsün daha düşük bir hacmi, beyin dışında viral ekspresyon riskini ve toksisiteyi de önemli ölçüde azaltır.
Beynin dışındaki viral ekspresyonları incelememiş olsak da, AAV2'nin beyin yüzeyinden subaraknoid uygulanmasının sadece beyinde (özellikle neokortekste) viral ekspresyona yol açması muhtemeldir. Varsayımımız aşağıdaki nedenlere dayanmaktadır. AAV9, kan-beyin bariyerini (BBB) geçebilen ve küresel CNS transdüksiyonu için yaygın olarak kullanılan rekombinant adeno-ilişkili bir virüstür 37,44. Bununla birlikte, beyin dokusunun BBB penetrasyonu ve transdüksiyonu AAV245 ile sınırlıdır. Ayrıca, virüsün subaraknoid enjeksiyonundan sonra fare beyin dilimlerinin analizi, dönüştürülen hücrelerin yalnızca ipsilateral (enjekte edilen) hemisferin neokorteksinde bulunduğunu gösterdi. Kontralateral neokortekste veya diğer beyin yapılarında transdüksiyon hücresi bulunamadı, bu da periferik organların bu enjeksiyon yöntemiyle transdüksiyonunun çok düşük bir ihtimal olduğunu düşündürmektedir.
Geniş bir enfeksiyon alanına ek olarak, subaraknoid virüs enjeksiyonu yöntemi, CAG gibi güçlü seçici olmayan promotörlerin kullanılmasıyla bile, beşinci katman piramidal nöronların seçici transdüksiyonuna izin verir. Belirli promotörlerle bile seçici ifadenin sağlanmasının oldukça zor olduğu iyi bilinmektedir 1,26. Örneğin, kullandığımız CaMKII promotörü teorik olarak tercihen glutamaterjik nöronları enfekte etmelidir. Bununla birlikte, buradaki sonuçlarda ve diğer çalışmalarda gösterildiği gibi, kullanıldığında, diğer hücre tiplerinin de transdüksiyonu, özellikle GABAerjik internöronlar46 meydana gelir. Ayrıca, subaraknoid enjeksiyonlarda hücre transdüksiyonu enjeksiyon bölgesinden önemli bir mesafede gerçekleştiğinden, bu yöntem nöronal aktivitenin sonraki optik veya elektrofizyolojik kayıtları için beyin dokusunun korunmasına yardımcı olur. Subaraknoid virüs enjeksiyonlarını, optogenetik stimülasyon ve fare görsel korteksinin L5 piramidal nöronlarının aktivitesinin hücre dışı kaydı ile yapılan deneylerde başarıyla kullandık in vivo32.
Bu çalışma, fare görsel korteksinin32 piramidal nöronlarında kanal rodopsinini eksprese etmek için AAV2'yi kullandığımız görsel korteksteki plastisite mekanizmaları üzerine yaptığımız büyük ölçekli çalışmamızın bir ürünüdür. Bu serotip ile çok fazla istatistik kazandık ve aslında subaraknoid enjeksiyon yöntemini geliştirdik. Pilot deneylerde de virüsün serotip 2/9 ile subaraknoid enjeksiyonunu denedik ve bu olguda detaylı morfometrik analiz yapmasak da benzer sonuçlar elde ettik. Ne yazık ki, subaraknoid uygulamadan sonra diğer serotiplerin nasıl davranacağını ve hangi virüs serotipinin en büyük transdüksiyon alanını sağlayacağını tahmin etmek mümkün değildir; Bu sadece ampirik olarak belirlenebilir ve bu da önemli miktarda çalışma gerektirir. Bu çalışmada, AAV2'nin yetişkin fare beyninin subaraknoid boşluğuna enjekte edilebileceğini ikna edici bir şekilde gösterdik, bu da neokorteksin beşinci katman piramidal nöronlarında hedef genin seçici ekspresyonu ve supragranüler katmanlarda seçici olmayan ekspresyonu ile sonuçlandı.
Bu subaraknoid virüs enjeksiyonu yöntemini kullanmanın en kritik adımı, enjeksiyon iğnesinin çapına tam olarak uyması gereken dura maddesindeki deliğin en uygun boyutunu sağlamaktır. Dura iğneyi sıkıca çevrelemeli ve bu nedenle enjeksiyon sırasında virüsün geri akışını önlemelidir. Bu yönteme subaraknoid enjeksiyon adını verdik, ancak subaraknoid boşluğa ek olarak, virüsün de subdural boşluğa (araknoid ve dura mater arasındaki boşluk) girip yayılmadığı açık değildir. Bu yöntemin diğer hayvanlarda, özellikle sıçanlarda veya diğer AAV serotiplerinde işe yarayıp yaramayacağı da açık değildir.
Daha önce, Xinjian Li ve meslektaşları, kortikal yüzeyde viral infüzyona dayanan bir nöronal transdüksiyon yöntemini tanımladılar. Viral kalsiyum raportörü AAV-GCaMP6'yı kortekse infüz etmek için kortikal yüzeyde geniş çaplı bir cam pipet kullandılar. Bu yöntemi kullanarak, viral parçacıklar, muhtemelen, bu duruma benzer şekilde, nöronlar tarafından yakalandıkları neokorteksin üst katmanlarına girerler. Yazarlar, kortikal yüzey virüsü infüzyonunun, derin katman nöronlarından kaçınırken yüzeysel katmanlardaki nöronları verimli bir şekilde etiketlediğini buldular47. Alıntılanan çalışmanın, çalışmamızda gözlemlediğimize benzer şekilde, beşinci katman piramidal nöronların transdüksiyonunu neden göstermediği tam olarak açık değildir.
Subaraknoid uygulamayı takiben, virüsün supragranüler tabakalarda dallanan nöronların dendritleri tarafından yakalandığına dair hipotezimizin göze çarpan bir zayıflığı vardır. Beşinci katmanın büyük piramitlerine ek olarak, dördüncü katman piramidal nöronlar48 ve fare görsel korteksindeki claustrum çıkıntılı L6 piramidal hücreler49 , birinci katmana ulaşan dendritlere sahiptir. Bu nedenle, bu hücrelerin neden subaraknoid virüs enjeksiyonu ile dönüştürülmediği açık değildir. Olası bir açıklama, yalnızca dendritleri viral partikülü hücre gövdesine taşıyacak kadar kalın olan hücrelerin enfekte olmasıdır - yani L5 piramitleri. Farelerin görsel korteksinde, dördüncü katman piramidal nöronların, neokorteks48'in birinci katmanına yalnızca bir ince dendrit gönderdiği gösterilmiştir. Bununla birlikte, subaraknoid virüs enjeksiyonundan sonra gözlenen enfeksiyon paterninin nedenini belirlemek için daha fazla çalışmaya ihtiyaç vardır.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Çalışma, Rusya Bilim Vakfı'nın 20-15-00398P hibesinin mali desteği ile gerçekleştirildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
Referanslar
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır