Method Article
نقل واسع النطاق للخلايا العصبية القشرية الحديثة للفأر عن طريق الحقن تحت العنكبوتية ل AAV2
In This Article
Summary
تم وصف تقنية جديدة لإيصال الفيروس المرتبط بالغدة على نطاق واسع والذي يستخدم تسريب الفيروس تحت العنكبوتية. لا تضمن هذه الطريقة نقلا واسع النطاق للخلايا العصبية القشرية الحديثة للفأر في الطبقات السطحية فحسب ، بل تؤدي أيضا إلى التعبير الانتقائي عن الجين المعدل في الخلايا العصبية الهرمية من الطبقة الخامسة ، حتى عند استخدام محفز غير انتقائي
Abstract
تعد الفيروسات المؤتلفة المرتبطة بالغدة أداة مرنة وقوية لإيصال والتعبير عن الجينات المختلفة ذات الأهمية في العديد من مجالات علم الأحياء التجريبي ، لا سيما في علم الأعصاب. الطريقة الأكثر شيوعا لدفع التعبير عن الجين المعدل المطلوب في منطقة معينة من الدماغ هي حقن ناقل AAV مباشرة في حمة الدماغ. ومع ذلك ، فإن هذه الطريقة لا تسمح بنقل الخلايا العصبية على نطاق واسع المطلوب لبعض التجارب في الجسم الحي . في هذه المقالة ، نقدم تقنية جديدة للتعبير الجيني على نطاق واسع في القشرة المخية الحديثة للفأر بناء على التسريب الفيروسي في الفضاء تحت العنكبوتية في الدماغ. لا تضمن طريقة وضع العلامات العصبية هذه نقلا واسع النطاق للخلايا العصبية في طبقات القشرة القشرية السطحية للفأر البالغ فحسب ، بل تؤدي أيضا إلى التعبير عن الجين المعدل في مجموعة كبيرة من الخلايا العصبية الهرمية من الطبقة الخامسة ذات الخصوصية العالية حتى عند استخدام محفز قوي غير انتقائي مثل CAG. علاوة على ذلك ، نظرا لأن نقل الخلايا يحدث على مسافة كبيرة من موقع الحقن ، يمكن أن تساعد هذه الطريقة في الحفاظ على أنسجة المخ للتسجيلات البصرية أو الفيزيولوجية الكهربية اللاحقة للنشاط العصبي.
Introduction
يتكون دماغ الثدييات من العديد من الخلايا المثبطة والمثيرة والمعدلة المترابطة في دوائر بواسطة تريليونات من نقاط الاشتباكالعصبي 1. يتمثل أحد التحديات الرئيسية لعلم الأعصاب في فك تشفير دور أنواع الخلايا المتميزة في تنظيم ووظيفة دوائر الدماغ والسلوك. يتطلب التلاعب بالخلايا المحددة وراثيا داخل الدماغ طرقا لإدخال الجينات المعدلة وراثيا والتعبير عنها. تعد أنظمة توصيل الجينات القائمة على الفيروس إلى حد بعيد الطريقة الأكثر فعالية وبساطة لتوصيل الجينات إلى الجهاز العصبي المركزي2. تعتمد أنظمة توصيل الفيروسات على تكرار الفيروسات (الفيروسات الغدية والفيروسات المرتبطة بالغدة (AAVs) وفيروسات العدسات والفيروسات القهقرية) التي لديها القدرة على توصيل المعلومات الجينية إلى الخلية المضيفة2،3.
أصبحت النواقل القائمة على AAV الآن واحدة من أكثر الأدوات استخداما لإيصال الجينات المعدلة وراثيا المرغوبة إلى الخلايا داخل الدماغ ، سواء لأغراض أبحاث علم الأعصاب الأساسية أو لتطوير العلاج الجيني للأمراض العصبية. عند مقارنتها بالفيروسات الأخرى ، تمتلك AAVs المعيبة في النسخ المتماثل العديد من الميزات التي تجعلها ناقلات مثالية لهذه الأغراض. والجدير بالذكر أن نواقل AAV تنقل بكفاءة الخلايا غير المنقسمة (المتمايزة نهائيا) مثل الخلايا العصبية والخلايا الدبقية ، مما يؤدي إلى مستويات عالية من التعبير الجينات المعدلة وراثيا في الجسم الحي2. يمكن إنتاج المتجهات بسهولة بعيار وظيفي عال مناسب للاستخدام في الجسم الحي 3،4،5. الأهم من ذلك ، أن توصيل الجينات بوساطة الفيروس المرتبط بالغدة في الجسم الحي لا ينتج عنه تغيرات نسيجية مرضية وسمية مرتبطة بالنواقل6. على عكس نواقل الفيروسات الغدية ، فإن الإدارة في الجسم الحي لنواقل AAV في النماذج الحيوانية عادة لا تثير استجابات مناعية للمضيف ضد الخلايا المنقولة ، مما يتيح التعبير المستقر للجينات المعدلة داخل حمة الدماغ لفترات طويلة من الزمن2،7،8.
سبب آخر لشعبية نواقل AAV هو المجموعة الواسعة من الأنماط المصلية AAV ذات المناطق المدارية الفريدة للأنسجة والخلية9،10،11،12،13،14. تؤدي بروتينات القفيصة المميزة التي يتم التعبير عنها بواسطة أنماط مصلية مختلفة من AAV إلى استخدام مستقبلات مختلفة لسطح الخلية لدخول الخلية ، وبالتالي ، مناطق الاستدارات المحددة10،14.
يتم تحديد استحاء AAV ليس فقط من خلال بروتينات القفيصة ولكن من خلال العديد من العوامل الأخرى14. لقد ثبت أن الأنماط المصلية AAV 1 و 2 و 6 و 7 و 8 و 9 نقلت كل من الخلايا العصبية والخلايا النجمية في الثقافة الأولية15،16 ، لكنها أظهرت انتحاء عصبيا قويا بعد حقن الدماغ داخل المتني17،18. يمكن أن تؤثر الطريقة المستخدمة في تحضير نواقل AAV أيضا على استحاء الخلايا العصبية ، حتى بالنسبة لنفس النمط المصلي. على سبيل المثال ، امتلك AAV8 المنقى CsCl استحاءا نجليا قويا بعد حقن الدماغ داخل المتني ، في حين أن AAV8 المنقى باليوديكسانول ، الذي تم حقنه في ظل ظروف متطابقة ، قام بتحويل الخلايا العصبيةفقط 19. قد يتأثر الانتحاء AAV أيضا بالجرعة المحقونة والحجم14. على سبيل المثال ، أدى العيار العالي rAAV2 / 1 إلى نقل كل من الخلايا العصبية المثيرة والمثبطة القشرية بكفاءة ، لكن استخدام العيارات المنخفضة كشف عن تفضيل قوي لنقل الخلايا العصبية المثبطة القشرية20.
وبالتالي ، لا يمكن تحقيق خصوصية قوية من نوع الخلية بناء على النمط المصلي للقفيصة فقط. يمكن استخدام محفزات محددة من نوع الخلية للتغلب على الانتوائية الطبيعية الواسعة لقفيصة AAV. على سبيل المثال ، يتم استخدام المشبك البشري I لاستهداف الخلايا العصبية21 ، ويمكن لمحفز CaMKII أن يقود التعبير الجيني المعدل في الخلايا العصبية المثيرة الجلوتاماتيرجيك ذات الخصوصيةالعالية 20 ، ويستهدف محفز ppHcrt الخلايا العصبية التي تعبر عن هيبوكريتين (HCRT) في منطقة ما تحت المهاد الجانبية22 ، ويستهدف محفز PRSx8 الخلايا العصبية النورادرينالية والأدرينالية التي تعبر عن الدوبامين بيتا هيدروكسيلاز23 ، ويمكن لمحفز GFAP أن يقود التعبير الخاص بالخلاياالنجمية 24. ومع ذلك ، فإن بعض المحفزات الخاصة بالخلايا لديها نشاط نسخ ضعيف ولا يمكنها دفع مستويات كافية من التعبير الجينيالمعدل 25. علاوة على ذلك ، غالبا ما لا تحتفظ المحفزات القصيرة التي تتناسب مع النواقل الفيروسية AAV بخصوصية نوع الخلية1،26. على سبيل المثال ، لقد ثبت أن بناء CaMKII ينقل أيضا الخلايا العصبية المثبطة12.
إلى جانب خصوصية نوع الخلية (الانتحاء) ، هناك ميزة أخرى مهمة ل AAVs وهي كفاءة التحويل. الأنماط المصلية المختلفة AAV لها خصائص انتشار مختلفة. تنتشر AAV2 وأربعة نواقل فيروسية بسهولة أقل من خلال حمة الدماغ ، وبالتالي ، تتوسط في النقل على مساحة أصغر17،27. لوحظ نقل الخلايا العصبية الأكثر انتشارا مع الأنماط المصلية AAV 1 و 9 و rh.1011،17،18،19،28.
الطريقة الأكثر شيوعا لدفع التعبير عن الجين المعدل المطلوب في منطقة معينة من الدماغ هي حقن ناقل AAV مباشرة في منطقة الدماغ محل الاهتمام (الحمة)3. بعد الحقن داخل المتني ، حتى الأنماط المصلية AAV ذات الانتشار الأكثر فعالية عبر الدماغ عادة ما تنقل منطقة محلية فقط حول موقع الحقن 12. علاوة على ذلك ، فإن الحقن داخل المتني هو إجراء جراحي ويؤدي إلى تلف الأنسجة المجاورة لمنطقة الاهتمام. وبالتالي ، فإن طريقة حقن الفيروسات هذه غير مناسبة لبعض المهام التجريبية. على سبيل المثال ، يعد وضع العلامات المكثفة للخلايا أمرا مرغوبا فيه للغاية في التجارب التي تهدف إلى دراسة وظائف الخلايا العصبية القشرية في التي تتحرك بحرية ، بما في ذلك استخدام الفحص المجهري ذو الفوتون الواحد أو الفوتونين29،30،31،32.
هنا ، نصف تقنية جديدة لحقن الفيروس المرتبط بالغدة تستخدم تسريب الفيروس تحت العنكبوتية لتوفير نقل واسع النطاق للخلايا العصبية القشرية الحديثة في الفئران البالغة والحفاظ على أنسجة المخ للتسجيلات البصرية أو الفيزيولوجية الكهربية اللاحقة للنشاط العصبي. لم تضمن هذه الطريقة نقلا واسع النطاق للخلايا العصبية في طبقات القشرة الحديثة السطحية فحسب ، بل أدت أيضا إلى التعبير عن الجين المعدل في عدد كبير من الخلايا العصبية الهرمية من الطبقة الخامسة ذات الخصوصية العالية حتى عند استخدام محفز قوي غير انتقائي مثل CAG.
Protocol
أجريت التجارب على C57Black / 6 فئران بالغة ، تتراوح أعمارهم بين 2-4 أشهر ، من كلا الجنسين (مركز تربية بوشينو ، فرع معهد شيمياكين-أوفتشينيكوف للكيمياء العضوية الحيوية في RAS). تم إيواء الفئران في فيفاريوم يتم التحكم في درجة حرارته (22 درجة مئوية ± 2 درجة مئوية ، 12 ساعة دورة ضوء / ظلام ، أضواء مضاءة في الساعة 08.00 ساعة) مع الطعام والماء المخصص. تم إجراء جميع الإجراءات التجريبية وفقا لإرشادات ARRIVE والتوجيه 2010/63 / EU للتجارب على. تمت الموافقة على بروتوكول الدراسة من قبل لجنة الأخلاقيات التابعة ل IHNA RAS (البروتوكول N1 اعتبارا من 01.02.2022). تم بذل كل جهد ممكن لتقليل معاناة وضمان موثوقية النتائج.
1. التحضير للجراحة
- تعقيم جميع الأدوات الجراحية قبل بدء الجراحة. نظف منطقة الجراحة باستخدام 70٪ من الإيثانول.
- تحقق من مستوى الأيزوفلوران في نظام التخدير واملأه إذا لزم الأمر. ضع منشفة ورقية نظيفة في الجزء السفلي من غرفة الحث.
- ضع وسادة تدفئة على الإطار التجسيمي. غطي الوسادة بمنشفة ورقية نظيفة.
- قم بإعداد زجاجة تحتوي على مبيض بنسبة 2٪ لجمع أطراف الماصات الدقيقة والأنابيب ومسحات القطن وغيرها من العناصر التي تتلامس مع الفيروس.
- قم بإزالة كمية من AAV من الفريزر -80 درجة مئوية وضعها على الثلج لتذوب.
2. تحضير الحقنة
- قم بتنظيف حقنة هاميلتون الدقيقة سعة 5 ميكرولتر بإبرة RN غير حادة 33G. استنشق ثم استغني عن 70٪ من الإيثانول. كرر 3 مرات مع الإيثانول الطازج. شطف المحقنة بالماء المقطر لإزالة الإيثانول الزائد. كرر 3 مرات.
- أخرج المكبس واملأ البرميل بزيت الفازلين من خلال الحافة باستخدام حقنة الأنسولين. تأكد من عدم وجود فقاعات هواء في المحقنة الدقيقة.
ملاحظة: الهواء المحبوس قابل للانضغاط ويؤثر على دقة الحقنة ودقتها. - ضع المكبس مرة أخرى في المحقنة الدقيقة وقم بتوزيع قطرة من الزيت. ضع المحقنة في الحاقن التجسيمي بحيث يكون المقياس مرئيا لمراقبة حجم المحلول الذي تم توزيعه.
3. تحضير الفئران للجراحة
- وزن الفأر. ضع الفأر في غرفة تحريض التخدير المتصلة بالأيزوفلوران. قم بتشغيل مبخر الأيزوفلوران المضبوط على 5٪ واضبط معدل التدفق على 250 مل / دقيقة. يتم تحقيق عمق كاف للتخدير في غضون 5 إلى 7 دقائق.
- للتحقق من المستوى الجراحي للتخدير ، تحقق من عدم وجود منعكس الخفق والانسحاب أثناء قرصة مؤلمة في المخلب الخلفي ، وعدم وجود وميض عند ملامسة العين.
- قم بتبديل صمام تدفق مبخر المرذاذ من غرفة الحث إلى القناع التجسيمي. قلل الأيزوفلوران إلى 1.8٪ -2.0٪ واضبط معدل التدفق وفقا لوزن الفأر (70-90 مل / دقيقة للفئران التي يتراوح وزنها بين 25 إلى 35 جم).
- أخرج الماوس من حجرة الحث وضعه في الجهاز التجسيمي فوق وسادة التدفئة (37 درجة مئوية) لمنع انخفاض حرارة الجسم أثناء التخدير الجراحي. ضع الأسنان الأمامية في شريط الأسنان ثم قم بتركيب قناع.
- ضع بعناية على قضبان الأذن. يسمح وضع الرأس الصحيح في الجهاز التجسيمي بالحركة الرأسية ولكن ليس الجانبية للرأس. تأكد من أن وضع لا يسبب ضيقا. راقب عمق التخدير وتنفس ودرجة حرارة الجسم بعناية طوال العملية.
- حلق الرأس من العينين إلى خلف الأذنين. نظف سطح الرأس المحلوق عن طريق المسح ب 70٪ من الإيثانول ، متبوعا بالمسح بمحلول كحول 5٪ من اليود.
- ضع جل العيون لمنع جفاف العين. ضع محلول ليدوكائين 4٪ موضعيا وديكساميثازون (0.02 مل عند 4 مجم / مل) تحت الجلد لمنع الألم المرتبط بالجراحة وتقليل الاستجابة الالتهابية المحتملة.
- باستخدام شفرة مشرط ومقص معقم ، قم بعمل شق بطول 4-5 مم على طول خط الوسط للرأس لفتح فروة الرأس. ابدأ بشق صغير بين الأذنين ثم قم بتوسيعه باستخدام المقص لتجنب تلف الجمجمة.
- امسح سطح الجمجمة بكمية صغيرة من بيروكسيد الهيدروجين بنسبة 3٪ لتصور المعالم التجسيمية: بريجما ولامدا. أوقف التفاعل باستخدام محلول ملحي كلوريد الصوديوم 0.9٪ على الفور. اكشط الأنسجة الموجودة أعلى الجمجمة باستخدام مكشطة العظام.
- قم بتركيب الحاقن الآلي المعد مسبقا مع حقنة هاميلتون على الذراع التجسيم. قم بتوجيه مصدر ضوء جراحي إلى الجمجمة المكشوفة وركز المجهر على البريجما.
- بالنظر من خلال المجهر ، قم بمعالجة ذراع الجهاز التجسيمي لتوسيط الجزء العلوي من الإبرة مباشرة فوق البرجما.
- باستخدام طرف الإبرة ، قم بمحاذاة البريغما واللامدا أفقيا ثم حرك الذراع للخلف إلى بريجما وسجل الإحداثيات. استخدم إحداثيات بريجما وإحداثيات الأطلس للمنطقة ذات الأهمية لحساب الإحداثيات النسبية للمنطقة المستهدفة.
- انقل الإبرة إلى المنطقة المستهدفة. اخفض الإبرة عند الإحداثيات الجديدة وحدد هذا الموضع. حدد موقع الحقن المجهري الفيروسي على مقربة من المنطقة المستهدفة مع مراعاة انتشار الفيروس.
ملاحظة: سيؤدي ذلك إلى تجنب إتلاف الأنسجة في المنطقة ذات الاهتمام. استخدمنا الإحداثيات التالية لمنطقة الاهتمام: AP-3.4 ، ML -2.0 ، وللحقن المجهري الفيروسي: AP-2.0 ، ML -1.4. الإحداثيات المذكورة أعلاه هي الأمثل إذا كانت الخلايا العصبية في القشرة البصرية الأولية ستصاب. - إذا أمكن ، تجنب المناطق ذات الأوعية الدموية الكبيرة. تحت المجهر الجراحي ، يجب أن تظهر الإضاءة الساطعة والباردة ، والغمر في محلول كلوريد الصوديوم 0.9٪ ، الأوعية الدموية الكبيرة في الجمجمة وعلى سطح الدماغ.
4. حقن الفيروسات
- خذ بردا معقما للأسنان (قطره 0.5 - 0.8 مم). عند عرض سطح الجمجمة من خلال المجهر الجراحي ، قم بحفر حج صغير للقحف يدويا (يدويا) أو باستخدام مثقاب مجهري. احرص على عدم الضغط المفرط على الجمجمة.
- حرك الذراع بعيدا عن الطريق لمنع تلف إبرة المحقنة الدقيقة أثناء حفر حج القحف (الثقب). ضع 0.9٪ من محلول كلوريد الصوديوم الملحي وتوقف مؤقتا بشكل متقطع لتجنب تسخين العظام وإتلاف الأم الجافة. استخدم الهواء المضغوط لتفجير غبار العظام.
ملاحظة: الأنواع التالية من أزيز الأسنان المصنوعة من الكربيد مناسبة: على شكل كمثرى (يفضل) ، أسطوانة مستديرة ، ومستديرة.- عند ترقق العظم بالبر ، تأكد من أن التخفيف موحد عبر المحيط بأكمله. سيسهل ذلك إزالة العظم دون الإضرار بالأم الجافية. للقيام بذلك ، استخدم البر بطرف دائري في البداية ثم البر بطرف مسطح. حافظ على البر عموديا على العظم. خلاف ذلك ، سيكون أحد الجانبين أرق من الآخر.
ملاحظة: بالإضافة إلى ذلك ، كلما كان حجم البر أصغر وأصغر حج القحف الذي تم إجراؤه ، كلما كان التلاعب أكثر تعقيدا. يوصى بإجراء حج القحف بقطر أصغر (0.5-0.6 مم) عند استخدام للعمل في الجسم الحي . إذا كنت تخطط لاستخدام دماغ في العمل خارج الجسم الحي ، فإن قطر حج القحف الأكبر مقبول لتبسيط الإجراء.
- عند ترقق العظم بالبر ، تأكد من أن التخفيف موحد عبر المحيط بأكمله. سيسهل ذلك إزالة العظم دون الإضرار بالأم الجافية. للقيام بذلك ، استخدم البر بطرف دائري في البداية ثم البر بطرف مسطح. حافظ على البر عموديا على العظم. خلاف ذلك ، سيكون أحد الجانبين أرق من الآخر.
- عندما يكون العظم الرقيق ناعما وشفافا ، توقف عن الحفر. عندما تتشكل مسافة بادئة كبيرة بما فيه الكفاية في العظم ، أوقف الدوران بشكل متكرر وراقب سمك العظم. يشير ظهور تشققات في العظام إلى أن التخفيف كاف.
- استحم الحفرة بمحلول ملحي معقم ثم قم بإزالة المحلول الملحي الزائد بقطعة قطن. قم بإزالة الطبقة المتبقية من العظم باستخدام إبرة 27G بطرف على شكل خطاف و / أو باستخدام ملاقط رفيعة الرؤوس. تجنب إتلاف الجافية.
- قم بتغطية سطح الجمجمة بقطعة معقمة من المناديل الورقية المبللة بالمحلول الملحي. ضع قطعة من الفيلم النظيف والشفاف على سطح جمجمة الفأر فوق الورق.
- حرك الذراع التجسيمية للخلف وضع إبرة المحقنة الدقيقة في مكانها فوق الفيلم مباشرة. قم بتوزيع الزيت الزائد حتى يصل إلى حجم 2 ميكرولتر.
ملاحظة: قد يختلف الحجم النهائي للزيت وفقا لحجم المحقنة الدقيقة. استخدمنا حقنة صغيرة سعة 5 ميكرولتر 75-RN Hamilton. - ماصة حجم من الفيروس يساوي الحجم المحقون + 2 ميكرولتر على قطعة من الفيلم الشفاف.
- بالنظر من خلال المجهر الجراحي ، اخفض الذراع لأسفل حتى يصبح طرف الإبرة في وسط قطرة الفيروس. قم بتحميل الفيروس في المحقنة الدقيقة باستخدام حاقن آلي. تخلص من طرف الماصة الدقيقة والفيلم الشفاف في الزجاجة مع مبيض بنسبة 2٪.
- قم بإزالة الورق المبلل بالمحلول الملحي من سطح الجمجمة وجفف الجمجمة بقطعة قطن. استخدم الذراع التجسيمية لوضع الإبرة فوق موقع الإدخال.
- قم بتوزيع قطرة من الفيروس للتأكد من عدم انسداد الإبرة. اصنع شقا صغيرا في الجافية باستخدام إبرة 30 جم بطرف على شكل خطاف.
ملاحظة: من المهم عمل أصغر شق ممكن في الأم الجافية ، مما يسمح للإبرة بالدخول دون ترك فجوة بين الإبرة وأم الجافية ، والتي يمكن أن يتسرب منها الفيروس. - اخفض إبرة المحقنة إلى الجافية وقم بإجراء الحسابات المناسبة للعمق. قم بتقدير العمق القشري للإدخال بالنسبة للنقطة التي لمست فيها الإبرة سطح القشرة لأول مرة.
- أدخل طرف الإبرة ببطء في القشرة على عمق 300 ميكرومتر. انتظر 2-3 دقائق للسماح للجافية بالالتصاق بالإبرة ، ثم اسحب الإبرة ببطء إلى عمق 200 ميكرومتر. انتظر 2-3 دقائق أخرى للسماح لأنسجة المخ بالاستقرار. ينتج عن هذا قيام الإبرة بسحب الجافية لأعلى ، مما يخلق مساحة تحت الجافية لانتشار الفيروس.
ملاحظة: لتقليل تلف القشرة القشرية ، استخدم إبرة 33 جم أو إبر G أقل. ضع في اعتبارك أنه كلما كان القطر الداخلي للطرف أصغر ، زادت فرصة انسداد التدفق العكسي للأنسجة. من المهم استخدام إبرة حادة بدلا من المشطوفة لأن الإبرة الحادة تطرد قطرة أكثر تحكما من المحلول الفيروسي.- إذا لم تمر الإبرة عبر الأم الجافية عند خفضها إلى 150-200 ميكرومتر وبدلا من ذلك ثنيها ، فتوقف عن الخفض. ارفع الإبرة وقم بعمل شق أكبر قليلا في الأم الجافية ، ثم حاول خفض الإبرة مرة أخرى.
- إذا بدأ السائل النخاعي في التسرب بنشاط من الشق أثناء خفض الإبرة ، انتظر حتى يتوقف عن التسرب. خلاف ذلك ، من الصعب التحكم في الإبرة التي تمر عبر الجافية. امسح السائل الدماغي النخاعي الزائد بطرف الأنسجة. بمجرد توقف السائل عن التدفق ، ارفع الإبرة وحاول مرة أخرى.
- ابدأ في حقن المعلق الفيروسي بمعدل 0.06 ميكرولتر / دقيقة أثناء مراقبة الحجم الذي يتم توزيعه. حقن 1 ميكرولتر من الفيروس. حقن الفيروس على عمق واحد حتى لا تكسر الختم بين الإبرة وأنسجة القشرة.
- استكشاف الأخطاء وإصلاحها: في بداية الحقن ، قد يحدث ارتجاع الفيروس إلى سطح الدماغ. توقف عن الحقن ، وانتظر 2-3 دقائق ، ثم استمر في حقن الفيروس. كرر هذه الإجراءات (الخطوات) حتى يتوقف التدفق العكسي للفيروس. سوف تلتصق الفيروسات والسوائل الدماغية الشوكية بالإبرة وتمنع التدفق العكسي.
- طريقة أخرى لوقف التدفق العكسي للفيروس ، ضع كمية صغيرة من الاغاروز على سطح القشرة. سوف يمنع نبض القشرة وسيساعد أيضا على إغلاق الإبرة. لكن تأكد من عدم انسداد الماصة بواسطة الاغاروز.
- نظرا لأن الإبرة قد لا تمر بالكامل عبر الأم الجافية عند خفضها ، ولكن جزئيا فقط ، فقد لا يتناسب جانب واحد من الإبرة بإحكام مع الجافية ، مما قد يتسبب في ارتجاع الفيروس. في هذه الحالة ، اسحب الإبرة ببطء من الأنسجة وحاول خفضها مرة أخرى.
- بمجرد اكتمال التسريب ، احتفظ بالإبرة في الموقع المستهدف لمدة 10 دقائق إضافية. هذا يسمح للفيروس بالتشتت بعيدا عن موقع الحقن. اسحب الإبرة من الدماغ ببطء لمنع الفيروس من التدفق مرة أخرى من مجرى الإبرة.
- بمجرد اكتمال سحب الإبرة ، تأكد من عدم انسدادها عن طريق توزيع قطرة صغيرة من الفيروس. أغلق شق الجلد باستخدام 5-0 خيوط قابلة للامتصاص أو غير قابلة للامتصاص.
5. رعاية ما بعد الجراحة
- بعد إغلاق الشق ، ضع مرهما مضادا للبكتيريا موضعيا. حقن مزيج من المحلول الملحي (5 مل / كجم) و 5٪ جلوكوز (5 مل / كجم) تحت الجلد لمنع الجفاف وتسهيل الشفاء بعد التخدير. حقن الكيتوبروفين في العضل (2.5 مجم / كجم) لتقليل الألم.
- ضع في قفص جديد فوق وسادة تدفئة وراقبه حتى يتعافى من التخدير. بعد أن يتفاعل الفأر ، ضع في قفص منزله.
6. علم الأنسجة
- في موعد لا يتجاوز 21 يوما بعد حقن الفيروس ، قم بتخدير الفئران بعمق بالأيزوفلوران كما هو موضح في الخطوة 3.
- قم بعمل شق خط الوسط (10-15 مم) على طول منطقة الصدر باستخدام مقص ضيق وفضح تجويف الصدر. افصل الحجاب الحاجز بعناية وافتح الصدر باستخدام المقص.
- أدخل إبرة 22G 1 1/2 في البطين الأيسر وقم بعمل شق في الأذين الأيمن بالمقص. النفخ مع 50 مل من محلول ملحي مخزن بالفوسفات المبرد مسبقا 100 ملي مولار (PBS) ، متبوعا ب 100 مل من الفورمالين المبرد مسبقا بنسبة 10٪.
- استخرج بعناية دماغ الفأر بالكامل. للقيام بذلك ، قم بعمل شق سهمي على طول وسط فروة الرأس باستخدام المقص. بعد ذلك ، قم بإزالة عظم الجمجمة قطعة قطعة باستخدام كماشة عظمية ذات أطراف مسطحة تبدأ من تقاطع الغرز السهمية واللامدويد والعمل إلى الأمام إلى عظم الأنف. عندما يتعرض الدماغ ، اقطع البصيلات الشمية ، وخفف الدماغ بملعقة منحنية ، وقم بإسقاطه في أنبوب سعة 50 مل يحتوي على 10٪ فورمالين مؤقت.
- إصلاح الدماغ بين عشية وضحاها. قم بتركيب أنسجة المخ على منصة معدنية من Vibratome باستخدام لاصق الأنسجة. قطع المقاطع الأمامية بسمك 50 ميكرومتر باستخدام شفرات من الصلب الكربوني.
7. تلغيم المناعة
- اليوم 1
- اغسل شرائح الدماغ 3 مرات لمدة 5 دقائق لكل منها باستخدام 1x PBS يحتوي على 0.3٪ Triton X-100 (PBS-T). احتضان الأقسام في PBS-T لمدة 20 دقيقة في درجة حرارة الغرفة (RT).
- قم بحظر الارتباط غير المحدد لمدة ساعة واحدة في RT باستخدام مخزن مؤقت مانع يتكون من 5٪ مصل الماعز العادي (NGS) و 0.3٪ Triton X-100 في 1x PBS.
- احتضان الأقسام طوال الليل عند 4 درجات مئوية مع الأجسام المضادة الأولية ضد البارفالبومين أو الكالبيندين المخفف 1: 500 في المخزن المؤقت للحجب (5٪ NGS و 0.3٪ Triton X-100 في 1x PBS).
- اليوم 2
- اغسل الأقسام 3 مرات لمدة 10 دقائق في PBS-T. احتضن في الظلام لمدة ساعتين في RT مع الأجسام المضادة الثانوية (الماعز المضاد للأرانب IgG (H + L) الجسم المضاد الثانوي الممتز ، Alexa Fluor 546) المخفف 1: 500 في المخزن المؤقت للحجب (5٪ NGS و 0.3٪ Triton X-100 في 1x PBS).
- اغسل الأقسام 3 مرات لمدة 5 دقائق لكل منها في 1x PBS. انقل شرائح الدماغ إلى شرائح زجاجية باستخدام فرشاة ناعمة.
- أضف على الفور 0.1 مل من وسيط التثبيت المضاد للبهتان إلى كل قسم. غطي الشرائح بغطاء مقاس 22 مم × 50 مم.
- قم بتكوين المجهر متحد البؤر على تكبير 20x أو 60x (A/1.4، زيت). استخدم ليزر بطول موجي 488 نانومتر و 594 نانومتر للحصول على صور متعددة القنوات لمناطق الدماغ ذات الأهمية.
النتائج
في سلسلة تجريبية من التجارب ، استخدمنا طريقة الحقن التقليدية داخل القشرة لنقل الخلايا العصبية الهرمية للطبقة الخامسة في القشرة المخية الحديثة للفأر بواسطة AAV2 التي تحمل جين رودوبسين سريع القناة (oChIEF) المدمجة مع بروتين الفلورسنت EGFP تحت محفز CaMKII. تمشيا مع السمة المميزة ل AAV212 ، حصلنا على مساحة صغيرة نسبيا من العدوى ، لا يتجاوز عرضها 1 مم (الشكل 1 أ). ومع ذلك ، في بعض التجارب ، لاحظنا انتشارا كبيرا بشكل غير عادي ل AAV2 ، وفي بعض الحالات يغطي القشرة المخية الحديثة لأكثر من نصف نصف الكرة المخية (الشكل 1 ب). افترضنا أن مثل هذا التوزيع الواسع النطاق للفيروس قد يحدث عندما يدخل الفيروس إلى الفضاء تحت العنكبوتية وينشر تيار السائل الدماغي النخاعي (CSF) الناقل الفيروسي عبر سطح الدماغ. لاحظنا أن هذا يحدث عندما يكون عمق إدخال إبرة الحقن صغيرا (<200 ميكرومتر) ويتطابق حجم الثقب الموجود في الأم الجافية تماما مع قطر الإبرة ، مما يمنع تعليق الجسيمات الفيروسية من التدفق العكسي. من أجل تصور هذه العملية ، أضفنا جزيئات نانوية فلورية حمراء إلى المعلق المحقون للجزيئات الفيروسية (ن = 3 فئران). في 3 أسابيع بعد الحقن ، تم نفخ الفئران عبر القلب مع 10٪ من الفورمالين المخزن ، وتمت إزالة الأدمغة بعناية من الجمجمة دون الإضرار بالأم الجافية. كشف فحص الأدمغة بأكملها تحت المجهر المجهر الفلوري عن التوزيع الواسع النطاق لجزيئات الفلورسنت الحمراء التي تجاوزت قليلا مساحة العدوى العصبية المرئية في قناة التألق الأخضر (الشكل 2). أظهر تحليل المقاطع السهمية من أدمغة هذه الفئران أن جزيئات الفلورسنت كانت موجودة في طبقة رقيقة على طول الأم ، دون اختراق عمق حمة الدماغ ، بينما تم العثور على الخلايا العصبية التي تعبر عن كوكب الزهرة ، كما في التجارب السابقة ، بأعداد كبيرة في الطبقتين 2/3 و 5.
بالإضافة إلى فيروس EGFP AAV2_CaMKII_oChIEF (المستخدم بتركيز 1.49 × 1012 vg / mL) ، أجرينا أيضا إعطاء تحت العنكبوتية لفيروسات AAV2_CaMKII_Venus (7.31 × 1012 vg / mL) و AAV2_CAG_GCamp6s (7.3 × 1013 vg / ml) وحصلنا على نتائج مماثلة. هذا مهم لأنه ، كما هو موضح ، يمكن للفيروسات من نفس النمط المصلي أن توفر أحجاما مختلفة من منطقة التنبيغ اعتمادا على المحفز والجين المستهدف المستخدم12.
لمقارنة مناطق التنبيغ بشكل منهجي بعد الإعطاء التقليدي وتحت العنكبوتية للفيروسات ، قمنا بحساب حجم منطقة العدوى في الاتجاهين الوسطي الوحشي والذيلية في أقسام تسلسلية بسمك 50 ميكرومتر من الأدمغة. وجد أن إعطاء الفيروس تحت العنكبوتية أدى إلى زيادة تقارب أربعة أضعاف في منطقة العدوى ، مقارنة بالإعطاء داخل اللحمة المتني (1.7 ± 0.52 مم (ن = 15 فأر) مقابل 0.46 ± 0.22 مم (ن = 6 فئران) ، ص < .00001 ، اختبار t في الاتجاه المتوسط الجانبي و 2.35 ± 0.8 مم (ن = 14 فأر) مقابل 0.84 ± 0.29 مم (ن = 6 فئران) p < .0003 ، اختبار T في اتجاه rostrocaudal ؛ الشكل 3 أ).
كشفت المراقبة المجهرية لشرائح الدماغ من الفئران المنقولة عن طريق حقن الفيروس تحت العنكبوتية عن نقل واسع النطاق في الطبقتين 2/3 و 5 ، بينما لم تكن هناك خلايا منقولة تقريبا في الطبقتين 4 و 6 (الشكل 3 ب). في الطبقة 4 ، كانت التشعبات الفلورية فقط من أهرامات الطبقة 5 مرئية بوضوح (الشكل 3 ب). تم تتبع محاور الفلورسنت في الطبقة 6 والمادة البيضاء (الشكل 3 ج). يمكن أن يكون نمط التنبيغ هذا بعد الحقن تحت العنكبوتية بسبب انتشار الفيروس من الفضاء تحت العنكبوتية إلى الطبقة 1 من القشرة (ربما أعمق) ، حيث تلتقطها التشعبات العصبية. وبالتالي ، تصاب الخلايا العصبية التي لها تفرع قوي في الطبقات العليا فقط. ومن المعروف أن الخلايا العصبية الداخلية GABAergic تتفرع في الغالب محليا. إذا كانت فرضيتنا صحيحة ، فيجب أن يؤدي إعطاء تحت العنكبوتية للفيروس إلى نقل الخلايا العصبية الداخلية في الطبقات فوق الحبيبية ولكن ليس في الطبقات تحت الحبيبية. لاختبار الفرضية ، أجرينا تلطيخا كيميائيا مناعيا لأقسام الدماغ من الفئران بعد الحقن تحت العنكبوتية للفيروس AAV2_CaMKII_Venus بالأجسام المضادة لعلامات فئتين وظيفيتين مختلفتين من الخلايا العصبية الداخلية GABAergic: بارفألبومين وكالبيندين.
لتحديد عدد الخلايا العصبية الداخلية المنقولة عن طريق الحقن تحت العنكبوتية للفيروس ، أجرينا تحليلا مورفومقياسيا يحسب العدد الإجمالي للخلايا المنقولة (التلوين الأخضر) ، وعدد الخلايا العصبية الموجبة للمناعة (التلوين الأحمر) وعدد الخلايا ذات العلامات المزدوجة على قسم 750 × 750 ميكرومتر (سمك مقطع 50 ميكرومتر).
في شرائح الدماغ الملطخة بالأجسام المضادة ضد البارفالبومين ، في الطبقات فوق الحبيبية ، بلغ متوسط عدد الخلايا العصبية ذات الملصقات الخضراء 57.4 ± 9.8 ، والخلايا العصبية الداخلية الإيجابية للبارفالبومين مع الملصقات الحمراء 9.6 ± 3.8 ، منها 4.1 ± 2.4 (42.7٪) كانت ذات تسمية مزدوجة (ن = 10 مستحضرات). في المقابل ، قمنا بإحصاء 14 ± 4.8 خلية عصبية منقولة بالفيروس و 19.1 ± 4.5 خلية عصبية إيجابية للبارفألبومين في الطبقة 5 من القشرة المخية الحديثة ولم نكتشف أي خلايا مزدوجة التسمية (ن = 10 مستحضرات).
عندما فحصنا الأقسام الملطخة كيميائيا مناعيا للكالبيندين ، وجدنا أنه في الطبقات فوق الحبيبية ، كان هناك ما معدله 21.1 ± 4.5 خلية عصبية منقولة فيروسيا، و 6.1 ± 2.6 خلية إيجابية كالبيندين ، منها 4.2 ± 1.9 خلية تحمل كلا الملصقين (69.1٪ ؛ ن = 10 مستحضرات). في الطبقة 5 ، أحصينا 19 ± 2.1 خلية عصبية منقولة ، و 15.9 ± 5.7 خلية عصبية داخلية كالبيندين ، منها 1.1 ± 1.5 (6.9٪) أظهرت تلطيخا مزدوجا. ومع ذلك ، تجدر الإشارة إلى أن 100٪ من الخلايا العصبية ذات العلامات المزدوجة في الطبقة 5 لها شكل هرمي مرئي بوضوح ، مما قد يشير إلى وجود خلايا عصبية هرمية إيجابية الكالبيندين أو بعض عدم خصوصية الأجسام المضادة. وبالتالي ، لم يلاحظ أي خلايا عصبية داخلية حقيقية من الكالبيندين يتم نقلها عن طريق الحقن تحت العنكبوتية للفيروس في الطبقة 5.
لذلك ، في حين أن الخلايا الإيجابية للبارفألبومين والكالبيندين كانت موجودة بالفعل بين الخلايا العصبية المنقولة في الطبقة 2/3 (الشكل 4 أ ، ج) ، لم يتم الكشف عن الخلايا العصبية الداخلية المنقولة في الطبقة 5 ، وتم تحديد جميع الخلايا التعبيرية عن EGFP بصريا على أنها خلايا عصبية هرمية (الشكل 4 ب ، د).

الشكل 1: مقارنة بين منطقة نقل AAV2 بعد الحقن الفيروسية التقليدية داخل القشرة وتحت العنكبوتية. (أ) انتشار CaMKII_oChieff_EGFP يبنى بعد 21 يوما من الحقن في حمة الدماغ على عمق 500 - 600 ميكرومتر. (ب) انتشار CaMKII_oChieff_EGFP في نصف الكرة الآخر من نفس بعد إعطاء تحت العنكبوتية. يتم عرض المقاطع الأمامية على مسافة 200-300 ميكرومتر في اتجاه الوردي الذيلي من موقع الحقن. شريط المقياس - 1 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: صورة لدماغ كامل به مادة جافية سليمة توضح انتشار فيروسات AAV2_CaMKII_Venus و FluoSpheres الحمراء المحقونة تحت العنكبوتية. (أ) تألق الجسيمات النانوية الحمراء التي تمت إضافتها إلى معلق الفيروس المحقون مما يدل على الانتشار المادي للحجم المحقون في الفضاء تحت العنكبوتية. (ب) يظهر نصف الكرة المخية نفسه في قناة التألق الأخضر منطقة تعبير كوكب الزهرة. يشار إلى موقع الحقن بواسطة الأسهم. بالإضافة إلى ذلك ، تم وضع علامة على موقع لامدا. شريط المقياس - 1 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: يؤدي الحقن تحت العنكبوتية للفيروس إلى انتشار عدوى الخلايا العصبية من الطبقتين 2/3 و 5 من القشرة المخية الحديثة. (أ) مقارنة مناطق التنبيغ (في الاتجاهات المتوسطة الجانبية (م / لتر) والمنقارية (r / c)) بعد حقن الفيروس داخل القشرة (i) وتحت العنكبوتية (s). تمثل القضبان المتوسط. تشير الشعيرات إلى الانحراف المعياري (**** - ص < 0.0001 ؛ *** - ص < 0.001 ؛ اختبار T). (ب) صورة مجهرية متحدة البؤر تظهر تعبير كوكب الزهرة في القشرة المخية الحديثة للفأر بعد الحقن تحت العنكبوتية لفيروسات AAV2_CaMKII_Venus. يتم عرض حدود الطبقة بشكل تخطيطي (L1 - L6). (ج) جزء من الصورة (B) ، يظهر بإعدادات سطوع وتباين مختلفة لإظهار محاور الفلورسنت التي تنتقل عبر الطبقة 6 والمادة البيضاء (WM). شريط المقياس هو 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
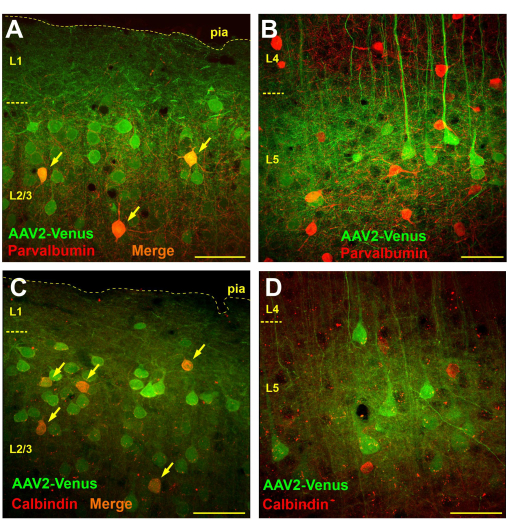
الشكل 4: يؤدي حقن الفيروس تحت العنكبوتية إلى نقل الخلايا العصبية الداخلية في الطبقات فوق الحبيبية ولكن ليس في الطبقات تحت الحبيبية من القشرة المخية الحديثة. (أ ، ب) تلطيخ كيميائي مناعي لأقسام الدماغ من فأر يتم نقله عن طريق الحقن تحت العنكبوتية للفيروس AAV2_CaMKII_Venus مع الأجسام المضادة للبارفألبومين (الأجسام المضادة الثانوية المترافقة Alexa594). تظهر الخلايا العصبية التي تحمل ملصقات خضراء وحمراء باللون البرتقالي (يشار إليها بالأسهم). (ج، د) صور مجهرية لقسم دماغ الفأر بعد حقن تحت العنكبوتية من AAV2_CaMKII_Venus ملطخة بالأجسام المضادة للكالبندين. لاحظ عدم وجود خلايا عصبية مزدوجة التسمية في L5. شريط المقياس هو 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
لقد طورنا طريقة جديدة لنقل الخلايا العصبية القشرية الحديثة للفأر عن طريق حقن معلق من الجسيمات الفيروسية AAV2 في الفضاء تحت العنكبوتية في الدماغ. يوفر هذا توزيعا واسع النطاق للفيروس ، أكبر بأربعة أضعاف تقريبا من حجم الأنسجة المصاب عندما يتم حقن نفس الكمية من الفيروس مباشرة في حمة الدماغ.
يعد حقن نواقل الفيروس مباشرة في السائل الدماغي النخاعي (CSF) عبر طرق مختلفة (على سبيل المثال ، داخل المخ البطيني أو داخل القراب أو داخل القص) استراتيجية شائعة لتوصيل الجينات على نطاق واسع في جميع أنحاء الجهاز العصبيالمركزي 33،34،35. ومع ذلك ، فإن الإعطاء داخل المخ البطيني أو داخل القراب لنواقل AAV2 في دماغ البالغين يؤدي إلى نقل محدود في الدماغ بسبب تقاربها العالي مع الخلايا البطانيةالعصبية 28،33،36،37. تم العثور على الخلايا البطانية كطبقة أحادية تبطن البطينين الثالث والرابع والقناة المركزية للحبلالشوكي 38. يعد وجود تقاطعات ضيقة بين الخلايا البطانية العصبية في البطين حاجزا كبيرا لبعض الأنماط المصلية AAV ، والتي يجب أن تمر عبر هذه الخلايا من البطين لتنتشر داخل البطن39.
في عملنا ، أدى حقن ناقل الفيروس AAV2 في الفضاء تحت العنكبوتية عبر سطح الدماغ إلى نقل واسع النطاق للخلايا العصبية القشرية الحديثة في الفئران البالغة. هناك أدلة على أن مادة pia لها هياكل مختلفة في مناطق مختلفة من الجهاز العصبي المركزي. الغشاء الموجود في الأم العمودية (التي تحيط بالحبل الشوكي) أكثر سمكا بكثير من الأم القحفية (التي تحيط بالدماغ) بسبب الطبيعة المكونة من طبقتين لغشاء الزاوية40. لقد ثبت أيضا أن السائل الدماغي النخاعي البطيني يدخل حمة الدماغ بشكل ضئيل ، في حين أن السائل الدماغي النخاعي تحت العنكبوتية يدخل بسرعة إلى حمة الدماغ على طول المساحات المجاورةللأوعية الدموية 41. لذلك ، من المحتمل أن تؤدي الطرق المختلفة لتوصيل الناقل الفيروسي إلى السائل الدماغي الشوكي نتائج مختلفة.
وتجدر الإشارة إلى أن الحقن داخل السائل الدماغي النخاعي لبعض متغيرات AAV ترتبط بآثار جانبية معينة. ثبت أن التوصيل داخل القراب أو داخل البطين ل AAV9 يؤدي إلى التعبير الجيني ليس فقط في الجهاز العصبي المركزي ولكن أيضا في الأعضاء الطرفية42،43. لنقل أكثر كفاءة للخلايا العصبية في جميع أنحاء الدماغ, مطلوب جرعات ناقلات عالية. على سبيل المثال ، تلقت فئران Sprague-Dawley البالغة حقنة أحادية الجانب من AAV9 في البطين الجانبي في ثلاث جرعات: 3.1 ميكرولتر و 15.5 ميكرولتر و 77.5 ميكرولتر42. تلقت الفئران AAV9 بحجم إجمالي قدره 10 ميكرولتر في صهريج ماجنا43. تتمثل فائدة طريقتنا في حقن الفيروس في أننا استخدمنا حجما أقل للناقل (1 ميكرولتر) من تلك المستخدمة في توصيل AAV داخل القراب أو داخل البطين. يقلل الحجم المنخفض للفيروس بشكل كبير من خطر التعبير الفيروسي خارج الدماغ والسمية أيضا.
على الرغم من أننا لم نفحص التعبيرات الفيروسية خارج الدماغ ، فمن المحتمل جدا أن يؤدي إعطاء AAV2 تحت العنكبوتية من خلال سطح الدماغ إلى تعبير فيروسي حصريا في الدماغ (على وجه التحديد في القشرة المخية الحديثة). ويستند افتراضنا إلى الأسباب التالية. AAV9 هو فيروس مؤتلف مرتبط بالغدة يمكنه عبور الحاجز الدموي الدماغي (BBB) ويستخدم بشكل شائع في نقل الجهاز العصبي المركزيالعالمي 37،44. ومع ذلك ، فإن تغلغل BBB ونقل أنسجة المخ محدود مع AAV245. علاوة على ذلك ، أظهر تحليل شرائح دماغ الفأر بعد الحقن تحت العنكبوتية للفيروس أن الخلايا المنقولة كانت موجودة حصريا في القشرة المخية الحديثة لنصف الكرة الأرضية المماثل (المحقون). لم يتم العثور على خلايا منقولة في القشرة المخية الحديثة المقابلة أو هياكل الدماغ الأخرى ، مما يشير إلى أن نقل الأعضاء الطرفية بهذه الطريقة من الحقن أمر غير مرجح للغاية.
بالإضافة إلى منطقة العدوى الكبيرة ، تسمح طريقة حقن الفيروس تحت العنكبوتية بالنقل الانتقائي للخلايا العصبية الهرمية من الطبقة الخامسة ، حتى مع استخدام محفزات قوية غير انتقائية مثل CAG. من المعروف أن ضمان التعبير الانتقائي حتى مع مروجين محددين أمر صعبللغاية 1،26. على سبيل المثال ، يجب أن يصيب محفز CaMKII الذي استخدمناه نظريا الخلايا العصبية الجلوتاماتيرجية بشكل تفضيلي. ومع ذلك ، كما هو موضح في النتائج هنا ودراسات أخرى ، عند استخدامه ، يحدث أيضا نقل أنواع أخرى من الخلايا ، على وجه الخصوص ، الخلايا العصبية الداخلية GABAergic46. علاوة على ذلك ، نظرا لأنه مع الحقن تحت العنكبوتية ، يتم نقل الخلايا على مسافة كبيرة من موقع الحقن ، فإن هذه الطريقة تساعد في الحفاظ على أنسجة المخ للتسجيلات البصرية أو الفيزيولوجية الكهربية اللاحقة للنشاط العصبي. لقد استخدمنا بنجاح حقن الفيروس تحت العنكبوتية في تجارب التحفيز البصري الوراثي والتسجيل خارج الخلية لنشاط الخلايا العصبية الهرمية L5 للقشرة البصرية للفأر في الجسم الحي32.
هذا العمل هو جزء من دراستنا واسعة النطاق حول آليات اللدونة في القشرة البصرية ، حيث استخدمنا AAV2 للتعبير عن قناة رودوبسين في الخلايا العصبية الهرمية للقشرة البصرية للفأر32. مع هذا النمط المصلي ، اكتسبنا الكثير من الإحصائيات ، وفي الواقع ، طورنا طريقة الحقن تحت العنكبوتية. في التجارب التجريبية ، جربنا أيضا الحقن تحت العنكبوتية للفيروس بالنمط المصلي 2/9 وحصلنا على نتائج مماثلة ، على الرغم من أننا لم نقم بإجراء تحليل مورفومتري مفصل في هذه الحالة. لسوء الحظ ، من المستحيل التنبؤ بكيفية تصرف الأنماط المصلية الأخرى بعد إعطاء تحت العنكبوتية وأي نمط مصلي للفيروس سيوفر أكبر منطقة نقل ؛ لا يمكن تحديد ذلك إلا تجريبيا ، الأمر الذي يتطلب قدرا كبيرا من العمل. في هذا العمل ، أظهرنا بشكل مقنع أنه يمكن حقن AAV2 في الفضاء تحت العنكبوتية لدماغ الفأر البالغ ، مما يؤدي إلى نقل واسع النطاق مع تعبير انتقائي للجين المستهدف في الخلايا العصبية الهرمية للطبقة الخامسة من القشرة المخية الحديثة والتعبير غير الانتقائي في الطبقات فوق الحبيبية.
تتمثل الخطوة الأكثر أهمية في استخدام هذه الطريقة لحقن الفيروس تحت العنكبوتية في ضمان الحجم الأمثل للثقب في مادة الجافية ، والتي يجب أن تتطابق تماما مع قطر إبرة الحقن. يجب أن تطوق الجافية الإبرة بإحكام ، وبالتالي تمنع ارتجاع الفيروس أثناء الحقن. لقد أطلقنا على هذه الطريقة اسم الحقن تحت العنكبوتية ، لكن ليس من الواضح ما إذا كان الفيروس ، بالإضافة إلى الفضاء تحت العنكبوتية ، يدخل وينتشر أيضا في الفضاء تحت الجافية (المسافة بين العنكبوتية والأم الجافية). كما أنه ليس من الواضح ما إذا كانت هذه الطريقة ستعمل في الأخرى ، وخاصة في الفئران ، أو مع الأنماط المصلية الأخرى ل AAV.
في السابق ، وصف Xinjian Li وزملاؤه طريقة نقل الخلايا العصبية بناء على التسريب الفيروسي على سطح القشرة. استخدموا ماصة زجاجية ذات قطر عريض على السطح القشري لضخ مراسل الكالسيوم الفيروسي AAV-GCaMP6 في القشرة. باستخدام هذه الطريقة ، تدخل الجسيمات الفيروسية ، على الأرجح ، على غرار هذه الحالة ، إلى الطبقات العليا من القشرة المخية الحديثة ، حيث يتم التقاطها بواسطة الخلايا العصبية. وجد المؤلفون أن ضخ الفيروس السطحي القشري يصنف الخلايا العصبية بكفاءة في الطبقات السطحية مع تجنب الخلايا العصبية ذات الطبقة العميقة47. ليس من الواضح تماما سبب عدم إظهار العمل المذكور نقل الخلايا العصبية الهرمية من الطبقة الخامسة ، على غرار ما لاحظناه في دراستنا.
فرضيتنا القائلة بأنه بعد إعطاء تحت العنكبوتية ، يتم التقاط الفيروس بواسطة تشعبات الخلايا العصبية المتفرعة في الطبقات فوق الحبيبية لديه ضعف ملحوظ واحد. بالإضافة إلى الأهرامات الكبيرة للطبقة الخامسة ، تحتوي الخلايا العصبية الهرمية للطبقة الرابعة48 والخلايا الهرمية L6 المسقطة49 في القشرة البصرية للفأر على التشعبات التي تصل إلى الطبقة الأولى. لذلك ، ليس من الواضح سبب عدم نقل هذه الخلايا بحقن الفيروس تحت العنكبوتية. أحد التفسيرات المحتملة هو أن تلك الخلايا التي تكون التشعبات فيها سميكة بما يكفي لنقل الجسيم الفيروسي إلى جسم الخلية هي فقط مصابة - أي أهرامات L5. لقد ثبت أنه في القشرة البصرية للفئران ، ترسل الخلايا العصبية الهرمية من الطبقة الرابعة تغصنات رقيقة واحدة فقط إلى الطبقة الأولى من القشرة المخيةالحديثة 48. ومع ذلك ، هناك حاجة إلى مزيد من الدراسات لتحديد سبب نمط العدوى الملحوظ بعد حقن الفيروس تحت العنكبوتية.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم تنفيذ العمل بدعم مالي من مؤسسة العلوم الروسية ، بمنحة 20-15-00398P.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
References
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved