Method Article
通过蛛网膜下腔注射 AAV2 广泛转导小鼠新皮层神经元
摘要
描述了一种使用蛛网膜下腔病毒输注广泛递送腺相关病毒的新技术。这种方法不仅确保了小鼠新皮层神经元在表层的广泛转导,而且即使在使用非选择性启动子时,也导致转基因在第 5 层锥体神经元中的选择性表达。
摘要
重组腺相关病毒是一种灵活而强大的工具,用于递送和表达实验生物学的许多领域,尤其是神经科学领域的各种目标基因。在特定大脑区域驱动所需转基因表达的最流行方法是将 AAV 载体直接注射到脑实质中。然而,这种方法不允许某些 体内 实验所需的广泛神经元转导。在本文中,我们提出了一种基于病毒输注到大脑蛛网膜下腔的小鼠新皮层中广泛基因表达的新技术。这种神经元标记方法不仅确保了成年小鼠浅表新皮层中神经元的广泛转导,而且即使在使用强非选择性启动子(如 CAG)时,也会导致转基因在大量第 5 层锥体神经元中表达,具有高特异性。此外,由于细胞转导发生在距离注射部位很远的地方,因此这种方法可以帮助保存脑组织,以便随后对神经元活动进行光学或电生理记录。
引言
哺乳动物的大脑由许多抑制性、兴奋性和调节性细胞组成,这些细胞通过数万亿个突触相互连接成回路1。神经科学的核心挑战之一是解码不同细胞类型在大脑回路和行为的组织和功能中的作用。纵大脑内遗传定义的细胞需要引入和表达转基因的方法。基于病毒的基因递送系统是迄今为止将基因递送到中枢神经系统的最有效和最简单的方法2。病毒递送系统基于复制病毒(腺病毒、腺相关病毒 (AAV)、慢病毒和逆转录病毒),这些病毒能够将遗传信息递送到宿主细胞中 2,3。
基于 AAV 的载体现已成为将所需转基因递送到大脑内细胞的最广泛使用的工具之一,既可用于基础神经科学研究,也可用于开发神经系统疾病的基因疗法。与其他病毒相比,复制缺陷型 AAV 具有许多特性,使其成为实现这些目的的理想载体。最值得注意的是,AAV 载体可有效转导非分裂(终末分化)细胞,例如神经元和神经胶质细胞,从而在体内产生高水平的转基因表达 2。载体可以很容易地以适合体内使用的高功能滴度产生 3,4,5。重要的是,腺相关病毒介导的体内基因递送不会产生组织病理学改变和载体相关毒性6。与腺病毒载体不同,在动物模型中体内施用 AAV 载体通常不会引发宿主对转导细胞的免疫反应,从而能够在脑实质内长时间稳定表达转基因 2,7,8。
AAV 载体受欢迎的另一个原因是 AAV 血清型的广泛,具有独特的组织和细胞型嗜性9、10、11、12、13、14。由不同 AAV 血清型表达的不同衣壳蛋白导致使用不同的细胞表面受体进入细胞,因此具有特异性嗜性10,14。
AAV 嗜性不仅由衣壳蛋白决定,还由许多其他因素决定14。已经表明,AAV 血清型 1、2、6、7、8 和 9 在原代培养物中转导神经元和星形胶质细胞15,16,但在脑实质内注射后表现出强烈的神经元嗜性17,18。用于 AAV 载体制备的方法也可以影响神经细胞的嗜性,即使对于相同的血清型也是如此。例如,CsCl 纯化的 AAV8 在脑实质内注射后具有很强的星形胶质细胞嗜性,而碘克沙醇纯化的 AAV8 在相同条件下注射后仅转导神经元19。AAV 趋向性也可能受注射剂量和体积14 的影响。例如,高滴度 rAAV2/1 可有效转导皮层兴奋性神经元和抑制性神经元,但使用较低滴度暴露了对皮层抑制性神经元转导的强烈偏好20。
因此,仅基于衣壳血清型是不可能实现稳健的细胞类型特异性的。细胞类型特异性启动子可用于克服 AAV 衣壳的广泛天然嗜性。例如,人突触蛋白 I 用于靶向神经元21,CaMKII 启动子可以驱动具有高特异性的谷氨酸能兴奋性神经元中的转基因表达 20,ppHcrt 启动子靶向下丘脑外侧表达下丘脑素 (HCRT)的神经元 22,PRSx8 启动子靶向表达多巴胺 β-羟化酶的去甲肾上腺素能和肾上腺素能神经元23,GFAP 启动子可以驱动星形胶质细胞特异性表达24。然而,一些细胞特异性启动子的转录活性较弱,无法驱动足够水平的转基因表达25。此外,适合 AAV 病毒载体的短启动子通常不保留细胞类型特异性 1,26。例如,已经表明 CaMKII 构建体也转导了抑制性神经元12。
除了细胞类型特异性(趋向性)外,AAV 的另一个重要特征是转导效率。各种 AAV 血清型具有不同的扩散特性。AAV2 和四种病毒载体不易通过脑实质扩散,因此在较小的区域介导转导17,27。在 AAV 血清型 1、9 和 rh.1011、17、18、19、28 中观察到最广泛的神经元转导。
在特定大脑区域驱动所需转基因表达的最常用方法是将 AAV 载体直接注射到感兴趣的大脑区域(实质)3。实质内注射后,即使是通过脑转导传播更有效的 AAV 血清型,通常也只在注射部位周围的局部区域 12。此外,实质内注射是一种侵入性手术,会导致感兴趣区域附近的组织损伤。因此,这种病毒注射方法不适用于某些实验任务。例如,在旨在研究自由移动动物的皮层神经元功能的实验中,包括使用单光子或双光子显微镜 29,30,31,32,非常需要对细胞进行广泛标记。
在这里,我们描述了一种新的腺相关病毒注射技术,该技术使用蛛网膜下腔病毒输注在成年小鼠中提供新皮层神经元的广泛转导,并保留脑组织用于随后的神经元活动的光学或电生理记录。这种方法不仅确保了浅表新皮层神经元的广泛转导,而且即使在使用强非选择性启动子(如 CAG)时,也会导致转基因在大量第 5 层锥体神经元中表达,具有高特异性。
研究方案
对 2-4 个月大的成年 C57Black/6 小鼠进行实验,男女(Pushchino 育种中心,RAS Shemyakin-Ovchinnikov 生物有机化学研究所分部)。将小鼠饲养在温控饲养箱 (22 °C ± 2 °C,12 h 光照/黑暗循环,08.00 h开灯)中, 随意进食和水。所有实验程序均按照 ARRIVE 指南和动物实验指令 2010/63/EU 进行。该研究方案已获得 IHNA RAS 伦理委员会的批准(2022 年 2 月 1 日的方案 N1)。我们尽一切努力减少动物的痛苦并确保结果的可靠性。
1. 手术准备
- 手术开始前对所有手术器械进行消毒。使用 70% 乙醇清洁手术区域。
- 检查麻醉系统中的异氟醚水平,并在需要时填充。将干净的纸巾放在感应室底部。
- 将加热垫放在立体定位框架上。用干净的纸巾盖住垫子。
- 准备一个装有 2% 漂白剂的瓶子,以收集微量移液器吸头、试管、棉签和其他与病毒接触的物品。
- 从 -80 °C 冰箱中取出等分试样 AAV,并将其置于冰上解冻。
2. 注射器制备
- 用 33G 钝性 RN 针头清洁 5 μL Hamilton 微量注射器。吸出,然后分配 70% 乙醇。用新鲜乙醇重复 3 次。用蒸馏水冲洗注射器以去除多余的乙醇。重复 3 次。
- 取出柱塞,使用胰岛素注射器通过法兰向枪管中注入凡士林油。确保微型注射器中没有气泡。
注:滞留的空气可压缩,会影响注射器的准确度和精密度。 - 将柱塞放回微量注射器中并分配一滴油。将注射器放入立体定位注射器中,使刻度可见,以便监测分配的溶液体积。
3. 小鼠手术准备
- 给鼠标称重。将鼠标放入与异氟醚相连的麻醉诱导室中。打开设置为 5% 的异氟醚蒸发器,并将流速调节至 250 mL/min。在 5 到 7 分钟内达到足够的麻醉深度。
- 为了验证手术麻醉的水平,请检查在后爪痛苦的捏合过程中是否有拂动和撤退反射,以及眼神接触时是否有眨眼。
- 将蒸发器流出阀从感应室切换到立体定位面罩。将异氟醚降低至 1.8%-2.0%,并根据小鼠体重设定流速(体重在 25 至 35 g 之间的小鼠为 70-90 mL/min)。
- 从诱导室中取出鼠标,并将其放置在加热垫 (37 °C) 顶部的立体定向装置中,以防止手术麻醉期间体温过低。将门牙放入齿条中,然后安装动物面具。
- 小心地将动物放在耳杆上。立体定向器中正确的头部位置允许头部垂直移动,但不能横向移动。确保动物的姿势不会造成痛苦。在整个手术过程中仔细监测麻醉深度、动物呼吸和体温。
- 从眼睛到耳后剃光头部。用 70% 乙醇擦拭清洁剃光的头部表面,然后用 5% 的碘酒精溶液擦拭。
- 涂抹眼凝胶以防止眼睛干涩。局部涂抹 4% 利多卡因溶液,皮下注射地塞米松(0.02 mL,4 mg/mL),以防止手术相关疼痛并减少可能的炎症反应。
- 用无菌手术刀刀片和剪刀,沿着头部中线切开 4-5 毫米长的切口,以打开头皮。从耳朵之间的一个小切口开始,然后用剪刀将其扩大,以避免损坏颅骨。
- 用少量 3% 的过氧化氢擦拭颅骨表面,以观察立体定位标志:前囟和 lambda。立即用 0.9% NaCl 盐水终止反应。用骨刮刀刮掉颅骨顶部的组织。
- 将带有 Hamilton 注射器的预制电动注射器安装在立体定位臂上。将手术光源对准暴露的颅骨,并将显微镜聚焦在前囟上。
- 通过显微镜观察,纵立体定向装置的臂,使针头顶部直接在前囟上居中。
- 使用针尖,水平对齐前囟和 lambda,然后将臂移回前囟并记录坐标。使用这些前囟坐标和感兴趣区域的图谱坐标来计算目标区域的相对坐标。
- 将针移动到目标区域。在新坐标处放下指针并标记此位置。在考虑病毒传播的同时,选择靠近目标区域的病毒显微注射部位。
注意:这将避免损坏感兴趣区域中的组织。我们对感兴趣区域使用以下坐标:AP-3.4、ML -2.0 和病毒显微注射:AP-2.0、ML -1.4。如果要感染初级视觉皮层神经元,上述坐标是最佳的。 - 如果可能,请避开血管较大的区域。在手术显微镜下,明亮的冷光照明和 0.9% NaCl 盐水浸泡,颅骨和大脑表面的大血管应该变得明显。
4. 病毒注射
- 取无菌牙针(直径 0.5 - 0.8 毫米)。通过手术显微镜观察颅骨表面,手动(手动)或使用微钻进行小开颅手术。注意不要对颅骨施加过大的压力。
- 将臂移开,以防止在开颅手术(孔)钻孔期间损坏微型注射器针头。浸入 0.9% NaCl 盐水并间歇暂停,以避免加热骨骼和损坏硬脑膜。使用加压空气吹走骨尘。
注意: 以下类型的硬质合金牙针是合适的:梨形(最好)、圆形圆柱体和圆形。- 用车针减薄骨头时,确保整个圆周的减薄均匀。这将使在不损坏硬脑膜的情况下更容易去除骨头。为此,请先使用圆头车针,然后使用平头车针。保持车针垂直于骨头;否则,一侧将比另一侧更薄。
注意:此外,车针的尺寸越小,开颅手术越小,作就越复杂。当进一步使用动物进行 体内 工作时,建议进行较小直径 (0.5-0.6 mm) 的开颅手术。如果计划使用动物的大脑进行 离体 工作,则可以接受更大的开颅手术直径以简化手术。
- 用车针减薄骨头时,确保整个圆周的减薄均匀。这将使在不损坏硬脑膜的情况下更容易去除骨头。为此,请先使用圆头车针,然后使用平头车针。保持车针垂直于骨头;否则,一侧将比另一侧更薄。
- 当变薄的骨头柔软透明时,停止钻孔。当骨骼中形成足够大的凹痕时,请经常停止旋转并监测骨骼的厚度。骨骼裂缝的出现表明变薄就足够了。
- 用无菌盐水给孔洗澡,然后用棉签去除多余的盐水。使用带有钩形尖端的 27G 针头和/或使用细尖镊子去除剩余的骨头层。避免损坏硬脑膜。
- 用一张蘸有盐水的无菌纸巾盖住颅骨表面。在纸张上方的鼠标头骨表面放置一块干净的透明薄膜。
- 将立体定位臂向后移动,并将微注射器针头定位在胶片正上方的位置。分配多余的油,直到体积达到 2 μL。
注意: 油的最终体积可能会根据微型注射器的体积而变化。我们使用了 5 μL 75-RN Hamilton 微量注射器。 - 将等于注射体积 + 2 μL 的病毒体积移液到一块透明薄膜上。
- 通过手术显微镜观察,将手臂向下降低,直到针尖位于病毒液滴的中心。使用电动注射器将病毒装入微量注射器中。将微量移液器的尖端和透明薄膜丢弃到装有 2% 漂白剂的瓶子中。
- 从颅骨表面取出蘸有盐水的纸,然后用棉签擦干颅骨。使用立体定位臂将针头定位在插入部位上方。
- 分配一滴病毒以确保针头没有堵塞。使用带有钩形尖端的 30 G 针在硬脑膜上划一个小口。
注意:重要的是在硬脑膜上开出尽可能小的缝隙,让针头进入,而不会在针头和硬脑膜之间留下缝隙,否则病毒可能会从中泄漏。 - 将注射器的针头降低到硬脑膜,并对深度进行适当的计算。估计相对于针头首次接触皮层表面的点的插入点的皮质深度。
- 将针尖缓慢插入皮层至 300 μm 的深度。等待 2-3 分钟,让硬脑膜粘附在针头上,然后慢慢将针头缩回 200 μm 的深度。再等待 2-3 分钟,让脑组织沉淀。这导致针头将硬脑膜向上拉,为病毒传播创造一个硬膜下空间。
注意:为了尽量减少皮质损伤,请使用 33 G 针或更低的 G 针。请记住,吸头的内径越小,组织回流堵塞它的可能性就越大。使用钝针而不是斜针很重要,因为钝针会更受控地排出一滴病毒溶液。- 如果针头在降低到 150-200 μm 时没有穿过硬脑膜,而是弯曲了它,请停止下降。提起针头并在硬脑膜上做一个稍大的切口,然后再次尝试放下针头。
- 如果在放下针头时脑脊液开始从切口主动渗出,请等到它停止渗漏;否则,很难控制针头穿过硬脑膜。用纸巾尖端吸干多余的脑脊液。液体停止流动后,提起针头并重试。
- 以 0.06 μL/min 的速率开始注射病毒悬浮液,同时监测分配的体积。注射 1 μL 病毒。以单一深度注射病毒,以免破坏针头和皮质组织之间的密封。
- 故障排除:在注射开始时,病毒可能会回流到大脑表面。停止注射,等待 2-3 分钟,然后继续病毒注射。重复这些作(步骤),直到病毒回流停止。病毒和脑脊液会粘在针头上并防止回流。
- 另一种阻止病毒回流的方法,在皮层表面放置少量琼脂糖。它会抑制皮层的脉动,也有助于密封针头。但请确保移液器没有被琼脂糖堵塞。
- 由于针头在降低时可能无法完全穿过硬脑膜,而只是部分穿过,因此针头的一侧可能无法紧紧贴合硬脑膜,从而导致病毒回流。在这种情况下,请慢慢地将针头从组织中抽出,然后再次尝试放下。
- 输注完成后,将针头保持在目标位置再 10 分钟。这使得病毒可以从注射部位扩散开来。将针头慢慢从大脑中缩回,以防止病毒从针道中涌出。
- 针头拔出完成后,喷出一小滴病毒检查它是否被堵塞。使用 5-0 可吸收或不可吸收缝合线闭合皮肤切口。
5. 术后护理
- 闭合切口后,局部涂抹抗菌软膏。皮下注射生理盐水 (5 mL/kg) 和 5% 葡萄糖 (5 mL/kg) 的混合物,以防止脱水并促进麻醉后恢复。肌肉注射酮洛芬 (2.5 mg/kg) 以减轻疼痛。
- 将动物放在加热垫顶部的新笼子中并监测,直到它从麻醉中恢复。老鼠反应过后,将动物放在它们的家笼中。
6. 组织学
- 如步骤 3 中所述,不早于病毒注射后 21 天用异氟醚深度麻醉小鼠。
- 使用窄剪刀沿胸部区域做一个中线切口(10 -15 毫米),露出胸腔。小心地分开隔膜并用剪刀打开胸部。
- 将 22G 1 1/2 针插入左心室,并用剪刀在右心房切开。灌注 50 mL 预冷的 100 mM 磷酸盐缓冲盐水 (PBS),然后灌注 100 mL 预冷的 10% 缓冲福尔马林。
- 小心地提取整个小鼠大脑。为此,请使用剪刀沿头皮中心做矢状切口。接下来,使用平尖骨钳从矢状缝线和 lambdoid 缝合线的交点开始,向前到鼻骨,逐块去除颅骨。当大脑暴露时,切开嗅球,用弯曲的刮刀将大脑放松,然后将其放入含有 50% 缓冲福尔马林的 10 mL 管中。
- 一夜之间修复大脑。使用组织粘合剂将脑组织安装在振动切片机的金属平台上。使用碳钢刀片切割厚度为 50 μm 的正面切片。
7. 免疫染色
- 第 1 天
- 用 1x PBS 清洗脑切片 3 次,每次 5 分钟,用 1x PBS 含有 0.3% Triton X-100 (PBS-T)。在室温 (RT) 下将切片在 PBS-T 中孵育 20 分钟。
- 使用由 5% 正常山羊血清 (NGS) 和 0.3% Triton X-100 在 1x PBS 中组成的封闭缓冲液,在 RT 下阻断非特异性结合 1 小时。
- 将切片在4°C下与在封闭缓冲液中以1:500稀释的针对小白蛋白或钙结合蛋白的一抗(5%NGS和0.3%Triton X-100在1x PBS中)孵育过夜。
- 第 2 天
- 在 PBS-T 中洗涤切片 3 次,每次 10 分钟。在室温下与在封闭缓冲液(5% NGS 和 0.3% Triton X-100 在 1x PBS 中)中以 1:500 稀释的二抗(山羊抗兔 IgG (H+L) 交叉吸附二抗,Alexa Fluor 546)在黑暗中孵育 2 小时。
- 在 1x PBS 中洗涤切片 3 次,每次 5 分钟。使用软刷将脑切片转移到载玻片上。
- 立即向每个切片中加入 0.1 mL 的抗淬灭封固剂。用 22 mm x 50 mm 的盖玻片覆盖切片。
- 将共聚焦显微镜配置为 20 倍或 60 倍(A/1.4,油)的放大倍率。使用 488 nm 和 594 nm 波长的激光器获取感兴趣大脑区域的多通道图像。
结果
在一系列试点实验中,我们使用传统的皮层内注射方法,通过 AAV2 转导小鼠新皮层中的第 5 层锥体神经元,AAV2 携带 快通道视紫红质 (oChIEF) 基因,在 CaMKII 启动子下与 EGFP 荧光蛋白融合。与 AAV212 的特征一致,我们获得了相对较小的感染区域,宽度不超过 1 毫米(图 1A)。然而,在一些实验中,我们观察到 AAV2 的异常大扩散,在某些情况下覆盖了大脑半球一半以上的新皮层(图 1B)。我们假设,当病毒进入蛛网膜下腔并且脑脊液 (CSF) 流将病毒载体传播到大脑表面时,可能会发生如此广泛的病毒分布。我们注意到,当注射针插入深度较小 (<200 μm) 并且硬脑膜上的孔的大小与针头的直径完全匹配时,就会发生这种情况,从而防止病毒颗粒的悬浮液回流。为了可视化这个过程,我们在注射的病毒颗粒悬浮液(n = 3 只小鼠)中添加了红色荧光纳米颗粒。注射后 3 周,用 10% 缓冲福尔马林经心脏灌注小鼠,小心地从颅骨中取出大脑,而不损伤硬脑膜。在落射荧光双目显微镜下对整个大脑的检查显示,红色荧光颗粒的广泛分布略超过绿色荧光通道中可见的神经元感染区域(图 2)。对这些小鼠大脑矢状切片的分析表明,荧光颗粒位于软脑膜的薄层中,没有深入脑实质,而表达金星的神经元,与之前的实验一样,在第 2/3 层和第 5 层中大量发现。
除了 AAV2_CaMKII_oChIEF EGFP 病毒(使用浓度为 1.49 x 1012 vg/mL)外,我们还进行了 AAV2_CaMKII_Venus (7.31 x 1012 vg/mL) 和 AAV2_CAG_GCamp6s (7.3 x 1013 vg/ml) 病毒的蛛网膜下腔给药,并获得了类似的结果。这很重要,因为正如已经表明的那样,相同血清型的病毒可以提供不同大小的转导区域,具体取决于所使用的启动子和靶基因12。
为了系统地比较传统和蛛网膜下腔病毒给药后的转导区域,我们计算了连续 50 μm 厚的大脑切片中中外侧和前尾方向的感染区域的大小。研究发现,与脑实质内给药(1.7 ± 0.52 毫米(n = 15 只小鼠)相比,病毒的病毒< 0±.00001,中外侧方向的 t 检验和 2.35 ± 0.8 毫米(n=14 只小鼠)与 0.84 ± 0.29 毫米(n = 6 只小鼠)相比,p < .0003, 前尾方向的 t 检验; 图 3A)。
对蛛网膜下腔病毒注射转导的小鼠脑切片的显微镜观察显示,第 2/3 层和第 5 层存在非常广泛的转导,而第 4 层和第 6 层几乎没有转导的细胞(图 3B)。在第 4 层中,只有第 5 层金字塔的荧光树突清晰可见(图 3B)。在第 6 层和白质中追踪荧光轴突 (图 3C)。蛛网膜下腔注射后的这种转导模式可能是由于病毒从蛛网膜下腔扩散到皮层的第 1 层(可能更深),神经元树突在那里捕获它。因此,只有在上层具有强烈分支的神经元才会被感染。众所周知,GABA 能中间神经元主要在局部分支。如果我们的假设是正确的,那么病毒的蛛网膜下腔给药应该会导致中间神经元在颗粒上层转导,但在亚颗粒层不会导致转导。为了检验这一假设,我们对蛛网膜下腔注射 AAV2_CaMKII_Venus 病毒后小鼠的脑切片进行了免疫化学染色,该抗体针对两种不同功能类别的 GABA 能中间神经元的标志物:小白蛋白和钙结合蛋白。
为了确定通过蛛网膜下腔注射病毒转导的中间神经元的数量,我们进行了形态学分析,计算转导细胞的总数(绿色染色)、免疫阳性神经元的数量(红色染色)和 750 x 750 μm 切片(50 μm 切片厚度)上的双标记细胞数量。
在用小白蛋白抗体染色的脑切片上,在超颗粒层中,绿色标记的神经元数量平均为 57.4 ± 9.8,红色标记的小白蛋白阳性中间神经元数量分别为 9.6 ± 3.8,其中 4.1 ± 2.4 (42.7%) 是双标记的 (n = 10 制剂)。相比之下,我们在新皮层第 5 层计数了 14 ± 4.8 个病毒转导的神经元和 19.1 ± 4.5 个小白蛋白阳性神经元,并且没有检测到任何双标记细胞 (n = 10 个制剂)。
当我们检查钙结合蛋白免疫化学染色的切片时,我们发现在颗粒上层中,平均有 21.1 ± 4.5 个病毒转导的神经元和 6.1 ± 2.6 个钙结合蛋白阳性细胞,其中 4.2 ± 1.9 个细胞同时带有两个标记 (69.1%;n = 10 个制剂)。在第 5 层,我们计数了 19 ± 2.1 个转导的神经元,15.9 ± 5.7 个钙结合蛋白中间神经元,其中 1.1 ± 1.5 个 (6.9%) 显示双重染色。然而,应该注意的是,第 5 层中 100% 的双标记神经元具有清晰可见的金字塔形状,这可能表明存在钙结合蛋白阳性锥体神经元或抗体的一些非特异性。因此,在第 5 层中没有观察到通过蛛网膜下腔注射病毒转导的真正钙结合蛋白中间神经元。
因此,虽然第 2/3 层的转导神经元中确实存在小白蛋白和钙结合蛋白阳性细胞(图 4A,C),但在第 5 层中没有检测到转导的中间神经元,并且所有表达 EGFP 的细胞都被目视识别为锥体神经元(图 4B,D)。

图 1:常规皮质内和蛛网膜下腔病毒注射后 AAV2 转导区域的比较。 (A) CaMKII_oChieff_EGFP构建体在注射到脑实质后 21 天扩散到 500 - 600 μm 的深度。(B) 蛛网膜下腔给药后 CaMKII_oChieff_EGFP 在同一动物的另一个半球的扩散。显示了距注射部位前尾方向 200-300 μm 处的额切片。比例尺 - 1 毫米。 请单击此处查看此图的较大版本。

图 2:具有完整硬脑膜的整个大脑的照片,显示 AAV2_CaMKII_Venus 病毒的传播和蛛网膜下腔注射的红色 FluoSpheres。 (A) 添加到注射病毒悬浮液中的红色纳米颗粒的荧光,显示注射体积在蛛网膜下腔的物理扩散。(B) 绿色荧光通道中的同一大脑半球显示了 Venus 表达区域。注射部位由箭头指示。此外,还会标记 lambda 的位置。比例尺 - 1 毫米。 请单击此处查看此图的较大版本。

图 3:病毒蛛网膜下腔注射导致新皮层第 2/3 层和第 5 层神经元的广泛感染。 (A) 皮层内 (i) 和蛛网膜下腔 (s) 病毒注射后转导区域(中外侧 (m/l) 和头尾 (r/c) 方向)的比较。条形表示平均值;须线表示标准差(**** - p < 0.0001;*** - p < 0.001;t 检验)。(B) 共聚焦显微照片显示蛛网膜下腔注射 AAV2_CaMKII_Venus 病毒后小鼠新皮层中的 Venus 表达。层边界示意图 (L1 - L6)。(C) 图像片段 (B),以不同的亮度和对比度设置显示,以展示荧光轴突穿过第 6 层和白质 (WM)。比例尺为 100 μm。 请单击此处查看此图的较大版本。
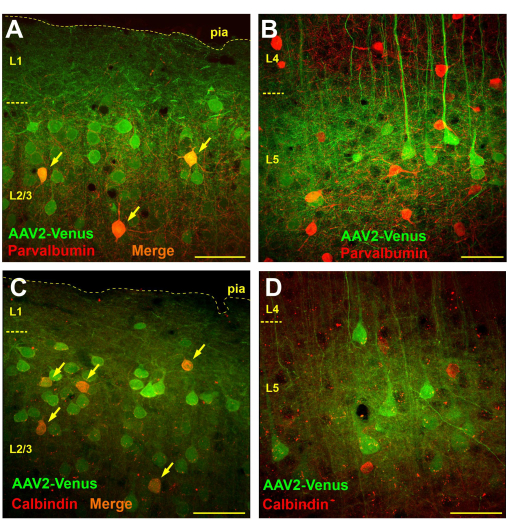
图 4:蛛网膜下腔病毒注射导致新皮层的上层而不是亚颗粒层的中间神经元转导。 (一、二)通过蛛网膜下腔注射 AAV2_CaMKII_Venus 病毒和小白蛋白抗体(Alexa594 偶联的二抗)对小鼠的脑切片进行免疫化学染色。同时带有绿色和红色标签的神经元显示为橙色(由箭头表示)。(C、D)蛛网膜下腔注射AAV2_CaMKII_Venus后小鼠脑切片的显微照片,用钙结合蛋白抗体染色。请注意 L5 中没有双标记神经元。比例尺为 50 μm。 请单击此处查看此图的较大版本。
讨论
我们开发了一种通过将 AAV2 病毒颗粒悬浮液注射到大脑蛛网膜下腔来转导小鼠新皮层神经元的新方法。这提供了广泛的病毒分布,几乎是直接将相同数量的病毒注射到脑实质时感染的组织体积的四倍。
通过不同途径(例如,脑室内、鞘内或脑池内)将病毒载体直接注射到脑脊液 (CSF) 中是在整个 CNS 中广泛传递基因的一种流行策略 33,34,35。然而,由于对室管膜细胞的高亲和力,在成人脑中脑室内或鞘内施用 AAV2 载体会导致有限的脑转导 28,33,36,37。室管膜细胞被发现为单层细胞,排列在第三和第四脑室以及脊髓中央管38。脑室中室管膜细胞之间存在紧密连接是某些 AAV 血清型的重要障碍,这些血清型必须从脑室穿过这些细胞才能在脑实质内扩散39。
在我们的工作中,通过脑表面将 AAV2 病毒载体注射到蛛网膜下腔导致成年小鼠新皮层神经元的广泛转导。有证据表明,软脑膜物质在 CNS 的不同区域具有不同的结构。由于软脑膜的两层性质,脊髓软脑膜(围绕脊髓)中的膜比颅脑软脑膜(围绕大脑)厚得多40。研究还表明,心室 CSF 进入脑实质的程度最小,而蛛网膜下腔 CSF 沿血管旁间隙迅速进入脑实质41。因此,病毒载体递送到 CSF 的不同途径可能会产生不同的结果。
应该注意的是,一些 AAV 变体的 CSF 内注射与某些副作用有关。AAV9 的鞘内或脑室内递送已被证明不仅在 CNS 中导致基因表达,而且在外周器官中也导致基因表达42,43。为了更有效地在整个大脑中转导神经元,需要高载体剂量。例如,成年 Sprague-Dawley 大鼠以三种剂量将 AAV9 单侧注射到侧脑室中:3.1 μL、15.5 μL 和 77.5 μL42。小鼠在大池43 中接受总体积为 10 μL 的 AAV9。我们的病毒注射方法的优点是,我们使用的载体体积 (1 μL) 低于用于鞘内或脑室内 AAV 递送的载体体积。较低的病毒体积可显著降低病毒在大脑外表达的风险和毒性。
虽然我们没有检查大脑外的病毒表达,但通过脑表面给予 AAV2 极有可能导致病毒仅在大脑中表达(特别是在新皮层中)。我们的假设基于以下原因。AAV9 是一种重组腺相关病毒,可穿过血脑屏障 (BBB),常用于整体 CNS 转导37,44。然而,AAV245 限制了 BBB 穿透和脑组织的转导。此外,对蛛网膜下腔注射病毒后小鼠脑切片的分析表明,转导的细胞仅位于同侧(注射)半球的新皮层。在对侧新皮层或其他脑结构中未发现转导细胞,这表明通过这种注射方法转导外周器官的可能性非常小。
除了较大的感染区域外,蛛网膜下腔病毒注射方法还允许选择性转导第 5 层锥体神经元,即使使用强非选择性启动子(如 CAG)也是如此。众所周知,即使使用特定的启动子,也很难确保选择性表达 1,26。例如,我们使用的 CaMKII 启动子理论上应该优先感染谷氨酸能神经元。然而,正如这里和其他研究的结果所示,当使用它时,也会发生其他类型细胞的转导,特别是 GABA 能中间神经元46。此外,由于蛛网膜下腔注射时,细胞转导发生在距离注射部位很远的地方,因此这种方法有助于保存脑组织,以便随后对神经元活动进行光学或电生理记录。我们已经成功地将蛛网膜下腔病毒注射液用于体内小鼠视觉皮层 L5 锥体神经元活动的光遗传学刺激和细胞外记录的实验 32。
这项工作是我们关于视觉皮层可塑性机制的大规模研究的衍生产品,其中我们使用 AAV2 在小鼠视觉皮层32 的锥体神经元中表达通道视紫红质。凭借这种血清型,我们获得了大量统计数据,实际上,我们开发了蛛网膜下腔注射的方法。在试点实验中,我们还尝试了血清型 2/9 病毒的蛛网膜下腔注射,并获得了类似的结果,尽管在这种情况下我们没有进行详细的形态测量分析。不幸的是,无法预测其他血清型在蛛网膜下腔给药后的行为以及哪种病毒血清型将提供最大的转导区域;这只能凭经验来确定,这需要大量的工作。在这项工作中,我们令人信服地表明 AAV2 可以注射到成年小鼠大脑的蛛网膜下腔,导致广泛转导,靶基因在新皮层的第 5 层锥体神经元中选择性表达,在颗粒上层非选择性表达。
使用这种蛛网膜下腔病毒注射方法最关键的步骤是确保硬脑膜上孔的最佳大小,该孔必须与注射针的直径完全匹配。硬脑膜应紧紧包围针头,因此可以防止病毒在注射过程中回流。我们将这种方法称为蛛网膜下腔注射,但目前尚不清楚除了蛛网膜下腔外,病毒是否还进入并扩散到硬膜下腔(蛛网膜和硬脑膜之间的空间)。目前尚不清楚这种方法是否适用于其他动物,尤其是大鼠,或适用于其他 AAV 血清型。
此前,Xinjian Li 及其同事描述了一种基于皮质表面病毒输注的神经元转导方法。他们在皮质表面使用宽直径玻璃移液器将病毒钙报告基因 AAV-GCaMP6 注入皮层。使用这种方法,病毒颗粒可能与这种情况类似,进入新皮层的上层,在那里它们被神经元捕获。作者发现,皮质表面病毒输注有效地标记了浅层神经元,同时避开了深层神经元47。目前尚不完全清楚为什么引用的工作没有显示第 5 层锥体神经元的转导,类似于我们在研究中观察到的情况。
我们的假设是,在蛛网膜下腔给药后,病毒被在颗粒上层分支的神经元的树突捕获,这是一个明显的弱点。除了第五层的大金字塔外,小鼠视觉皮层中的第四层锥体神经元48 和幽闭突出的L6锥体细胞49 还具有达到第一层的树突。因此,目前尚不清楚为什么这些细胞不通过蛛网膜下腔病毒注射液进行转导。一种可能的解释是,只有那些树突足够厚以将病毒颗粒运输到细胞体的细胞才会被感染——即 L5 金字塔。已经表明,在小鼠的视觉皮层中,第 4 层锥体神经元仅将一个薄树突发送到新皮层48 的第 1 层。然而,需要进一步的研究来确定蛛网膜下腔病毒注射后观察到的感染模式的原因。
披露声明
作者声明没有利益冲突。
致谢
这项工作是在俄罗斯科学基金会的财政支持下进行的,资助 20-15-00398P。
材料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
参考文献
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。