Method Article
התמרה נרחבת של נוירונים ניאוקורטיקליים של עכברים על ידי הזרקה תת-עכבישית של AAV2
In This Article
Summary
מתוארת טכניקה חדשה להעברה נרחבת של נגיף הקשור לאדנו, המשתמשת בעירוי וירוס תת-עכבישי. שיטה זו לא רק מבטיחה התמרה נרחבת של נוירונים ניאו-קורטיקליים של עכברים בשכבות שטחיות, אלא גם מביאה לביטוי סלקטיבי של הטרנסגן בנוירונים פירמידליים בשכבה חמש, גם כאשר משתמשים במקדם לא סלקטיבי.
Abstract
נגיפים רקומביננטיים הקשורים לאדנו-הם כלי גמיש ורב עוצמה להעברה וביטוי של גנים שונים בעלי עניין בתחומים רבים של ביולוגיה ניסויית, במיוחד במדעי המוח. השיטה הפופולרית ביותר להניע את הביטוי של טרנסגן רצוי באזור מסוים במוח היא הזרקת וקטור AAV ישירות לפרנכימה של המוח. עם זאת, שיטה זו אינה מאפשרת התמרה עצבית נרחבת הנדרשת לחלק מניסויי in vivo . במאמר זה, אנו מציגים טכניקה חדשה לביטוי גנים נרחב בניאו-קורטקס של עכברים המבוססת על עירוי ויראלי לחלל התת-עכבישי של המוח. שיטת תיוג עצבית זו לא רק מבטיחה התמרה נרחבת של נוירונים בשכבות ניאו-קורטיקליות שטחיות של עכבר בוגר, אלא גם מביאה לביטוי של הטרנסגן באוכלוסייה גדולה של נוירונים פירמידליים בשכבה חמש עם ספציפיות גבוהה גם בעת שימוש במקדם חזק ולא סלקטיבי כגון CAG. יתר על כן, מכיוון שהתמרת תאים מתרחשת במרחק משמעותי מאתר ההזרקה, שיטה זו יכולה לסייע בשימור רקמת המוח לצורך הקלטות אופטיות או אלקטרופיזיולוגיות של פעילות עצבית לאחר מכן.
Introduction
מוח היונקים מורכב מתאים מעכבים, מעוררים ומווסתים רבים המחוברים זה לזה למעגלים על ידי טריליוני סינפסות1. אחד האתגרים המרכזיים של מדעי המוח הוא לפענח את תפקידם של סוגי תאים שונים בארגון ובתפקוד של מעגלי מוח והתנהגות. מניפולציה של תאים מוגדרים גנטית בתוך המוח דורשת שיטות להחדרה ולביטוי של טרנסגנים. מערכות העברת גנים מבוססות ויראלים הן ללא ספק השיטה היעילה והפשוטה ביותר להעברת גנים למערכת העצבים המרכזית2. מערכות אספקה ויראליות מבוססות על שכפול וירוסים (אדנו-וירוסים, וירוסים הקשורים לאדנו-וירוסים (AAVs), לנטי-וירוסים ורטרו-וירוסים) שיש להם את היכולת להעביר מידע גנטי לתא מארח 2,3.
וקטורים מבוססי AAV הפכו כעת לאחד הכלים הנפוצים ביותר להעברת טרנסגנים רצויים לתאים במוח, הן למטרות מחקר בסיסי במדעי המוח והן לפיתוח ריפוי גנטי למחלות נוירולוגיות. בהשוואה לנגיפים אחרים, ל-AAV פגומים בשכפול יש תכונות רבות שהופכות אותם לווקטורים אידיאליים למטרות אלה. בעיקר, וקטורי AAV מתמרים ביעילות תאים שאינם מתחלקים (מובחנים סופנית) כגון נוירונים ותאי גליה, וכתוצאה מכך רמות גבוהות של ביטוי טרנסגנים in vivo2. ניתן לייצר את הווקטורים בקלות בטיטר פונקציונלי גבוה המתאים לשימוש in vivo 3,4,5. חשוב לציין, העברת גנים בתיווך נגיף הקשור לאדנו in vivo אינה מייצרת שינויים היסטופתולוגיים ורעילות הקשורה לווקטור6. בניגוד לווקטורים אדנו-ויראליים, מתן in vivo של וקטורי AAV במודלים של בעלי חיים בדרך כלל אינו מעורר תגובות חיסוניות של המארח כנגד תאים מותמרים, ומאפשר ביטוי טרנסגנים יציב בתוך פרנכימת המוח לפרקי זמן ממושכים 2,7,8.
סיבה נוספת לפופולריות של וקטורי AAV היא המגוון הרחב של סרוטיפים AAV עם טרופיזמים ייחודיים של רקמות ותאים 9,10,11,12,13,14. חלבוני קפסיד מובהקים המתבטאים על ידי סרוטיפים שונים של AAV מביאים לשימוש בקולטנים שונים על פני התא לכניסת תאים ובכך לטרופיזמים ספציפיים10,14.
טרופיזם AAV נקבע לא רק על ידי חלבוני קפסיד אלא על ידי גורמים רבים אחרים14. הוכח כי סרוטיפים 1, 2, 6, 7, 8 ו-9 של AAV התמירו הן נוירונים והן אסטרוציטים בתרבית ראשונית15,16, אך הפגינו טרופיזם עצבי חזק לאחר הזרקת מוח תוך-פרנכימלית17,18. השיטה המשמשת להכנת וקטור AAV יכולה גם להשפיע על טרופיזם של תאי עצבים, אפילו עבור אותו סרוטיפ. לדוגמה, AAV8 מטוהר CsCl היה בעל טרופיזם אסטרוגליאלי חזק לאחר הזרקת מוח תוך-פרנכימלית, בעוד ש-AAV8 מטוהר יודיקסאנול, שהוזרק בתנאים זהים, התמיר רק נוירונים19. טרופיזם AAV עשוי להיות מושפע גם מהמינון המוזרק ומנפח14. לדוגמה, טיטר גבוה rAAV2/1 התמיר ביעילות הן נוירונים מעוררים קליפת המוח והן נוירונים מעכבים, אך השימוש בטיטרים נמוכים יותר חשף העדפה חזקה להתמרה של נוירונים מעכבים בקליפת המוח20.
לפיכך, לא ניתן להשיג ספציפיות חזקה של סוג התא המבוססת אך ורק על סרוטיפ הקפסיד. ניתן להשתמש במקדמים ספציפיים לסוג תא כדי להתגבר על הטרופיזם הטבעי הרחב של קפסיד AAV. לדוגמה, סינפסין I אנושי משמש להתמקדות בנוירונים21, מקדם CaMKII יכול להניע ביטוי טרנסגנים בנוירונים מעוררים גלוטמטרגיים עם ספציפיות גבוהה20, מקדם ppHcrt מכוון לנוירונים המבטאים היפוקרטין (HCRT) בהיפותלמוס הצדדי22, מקדם PRSx8 מכוון לנוירונים נוראדרנרגיים ואדרנרגיים המבטאים דופמין בטא-הידרוקסילאז23, ומקדם GFAP יכול להניע ביטוי ספציפי לאסטרוציטים24. עם זאת, לחלק מהמקדמים הספציפיים לתא יש פעילות שעתוק חלשה ואינם יכולים להניע רמות מספיקות של ביטוי טרנסגנים25. יתר על כן, המקדמים הקצרים המתאימים לווקטורים נגיפיים של AAV לרוב אינם שומרים על ספציפיות סוג התא 1,26. לדוגמה, הוכח שמבנה CaMKII התמיר גם נוירונים מעכבים12.
מלבד ספציפיות סוג התא (טרופיזם), מאפיין משמעותי נוסף של AAVs הוא יעילות התמרה. לסרוטיפים השונים של AAV יש תכונות דיפוזיה שונות. AAV2 וארבעה וקטורים נגיפיים מתפזרים פחות בקלות דרך פרנכימת המוח ולכן מתווכים התמרה על פני שטח קטן יותר17,27. ההתמרה העצבית הנפוצה ביותר נצפית עם סרוטיפים AAV 1, 9 ו-rh.10 11,17,18,19,28.
השיטה הפופולרית ביותר להניע את הביטוי של טרנסגן רצוי באזור מסוים במוח היא להזריק את וקטור ה-AAV ישירות לאזור המוח המעניין (פרנכימה)3. לאחר הזרקה תוך-פרנכימלית, אפילו סרוטיפים של AAV עם דיפוזיה יעילה יותר דרך המוח מתמרים בדרך כלל רק אזור מקומי סביב אתר ההזרקה 12. יתרה מכך, הזרקה תוך פרנכימלית היא הליך פולשני ומוביל לנזק לרקמות הסמוכות לאזור העניין. לפיכך, שיטה זו של הזרקת וירוסים אינה מתאימה למשימות ניסיוניות מסוימות. לדוגמה, תיוג נרחב של תאים רצוי מאוד בניסויים שמטרתם לחקור תפקודי נוירונים בקליפת המוח בבעלי חיים הנעים בחופשיות, כולל באמצעות מיקרוסקופיה של פוטון אחד או שניים 29,30,31,32.
כאן, אנו מתארים טכניקת הזרקת וירוסים חדשה הקשורה לאדנו, המשתמשת בעירוי וירוסים תת-עכבישיים כדי לספק התמרה נרחבת של נוירונים ניאו-קורטיקליים בעכברים בוגרים ולשמר רקמת מוח להקלטות אופטיות או אלקטרופיזיולוגיות של פעילות עצבית. שיטה זו לא רק הבטיחה התמרה נרחבת של נוירונים בשכבות ניאו-קורטיקליות שטחיות, אלא הביאה לביטוי של הטרנסגן באוכלוסייה גדולה של נוירונים פירמידליים בשכבה חמש עם ספציפיות גבוהה גם בעת שימוש במקדם חזק ולא סלקטיבי כגון CAG.
Protocol
נערכו ניסויים בעכברים בוגרים C57Black/6 משני המינים (מרכז גידול פושצ'ינו, סניף המכון לכימיה ביואורגנית ע"ש שמיאקין-אובצ'יניקוב של RAS). העכברים שוכנו בוויווריום מבוקר טמפרטורה (22 מעלות צלזיוס ± 2 מעלות צלזיוס, מחזור אור/חושך של 12 שעות, אורות דולקים בשעה 08:00) עם מזון ומים אד ליביטום. כל הליכי הניסוי נערכו בהתאם להנחיות ARRIVE ולהנחיה 2010/63/EU לניסויים בבעלי חיים. פרוטוקול המחקר אושר על ידי ועדת האתיקה של IHNA RAS (פרוטוקול N1 מיום 01.02.2022). נעשה כל מאמץ למזער את סבלם של בעלי החיים ולהבטיח את אמינות התוצאות.
1. הכנה לניתוח
- עקר את כל המכשירים הכירורגיים לפני תחילת הניתוח. נקה את אזור הניתוח באמצעות 70% אתנול.
- בדוק את רמת האיזופלורן במערכת ההרדמה ומלא אותה במידת הצורך. הניחו מגבת נייר נקייה בתחתית תא האינדוקציה.
- הנח כרית חימום על המסגרת הסטריאוטקסית. מכסים את הכרית במגבת נייר נקייה.
- הכינו בקבוק עם אקונומיקה של 2% כדי לאסוף קצות מיקרופיפטות, צינורות, צמר גפן ופריטים אחרים שבאים במגע עם הנגיף.
- מוציאים כמות של AAV מהמקפיא של -80 מעלות צלזיוס ומניחים אותה על קרח להפשרה.
2. הכנת מזרק
- נקה מיקרו-מזרק המילטון 5 מיקרוליטר עם מחט RN קהה 33G. שאפו ואז חלקו 70% אתנול. חזור על הפעולה 3 פעמים עם אתנול טרי. שוטפים את המזרק במים מזוקקים כדי להסיר את עודפי האתנול. חזור על הפעולה 3x.
- הוציאו את הבוכנה ומלאו את הקנה בשמן וזלין דרך האוגן באמצעות מזרק אינסולין. וודאו כי אין בועות אוויר במיקרו-מזרק.
הערה: אוויר כלוא ניתן לדחיסה ומשפיע על דיוק ודיוק המזרק. - החזירו את הבוכנה למיקרו-מזרק והוציאו טיפת שמן. הנח את המזרק לתוך המזרק הסטריאוטקסי כך שהסולם יהיה גלוי לניטור נפח התמיסה המחולקת.
3. הכנת עכברים לניתוח
- שקלו עכבר. הנח את העכבר בתא האינדוקציה של ההרדמה המחובר לאיזופלורן. הפעל את מכשיר האידוי איזופלורן המוגדר ל-5% והתאם את קצב הזרימה ל-250 מ"ל/דקה. עומק הרדמה הולם מושג תוך 5 עד 7 דקות.
- כדי לאמת את רמת ההרדמה הכירורגית, בדוק אם יש היעדר רפלקס הקצפה ונסיגה במהלך צביטה כואבת בכף האחורית, והיעדר מצמוץ בקשר עין.
- העבר את שסתום יציאת הוופורייזר מתא האינדוקציה למסכה הסטריאוטקסית. הפחת את האיזופלורן ל-1.8%-2.0% והגדר את קצב הזרימה בהתאם למשקל העכבר (70-90 מ"ל/דקה לעכברים במשקל שבין 25 ל-35 גרם).
- הסר את העכבר מתא האינדוקציה והנח אותו במנגנון הסטריאוטקטי על גבי כרית חימום (37 מעלות צלזיוס) למניעת היפותרמיה במהלך הרדמה כירורגית. הנח את השיניים הקדמיות במוט השיניים ולאחר מכן הרכיב את מסכת החיה.
- מקם בזהירות את החיה על מוטות האוזניים. תנוחת הראש הנכונה במנגנון הסטריאוטקטי מאפשרת תנועה אנכית אך לא רוחבית של הראש. ודא שמיקום החיה אינו גורם למצוקה. עקוב בקפידה אחר עומק ההרדמה, נשימת בעלי החיים וטמפרטורת הגוף לאורך כל הניתוח.
- לגלח את הראש מהעיניים אל מאחורי האוזניים. נקו את פני השטח המגולחים של הראש על ידי ספוגית עם 70% אתנול, ולאחר מכן ספוג עם תמיסת אלכוהול של 5% יוד.
- מרחו ג'ל עיניים למניעת ייבוש בעיניים. יש למרוח תמיסת לידוקאין 4% באופן מקומי ודקסמתזון (0.02 מ"ל ב-4 מ"ג/מ"ל) תת עורית כדי למנוע כאבים הקשורים לניתוח ולהפחית את התגובה הדלקתית האפשרית.
- בעזרת להב אזמל סטרילי ומספריים, בצע חתך באורך 4-5 מ"מ לאורך קו האמצע של הראש כדי לפתוח את הקרקפת. התחל בחתך קטן בין האוזניים ולאחר מכן הרחב אותו באמצעות מספריים כדי למנוע נזק לגולגולת.
- ספוג את פני הגולגולת בכמות קטנה של 3% מי חמצן כדי לדמיין את ציוני הדרך הסטריאוטקסיים: ברגמה ולמבדה. עצור את התגובה עם 0.9% NaCl מלח מיד. מגרדים רקמות על גבי הגולגולת בעזרת מגרד עצם.
- התקן את המזרק הממונע שהוכן מראש עם מזרק המילטון על הזרוע הסטריאוטקסית. כוון מקור אור כירורגי על הגולגולת החשופה ומקד את המיקרוסקופ על הברגמה.
- בהסתכלות דרך המיקרוסקופ, תפעל את הזרוע של המנגנון הסטריאוטקטי כדי למרכז את החלק העליון של המחט ישירות מעל הברגמה.
- בעזרת קצה המחט, יישר את הברגמה והלמבדה אופקית ולאחר מכן הזז את הזרוע לאחור לברגמה ורשום את הקואורדינטות. השתמש בקואורדינטות ברגמה אלה ובקואורדינטות האטלס של אזור העניין כדי לחשב את הקואורדינטות היחסיות של אזור היעד.
- העבר את המחט לאזור הממוקד. הורד את המחט בקואורדינטות החדשות וסמן מיקום זה. בחר את האתר למיקרו-הזרקה ויראלית בסמיכות לאזור היעד תוך התחשבות בהתפשטות הנגיף.
הערה: זה ימנע פגיעה ברקמה באזור העניין. השתמשנו בקואורדינטות הבאות עבור אזור העניין: AP-3.4, ML -2.0, ולמיקרו-הזרקה ויראלית: AP-2.0, ML -1.4. הקואורדינטות לעיל הן אופטימליות אם נוירונים ראשוניים בקליפת המוח הראייתית אמורים להיות נגועים. - במידת האפשר, הימנע מאזורים עם כלי דם גדולים. תחת מיקרוסקופ כירורגי, תאורה בהירה וקרה וטבילה של 0.9% NaCl במי מלח, אמורים להתגלות כלי דם גדולים בגולגולת ועל פני המוח.
4. הזרקת וירוסים
- קח בור שיניים סטרילי (קוטר 0.5 - 0.8 מ"מ). התבוננות במשטח הגולגולת דרך המיקרוסקופ הכירורגי, קדחו קרניוטומיה קטנה באופן ידני (ביד) או באמצעות מיקרו-מקדחה. הקפד לא להפעיל לחץ מוגזם על הגולגולת.
- הזז את הזרוע מהדרך כדי למנוע נזק למחט המיקרו-מזרק במהלך קידוח הגולגולת (חור). יש למרוח טבילה במי מלח של 0.9% NaCl ולעצור לסירוגין כדי למנוע חימום העצם ופגיעה בדורה מאטר. השתמש באוויר בלחץ כדי לפוצץ אבק עצמות.
הערה: הסוגים הבאים של בורות שיניים מקרביד מתאימים: בצורת אגס (רצוי), גליל מעוגל ועגול.- בעת דילול העצם עם הבור, ודא שהדילול אחיד על פני כל ההיקף. זה יקל על הסרת העצם מבלי לפגוע בדורה מאטר. לשם כך, השתמש בתחילה בבור עם קצה עגול ולאחר מכן בבור עם קצה שטוח. שמור על הבור בניצב לעצם; אחרת, צד אחד יהיה דק יותר מהשני.
הערה: בנוסף, ככל שגודל הבור קטן יותר וככל שהגולגולת המבוצעת קטנה יותר, כך המניפולציה תהיה מורכבת יותר. מומלץ לבצע קרניוטומיה בקוטר קטן יותר (0.5-0.6 מ"מ) בעת שימוש נוסף בבעל החיים לעבודה in vivo . אם מתכננים להשתמש במוח החיה לעבודה מחוץ לגוף , מקובל קוטר גולגולת גדול יותר כדי לפשט את ההליך.
- בעת דילול העצם עם הבור, ודא שהדילול אחיד על פני כל ההיקף. זה יקל על הסרת העצם מבלי לפגוע בדורה מאטר. לשם כך, השתמש בתחילה בבור עם קצה עגול ולאחר מכן בבור עם קצה שטוח. שמור על הבור בניצב לעצם; אחרת, צד אחד יהיה דק יותר מהשני.
- כאשר העצם הדלילה רכה ושקופה, הפסק לקדוח. כאשר נוצר שקע גדול מספיק בעצם, עצור לעתים קרובות את הסיבוב ופקח על עובי העצם. הופעת סדקים בעצם מעידה על כך שדילול מספיק.
- רחצו את החור במי מלח סטריליים ואז הסירו את עודפי המלח בעזרת צמר גפן. הסר את שכבת העצם הנותרת באמצעות מחט 27 גרם עם קצה בצורת וו / או באמצעות פינצטה עדינה. הימנע מפגיעה בדורא.
- מכסים את פני הגולגולת בפיסת מגבת נייר סטרילית לחה במי מלח. הנח פיסת סרט נקי ושקוף על משטח גולגולת העכבר מעל הנייר.
- הזז את הזרוע הסטריאוטקסית לאחור ומקם את מחט המיקרו-מזרק במקומה ישירות מעל הסרט. מוציאים את עודפי השמן עד שמגיעים לנפח של 2 מיקרוליטר.
הערה: הנפח הסופי של השמן עשוי להשתנות בהתאם לנפח מזרק המיקרו. השתמשנו במזרק מיקרו 5 μL 75-RN Hamilton. - פיפטה נפח וירוס השווה לנפח המוזרק + 2 מיקרוליטר על פיסת סרט שקוף.
- בהסתכלות דרך המיקרוסקופ הכירורגי, הורד את הזרוע כלפי מטה עד שקצה המחט נמצא במרכז טיפת הנגיף. טען את הנגיף לתוך המיקרו-מזרק באמצעות מזרק ממונע. השלך את קצה המיקרופיפטה והסרט השקוף לבקבוק עם אקונומיקה 2%.
- הסר את הנייר הרטוב במי מלח מעל פני הגולגולת וייבש את הגולגולת בעזרת צמר גפן. השתמש בזרוע הסטריאוטקסית כדי למקם את המחט מעל מקום ההחדרה.
- יש להוציא טיפה מהנגיף כדי לוודא שהמחט אינה סתומה. צור חריץ קטן בדורה באמצעות מחט 30 גרם עם קצה בצורת וו.
הערה: חשוב ליצור את החריץ הקטן ביותר האפשרי בדורה מאטר, ולאפשר למחט להיכנס מבלי להשאיר רווח בין המחט לדורה מאטר, שממנו הנגיף עלול לדלוף. - הורד את מחט המזרק עד לדורה ובצע את החישובים המתאימים לעומק. העריכו את עומק קליפת המוח של ההחדרה ביחס לנקודה שבה המחט נגעה לראשונה בפני השטח של קליפת המוח.
- הכנס לאט את קצה המחט לקליפת המוח לעומק של 300 מיקרומטר. המתן 2-3 דקות כדי לאפשר לדורה להיצמד למחט, ולאחר מכן החזר לאט את המחט לעומק של 200 מיקרומטר. המתן עוד 2-3 דקות כדי לאפשר לרקמת המוח להתייצב. התוצאה היא שהמחט מושכת את הדורה כלפי מעלה, ויוצרת מרחב תת-דוראלי להתפשטות הנגיף.
הערה: כדי למזער את הנזק לקליפת המוח, השתמש במחט 33 גרם או במחטים נמוכות יותר. זכור שככל שהקוטר הפנימי של הקצה קטן יותר, כך גדל הסיכוי שזרימה חוזרת של רקמות תסתום אותו. חשוב להשתמש במחט קהה במקום משופעת מכיוון שמחט קהה מוציאה טיפה מבוקרת יותר של תמיסה ויראלית.- אם המחט לא עוברת דרך הדורה מאטר כשהיא מונמכת ל 150-200 מיקרומטר ובמקום זאת מכופפת אותה, הפסק להנמיך. הרם את המחט ובצע חתך מעט גדול יותר בדורה מאטר, ולאחר מכן נסה להוריד את המחט שוב.
- אם נוזל המוח מתחיל לדלוף באופן פעיל מהחתך תוך כדי הורדת המחט, המתן עד שהוא יפסיק לדלוף; אחרת, קשה לשלוט במחט העוברת דרך הדורה. כתם את עודפי נוזל המוח עם קצה רקמה. ברגע שהנוזל מפסיק לזרום, הרם את המחט ונסה שוב.
- התחל להזריק את התרחיף הנגיפי בקצב של 0.06 מיקרוליטר לדקה תוך ניטור הנפח המופץ. הזרקו 1 מיקרוליטר של נגיף. להזריק את הנגיף בעומק אחד על מנת לא לשבור את האיטום בין המחט לרקמת קליפת המוח.
- פתרון בעיות: בתחילת ההזרקה, עלולה להתרחש זרימה חוזרת של הנגיף אל פני השטח של המוח. הפסק להזריק, המתן 2-3 דקות ולאחר מכן המשך בהזרקת הנגיף. חזור על פעולות אלה (שלבים) עד שהזרימה החוזרת של הנגיף תיפסק. וירוסים ונוזלי מוח השדרה יידבקו למחט וימנעו זרימה חוזרת.
- דרך נוספת לעצור את הזרימה החוזרת של הנגיף, לשים כמות קטנה של אגרוז על פני קליפת המוח. זה ידכא את פעימת קליפת המוח וגם יעזור לאטום את המחט. אך וודאו כי הפיפטה אינה סתומה על ידי האגרוז.
- מכיוון שייתכן שהמחט לא תעבור במלואה דרך הדורה מאטר כאשר היא מונמכת, אלא רק באופן חלקי, ייתכן שצד אחד של המחט לא יתאים היטב לדורה, מה שעלול לגרום לזרימה חוזרת של הנגיף. במקרה זה, משוך לאט את המחט מהרקמה ונסה להוריד אותה שוב.
- לאחר השלמת העירוי, שמור את המחט במיקום היעד למשך 10 דקות נוספות. זה מאפשר לנגיף להתפזר הרחק מאתר ההזרקה. הוצא את המחט מהמוח באיטיות כדי למנוע מהנגיף להציף בחזרה ממערכת המחט.
- לאחר השלמת משיכת המחט, בדוק שהיא אינה סתומה על ידי הוצאת טיפה קטנה של נגיף. סגור את חתך העור באמצעות 5-0 תפרים נספגים או לא נספגים.
5. טיפול לאחר הניתוח
- לאחר סגירת החתך יש למרוח משחה אנטיבקטריאלית באופן מקומי. יש להזריק תערובת של מי מלח (5 מ"ל/ק"ג) ו-5% גלוקוז (5 מ"ל/ק"ג) תת עורית כדי למנוע התייבשות ולהקל על ההחלמה לאחר ההרדמה. יש להזריק קטופרופן תוך שרירי (2.5 מ"ג/ק"ג) כדי להפחית את הכאב.
- הניחו את החיה בכלוב טרי על גבי כרית חימום ועקבו אחריה עד שהיא מתאוששת מההרדמה. לאחר שהעכבר מגיב, הניחו את החיה בכלוב הביתי שלהם.
6. היסטולוגיה
- לא לפני 21 יום לאחר הזרקת הנגיף יש להרדים עכברים עם איזופלורן כמתואר בשלב 3.
- בצע חתך בקו האמצע (10-15 מ"מ) לאורך אזור בית החזה בעזרת מספריים צרים וחשוף את חלל החזה. הפרד בזהירות את הסרעפת ופתח את החזה בעזרת מספריים.
- הכנס מחט 22G 1 1/2 לחדר השמאלי ובצע חתך באטריום הימני בעזרת מספריים. פרפיוז עם 50 מ"ל של 100 מ"מ מלח פוספט חוצץ (PBS) מקורר מראש, ואחריו 100 מ"ל של פורמלין 10% חוצץ מקורר מראש.
- חלץ בזהירות את כל מוח העכבר. לשם כך, בצע חתך סגיטלי לאורך מרכז הקרקפת בעזרת מספריים. לאחר מכן, הסר את עצם הגולגולת חתיכה אחר חתיכה באמצעות צבת עצם עם קצוות שטוחים החל מההצטלבות של התפרים הסגיטלים והלמבדואידים וממשיכים קדימה לעצם האף. כאשר המוח חשוף, חתכו את פקעות הריח, שחררו את המוח בעזרת מרית מעוקלת והשליכו אותו לתוך שפופרת של 50 מ"ל המכילה 10% פורמלין חוצץ.
- תקן את המוח בן לילה. הרכיבו את רקמת המוח על פלטפורמת מתכת של ויברטום באמצעות דבק רקמות. חותכים חלקים קדמיים בעובי של 50 מיקרומטר באמצעות להבי פלדת פחמן.
7. צביעה חיסונית
- יום 1
- שטפו את פרוסות המוח 3 פעמים למשך 5 דקות כל אחת עם 1x PBS המכיל 0.3% טריטון X-100 (PBS-T). דגרו את החלקים ב-PBS-T למשך 20 דקות בטמפרטורת החדר (RT).
- חסום קשירה לא ספציפית למשך שעה אחת ב-RT באמצעות מאגר חוסם המורכב מ-5% סרום עיזים רגיל (NGS) ו-0.3% טריטון X-100 ב-1x PBS.
- דגרו את החלקים למשך הלילה ב-4 מעלות צלזיוס עם נוגדנים ראשוניים נגד פרוואלבומין או קלבינדין מדולל 1:500 במאגר החוסם (5% NGS ו-0.3% טריטון X-100 ב-1x PBS).
- יום 2
- שטפו את החלקים 3 פעמים למשך 10 דקות ב-PBS-T. דגירה בחושך למשך שעתיים ב-RT עם נוגדנים משניים (עז נגד ארנב IgG (H+L) נוגדן משני נספג צולב, Alexa Fluor 546) מדולל 1:500 במאגר החוסם (5% NGS ו-0.3% טריטון X-100 ב-1x PBS).
- שטפו את החלקים 3 פעמים למשך 5 דקות כל אחד ב-1x PBS. העבירו פרוסות מוח על שקופיות זכוכית בעזרת מברשת רכה.
- הוסף מיד 0.1 מ"ל של אמצעי הרכבה נגד דהייה לכל חלק. מכסים את הפרוסות בכיסוי בגודל 22 מ"מ על 50 מ"מ.
- הגדר את המיקרוסקופ הקונפוקלי להגדלה של פי 20 או פי 60 (A/1.4, שמן). השתמש בלייזרים באורכי גל של 488 ננומטר ו-594 ננומטר כדי לרכוש תמונות רב-ערוציות של אזורי המוח המעניינים.
תוצאות
בסדרת ניסויים פיילוט, השתמשנו בשיטת ההזרקה התוך-קורטיקלית המסורתית כדי להמיר נוירונים פירמידליים בשכבה חמש בניאו-קורטקס העכבר על ידי AAV2 הנושא את הגן המהיר channelrhodopsin (oChIEF) שהתמזג עם חלבון פלואורסצנטי EGFP תחת מקדם CaMKII. בהתאם למאפיין האופייני של AAV212, קיבלנו אזור זיהום קטן יחסית, שרוחבו אינו עולה על 1 מ"מ (איור 1A). אולם בחלק מהניסויים ראינו התפשטות גדולה באופן יוצא דופן של AAV2, בחלק מהמקרים מכסה את הניאו-קורטקס של יותר ממחצית מחצי הכדור של המוח (איור 1B). שיערנו כי התפשטות נרחבת כזו של הנגיף עשויה להתרחש כאשר הנגיף נכנס לחלל התת-עכבישי וזרם הנוזל השדרתי (CSF) מפיץ את הווקטור הנגיפי על פני המוח. ציינו שזה קורה כאשר עומק החדרת מחט ההזרקה קטן (<200 מיקרומטר) וגודל החור בדורה מאטר תואם בדיוק את קוטר המחט, ומונע את השעיית החלקיקים הנגיפיים מזרימה חוזרת. על מנת להמחיש את התהליך הזה, הוספנו ננו-חלקיקים פלואורסצנטיים אדומים לתרחיף המוזרק של חלקיקים נגיפיים (n = 3 עכברים). 3 שבועות לאחר ההזרקה, העכברים עברו עירוי דרך הלב עם 10% פורמלין חוצץ, והמוחות הוצאו בזהירות מהגולגולת מבלי לפגוע בדורה מאטר. בחינה של מוחות שלמים תחת מיקרוסקופ דו-עיני אפיפלואורסצנטי חשפה את ההתפלגות הנרחבת של חלקיקים פלואורסצנטיים אדומים שחרגו מעט מאזור הזיהום העצבי שנראה בתעלת הקרינה הירוקה (איור 2). ניתוח חתכים סגיטליים ממוחם של עכברים אלה הראה כי חלקיקים פלואורסצנטיים ממוקמים בשכבה דקה לאורך ה-pia mater, מבלי לחדור עמוק לפרנכימה של המוח, בעוד שתאי עצב המבטאים נוגה, כמו בניסויים קודמים, נמצאו במספרים גדולים בשכבות 2/3 ו-5.
בנוסף לנגיף EGFP AAV2_CaMKII_oChIEF (בשימוש בריכוז של 1.49 x 1012 vg/mL), ביצענו גם מתן תת-עכבישי של נגיפי AAV2_CaMKII_Venus (7.31 x 1012 vg/mL) ו-AAV2_CAG_GCamp6s (7.3 x 1013 vg/ml) וקיבלנו תוצאות דומות. זה חשוב מכיוון שכפי שהוכח, נגיפים מאותו סרוטיפ יכולים לספק גדלים שונים של שטח התמרה בהתאם למקדם ולגן המטרה בו נעשה שימוש12.
כדי להשוות באופן שיטתי אזורי התמרה לאחר מתן מסורתי ותת-עכבישי של נגיפים, חישבנו את גודל אזור ההדבקה בכיוונים הבינוניים והרוסטרו-קאודליים בחלקים סדרתיים בעובי 50 מיקרומטר של המוח. נמצא כי מתן תת-עכבישי של הנגיף הוביל לעלייה של כמעט פי ארבעה באזור ההדבקה, בהשוואה למתן תוך-פרנכימלי (1.7 ± 0.52 מ"מ (n = 15 עכברים) לעומת 0.46 ± 0.22 מ"מ (n = 6 עכברים), p < .00001, בדיקת t בכיוון המדיולטרלי ו-2.35 ± 0.8 מ"מ (n=14 עכברים) לעומת 0.84 ± 0.29 מ"מ (n = 6 עכברים) p <.0003, מבחן t בכיוון הרוסטרוקאודלי; איור 3A).
תצפית מיקרוסקופית על פרוסות מוח מעכברים שהומרו על ידי הזרקת וירוס תת-עכבישי חשפה התמרה נרחבת מאוד בשכבות 2/3 ו-5, בעוד שכמעט ולא היו תאים מותמרים בשכבות 4 ו-6 (איור 3B). בשכבה 4, רק דנדריטים פלואורסצנטיים של פירמידות משכבה 5 נראו בבירור (איור 3B). אקסונים פלואורסצנטיים אותרו בשכבה 6 ובחומר לבן (איור 3C). דפוס התמרה כזה לאחר הזרקה תת-עכבישית יכול לנבוע מדיפוזיה של הנגיף מהחלל התת-עכבישי לשכבה 1 של קליפת המוח (אולי עמוקה יותר), שם דנדריטים עצביים לוכדים אותו. לפיכך, רק נוירונים בעלי הסתעפות נמרצת בשכבות העליונות נגועים. ידוע כי אינטרנוירונים GABAergic מסתעפים בעיקר באופן מקומי. אם ההשערה שלנו נכונה, אז מתן תת-עכבישי של הנגיף אמור להוביל להתמרה של אינטרנוירונים בשכבות העל-גרגיריות אך לא בשכבות התת-גרגיריות. כדי לבחון את ההשערה, ביצענו צביעה אימונוכימית של חלקי מוח מעכברים לאחר הזרקה תת-עכבישית של נגיף AAV2_CaMKII_Venus עם נוגדנים לסמנים של שתי קבוצות תפקודיות שונות של אינטרנוירונים GABAergic: פרוואלבומין וקלבינדין.
כדי לקבוע את מספר האינטרנוירונים שהועברו על ידי הזרקה תת-עכבישית של הנגיף, ביצענו ניתוח מורפומטרי שספר את המספר הכולל של תאים מתמרים (צביעה ירוקה), מספר הנוירונים האימונוחיוביים (צביעה אדומה) ומספר התאים בעלי התווית הכפולה בחתך של 750 x 750 מיקרומטר (עובי חתך של 50 מיקרומטר).
בפרוסות מוח מוכתמות בנוגדנים נגד פרוואלבומין, בשכבות העל-גרנולריות, מספר הנוירונים עם הסימון הירוק היה בממוצע 57.4 ±-9.8, אינטרנוירונים חיוביים לפרבאלבומין עם תווית אדומה 9.6 ±-3.8, מתוכם 4.1 ±-2.4 (42.7%) היו בעלי תווית כפולה (n = 10 תכשירים). לעומת זאת, ספרנו 14 ± 4.8 נוירונים שהועברו על ידי וירוס ו-19.1 ± 4.5 נוירונים חיוביים לפרוואלבומין בשכבה 5 של הניאו-קורטקס ולא זיהינו תאים בעלי תווית כפולה (n = 10 תכשירים).
כאשר בחנו קטעים שנצבעו אימונוכימית עבור קלבינדין, מצאנו שבשכבות העל-גרגיריות היו בממוצע 21.1 ± 4.5 תאי עצב מותמרים ויראלית ו-6.1 ±-2.6 תאים חיוביים לקאלבינדין, מתוכם 4.2 ±-1.9 תאים נשאו את שתי התוויות (69.1%; n = 10 תכשירים). בשכבה 5 ספרנו 19 ±-2.1 נוירונים מותמרים, 15.9 ±-5.7 אינטרנוירונים קלבינדין, מתוכם 1.1 ±-1.5 (6.9%) הראו צביעה כפולה. עם זאת, יש לציין כי ל-100% מהנוירונים בעלי התווית הכפולה בשכבה 5 הייתה צורה פירמידלית נראית בבירור, מה שעשוי להצביע על נוכחות של נוירונים פירמידליים חיוביים לקאלבינדין או אי ספציפיות כלשהי של הנוגדנים. לפיכך, לא נצפו אינטרנוירונים אמיתיים של קלבינדין שהועברו על ידי הזרקה תת-עכבישית של הנגיף בשכבה 5.
לכן, בעוד שתאי פרוואלבומין ותאים חיוביים לקאלבינדין אכן היו נוכחים בקרב תאי העצב המומרים בשכבה 2/3 (איור 4A,C), לא זוהו תאי עצב מתמרים בשכבה 5, וכל התאים המבטאים EGFP זוהו ויזואלית כתאי עצב פירמידליים (איור 4B,D).

איור 1: השוואה של אזור התמרה של AAV2 לאחר זריקות קונבנציונליות של נגיפים תוך-קורטיקליים ותת-עכבישיים. (A) התפשטות CaMKII_oChieff_EGFP מבנית 21 יום לאחר ההזרקה לפרנכימה של המוח לעומק של 500 - 600 מיקרומטר. (B) התפשטות CaMKII_oChieff_EGFP בחצי הכדור השני של אותה חיה לאחר מתן תת-עכבישי. מוצגים חתכים קדמיים במרחק של 200-300 מיקרומטר בכיוון הרוסטרוקאודלי מאתר ההזרקה. סרגל קנה מידה - 1 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: תצלום של מוח שלם עם חומר דורה שלם שמראה את ההתפשטות של וירוסים AAV2_CaMKII_Venus ו-FluoSpheres אדומים שהוזרקו תת-עכבישית. (A) פלואורסצנטיות של ננו-חלקיקים אדומים שנוספו לתרחיף הווירוס המוזרק שמראה את ההתפשטות הפיזית של הנפח המוזרק בחלל התת-עכבישי. (B) אותה המיספרה של המוח בערוץ הקרינה הירוק מראה את אזור הביטוי של נוגה. אתר ההזרקה מסומן על ידי חצים. בנוסף, מסומן מיקום הלמבדה. סרגל קנה מידה - 1 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: הזרקה תת-עכבישית של הנגיף גורמת לזיהום נרחב של נוירונים בשכבות 2/3 ו-5 של הניאו-קורטקס. (A) השוואה בין אזורי ההתמרה (בכיוון המדיולטרלי (m/l) והרוסטרו-קאודלי (r/c)) לאחר הזרקת וירוס תוך קורטיקלי (i) ותת-עכבישי (s). העמודות מייצגות את הממוצע; השפם מציין את סטיית התקן (**** - p < 0.0001; *** - p < 0.001; מבחן t). (B) מיקרוגרף קונפוקלי שמראה את ביטוי ונוס בניאו-קורטקס של העכבר אחרי הזרקה תת-עכבישית של וירוסים AAV2_CaMKII_Venus. גבולות השכבה מוצגים באופן סכמטי (L1 - L6). (C) קטע של תמונה (B), שמוצג עם הגדרות בהירות וניגודיות שונות כדי להדגים אקסונים פלואורסצנטיים שנעים על פני שכבה 6 ועל פני החומר הלבן (WM). סרגל קנה המידה הוא 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
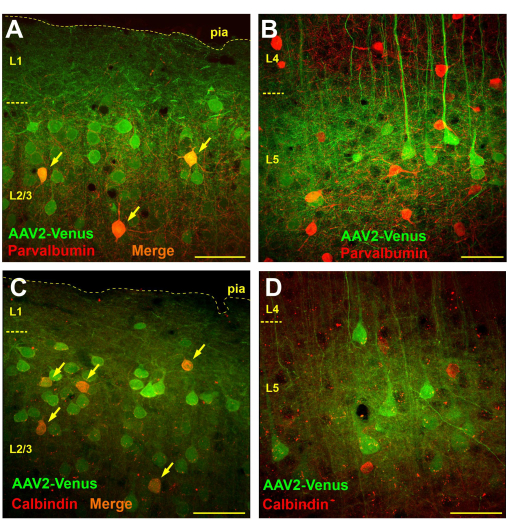
איור 4: הזרקת נגיף תת-עכבישי מביאה להתמרה של אינטרנוירונים בשכבות על-גרגיריות אך לא בשכבות תת-גרגיריות של הניאו-קורטקס. (א, ב) צביעה אימונוכימית של חלקי מוח מעכבר שהומרו על ידי הזרקה תת-עכבישית של נגיף AAV2_CaMKII_Venus עם נוגדנים לפרבאלבומין (נוגדנים משניים מצומדים Alexa594). תאי עצב שנושאים תוויות ירוקות ואדומות נראים כתומים (מסומנים על ידי חיצים). (ג, ד) מיקרוגרפים של קטע מוח של עכבר לאחר הזרקה תת-עכבישית של AAV2_CaMKII_Venus מוכתמים בנוגדנים לקלבינדין. שימו לב להיעדר נוירונים עם תווית כפולה ב-L5. סרגל קנה המידה הוא 50 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
פיתחנו שיטה חדשה להתמרת נוירונים ניאו-קורטיקליים של עכברים על ידי הזרקת תרחיף של חלקיקים נגיפיים AAV2 לחלל התת-עכבישי של המוח. זה מספק תפוצה נרחבת של הנגיף, כמעט פי ארבעה מנפח הרקמה הנגועה כאשר אותה כמות של וירוס מוזרקת ישירות לפרנכימה של המוח.
הזרקת וקטורים של נגיף ישירות לנוזל המוח השדרתי (CSF) דרך מסלולים שונים (למשל, תוך מוחי, תוך-מוחי, או תוך-ציסטרנלי) היא אסטרטגיה פופולרית להעברת גנים נרחבת ברחבי מערכת העצבים המרכזית 33,34,35. עם זאת, מתן תוך מוחי-חדרי או תוך-תקלי של וקטורי AAV2 במוח הבוגר מביא להתמרה מוחית מוגבלת בשל זיקתם הגבוהה לתאי האפנדימליים 28,33,36,37. תאים אפנדימליים נמצאים כשכבה חד-שכבתית המצפה את החדר השלישי והרביעי ואת התעלה המרכזית של חוט השדרה38. נוכחותם של צמתים הדוקים בין תאים אפנדימליים בחדר מהווה מחסום משמעותי עבור כמה סרוטיפים של AAV, שחייבים לעבור דרך תאים אלה מהחדר כדי להתפשט תוך פרנכימלי39.
בעבודתנו, הזרקת הווקטור הנגיפי AAV2 לחלל התת-עכבישי דרך פני המוח הביאה להתמרה נרחבת של נוירונים ניאו-קורטיקליים בעכברים בוגרים. ישנן עדויות לכך שלחומר ה-pia יש מבנים שונים באזורים שונים של מערכת העצבים המרכזית. הממברנה בעמוד השדרה פיה מאטר (המקיפה את חוט השדרה) עבה בהרבה מהגולגולת פיה מאטר (המקיפה את המוח) בשל האופי הדו-שכבתי של קרום פיה40. כמו כן, הוכח כי CSF חדרי נכנס לפרנכימה של המוח באופן מינימלי, בעוד ש-CSF תת-עכבישי נכנס במהירות לפרנכימה של המוח לאורך חללים פרה-וסקולריים41. לכן, סביר להניח שמסלולים שונים של העברת הווקטור הנגיפי לתוך ה-CSF עשויים לתת תוצאות שונות.
יש לציין כי זריקות תוך CSF של כמה גרסאות AAV קשורות לתופעות לוואי מסוימות. הוכח כי אספקה תוך-מוחית או תוך-חדרית של AAV9 מביאה לביטוי גנים לא רק במערכת העצבים המרכזית אלא גם באיברים היקפיים42,43. לצורך התמרה יעילה יותר של נוירונים ברחבי המוח, נדרשים מינונים וקטוריים גבוהים. לדוגמה, חולדות Sprague-Dawley בוגרות קיבלו זריקה חד צדדית של AAV9 לחדר הצדדי בשלוש מנות: 3.1 מיקרוליטר, 15.5 מיקרוליטר ו-77.5 מיקרוליטר42. עכברים קיבלו AAV9 בנפח כולל של 10 מיקרוליטר בבור מגנה43. היתרון של שיטת הזרקת הנגיף שלנו הוא שהשתמשנו בנפח וקטורי נמוך יותר (1 מיקרוליטר) מאלה ששימשו לאספקה תוך-תאית או תוך-חדרית של AAV. נפח נמוך יותר של הנגיף מפחית משמעותית את הסיכון לביטוי ויראלי מחוץ למוח וגם לרעילות.
למרות שלא בחנו ביטויים נגיפיים מחוץ למוח, סביר מאוד להניח שמתן תת-עכבישי של AAV2 דרך פני השטח של המוח הביא לביטוי ויראלי אך ורק במוח (במיוחד בניאו-קורטקס). הנחתנו מבוססת על הסיבות הבאות. AAV9 הוא נגיף רקומביננטי הקשור לאדנו, שיכול לחצות את מחסום הדם-מוח (BBB) ומשמש בדרך כלל להתמרה גלובלית של מערכת העצבים המרכזית37,44. עם זאת, חדירת BBB והתמרה של רקמת המוח מוגבלות עם AAV245. יתר על כן, ניתוח של פרוסות מוח של עכבר לאחר הזרקה תת-עכבישית של הנגיף הראה כי תאים מותמרים היו ממוקמים אך ורק בניאו-קורטקס של חצי הכדור המקביל (המוזרק). לא נמצאו תאים מותמרים בניאו-קורטקס הנגדי או במבני מוח אחרים, מה שמצביע על כך שהתמרה של איברים היקפיים בשיטת הזרקה זו היא מאוד לא סבירה.
בנוסף לאזור זיהום גדול, שיטת הזרקת הנגיף התת-עכבישי מאפשרת התמרה סלקטיבית של נוירונים פירמידליים בשכבה חמש, אפילו עם שימוש במקדמים חזקים שאינם סלקטיביים כגון CAG. ידוע היטב כי הבטחת ביטוי סלקטיבי גם עם מקדמים ספציפיים היא די קשה 1,26. לדוגמה, מקדם CaMKII בו השתמשנו אמור באופן תיאורטי להדביק נוירונים גלוטמטרגיים. עם זאת, כפי שמוצג בתוצאות כאן ובמחקרים אחרים, כאשר משתמשים בו, מתרחשת גם התמרה של סוגים אחרים של תאים, בפרט, אינטרנוירונים GABAergic46. יתר על כן, מכיוון שבזריקות תת-עכבישיות, העברת תאים מתרחשת במרחק משמעותי מאתר ההזרקה, שיטה זו מסייעת בשימור רקמת המוח לצורך הקלטות אופטיות או אלקטרופיזיולוגיות של פעילות עצבית. השתמשנו בהצלחה בהזרקות וירוס תת-עכבישי בניסויים עם גירוי אופטוגנטי ורישום חוץ-תאי של פעילות נוירונים פירמידליים L5 בקליפת המוח החזותית של העכבר in vivo32.
עבודה זו היא ספין-אוף של מחקר רחב היקף שלנו על מנגנוני הפלסטיות בקליפת המוח הראייה, שבו השתמשנו ב-AAV2 כדי לבטא רודופסין ערוץ בתאי העצב הפירמידליים של קליפת המוח הראייתית של העכבר32. בעזרת הסרוטיפ הזה צברנו הרבה סטטיסטיקות ולמעשה פיתחנו את שיטת ההזרקה התת-עכבישית. בניסויי פיילוט ניסינו גם הזרקה תת-עכבישית של הנגיף עם סרוטיפ 2/9 וקיבלנו תוצאות דומות, אם כי לא ביצענו ניתוח מורפומטרי מפורט במקרה זה. למרבה הצער, אי אפשר לחזות כיצד יתנהגו סרוטיפים אחרים לאחר מתן תת-עכבישי ואיזה סרוטיפ וירוס יספק את שטח ההתמרה הגדול ביותר; ניתן לקבוע זאת רק באופן אמפירי, הדורש כמות ניכרת של עבודה. בעבודה זו, הראינו באופן משכנע שניתן להזריק AAV2 לחלל התת-עכבישי של מוח העכבר הבוגר, וכתוצאה מכך התמרה נרחבת עם ביטוי סלקטיבי של גן המטרה בנוירונים פירמידליים בשכבה חמש של הניאו-קורטקס וביטוי לא סלקטיבי בשכבות העל-גרגיריות.
השלב הקריטי ביותר בשימוש בשיטה זו של הזרקת וירוס תת-עכבישי הוא להבטיח את הגודל האופטימלי של החור בחומר הדורה שחייב להתאים בדיוק לקוטר מחט ההזרקה. הדורה צריכה להקיף היטב את המחט ולכן למנוע זרימה חוזרת של הנגיף במהלך ההזרקה. קראנו לשיטה זו הזרקה תת-עכבישית, אך לא ברור אם בנוסף לחלל התת-עכבישי, הנגיף נכנס ומתפשט גם לחלל התת-דוראלי (החלל שבין הארכנואיד לדורה מאטר). כמו כן, לא ברור אם שיטה זו תעבוד בבעלי חיים אחרים, במיוחד בחולדות, או עם סרוטיפים אחרים של AAV.
בעבר, שינג'יאן לי ועמיתיו תיארו שיטת התמרה עצבית המבוססת על עירוי ויראלי על פני השטח של קליפת המוח. הם השתמשו בפיפטה מזכוכית בקוטר רחב על פני השטח של קליפת המוח כדי להחדיר את מדווח הסידן הנגיפי AAV-GCaMP6 לקליפת המוח. בשיטה זו, חלקיקים נגיפיים, ככל הנראה, בדומה למקרה זה, נכנסים לשכבות העליונות של הניאו-קורטקס, שם הם נלכדים על ידי נוירונים. המחברים מצאו כי עירוי וירוס פני השטח של קליפת המוח תייג ביעילות נוירונים בשכבות השטחיות תוך הימנעות מנוירונים בשכבה העמוקה47. לא לגמרי ברור מדוע העבודה המצוטטת לא הראתה התמרה של נוירונים פירמידליים בשכבה חמש, בדומה למה שראינו במחקר שלנו.
ההשערה שלנו שלאחר מתן תת-עכבישי, הנגיף נלכד על ידי הדנדריטים של נוירונים המסתעפים בשכבות העל-גרגיריות יש חולשה בולטת אחת. בנוסף לפירמידות הגדולות של שכבה חמש, לתאי העצב הפירמידליים של שכבהארבע 48 ולתאי הפירמידה L6 המקרינים קלאוסטרום49 בקליפת המוח הראייתית של העכבר יש דנדריטים שמגיעים לשכבה הראשונה. לכן, לא ברור מדוע תאים אלה אינם מתמרים בהזרקת נגיף תת-עכבישי. הסבר אפשרי אחד הוא שרק התאים שהדנדריטים שלהם עבים מספיק כדי להעביר את החלקיק הנגיפי לגוף התא נגועים - כלומר, פירמידות L5. הוכח כי בקליפת המוח הראייתית של עכברים, נוירונים פירמידליים בשכבה ארבע שולחים רק דנדריט דק אחד לשכבה הראשונה של הניאו-קורטקס48. עם זאת, יש צורך במחקרים נוספים כדי לקבוע את הגורם לדפוס הזיהום שנצפה לאחר הזרקת הנגיף התת-עכבישי.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
העבודה בוצעה בתמיכה כספית של קרן המדע הרוסית, מענק 20-15-00398P.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
References
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved