Method Article
Широко распространенная трансдукция неокортикальных нейронов мышей путем субарахноидальной инъекции AAV2
В этой статье
Резюме
Описана новая методика широкой доставки аденоассоциированного вируса, использующая инфузию субарахноидального вируса. Этот метод не только обеспечивает широкую трансдукцию нейронов неокортикального мозга мыши в поверхностных слоях, но и приводит к избирательной экспрессии трансгена в пирамидальных нейронах пятого слоя, даже при использовании неселективного промотора.
Аннотация
Рекомбинантные аденоассоциированные вирусы являются гибким и мощным инструментом для доставки и экспрессии различных генов, представляющих интерес во многих областях экспериментальной биологии, в частности в нейробиологии. Наиболее популярным методом стимуляции экспрессии желаемого трансгена в определенной области мозга является инъекция вектора AAV непосредственно в паренхиму мозга. Однако этот метод не позволяет широко использовать нейронную трансдукцию, которая требуется для некоторых экспериментов in vivo . В данной статье мы представляем новую методику широко распространенной экспрессии генов в неокортексе мыши, основанную на инфузии вируса в субарахноидальное пространство мозга. Этот метод маркировки нейронов не только обеспечивает широкую трансдукцию нейронов в поверхностных слоях неокортекса взрослой мыши, но и приводит к экспрессии трансгена в большой популяции пирамидальных нейронов пятого слоя с высокой специфичностью даже при использовании сильного неселективного промотора, такого как ЦАГ. Более того, поскольку клеточная трансдукция происходит на значительном расстоянии от места инъекции, этот метод может помочь сохранить мозговую ткань для последующей оптической или электрофизиологической записи нейронной активности.
Введение
Мозг млекопитающих состоит из множества тормозных, возбуждающих и модулирующих клеток, соединенных между собой триллионами синапсов. Одной из центральных задач нейробиологии является расшифровка роли различных типов клеток в организации и функционировании мозговых цепей и поведении. Манипулирование генетически определенными клетками в мозге требует методов введения и экспрессии трансгенов. Вирусные системы доставки генов на сегодняшний день являются наиболее эффективным и простым методом доставки генов в центральную нервную систему2. Системы доставки вирусов основаны на реплицирующихся вирусах (аденовирусах, аденоассоциированных вирусах (AAV), лентивирусах и ретровирусах), которые обладают способностью доставлять генетическую информацию в клетку-хозяина 2,3.
Векторы на основе AAV в настоящее время стали одним из наиболее широко используемых инструментов для доставки желаемых трансгенов в клетки мозга, как в целях фундаментальных исследований в области нейробиологии, так и для разработки генной терапии неврологических заболеваний. По сравнению с другими вирусами, дефектные репликации AAV обладают многими особенностями, которые делают их идеальными векторами для этих целей. В частности, векторы AAV эффективно трансдуцируют неделящиеся (терминально дифференцированные) клетки, такие как нейроны и глиальные клетки, что приводит к высокому уровню экспрессии трансгена in vivo2. Векторы могут быть легко получены с высоким функциональным титром, подходящим для использования in vivo 3,4,5. Важно отметить, что аденоассоциированная вирус-опосредованная доставка генов in vivo не вызывает гистопатологических изменений и векторной токсичности6. В отличие от аденовирусных векторов, введение векторов AAV in vivo на животных моделях обычно не вызывает иммунных реакций хозяина против трансдуцированных клеток, обеспечивая стабильную экспрессию трансгенов в паренхиме мозга в течение длительных периодов времени 2,7,8.
Еще одной причиной популярности AAV-векторов является широкий спектр серотипов AAV с уникальными тканевыми и клеточными тропизмами 9,10,11,12,13,14. Различные капсидные белки, экспрессируемые различными серотипами AAV, приводят к использованию различных рецепторов клеточной поверхности для проникновения в клетку и, таким образом, к специфическим тропизмам10,14.
Тропизм AAV определяется не только капсидными белками, но и многими другими факторами14. Было показано, что серотипы AAV 1, 2, 6, 7, 8 и 9 трансдуцировали как нейроны, так и астроциты в первичной культуре15,16, но демонстрировали сильный нейрональный тропизм после интрапаренхиматозной инъекции мозга17,18. Метод, используемый для получения вектора AAV, также может влиять на тропизм нервных клеток, даже для одного и того же серотипа. Например, очищенный от CsCl AAV8 обладал сильным астроглиальным тропизмом после внутрипаренхиматозной инъекции в мозг, в то время как йодиксанол-очищенный AAV8, введенный в идентичных условиях, трансдуцировал только нейроны19. На тропизм AAV также могут влиять введенная доза и объем14. Например, высокий титр rAAV2/1 эффективно трансдуцировал как корковые возбуждающие, так и тормозные нейроны, но использование более низких титров показало сильное предпочтение трансдукции корковых тормозных нейронов20.
Таким образом, невозможно достичь устойчивой специфичности типа клеток, основанной исключительно на серотипе капсида. Промоторы, специфичные для клеточного типа, могут быть использованы для преодоления широкого естественного тропизма AAV-капсида. Например, человеческий синапсин I используется для нацеливания на нейроны21, промотор CaMKII может управлять экспрессией трансгена в глутаматергических возбуждающих нейронах с высокой специфичностью20, промотор ppHcrt нацелен на нейроны, экспрессирующие гипокретин (HCRT) в латеральном гипоталамусе22, промотор PRSx8 нацелен на норадренергические и адренергические нейроны, экспрессирующие дофамин-бета-гидроксилазу23, а промотор GFAP может управлять специфической экспрессиейастроцитов 24. Тем не менее, некоторые специфические для клеток промоторы обладают слабой транскрипционной активностью и не могут управлять достаточным уровнем экспрессиитрансгенов25. Кроме того, короткие промоторы, которые входят в состав вирусных векторов AAV, часто не сохраняют специфичность типа клеток 1,26. Например, было показано, что конструкция CaMKII также трансдуцирует тормозные нейроны12.
Помимо специфичности типа клеток (тропизма), еще одной важной особенностью AAV является эффективность трансдукции. Различные серотипы AAV обладают различными диффузионными свойствами. AAV2 и четыре вирусных вектора менее легко диффундируют через паренхиму мозга и, следовательно, опосредуют трансдукцию на меньшей площади17,27. Наиболее распространенная нейрональная трансдукция наблюдается при серотипах AAV 1, 9 и rh.10 11,17,18,19,28.
Наиболее популярным методом стимуляции экспрессии желаемого трансгена в определенной области мозга является инъекция вектора AAV непосредственно в интересующую область мозга (паренхиму). После внутрипаренхиматозной инъекции даже серотипы AAV с более эффективной диффузией через мозг обычно трансдуцируют только локальную область вокруг места инъекции 12. Более того, внутрипаренхиматозная инъекция является инвазивной процедурой и приводит к повреждению тканей, прилегающих к интересующей области. Таким образом, данный способ внедрения вируса не подходит для некоторых экспериментальных задач. Например, обширная маркировка клеток крайне желательна в экспериментах, направленных на изучение функций корковых нейронов у свободно движущихся животных, в том числе с использованием одно- или двухфотонной микроскопии 29,30,31,32.
В данной статье мы описываем новую технику инъекции аденоассоциированного вируса, в которой используется инфузия субарахноидального вируса для обеспечения широкой трансдукции нейронов неокортекса у взрослых мышей и сохранения мозговой ткани для последующей оптической или электрофизиологической регистрации нейронной активности. Этот метод не только обеспечил широкую трансдукцию нейронов в поверхностных слоях неокортекса, но и привел к экспрессии трансгена в большой популяции пирамидальных нейронов пятого слоя с высокой специфичностью даже при использовании сильного неселективного промотора, такого как ЦАГ.
протокол
Эксперименты проводили на взрослых мышах C57Black/6 в возрасте 2-4 месяцев обоего пола (Пущинский селекционный центр филиала Института биоорганической химии им. академиков М.М. Шемякина и Овчинникова РАН). Мышей содержали в виварии с регулируемой температурой (22 °C ± 2 °C, цикл свет/темнота 12 часов, свет включается в 08:00 ч) с едой и водой в неограниченном количестве. Все экспериментальные процедуры проводились в соответствии с руководящими принципами ARRIVE, а также Директивой 2010/63/ЕС для экспериментов на животных. Протокол исследования утвержден Этическим комитетом ИГН РАН (протокол N1 от 01.02.2022). Были приложены все усилия, чтобы свести к минимуму страдания животных и обеспечить достоверность результатов.
1. Подготовка к операции
- Стерилизуйте все хирургические инструменты до начала операции. Очистите операционную область, используя 70% этанол.
- Проверьте уровень изофлурана в анестезиологической системе и при необходимости заполните его. Положите на дно индукционной камеры чистое бумажное полотенце.
- Поместите грелку на стереотаксическую рамку. Накройте подушечку чистым бумажным полотенцем.
- Подготовьте флакон с 2% отбеливателем для сбора наконечников микропипеток, пробирок, ватных палочек и других предметов, контактирующих с вирусом.
- Достаньте аликвоту AAV из морозильной камеры при температуре -80 °C и положите ее на лед для оттаивания.
2. Подготовка шприца
- Очистите микрошприц Hamilton объемом 5 мкл с помощью тупой иглы RN 33G. Аспиратуйте, а затем дозируйте 70% этанол. Повторите 3 раза со свежим этанолом. Промойте шприц дистиллированной водой, чтобы удалить излишки этанола. Повторите 3 раза.
- Выньте поршень и заполните цилиндр вазелиновым маслом через фланец с помощью инсулинового шприца. Следите за тем, чтобы в микрошприце не было пузырьков воздуха.
ПРИМЕЧАНИЕ: Захваченный воздух сжимается и влияет на точность и аккуратность шприца. - Поместите поршень обратно в микрошприц и выдавите каплю масла. Поместите шприц в стереотаксический инжектор так, чтобы была видна шкала для контроля объема выдаваемого раствора.
3. Подготовка мышей к операции
- Взвесьте мышь. Поместите мышь в индукционную камеру анестезии, подключенную к изофлурану. Включите вапорайзер изофлурана на 5% и отрегулируйте скорость потока до 250 мл/мин. Адекватная глубина анестезии достигается в течение 5-7 минут.
- Чтобы проверить хирургический уровень анестезии, проверьте отсутствие вздергивания и рефлекса отмены во время болезненного щипки задней лапы, а также отсутствие моргания при контакте с глазами.
- Переключите выпускной клапан испарителя с индукционной камеры на стереотаксическую маску. Уменьшите концентрацию изофлурана до 1,8%-2,0% и установите скорость потока в зависимости от веса мыши (70-90 мл/мин для мышей весом от 25 до 35 г).
- Извлеките мышь из индукционной камеры и поместите ее в стереотаксический аппарат поверх грелки (37 °C), чтобы предотвратить переохлаждение во время хирургической анестезии. Поместите передние зубы в зубную планку, а затем установите маску животного.
- Осторожно расположите животное на ушных планках. Правильное положение головы в стереотаксическом аппарате позволяет осуществлять вертикальное, но не боковое движение головы. Убедитесь, что положение животного не вызывает стресса. Внимательно следите за глубиной анестезии, дыханием животного и температурой тела на протяжении всей операции.
- Побрейте голову от глаз до задних ушей. Очистите выбритую поверхность головы, протерев там 70% этанол с последующим смазыванием 5% спиртовым раствором йода.
- Нанесите офтальмологический гель для предотвращения сухости глаз. Применяйте 4% раствор лидокаина местно и дексаметазон (0,02 мл в дозе 4 мг/мл) подкожно для предотвращения боли, связанной с хирургическим вмешательством, и уменьшения возможной воспалительной реакции.
- Стерильным лезвием скальпеля и ножницами сделайте разрез длиной 4-5 мм по средней линии головы, чтобы открыть кожу головы. Начните с небольшого разреза между ушами, а затем расширьте его с помощью ножниц, чтобы избежать повреждения черепа.
- Промокните поверхность черепа небольшим количеством 3% перекиси водорода, чтобы визуализировать стереотаксические ориентиры: брегму и лямбду. Немедленно остановите реакцию с помощью 0,9% раствора NaCl. Соскребите ткани на верхней части черепа с помощью скребка для костей.
- Установите заранее подготовленный моторизованный инжектор со шприцем Гамильтона на стереотаксический рычаг. Направьте хирургический источник света на открытый череп и сфокусируйте микроскоп на брегме.
- Глядя в микроскоп, манипулируйте рычагом стереотаксического аппарата так, чтобы верхняя часть иглы располагалась непосредственно над брегмой.
- С помощью кончика иглы выровняйте брегму и лямбду по горизонтали, а затем переместите руку обратно в брегму и запишите координаты. Используйте эти координаты брегмы и координаты атласа интересующей области для вычисления относительных координат целевой области.
- Переместите иглу в целевую область. Опустите иглу по новым координатам и отметьте это положение. Выберите место для вирусной микроинъекции в непосредственной близости от целевой области с учетом распространения вируса.
ПРИМЕЧАНИЕ: Это позволит избежать повреждения тканей в интересующей области. Для интересующей области использовались следующие координаты: AP-3.4, ML -2.0, а для вирусных микроинъекций: AP-2.0, ML -1.4. Приведенные выше координаты являются оптимальными, если предполагается инфицирование первичных нейронов зрительной коры. - По возможности избегайте областей с крупными кровеносными сосудами. Под хирургическим микроскопом при ярком холодном освещении и погружении 0,9% солевым раствором NaCl крупные кровеносные сосуды в черепе и на поверхности мозга должны стать очевидными.
4. Внедрение вирусов
- Возьмите стерильный зубной бор (0,5 – 0,8 мм в диаметре). Рассматривая поверхность черепа через операционный микроскоп, просверлите небольшой трепанацию черепа вручную (вручную) или с помощью микродрели. Следите за тем, чтобы не оказывать чрезмерного давления на череп.
- Отведите руку в сторону, чтобы не повредить иглу микрошприца во время сверления трепанации черепа (отверстия). Нанесите 0,9% раствор NaCl и периодически делайте паузы, чтобы не нагреть кость и не повредить твердую мозговую оболочку. Используйте сжатый воздух, чтобы сдуть костную пыль.
ПРИМЕЧАНИЕ: Подходят следующие типы твердосплавных зубных боров: грушевидные (предпочтительно), округлые цилиндрические и круглые.- При истончении кости с помощью бора убедитесь, что истончение равномерно по всей окружности. Это облегчит удаление кости без повреждения твердой мозговой оболочки. Для этого сначала используют бор с круглым кончиком, а затем бор с плоским кончиком. Держите бор перпендикулярно кости; В противном случае одна сторона будет тоньше другой.
ПРИМЕЧАНИЕ: Кроме того, чем меньше размер бора и чем меньше выполненная трепанация черепа, тем сложнее будет манипуляция. Рекомендуется выполнять трепанацию черепа меньшего диаметра (0,5-0,6 мм) при дальнейшем использовании животного для работы in vivo . Если вы планируете использовать мозг животного для работы ex vivo , для упрощения процедуры приемлем больший диаметр черепа.
- При истончении кости с помощью бора убедитесь, что истончение равномерно по всей окружности. Это облегчит удаление кости без повреждения твердой мозговой оболочки. Для этого сначала используют бор с круглым кончиком, а затем бор с плоским кончиком. Держите бор перпендикулярно кости; В противном случае одна сторона будет тоньше другой.
- Когда истонченная кость станет мягкой и прозрачной, прекратите сверление. Когда в кости образуется достаточно большое углубление, часто останавливайте вращение и следите за толщиной кости. Появление трещин на кости свидетельствует о том, что достаточно истончения.
- Промойте отверстие стерильным физиологическим раствором, а затем удалите излишки солевого раствора ватным тампоном. Удалите оставшийся слой кости с помощью иглы 27G с крючкообразным наконечником и/или пинцета с тонким наконечником. Не повреждайте твердую мозговую оболочку.
- Накройте поверхность черепа стерильным куском бумажного полотенца, смоченного в физрастворе. Положите кусок чистой прозрачной пленки на поверхность черепа мыши над бумагой.
- Отодвиньте стереотаксический кронштейн назад и расположите иглу микрошприца на месте прямо над пленкой. Слейте излишки масла до тех пор, пока не будет достигнут объем 2 μл.
ПРИМЕЧАНИЕ: Конечный объем масла может варьироваться в зависимости от объема микрошприца. Мы использовали микрошприц Hamilton объемом 5 мкл 75-RN. - Нанесите пипеткой на кусок прозрачной пленки объем вируса, равный введенному объему + 2 μл.
- Глядя в операционный микроскоп, опустите руку вниз до тех пор, пока кончик иглы не окажется в центре капли вируса. Загрузите вирус в микрошприц с помощью моторизованного инжектора. Выбросьте кончик микропипетки и прозрачную пленку во флакон с 2% отбеливателем.
- Снимите с поверхности черепа бумагу, смоченную солевым раствором, и высушите череп ватным тампоном. С помощью стереотаксического рычага расположите иглу над местом введения.
- Распылите каплю вируса, чтобы убедиться, что игла не забита. Сделайте небольшой разрез в твердой мозговой оболочке с помощью иглы 30 G с крючкообразным наконечником.
ПРИМЕЧАНИЕ: Важно сделать как можно меньший разрез в твердой мозговой оболочке, позволяющий игле войти, не оставляя зазора между иглой и твердой мозговой оболочкой, из которого может просочиться вирус. - Опустите иглу шприца вниз к твердой мозговой оболочке и произведите соответствующие расчеты глубины. Оцените корковую глубину введения относительно точки, в которой игла впервые коснулась поверхности коры.
- Медленно введите кончик иглы в кору головного мозга на глубину до 300 мкм. Подождите 2-3 минуты, чтобы твердая мозговая оболочка прилипла к игле, а затем медленно втяните иглу на глубину 200 мкм. Подождите еще 2-3 минуты, чтобы ткани мозга остыли. Это приводит к тому, что игла подтягивает твердую мозговую оболочку вверх, создавая субдуральное пространство для распространения вируса.
ПРИМЕЧАНИЕ: Чтобы свести к минимуму повреждение коры головного мозга, используйте иглу 33 G или опустите иглы G. Имейте в виду, что чем меньше внутренний диаметр наконечника, тем выше вероятность его закупорки тканевым оттоком. Важно использовать тупую иглу вместо скошенной, потому что тупая игла выделяет более контролируемую каплю вирусного раствора.- Если игла при опускании не проходит через твердую мозговую оболочку на 150-200 мкм, а вместо этого изгибает ее, опускание прекратите. Поднимите иглу и сделайте немного больший разрез в твердой мозговой оболочке, затем попробуйте опустить иглу еще раз.
- Если спинномозговая жидкость начинает активно вытекать из разреза во время опускания иглы, подождите, пока она перестанет вытекать; В противном случае будет трудно контролировать прохождение иглы через твердую мозговую оболочку. Промокните лишнюю спинномозговую жидкость тканевым кончиком. Как только жидкость перестанет течь, поднимите иглу и повторите попытку.
- Начните вводить вирусную суспензию со скоростью 0,06 мкл/мин, контролируя при этом выдаваемый объем. Введите 1 мкл вируса. Вводите вирус на одну глубину, чтобы не нарушить пломбу между иглой и тканью коры головного мозга.
- Устранение неполадок: В начале инъекции может произойти обратный ток вируса к поверхности мозга. Прекратите инъекцию, подождите 2-3 минуты, а затем продолжайте инъекцию вируса. Повторяйте эти действия (шаги) до тех пор, пока обратный поток вируса не остановится. Вирус и спинномозговая жидкость будут прилипать к игле и препятствовать обратному току.
- Еще один способ остановить обратный ток вируса, нанести небольшое количество агарозы на поверхность коры. Он подавит пульсацию коры головного мозга, а также поможет запечатать иглу. Но следите за тем, чтобы пипетка не была забита агарозой.
- Поскольку игла при опускании может проходить через твердую мозговую оболочку не полностью, а лишь частично, одна сторона иглы может не плотно прилегать к твердой мозговой оболочке, что может вызвать обратный поток вируса. В этом случае медленно извлеките иглу из ткани и попробуйте опустить ее снова.
- После завершения инфузии удерживайте иглу в целевом месте еще 10 минут. Это позволяет вирусу распространяться вдали от места инъекции. Медленно втягивайте иглу из мозга, чтобы предотвратить попадание вируса обратно из игольчатого тракта.
- После того, как забор иглы будет завершен, убедитесь, что она не забита, выпустив небольшую каплю вируса. Закройте разрез кожи с помощью 5-0 рассасывающихся или нерассасывающихся швов.
5. Послеоперационный уход
- После закрытия разреза нанести антибактериальную мазь местно. Введите смесь физиологического раствора (5 мл/кг) и 5% глюкозы (5 мл/кг) подкожно, чтобы предотвратить обезвоживание и облегчить восстановление после анестезии. Введите кетопрофен внутримышечно (2,5 мг/кг) для уменьшения боли.
- Поместите животное в свежую клетку поверх грелки и наблюдайте, пока оно не оправится от анестезии. После того как мышь начнет реагировать, поместите животное в домашнюю клетку.
6. Гистология
- Не ранее, чем через 21 день после введения вируса, глубоко обезболить мышей изофлураном, как описано в шаге 3.
- Сделайте разрез по средней линии (10 -15 мм) вдоль грудного отдела с помощью узких ножниц и обнажите грудную полость. Аккуратно отделите диафрагму и откройте грудную клетку с помощью ножниц.
- Введите иглу 22G 1 1/2 в левый желудочек и сделайте разрез в правом предсердии ножницами. Перфузируйте 50 мл предварительно охлажденного 100 мМ фосфатного буферного раствора (PBS), а затем 100 мл предварительно охлажденного 10% буферизованного формалина.
- Аккуратно извлеките весь мозг мыши. Для этого нужно сделать сагиттальный разрез по центру кожи головы с помощью ножниц. Затем удаляйте черепную кость по частям с помощью костных плоскогубцев с плоскими концами, начиная от пересечения сагиттального и лямбдоидного швов и продвигаясь вперед к носовой кости. Когда мозг обнажен, разрежьте обонятельные луковицы, облегчите мозг изогнутым шпателем и опустите его в пробирку объемом 50 мл, содержащую 10% буферного формалина.
- Зафиксируйте мозг на ночь. Закрепите мозговую ткань на металлической платформе вибратома с помощью тканевого клея. Режьте лобовые секции толщиной 50 мкм с помощью лезвий из углеродистой стали.
7. Иммуноокрашивание
- День 1
- Промойте ломтики мозга 3 раза в течение 5 минут каждый 1x PBS, содержащим 0,3% Triton X-100 (PBS-T). Инкубируйте секции в PBS-T в течение 20 минут при комнатной температуре (RT).
- Блокируйте неспецифическое связывание в течение 1 ч при ЛТ, используя блокирующий буфер, состоящий из 5% нормальной козьей сыворотки (NGS) и 0,3% Triton X-100 в 1x PBS.
- Инкубируйте срезы в течение ночи при 4 °C с первичными антителами против парвальбумина или кальбиндина, разведенными в соотношении 1:500 в блокирующем буфере (5% NGS и 0,3% Triton X-100 в 1x PBS).
- День 2
- Промойте срезы 3 раза в течение 10 минут в PBS-T. Инкубировать в темноте в течение 2 ч при ЛТ с вторичными антителами (Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Parentbody, Alexa Fluor 546), разведенными в соотношении 1:500 в блокирующем буфере (5% NGS и 0,3% Triton X-100 в 1x PBS).
- Вымойте секции 3 раза по 5 минут каждая в 1x PBS. Перенесите срезы мозга на предметные стекла с помощью мягкой щетки.
- Немедленно добавьте 0,1 мл монтажной среды, препятствующей выцветанию, в каждую секцию. Накройте ломтики покровным стеклом размером 22 мм x 50 мм.
- Настройте конфокальный микроскоп на увеличение 20x или 60x (A/1.4, масло). Используйте лазеры с длиной волны 488 нм и 594 нм для получения многоканальных изображений интересующих областей мозга.
Результаты
В пилотной серии экспериментов мы использовали традиционный метод интракортикальной инъекции для трансдукции пирамидальных нейронов пятого слоя неокортекса мыши с помощью AAV2, несущего ген быстрого каналродопсина (oChIEF), слитый с флуоресцентным белком EGFP под промотором CaMKII. В соответствии с характерным признаком AAV212 мы получили относительно небольшую площадь инфекции, не превышающую 1 мм в ширину (рисунок 1А). Тем не менее, в некоторых экспериментах мы наблюдали необычно большое распространение AAV2, в некоторых случаях охватывающее неокортекс более половины полушария мозга (рис. 1B). Мы предположили, что такое широкое распространение вируса может происходить, когда вирус проникает в субарахноидальное пространство и поток спинномозговой жидкости (ликвор) распространяет вирусный вектор по поверхности мозга. Мы отметили, что это происходит, когда глубина введения инъекционной иглы мала (<200 мкм) и размер отверстия в твердой мозговой оболочке точно совпадает с диаметром иглы, препятствуя обратному потоку взвеси вирусных частиц. Для того чтобы визуализировать этот процесс, мы добавили красные флуоресцентные наночастицы во введенную суспензию вирусных частиц (n = 3 мыши). Через 3 недели после инъекции мышам перфузировали транскардиально с 10% буферным формалином, а мозг осторожно удаляли из черепа, не повреждая твердую мозговую оболочку. Исследование всего мозга под эпифлуоресцентным бинокулярным микроскопом выявило широкое распространение красных флуоресцентных частиц, которое несколько превышало площадь нейрональной инфекции, видимую в зеленом флуоресцентном канале (рис. 2). Анализ сагиттальных срезов мозга этих мышей показал, что флуоресцентные частицы располагались тонким слоем вдоль мозговой оболочки, не проникая вглубь паренхимы мозга, в то время как венерины-экспрессирующие нейроны, как и в предыдущих экспериментах, были обнаружены в большом количестве в слоях 2/3 и 5.
В дополнение к вирусу AAV2_CaMKII_oChIEF EGFP (используемому в концентрации 1,49 x 1012 vg/мл) мы также провели субарахноидальное введение вирусов AAV2_CaMKII_Venus (7,31 x 1012 vg/мл) и AAV2_CAG_GCamp6s (7,3 x10 13 vg/мл) и получили аналогичные результаты. Это важно, поскольку, как было показано, вирусы одного и того же серотипа могут обеспечивать различные размеры площади трансдукции в зависимости от используемого промотора и целевого гена12.
Для систематического сравнения площадей трансдукции после традиционного и субарахноидального введения вирусов мы рассчитали размер области инфекции в медиолатеральном и рострокаудальном направлениях на последовательных срезах мозга толщиной 50 мкм. Установлено, что субарахноидальное введение вируса приводило к почти четырехкратному увеличению площади инфекции, по сравнению с внутрипаренхиматозным введением (1,7 ± 0,52 мм (n = 15 мышей) против 0,46 ± 0,22 мм (n = 6 мышей), p < 0,00001, t-критерий в медиолатеральном направлении и 2,35 ± 0,8 мм (n=14 мышей) против 0,84 ± 0,29 мм (n=6 мышей) p < 0,0003, Т-критерий в рострокаудальном направлении; Рисунок 3А).
Микроскопическое наблюдение за срезами мозга мышей, трансдуцированных инъекцией субарахноидального вируса, выявило очень широкую трансдукцию в слоях 2/3 и 5, в то время как в слоях 4 и 6 трансдуцированных клеток практически не было (рис. 3B). В слое 4 были хорошо видны только флуоресцентные дендриты пирамид слоя 5 (рисунок 3В). Флуоресцентные аксоны были прослежены в слое 6 и белом веществе (рис. 3C). Такой паттерн трансдукции после субарахноидальной инъекции может быть обусловлен диффузией вируса из субарахноидального пространства в слой 1 коры (возможно, глубже), где нейронные дендриты захватывают его. Таким образом, инфекции подвергаются только те нейроны, которые имеют энергичное ветвление в верхних слоях. Известно, что ГАМКергические интернейроны преимущественно разветвляются локально. Если наша гипотеза верна, то субарахноидальное введение вируса должно приводить к трансдукции интернейронов в надзернистые слои, но не в субгранулярные. Для проверки гипотезы было проведено иммунохимическое окрашивание участков мозга мышей после введения субарахноидального введения вируса AAV2_CaMKII_Venus антителами к маркерам двух различных функциональных классов ГАМКергических интернейронов: парвальбумину и кальбиндину.
Для определения количества интернейронов, трансдуцированных субарахноидальным введением вируса, мы провели морфометрический анализ, подсчитав общее количество трансдуцированных клеток (зеленое окрашивание), количество иммунопозитивных нейронов (красное окрашивание) и количество двойных меченых клеток на участке размером 750 х 750 мкм (толщина участка 50 мкм).
На срезах мозга, окрашенных антителами к парвальбумину, в надзернистых слоях количество нейронов с зеленой мечкой составило в среднем 57,4 ± 9,8, парвальбумин-позитивных интернейронов с красной мечкой 9,6 ± 3,8, из них 4,1 ± 2,4 (42,7%) были двойными мечеными (n = 10 препаратов). Напротив, мы насчитали 14 ± 4,8 вирус-трансдуцированных нейронов и 19,1 ± 4,5 парвальбумин-позитивных нейронов в слое 5 неокортекса и не обнаружили двойных меченых клеток (n = 10 препаратов).
При исследовании срезов, иммунохимически окрашенных на кальбиндин, было обнаружено, что в надзернистых слоях в среднем насчитывалось 21,1 ± 4,5 вирусно трансдуцированных нейронов и 6,1 ± 2,6 кальбиндин-положительных клеток, из которых 4,2 ± 1,9 клетки несли обе метки (69,1%; n = 10 препаратов). В слое 5 мы насчитали 19 ± 2,1 трансдуцированных нейронов, 15,9 ± 5,7 интернейронов кальбиндина, из которых 1,1 ± 1,5 (6,9%) показали двойное окрашивание. Однако следует отметить, что 100% нейронов с двойной меченой меткой в слое 5 имели четко видимую пирамидальную форму, что может свидетельствовать о наличии кальбиндин-положительных пирамидальных нейронов или некоторой неспецифичности антител. Таким образом, в слое 5 не наблюдалось истинных интернейронов кальбиндина, трансдуцированных субарахноидальной инъекцией вируса.
Таким образом, в то время как парвальбумин и кальбиндин-положительные клетки действительно присутствовали среди трансдуцированных нейронов в слое 2/3 (рис. 4A, C), в слое 5 трансдуцированные интернейроны не были обнаружены, и все EGFP-экспрессирующие клетки были визуально идентифицированы как пирамидальные нейроны (рис. 4B, D).

Рисунок 1: Сравнение площади трансдукции AAV2 после обычных интракортикальных инъекций и инъекций субарахноидального вируса. (A) Распространение CaMKII_oChieff_EGFP конструируется через 21 день после инъекции в паренхиму мозга на глубину 500 - 600 мкм. (B) Распространение CaMKII_oChieff_EGFP в другом полушарии того же животного после введения субарахноида. Показаны фронтальные срезы на расстоянии 200-300 мкм в рострокаудальном направлении от места инъекции. Масштабная линейка - 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 2: Фотография всего мозга с неповрежденным твердым мозговым веществом, показывающая распространение вирусов AAV2_CaMKII_Venus и красных флуосфер, введенных субарахноидально. (А) Флуоресценция красных наночастиц, которые были добавлены к введенной вирусной суспензии, показывающая физическое распространение введенного объема в субарахноидальном пространстве. (B) То же полушарие мозга в зеленом флуоресцентном канале показывает область экспрессии Венеры. Место укола обозначается стрелками. Кроме того, отмечается место расположения лямбды. Масштабная линейка - 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 3: Субарахноидальная инъекция вируса приводит к широкому инфицированию нейронов слоев 2/3 и 5 неокортекса. (А) Сравнение областей трансдукции (в медиолатеральном (м/л) и рострокаудальном (р/к) направлениях) после интракортикального (i) и субарахноидального (s) введения вируса. Столбцы представляют среднее значение; Усы обозначают стандартное отклонение (**** - p < 0,0001; *** - p < 0,001; t-критерий). (B) Конфокальная микрофотография, показывающая экспрессию Венеры в неокортексе мыши после субарахноидальной инъекции вирусов AAV2_CaMKII_Venus. Границы слоев показаны схематически (L1 - L6). (C) Фрагмент изображения (B), показанный с различными настройками яркости и контрастности, чтобы продемонстрировать движение флуоресцентных аксонов через слой 6 и белое вещество (WM). Масштабная линейка составляет 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
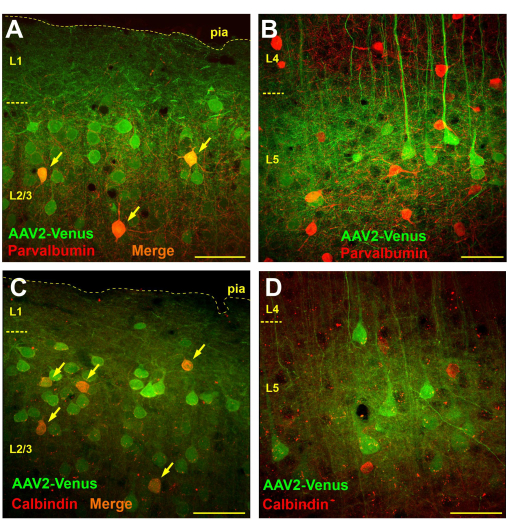
Рисунок 4: Инъекция субарахноидального вируса приводит к трансдукции интернейронов в над-, но не в субгранулярных слоях неокортекса. (А, Б) Иммунохимическое окрашивание участков мозга у мыши, трансдуцированное путем субарахноидального введения вируса AAV2_CaMKII_Venus с антителами к парвальбумину (Alexa594-конъюгированные вторичные антитела). Нейроны, несущие как зеленые, так и красные метки, отображаются оранжевым цветом (обозначены стрелками). (С, Г) Микрофотографии участка мозга мыши после введения субарахноидального AAV2_CaMKII_Venus окрашенного антителами к кальбиндину. Обратите внимание на отсутствие нейронов с двойной меткой в L5. Масштабная линейка составляет 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Мы разработали новый метод трансдукции нейронов неокортикальной коры мыши путем введения суспензии вирусных частиц AAV2 в субарахноидальное пространство мозга. Это обеспечивает широкое распространение вируса, почти в четыре раза превышающее объем инфицированной ткани при введении такого же количества вируса непосредственно в паренхиму мозга.
Инъекция вирусных векторов непосредственно в спинномозговую жидкость (СМЖ) различными путями (например, внутримозговыми, интратекальными или интрацистернальными) является популярной стратегией для широкой доставки генов по всей ЦНС 33,34,35. Тем не менее, внутримозговое или интратекальное введение векторов AAV2 в мозг взрослого человека приводит к ограниченной трансдукции мозга из-за их высокого сродства к эпендимальным клеткам 28,33,36,37. Эпендимальные клетки обнаруживаются в виде монослоя, выстилающего третий и четвертый желудочки и центральный канал спинного мозга38. Наличие плотных соединений между эпендимальными клетками в желудочке является значимым барьером для некоторых серотипов AAV, которые должны проходить через эти клетки из желудочка для внутрипаренхиматозного распространения39.
В нашей работе инъекция вирусного вектора AAV2 в субарахноидальное пространство через поверхность мозга привела к широкой трансдукции нейронов неокортекса у взрослых мышей. Есть свидетельства того, что вещество pia имеет различную структуру в разных областях ЦНС. Мембрана в спинномозговой мозговой оболочке (которая окружает спинной мозг) намного толще, чем черепная мозговая оболочка (которая окружает головной мозг) из-за двухслойной природы мембраныpia 40. Также показано, что желудочковая спинномозговая жидкость проникает в паренхиму головного мозга минимально, тогда как субарахноидальная спинномозговая жидкость быстро проникает в паренхиму головного мозга по параваскулярным пространствам41. Таким образом, вполне вероятно, что различные пути доставки вирусного вектора в спинномозговую жидкость могут давать разные результаты.
Следует отметить, что внутриспинномозговые инъекции некоторых вариантов AAV связаны с определенными побочными эффектами. Было показано, что интратекальная или внутримозговая доставка AAV9 приводит к экспрессии генов не только в ЦНС, но и в периферических органах42,43. Для более эффективной трансдукции нейронов по всему мозгу требуются высокие дозы векторов. Например, взрослые крысы Спрэга-Доули получали одностороннюю инъекцию AAV9 в боковой желудочек в трех дозах: 3,1 μл, 15,5 μл и 77,5 μл42. Мыши получали AAV9 в общем объеме 10 мкл в цистерне43. Преимущество нашего метода инъекции вируса заключается в том, что мы использовали меньший объем вектора (1 мкл), чем те, которые использовались для интратекальной или внутримозговой доставки AAV. Меньший объем вируса значительно снижает риск экспрессии вируса за пределами мозга, а также токсичность.
Хотя мы не изучали вирусную экспрессию за пределами мозга, весьма вероятно, что субарахноидальное введение AAV2 через поверхность мозга привело к экспрессии вируса исключительно в мозге (в частности, в неокортексе). Наше предположение основано на следующих причинах. AAV9 является рекомбинантным аденоассоциированным вирусом, который может проникать через гематоэнцефалический барьер (ГЭБ) и обычно используется для глобальной трансдукции ЦНС37,44. Тем не менее, проникновение ГЭБ и трансдукция мозговой ткани ограничены AAV245. Кроме того, анализ срезов мозга мышей после субарахноидальной инъекции вируса показал, что трансдуцированные клетки располагались исключительно в неокортексе ипсилатерального (инъецированного) полушария. В контралатеральном неокортексе или других структурах мозга не было обнаружено трансдуцированных клеток, что позволяет предположить, что трансдукция периферических органов таким методом инъекции очень маловероятна.
В дополнение к большой площади инфекции, метод инъекции субарахноидального вируса позволяет селективно трансдукцию пирамидальных нейронов пятого слоя, даже с использованием сильных неселективных промоторов, таких как CAG. Хорошо известно, что обеспечить селективную экспрессию даже со специфическими промоторами довольно сложно 1,26. Например, используемый нами промотор CaMKII теоретически должен преимущественно инфицировать глутаматергические нейроны. Однако, как показано в полученных здесь и других исследованиях, при его использовании происходит и трансдукция других типов клеток, в частности, ГАМКергических интернейронов46. Более того, поскольку при субарахноидальных инъекциях трансдукция клеток происходит на значительном расстоянии от места инъекции, этот метод помогает сохранить ткани мозга для последующей оптической или электрофизиологической записи нейронной активности. Мы успешно использовали инъекции субарахноидального вируса в экспериментах с оптогенетической стимуляцией и внеклеточной регистрацией активности пирамидальных нейронов L5 зрительной коры мыши in vivo32.
Эта работа является продолжением нашего масштабного исследования механизмов пластичности в зрительной коре, в котором мы использовали AAV2 для экспрессии канала родопсин в пирамидальных нейронах зрительной коры32 мыши. С этим серотипом мы получили много статистики и, по сути, разработали метод субарахноидального введения. В пилотных экспериментах мы также пробовали субарахноидальную инъекцию вируса с серотипом 2/9 и получили аналогичные результаты, хотя детальный морфометрический анализ в данном случае мы не проводили. К сожалению, невозможно предсказать, как поведут себя другие серотипы после введения субарахноидального введения и какой серотип вируса обеспечит наибольшую площадь трансдукции; Это можно определить только опытным путем, что требует немалого объема работы. В данной работе мы убедительно показали, что AAV2 может быть введен в субарахноидальное пространство мозга взрослой мыши, что приводит к широкой трансдукции с селективной экспрессией гена-мишени в пятом слое пирамидных нейронов неокортекса и неселективной экспрессией в надзернистых слоях.
Наиболее важным этапом использования данного метода инъекции субарахноидального вируса является обеспечение оптимального размера отверстия в твердой мозговой оболочке, которое должно точно совпадать с диаметром инъекционной иглы. Твердая мозговая оболочка должна плотно обхватывать иглу и, следовательно, предотвращать обратный ток вируса во время инъекции. Мы назвали этот метод субарахноидальной инъекцией, но неясно, проникает ли вирус, помимо субарахноидального пространства, и распространяется ли он в субдуральное пространство (пространство между паутинной оболочкой и твердой мозговой оболочкой). Также неясно, будет ли этот метод работать у других животных, особенно у крыс, или с другими серотипами AAV.
Ранее Синьцзянь Ли и его коллеги описали метод нейрональной трансдукции, основанный на вливании вируса на поверхность коры головного мозга. Они использовали стеклянную пипетку широкого диаметра на поверхности коры головного мозга для введения вирусного кальциевого репортера AAV-GCaMP6 в кору головного мозга. Используя этот метод, вирусные частицы, предположительно, аналогично этому случаю, попадают в верхние слои неокортекса, где захватываются нейронами. Авторы обнаружили, что поверхностная инфузия вируса коры головного мозга эффективно помечает нейроны в поверхностных слоях, избегая при этомнейронов глубокого слоя. Не совсем понятно, почему в цитируемой работе не была показана трансдукция пирамидальных нейронов пятого слоя, аналогичная той, которую мы наблюдали в нашем исследовании.
Наша гипотеза о том, что после введения субарахноидального введения вирус захватывается дендритами нейронов, разветвляющимися в надзернистых слоях, имеет одну заметную слабость. В дополнение к большим пирамидам пятого слоя, пирамидальные нейроны48 четвертого слоя и проецирующие клауструм пирамидальные клетки49 L6 в зрительной коре головного мозга мыши имеют дендриты, которые достигают первого слоя. Поэтому непонятно, почему эти клетки не трансдуцируются с помощью инъекции субарахноидального вируса. Одно из возможных объяснений состоит в том, что инфицированы только те клетки, дендриты которых достаточно толсты, чтобы транспортировать вирусную частицу к телу клетки, т.е. пирамиды L5. Было показано, что в зрительной коре головного мозга мышей пирамидальные нейроны четвертого слоя посылают только один тонкий дендрит в первый слой неокортекса48. Тем не менее, необходимы дальнейшие исследования, чтобы определить причину наблюдаемой картины инфекции после инъекции субарахноидального вируса.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Работа выполнена при финансовой поддержке Российского научного фонда, грант 20-15-00398P.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
Ссылки
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены