Method Article
Weit verbreitete Transduktion neokortikaler Neuronen der Maus durch Subarachnoidal-Injektion von AAV2
In diesem Artikel
Zusammenfassung
Es wird eine neue Technik zur großflächigen Verabreichung von Adeno-assoziierten Viren beschrieben, die eine Subarachnoidalvirus-Infusion verwendet. Diese Methode gewährleistet nicht nur eine weit verbreitete Transduktion von neokortikalen Neuronen der Maus in oberflächlichen Schichten, sondern führt auch zu einer selektiven Expression des Transgens in pyramidalen Neuronen der fünften Schicht, selbst wenn ein nicht-selektiver Promotor verwendet wird.
Zusammenfassung
Rekombinante Adeno-assoziierte Viren sind ein flexibles und leistungsfähiges Werkzeug für die Verabreichung und Expression verschiedener Gene, die in vielen Bereichen der experimentellen Biologie, insbesondere in den Neurowissenschaften, von Interesse sind. Die beliebteste Methode, um die Expression eines gewünschten Transgens in einem bestimmten Gehirnbereich zu steuern, besteht darin, einen AAV-Vektor direkt in das Hirnparenchym zu injizieren. Diese Methode erlaubt jedoch keine großflächige neuronale Transduktion, die für einige in vivo-Experimente erforderlich ist. In diesem Artikel stellen wir eine neue Technik für die weit verbreitete Genexpression im Neokortex der Maus vor, die auf einer viralen Infusion in den Subarachnoidalraum des Gehirns basiert. Diese neuronale Markierungsmethode gewährleistet nicht nur eine weit verbreitete Transduktion von Neuronen in oberflächlichen neokortikalen Schichten adulter Mäuse, sondern führt auch zur Expression des Transgens in einer großen Population von pyramidalen Neuronen der fünften Schicht mit hoher Spezifität, selbst wenn ein starker nicht-selektiver Promotor wie CAG verwendet wird. Da die Zelltransduktion in erheblicher Entfernung von der Injektionsstelle stattfindet, kann diese Methode außerdem dazu beitragen, Hirngewebe für spätere optische oder elektrophysiologische Aufzeichnungen der neuronalen Aktivität zu erhalten.
Einleitung
Das Säugetiergehirn besteht aus vielen hemmenden, exzitatorischen und modulatorischen Zellen, die durch Billionen von Synapsen zu Schaltkreisen miteinander verbunden sind1. Eine der zentralen Herausforderungen der Neurowissenschaften besteht darin, die Rolle unterschiedlicher Zelltypen bei der Organisation und Funktion von Schaltkreisen und Verhalten im Gehirn zu entschlüsseln. Die Manipulation genetisch definierter Zellen im Gehirn erfordert Methoden zur Einführung und Expression von Transgenen. Virale Gentransfersysteme sind bei weitem die effektivste und einfachste Methode für die Genübertragung in das zentrale Nervensystem2. Virale Verabreichungssysteme basieren auf replizierenden Viren (Adenoviren, Adeno-assoziierte Viren (AAVs), Lentiviren und Retroviren), die in der Lage sind, genetische Informationen in eine Wirtszelle zu bringen 2,3.
AAV-basierte Vektoren sind mittlerweile zu einem der am weitesten verbreiteten Werkzeuge für die Verabreichung gewünschter Transgene an Zellen im Gehirn geworden, sowohl für die neurowissenschaftliche Grundlagenforschung als auch für die Entwicklung von Gentherapien für neurologische Erkrankungen. Im Vergleich zu anderen Viren besitzen replikationsdefekte AAVs viele Eigenschaften, die sie zu idealen Vektoren für diese Zwecke machen. Vor allem transduzieren AAV-Vektoren effizient sich nicht teilende (terminale differenzierte) Zellen wie Neuronen und Gliazellen, was zu einer hohen Transgenexpression in vivoführt 2. Die Vektoren können leicht bei einem hochfunktionellen Titer hergestellt werden, der für die In-vivo-Verwendung geeignet ist 3,4,5. Wichtig ist, dass die Adeno-assoziierte Virus-vermittelte Genverabreichung in vivo keine histopathologischen Veränderungen und vektorbedingte Toxizität hervorruft6. Im Gegensatz zu adenoviralen Vektoren löst die In-vivo-Verabreichung von AAV-Vektoren in Tiermodellen in der Regel keine Immunantworten des Wirts gegen transduzierte Zellen aus, was eine stabile Transgenexpression innerhalb des Hirnparenchyms über längere Zeiträume ermöglicht 2,7,8.
Ein weiterer Grund für die Beliebtheit von AAV-Vektoren ist die breite Palette von AAV-Serotypen mit einzigartigen Gewebe- und Zelltyp-Tropismen 9,10,11,12,13,14. Unterschiedliche Kapsidproteine, die von verschiedenen AAV-Serotypen exprimiert werden, führen zur Verwendung unterschiedlicher Zelloberflächenrezeptoren für den Zelleintritt und damit zu spezifischen Tropismen10,14.
Der AAV-Tropismus wird nicht nur durch Kapsidproteine, sondern auch durch viele andere Faktoren bestimmt14. Es wurde gezeigt, dass die AAV-Serotypen 1, 2, 6, 7, 8 und 9 in Primärkulturen sowohl Neuronen als auch Astrozyten transduzierten15,16, aber nach intraparenchymaler Hirninjektion einen starken neuronalen Tropismus aufwiesen17,18. Die Methode, die zur Herstellung von AAV-Vektoren verwendet wird, kann auch den Nervenzelltropismus beeinflussen, selbst bei demselben Serotyp. Zum Beispiel besaß CsCl-gereinigtes AAV8 nach intraparenchymaler Hirninjektion einen starken astroglialen Tropismus, während Iodixanol-gereinigtes AAV8, das unter identischen Bedingungen injiziert wurde, nur Neuronentransduzierte 19. Der AAV-Tropismus kann auch durch die injizierte Dosis und das Volumen14 beeinflusst werden. Zum Beispiel transduzierte rAAV2/1 mit hohem Titer effizient sowohl kortikale exzitatorische als auch inhibitorische Neuronen, aber die Verwendung niedrigerer Titer zeigte eine starke Präferenz für die Transduktion kortikaler inhibitorischer Neuronen20.
Daher ist es nicht möglich, eine robuste Zelltypspezifität allein auf der Grundlage des Kapsid-Serotyps zu erreichen. Zelltypspezifische Promotoren können verwendet werden, um den breiten natürlichen Tropismus des AAV-Kapsids zu überwinden. Zum Beispiel wird humanes Synapsin I für das Targeting von Neuronenverwendet 21, der CaMKII-Promotor kann die Transgenexpression in glutamatergen exzitatorischen Neuronen mit hoher Spezifität steuern20, der ppHcrt-Promotor zielt auf Hypocretin (HCRT)-exprimierende Neuronen im lateralen Hypothalamusab 22, der PRSx8-Promotor zielt auf noradrenerge und adrenerge Neuronen ab, die Dopamin-Beta-Hydroxylase23 exprimieren, und der GFAP-Promotor kann die Astrozyten-spezifische Expressionsteuern 24. Einige zellspezifische Promotoren weisen jedoch eine schwache transkriptionelle Aktivität auf und können keine ausreichende Transgenexpression bewirken25. Darüber hinaus behalten die kurzen Promotoren, die in AAV-virale Vektoren passen, oft keine Zelltypspezifität bei 1,26. So konnte beispielsweise gezeigt werden, dass ein CaMKII-Konstrukt auch inhibitorische Neuronen transduziert12.
Neben der Zelltypspezifität (Tropismus) ist die Transduktionseffizienz ein weiteres wesentliches Merkmal von AAVs. Die verschiedenen AAV-Serotypen haben unterschiedliche Diffusionseigenschaften. AAV2 und vier virale Vektoren diffundieren weniger leicht durch das Hirnparenchym und vermitteln daher die Transduktion über einen kleineren Bereich17,27. Die am weitesten verbreitete neuronale Transduktion wird bei den AAV-Serotypen 1, 9 und rh beobachtet.10 11,17,18,19,28.
Die beliebteste Methode, um die Expression eines gewünschten Transgens in einem bestimmten Hirnbereich zu steuern, besteht darin, den AAV-Vektor direkt in die interessierende Hirnregion (Parenchym) zu injizieren3. Nach intraparenchymaler Injektion transduzieren selbst AAV-Serotypen mit effektiverer Diffusion durch das Gehirn typischerweise nur einen lokalen Bereich um die Injektionsstelle 12. Darüber hinaus ist die intraparenchymale Injektion ein invasives Verfahren und führt zu Gewebeschäden in der Nähe der interessierenden Region. Daher ist diese Methode der Virusinjektion für einige experimentelle Aufgaben ungeeignet. Zum Beispiel ist eine umfangreiche Markierung von Zellen in Experimenten zur Untersuchung der kortikalen Neuronenfunktionen bei frei beweglichen Tieren sehr wünschenswert, einschließlich unter Verwendung von Ein- oder Zwei-Photonen-Mikroskopie 29,30,31,32.
Hier beschreiben wir eine neue Adeno-assoziierte Virusinjektionstechnik, die die Subarachnoidalvirus-Infusion verwendet, um eine weit verbreitete Transduktion von neokortikalen Neuronen in erwachsenen Mäusen zu ermöglichen und Hirngewebe für nachfolgende optische oder elektrophysiologische Aufzeichnungen der neuronalen Aktivität zu erhalten. Diese Methode gewährleistete nicht nur eine weit verbreitete Transduktion von Neuronen in oberflächlichen neokortikalen Schichten, sondern führte auch zu einer Expression des Transgens in einer großen Population von pyramidalen Neuronen der fünften Schicht mit hoher Spezifität, selbst wenn ein starker nicht-selektiver Promotor wie CAG verwendet wurde.
Protokoll
Die Experimente wurden an adulten C57Black/6 Mäusen im Alter von 2-4 Monaten beiderlei Geschlechts durchgeführt (Puschtschino-Zuchtzentrum, Abteilung des Shemyakin-Ovchinnikov-Instituts für Bioorganische Chemie der RAS). Die Mäuse wurden in einem temperierten Vivarium (22 °C ± 2 °C, 12 h Hell-Dunkel-Zyklus, Licht an um 08.00 Uhr) mit Futter und Wasser ad libitum untergebracht. Alle Versuchsverfahren wurden in Übereinstimmung mit den ARRIVE-Richtlinien und der Richtlinie 2010/63/EU für Tierversuche durchgeführt. Das Studienprotokoll wurde von der Ethikkommission der IHNA RAS genehmigt (Protokoll N1 vom 01.02.2022). Es wurden alle Anstrengungen unternommen, um das Leiden der Tiere zu minimieren und die Zuverlässigkeit der Ergebnisse zu gewährleisten.
1. Vorbereitung auf die Operation
- Sterilisieren Sie alle chirurgischen Instrumente vor Beginn der Operation. Reinigen Sie den Operationsbereich mit 70 % Ethanol.
- Überprüfen Sie den Isofluranspiegel im Anästhesiesystem und füllen Sie es bei Bedarf auf. Legen Sie ein sauberes Papiertuch auf den Boden der Induktionskammer.
- Lege ein Heizkissen auf den stereotaktischen Rahmen. Decken Sie den Block mit einem sauberen Papiertuch ab.
- Bereiten Sie eine Flasche mit 2 % Bleichmittel vor, um Mikropipettenspitzen, Röhrchen, Wattestäbchen und andere Gegenstände zu sammeln, die mit dem Virus in Kontakt kommen.
- Nehmen Sie ein Aliquot AAV aus dem -80 °C Gefrierschrank und legen Sie es zum Auftauen auf Eis.
2. Vorbereitung der Spritze
- Reinigen Sie eine 5 μl Hamilton Mikrospritze mit einer 33G stumpfen RN-Nadel. Aspirieren und geben Sie dann 70% Ethanol ab. 3x mit frischem Ethanol wiederholen. Spülen Sie die Spritze mit destilliertem Wasser aus, um das überschüssige Ethanol zu entfernen. 3x wiederholen.
- Nehmen Sie den Kolben heraus und füllen Sie den Zylinder mit einer Insulinspritze durch den Flansch mit Vaselineöl. Achten Sie darauf, dass sich keine Luftblasen in der Mikrospritze befinden.
HINWEIS: Eingeschlossene Luft ist komprimierbar und beeinträchtigt die Genauigkeit und Präzision der Spritze. - Setzen Sie den Kolben wieder in die Mikrospritze ein und geben Sie einen Tropfen Öl ab. Setzen Sie die Spritze so in den stereotaktischen Injektor ein, dass die Skala sichtbar ist, um das Volumen der abgegebenen Lösung zu überwachen.
3. Vorbereitung der Mäuse für die Operation
- Wiegen Sie eine Maus. Platzieren Sie die Maus in der Anästhesie-Induktionskammer, die mit dem Isofluran verbunden ist. Schalten Sie den Isofluran-Verdampfer ein, der auf 5% eingestellt ist, und stellen Sie die Durchflussrate auf 250 mL/min ein. Eine adäquate Narkosetiefe wird innerhalb von 5 bis 7 min erreicht.
- Um das chirurgische Niveau der Anästhesie zu überprüfen, überprüfen Sie, ob während eines schmerzhaften Kneifens in der Hinterpfote kein Schneebesen und kein Blinzeln vorhanden ist, und ob bei Augenkontakt kein Blinzeln auftritt.
- Schalten Sie das Verdampfer-Auslassventil von der Induktionskammer auf die stereotaktische Maske um. Reduzieren Sie das Isofluran auf 1,8%-2,0% und stellen Sie die Flussrate entsprechend dem Gewicht der Maus ein (70-90 mL/min für Mäuse mit einem Gewicht zwischen 25 und 35 g).
- Nehmen Sie die Maus aus der Induktionskammer und legen Sie sie in das stereotaktische Gerät auf ein Heizkissen (37 °C), um eine Unterkühlung während der chirurgischen Anästhesie zu vermeiden. Setzen Sie die Frontzähne in den Zahnsteg ein und montieren Sie dann die Tiermaske.
- Positionieren Sie das Tier vorsichtig auf den Ohrbügeln. Die korrekte Kopfhaltung im stereotaktischen Apparat ermöglicht eine vertikale, aber nicht laterale Bewegung des Kopfes. Stellen Sie sicher, dass die Positionierung des Tieres keinen Stress verursacht. Überwachen Sie die Narkosetiefe, die Atmung des Tieres und die Körpertemperatur während der gesamten Operation sorgfältig.
- Rasieren Sie den Kopf von den Augen bis hinter die Ohren. Reinigen Sie die rasierte Oberfläche des Kopfes, indem Sie einen Tupfer mit 70 % Ethanol und anschließend einen Abstrich mit einer 5%igen Alkohollösung aus Jod machen.
- Tragen Sie ophthalmisches Gel auf, um ein Austrocknen der Augen zu verhindern. Tragen Sie 4% ige Lidocainlösung topisch und Dexamethason (0,02 ml bei 4 mg/ml) subkutan auf, um chirurgische Schmerzen zu verhindern und die mögliche Entzündungsreaktion zu reduzieren.
- Machen Sie mit einer sterilen Skalpellklinge und einer Schere einen 4-5 mm langen Schnitt entlang der Mittellinie des Kopfes, um die Kopfhaut zu öffnen. Beginnen Sie mit einem kleinen Schnitt zwischen den Ohren und erweitern Sie ihn dann mit einer Schere, um Schäden am Schädel zu vermeiden.
- Tupfen Sie die Oberfläche des Schädels mit einer kleinen Menge 3% Wasserstoffperoxid ab, um die stereotaktischen Orientierungspunkte zu visualisieren: Bregma und Lambda. Stoppen Sie die Reaktion mit 0,9% NaCl-Kochsalzlösung sofort. Kratzen Sie das Gewebe auf dem Schädel mit einem Knochenschaber ab.
- Montieren Sie den vorbereiteten motorisierten Injektor mit der Hamilton-Spritze auf dem stereotaktischen Arm. Richten Sie eine chirurgische Lichtquelle auf den freiliegenden Schädel und fokussieren Sie das Mikroskop auf das Bregma.
- Wenn du durch das Mikroskop schaust, bewege den Arm des stereotaktischen Apparats so, dass die Spitze der Nadel direkt über dem Bregma zentriert ist.
- Richten Sie Bregma und Lambda mit der Spitze der Nadel horizontal aus und bewegen Sie dann den Arm zurück zum Bregma und notieren Sie die Koordinaten. Verwenden Sie diese Bregma-Koordinaten und die Atlas-Koordinaten des interessierenden Bereichs, um die relativen Koordinaten des Zielbereichs zu berechnen.
- Bewegen Sie die Nadel in den Zielbereich. Senken Sie die Nadel bei den neuen Koordinaten ab und markieren Sie diese Position. Wählen Sie den Ort für die virale Mikroinjektion in unmittelbarer Nähe des Zielbereichs unter Berücksichtigung der Ausbreitung des Virus aus.
HINWEIS: Dadurch wird eine Beschädigung des Gewebes im interessierenden Bereich vermieden. Wir verwendeten die folgenden Koordinaten für die Region of Interest: AP-3.4, ML -2.0 und für die virale Mikroinjektion: AP-2.0, ML -1.4. Die obigen Koordinaten sind optimal, wenn primäre Neuronen des visuellen Kortex infiziert werden sollen. - Vermeiden Sie nach Möglichkeit Regionen mit großen Blutgefäßen. Unter einem Operationsmikroskop, heller Kaltlichtbeleuchtung und 0,9 % NaCl-Kochsalzlösung sollten große Blutgefäße im Schädel und auf der Gehirnoberfläche sichtbar werden.
4. Virus-Injektion
- Nehmen Sie einen sterilen Zahnbohrer (0,5 - 0,8 mm Durchmesser). Betrachten Sie die Oberfläche des Schädels durch das Operationsmikroskop und bohren Sie eine kleine Kraniotomie manuell (von Hand) oder mit einem Mikrobohrer. Achten Sie darauf, keinen übermäßigen Druck auf den Schädel auszuüben.
- Schieben Sie den Arm aus dem Weg, um eine Beschädigung der Mikrospritzennadel während des Bohrens des Kraniotomie (Lochs) zu vermeiden. Tragen Sie 0,9 % NaCl-Kochsalzlösung auf und pausieren Sie intermittierend, um eine Erwärmung des Knochens und eine Beschädigung der Dura mater zu vermeiden. Verwenden Sie Druckluft, um Knochenstaub wegzublasen.
HINWEIS: Die folgenden Arten von Hartmetall-Zahnbohrern sind geeignet: birnenförmig (bevorzugt), abgerundeter Zylinder und rund.- Wenn Sie den Knochen mit dem Bohrer ausdünnen, stellen Sie sicher, dass die Ausdünnung über den gesamten Umfang gleichmäßig ist. Dies erleichtert die Entfernung des Knochens, ohne die Dura mater zu beschädigen. Verwenden Sie dazu zunächst einen Bohrer mit runder Spitze und dann einen Bohrer mit flacher Spitze. Halten Sie den Bohrer senkrecht zum Knochen; Andernfalls ist eine Seite dünner als die andere.
HINWEIS: Je kleiner die Größe des Bohrers und je kleiner die durchgeführte Kraniotomie ist, desto komplexer ist die Manipulation. Es wird empfohlen, eine Kraniotomie mit kleinerem Durchmesser (0,5-0,6 mm) durchzuführen, wenn das Tier weiterhin für In-vivo-Arbeiten verwendet wird. Wenn Sie planen, das Gehirn des Tieres für Ex-vivo-Arbeiten zu verwenden, ist ein größerer Kraniotomiedurchmesser akzeptabel, um das Verfahren zu vereinfachen.
- Wenn Sie den Knochen mit dem Bohrer ausdünnen, stellen Sie sicher, dass die Ausdünnung über den gesamten Umfang gleichmäßig ist. Dies erleichtert die Entfernung des Knochens, ohne die Dura mater zu beschädigen. Verwenden Sie dazu zunächst einen Bohrer mit runder Spitze und dann einen Bohrer mit flacher Spitze. Halten Sie den Bohrer senkrecht zum Knochen; Andernfalls ist eine Seite dünner als die andere.
- Wenn der ausgedünnte Knochen weich und durchsichtig ist, hören Sie auf zu bohren. Wenn sich eine ausreichend große Vertiefung im Knochen bildet, stoppen Sie häufig die Rotation und überwachen Sie die Dicke des Knochens. Das Auftreten von Rissen im Knochen deutet darauf hin, dass eine Ausdünnung ausreichend ist.
- Baden Sie das Loch mit steriler Kochsalzlösung und entfernen Sie dann die überschüssige Kochsalzlösung mit einem Wattestäbchen. Entfernen Sie die verbleibende Knochenschicht mit einer 27G-Nadel mit hakenförmiger Spitze und/oder mit einer Pinzette mit feiner Spitze. Vermeiden Sie es, die Dura zu beschädigen.
- Decken Sie die Oberfläche des Schädels mit einem sterilen Stück Papiertuch ab, das mit Kochsalzlösung angefeuchtet ist. Lege ein Stück saubere, transparente Folie auf die Oberfläche des Mäuseschädels über dem Papier.
- Bewegen Sie den stereotaktischen Arm nach hinten und positionieren Sie die Mikrospritzennadel direkt über dem Film. Geben Sie das überschüssige Öl ab, bis ein Volumen von 2 μL erreicht ist.
HINWEIS: Das endgültige Volumen des Öls kann je nach Volumen der Mikrospritze variieren. Wir verwendeten eine 5 μL 75-RN Hamilton Mikrospritze. - Pipettieren Sie ein Virusvolumen, das dem injizierten Volumen + 2 μl entspricht, auf ein Stück transparente Folie.
- Wenn Sie durch das Operationsmikroskop schauen, senken Sie den Arm nach unten, bis sich die Nadelspitze in der Mitte des Tropfens des Virus befindet. Laden Sie das Virus mit einem motorisierten Injektor in die Mikrospritze. Entsorgen Sie die Spitze der Mikropipette und die transparente Folie in der Flasche mit 2 % Bleichmittel.
- Entfernen Sie das mit Kochsalzlösung angefeuchtete Papier von der Oberfläche des Schädels und trocknen Sie den Schädel mit einem Wattestäbchen. Verwenden Sie den stereotaktischen Arm, um die Nadel über der Einstichstelle zu positionieren.
- Geben Sie einen Tropfen des Virus ab, um sicherzustellen, dass die Nadel nicht verstopft ist. Mit einer 30 G Nadel mit hakenförmiger Spitze einen kleinen Schlitz in die Dura stechen.
HINWEIS: Es ist wichtig, einen möglichst kleinen Schlitz in die Dura mater zu bohren, damit die Nadel eindringen kann, ohne einen Spalt zwischen der Nadel und der Dura mater zu hinterlassen, aus dem das Virus austreten könnte. - Senken Sie die Nadel der Spritze bis zur Dura ab und berechnen Sie die entsprechende Tiefe. Schätzen Sie die kortikale Tiefe der Insertion relativ zu dem Punkt, an dem die Nadel zum ersten Mal die Oberfläche der Rinde berührt hat.
- Führen Sie die Nadelspitze langsam bis zu einer Tiefe von 300 μm in die Rinde ein. Warten Sie 2-3 Minuten, damit die Dura an der Nadel haften kann, und ziehen Sie die Nadel dann langsam bis zu einer Tiefe von 200 μm zurück. Warten Sie weitere 2-3 Minuten, damit sich das Gehirngewebe absetzen kann. Dies führt dazu, dass die Nadel die Dura nach oben zieht und einen subduralen Raum schafft, in dem sich das Virus ausbreiten kann.
HINWEIS: Um kortikale Schäden zu minimieren, verwenden Sie eine 33-G-Nadel oder niedrigere G-Nadeln. Denken Sie daran, dass die Wahrscheinlichkeit, dass der Geweberückfluss die Spitze verstopft, umso höher ist, je kleiner der Innendurchmesser der Spitze ist. Es ist wichtig, eine stumpfe Nadel anstelle einer abgeschrägten Nadel zu verwenden, da eine stumpfe Nadel einen kontrollierteren Tropfen der Viruslösung ausstößt.- Wenn die Nadel beim Absenken auf 150-200 μm nicht durch die Dura mater geht und diese stattdessen biegt, hören Sie mit dem Absenken auf. Hebe die Nadel an und mache einen etwas größeren Schnitt in der Dura Mater, dann versuche wieder, die Nadel zu senken.
- Wenn beim Absenken der Nadel aktiv Flüssigkeit aus dem Schnitt austritt, warten Sie, bis sie aufhört zu lecken. Andernfalls ist es schwierig, die Nadel zu kontrollieren, die durch die Dura geht. Tupfen Sie die überschüssige Zerebrospinalflüssigkeit mit einer Gewebespitze ab. Sobald die Flüssigkeit nicht mehr fließt, heben Sie die Nadel an und versuchen Sie es erneut.
- Beginnen Sie mit der Injektion der Virussuspension mit einer Geschwindigkeit von 0,06 μl/min, während Sie das abgegebene Volumen überwachen. Injizieren Sie 1 μl Virus. Injizieren Sie das Virus in einer einzigen Tiefe, um die Versiegelung zwischen Nadel und Rindengewebe nicht zu beschädigen.
- Fehlerbehebung: Zu Beginn der Injektion kann es zu einem Virusrückfluss an die Gehirnoberfläche kommen. Beenden Sie die Injektion, warten Sie 2-3 Minuten und fahren Sie dann mit der Virusinjektion fort. Wiederholen Sie diese Aktionen (Schritte), bis der Virusrückfluss gestoppt wird. Viren und Liquor cerebrospinalis bleiben an der Nadel haften und verhindern einen Rückfluss.
- Eine andere Möglichkeit, den Virusrückfluss zu stoppen, besteht darin, eine kleine Menge Agarose auf die Oberfläche des Kortex zu geben. Es unterdrückt das Pulsieren der Hirnrinde und hilft auch, die Nadel abzudichten. Achten Sie aber darauf, dass die Pipette nicht durch die Agarose verstopft ist.
- Da die Nadel im abgesenkten Zustand möglicherweise nicht vollständig, sondern nur teilweise durch die Dura mater hindurchgeht, kann es sein, dass eine Seite der Nadel nicht fest an der Dura anliegt, was zu einem Rückfluss des Virus führen kann. Ziehen Sie in diesem Fall die Nadel langsam aus dem Gewebe zurück und versuchen Sie wieder, sie abzusenken.
- Sobald die Infusion abgeschlossen ist, halten Sie die Nadel für weitere 10 Minuten an der Zielstelle. Dadurch kann sich das Virus von der Injektionsstelle weg verteilen. Ziehen Sie die Nadel langsam aus dem Gehirn zurück, um zu verhindern, dass das Virus wieder aus dem Nadeltrakt zurückströmt.
- Sobald die Nadelentnahme abgeschlossen ist, überprüfen Sie, ob sie nicht verstopft ist, indem Sie einen kleinen Tropfen Virus abgeben. Verschließen Sie den Hautschnitt mit 5-0 resorbierbaren oder nicht resorbierbaren Nähten.
5. Nachsorge
- Tragen Sie nach dem Schließen des Einschnitts die antibakterielle Salbe topisch auf. Injizieren Sie eine Mischung aus Kochsalzlösung (5 ml/kg) und 5% Glukose (5 ml/kg) subkutan, um Dehydration zu verhindern und die Genesung nach der Anästhesie zu erleichtern. Injizieren Sie Ketoprofen intramuskulär (2,5 mg/kg), um die Schmerzen zu lindern.
- Setzen Sie das Tier in einen frischen Käfig auf ein Heizkissen und überwachen Sie, bis es sich von der Narkose erholt hat. Nachdem die Maus reagiert hat, setzen Sie das Tier in seinen Heimatkäfig.
6. Histologie
- Frühestens 21 Tage nach der Virusinjektion betäuben Sie Mäuse tief mit Isofluran, wie in Schritt 3 beschrieben.
- Machen Sie mit einer schmalen Schere einen Schnitt (10 -15 mm) in der Mitte des Brustbereichs und legen Sie die Brusthöhle frei. Trennen Sie vorsichtig das Zwerchfell und öffnen Sie die Brust mit einer Schere.
- Führen Sie eine 22G 1 1/2 Nadel in die linke Herzkammer ein und machen Sie mit einer Schere einen Schnitt in den rechten Vorhof. Perfundierte mit 50 mL vorgekühlter 100 mM phosphatgepufferter Kochsalzlösung (PBS), gefolgt von 100 mL vorgekühltem 10 % gepuffertem Formalin.
- Entnehmen Sie vorsichtig das gesamte Gehirn der Maus. Machen Sie dazu mit einer Schere einen sagittalen Schnitt entlang der Mitte der Kopfhaut. Entfernen Sie anschließend den Schädelknochen Stück für Stück mit einer Knochenzange mit flachen Spitzen, beginnend am Schnittpunkt der sagittalen und lambdoiden Naht und nach vorne zum Nasenbein. Wenn das Gehirn freigelegt ist, schneiden Sie durch die Riechkolben, lockern Sie das Gehirn mit einem gebogenen Spatel heraus und geben Sie es in ein 50-ml-Röhrchen mit 10 % gepuffertem Formalin.
- Repariere das Gehirn über Nacht. Befestigen Sie das Hirngewebe mit Gewebekleber auf einer Metallplattform eines Vibratoms. Schneiden Sie Stirnabschnitte mit einer Dicke von 50 μm mit Klingen aus Kohlenstoffstahl.
7. Immunfärbung
- Tag 1
- Waschen Sie die Gehirnscheiben 3x für je 5 min mit 1x PBS mit 0,3% Triton X-100 (PBS-T). Inkubieren Sie die Schnitte in PBS-T für 20 Minuten bei Raumtemperatur (RT).
- Blockieren Sie die unspezifische Bindung für 1 h bei RT mit einem Blockierungspuffer, der aus 5 % normalem Ziegenserum (NGS) und 0,3 % Triton X-100 in 1x PBS besteht.
- Die Schnitte werden über Nacht bei 4 °C mit Primärantikörpern gegen Parvalbumin oder Calbindin inkubiert, die 1:500 im Blockierungspuffer verdünnt sind (5 % NGS und 0,3 % Triton X-100 in 1x PBS).
- Tag 2
- Waschen Sie die Partien 3x für 10 min in PBS-T. Inkubieren Sie im Dunkeln für 2 h bei RT mit Sekundärantikörpern (Ziege anti-Kaninchen IgG (H+L) kreuzadsorbierter Sekundärantikörper, Alexa Fluor 546), verdünnt 1:500 im Blockierungspuffer (5% NGS und 0,3% Triton X-100 in 1x PBS).
- Die Abschnitte 3x für je 5 min in 1x PBS waschen. Übertragen Sie Gehirnschnitten mit einer weichen Bürste auf Objektträger.
- Geben Sie sofort 0,1 ml Antifading-Eindeckmedium in jeden Abschnitt. Decken Sie die Scheiben mit einem Deckglas von 22 mm x 50 mm ab.
- Konfigurieren Sie das konfokale Mikroskop auf eine 20-fache oder 60-fache Vergrößerung (A/1,4, Öl). Verwenden Sie Laser mit einer Wellenlänge von 488 nm und 594 nm, um Mehrkanalbilder der interessierenden Gehirnregionen aufzunehmen.
Ergebnisse
In einer Pilotreihe von Experimenten verwendeten wir die traditionelle intrakortikale Injektionsmethode, um Pyramidenneuronen der fünften Schicht im Neokortex der Maus durch AAV2 zu transduzieren, das das schnelle Channelrhodopsin (oChIEF)- Gen trug, das mit dem fluoreszierenden EGFP-Protein unter dem CaMKII-Promotor fusioniert war. In Übereinstimmung mit dem charakteristischen Merkmal von AAV212 erhielten wir eine relativ kleine Infektionsfläche von nicht mehr als 1 mm Breite (Abbildung 1A). In einigen Experimenten beobachteten wir jedoch eine ungewöhnlich große Ausbreitung von AAV2, die in einigen Fällen den Neokortex von mehr als der Hälfte der Gehirnhälfte bedeckte (Abbildung 1B). Wir stellten die Hypothese auf, dass eine solche weit verbreitete Virusverteilung auftreten kann, wenn das Virus in den Subarachnoidalraum eindringt und der Liquorstrom (CSF) den viralen Vektor über die Gehirnoberfläche verteilt. Wir haben festgestellt, dass dies geschieht, wenn die Einführtiefe der Injektionsnadel klein ist (<200 μm) und die Größe des Lochs in der Dura mater genau dem Durchmesser der Nadel entspricht, wodurch die Suspension von Viruspartikeln vor dem Rückfluss verhindert wird. Um diesen Prozess sichtbar zu machen, fügten wir der injizierten Suspension von Viruspartikeln (n = 3 Mäuse) rot fluoreszierende Nanopartikel hinzu. 3 Wochen nach der Injektion wurden die Mäuse transkardial mit 10% gepuffertem Formalin perfundiert, und die Gehirne wurden vorsichtig aus dem Schädel entfernt, ohne die Dura mater zu beschädigen. Die Untersuchung ganzer Gehirne unter einem binokularen Epifluoreszenzmikroskop zeigte die weit verbreitete Verteilung von rot fluoreszierenden Partikeln, die den im grünen Fluoreszenzkanal sichtbaren Bereich der neuronalen Infektion leicht überschritten (Abbildung 2). Die Analyse von sagittalen Schnitten aus dem Gehirn dieser Mäuse zeigte, dass sich fluoreszierende Partikel in einer dünnen Schicht entlang der Pia mater befanden, ohne tief in das Hirnparenchym einzudringen, während Venus-exprimierende Neuronen wie in früheren Experimenten in großer Zahl in den Schichten 2/3 und 5 gefunden wurden.
Neben dem AAV2_CaMKII_oChIEF EGFP-Virus (verwendet in einer Konzentration von 1,49 x 1012 vg/ml) führten wir auch eine Subarachnoidalverabreichung der Viren AAV2_CaMKII_Venus (7,31 x 1012 vg/ml) und AAV2_CAG_GCamp6s (7,3 x 1013 vg/ml) durch und erzielten ähnliche Ergebnisse. Dies ist wichtig, da, wie gezeigt wurde, Viren desselben Serotyps je nach verwendetem Promotor und Zielgen unterschiedlich große Transduktionsflächen bereitstellen können12.
Um Transduktionsbereiche nach traditioneller und subarachnoidaler Verabreichung von Viren systematisch vergleichen zu können, berechneten wir die Größe des Infektionsbereichs in mediolateraler und rostrocaudaler Richtung in seriellen 50 μm dicken Schnitten von Gehirnen. Es zeigte sich, dass die Subarachnoidal-Verabreichung des Virus zu einer fast vierfachen Vergrößerung des Infektionsgebietes führte, verglichen mit intraparenchymaler Verabreichung (1,7 ± 0,52 mm (n = 15 Mäuse) versus 0,46 ± 0,22 mm (n = 6 Mäuse), p < 0,00001, t-Test in mediolateraler Richtung und 2,35 ± 0,8 mm (n=14 Mäuse) versus 0,84 ± 0,29 mm (n = 6 Mäuse) p < 0,0003, t-Test in rostrocaudaler Richtung; Abbildung 3A).
Die mikroskopische Betrachtung von Hirnschnitten von Mäusen, die durch Subarachnoidalvirus-Injektion transduziert wurden, ergab eine sehr weit verbreitete Transduktion in den Schichten 2/3 und 5, während es in den Schichten 4 und 6 praktisch keine transduzierten Zellen gab (Abbildung 3B). In Schicht 4 waren nur fluoreszierende Dendriten der Pyramiden der Schicht 5 deutlich sichtbar (Abbildung 3B). Fluoreszierende Axone wurden in Schicht 6 und weißer Substanz verfolgt (Abbildung 3C). Ein solches Transduktionsmuster nach Subarachnoidal-Injektion könnte auf eine Virusdiffusion aus dem Subarachnoidalraum in Schicht 1 des Kortex (möglicherweise tiefer) zurückzuführen sein, wo es von neuronalen Dendriten eingefangen wird. So werden nur Neuronen infiziert, die in den oberen Schichten kräftige Verzweigungen aufweisen. Es ist bekannt, dass sich GABAerge Interneurone überwiegend lokal verzweigen. Wenn unsere Hypothese richtig ist, dann sollte die subarachnoidale Verabreichung des Virus zur Transduktion von Interneuronen in den supragranularen Schichten führen, nicht aber in den subgranularen Schichten. Um die Hypothese zu testen, führten wir eine immunchemische Färbung von Hirnschnitten von Mäusen nach Subarachnoidal-Injektion des AAV2_CaMKII_Venus-Virus mit Antikörpern gegen Marker von zwei verschiedenen Funktionsklassen von GABAergen Interneuronen durch: Parvalbumin und Calbindin.
Um die Anzahl der Interneurone zu bestimmen, die durch Subarachnoidal-Injektion des Virus transduziert wurden, führten wir eine morphometrische Analyse durch, bei der die Gesamtzahl der transduzierten Zellen (grüne Färbung), die Anzahl der immunpositiven Neuronen (rote Färbung) und die Anzahl der doppelt markierten Zellen auf einem 750 x 750 μm großen Schnitt (50 μm Schnittdicke) gezählt wurden.
Auf Hirnschnitten, die mit Antikörpern gegen Parvalbumin gefärbt waren, betrug die Anzahl der Neuronen mit grüner Markierung in den supragranularen Schichten durchschnittlich 57,4 ± 9,8, Parvalbumin-positive Interneurone mit roter Markierung 9,6 ± 3,8, von denen 4,1 ± 2,4 (42,7%) doppelt markiert waren (n = 10 Präparate). Im Gegensatz dazu zählten wir 14 ± 4,8 virustransduzierte Neuronen und 19,1 ± 4,5 Parvalbumin-positive Neuronen in Schicht 5 des Neokortex und konnten keine doppelt markierten Zellen nachweisen (n = 10 Präparate).
Bei der Untersuchung von Abschnitten, die immunchemisch auf Calbindinin gefärbt waren, stellten wir fest, dass es in den supragranularen Schichten durchschnittlich 21,1 ± 4,5 viral transduzierte Neuronen und 6,1 ± 2,6 Calbindin-positive Zellen gab, von denen 4,2 ± 1,9 Zellen beide Markierungen trugen (69,1%; n = 10 Präparate). In Schicht 5 zählten wir 19 ± 2,1 transduzierte Neuronen, 15,9 ± 5,7 Calbindin-Interneuronen, von denen 1,1 ± 1,5 (6,9%) eine Doppelfärbung aufwiesen. Es sollte jedoch beachtet werden, dass 100% der doppelt markierten Neuronen in Schicht 5 eine deutlich sichtbare Pyramidenform aufwiesen, was auf das Vorhandensein von Calbindin-positiven pyramidalen Neuronen oder eine gewisse Unspezifität der Antikörper hinweisen könnte. Somit wurden in Schicht 5 keine echten Calbindin-Interneurone beobachtet, die durch Subarachnoidal-Injektion des Virus transduziert wurden.
Während Parvalbumin- und Calbindin-positive Zellen tatsächlich unter den transduzierten Neuronen in Schicht 2/3 vorhanden waren (Abbildung 4A,C), wurden in Schicht 5 keine transduzierten Interneurone nachgewiesen, und alle EGFP-exprimierenden Zellen wurden visuell als pyramidale Neuronen identifiziert (Abbildung 4B,D).

Abbildung 1: Vergleich des AAV2-Transduktionsbereichs nach konventionellen intrakortikalen und subarachnoidalen Virusinjektionen. (A) Die Ausbreitung von CaMKII_oChieff_EGFP Konstrukten 21 Tage nach der Injektion in das Hirnparenchym bis zu einer Tiefe von 500 - 600 μm. (B) Die Ausbreitung von CaMKII_oChieff_EGFP in der anderen Hemisphäre desselben Tieres nach Subarachnoidalverabreichung. Dargestellt sind frontale Schnitte in einem Abstand von 200-300 μm in rostrocaudaler Richtung von der Injektionsstelle. Maßstabsleiste - 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Foto eines ganzen Gehirns mit intakter Dura-Materie, das die Ausbreitung von AAV2_CaMKII_Venus Viren und roten FluoSpheres zeigt, die subarachnoidal injiziert werden. (A) Fluoreszenz von roten Nanopartikeln, die der injizierten Virussuspension zugesetzt wurden, was die physikalische Ausbreitung des injizierten Volumens im Subarachnoidalraum zeigt. (B) Die gleiche Gehirnhälfte im grünen Fluoreszenzkanal zeigt den Venus-Expressionsbereich. Die Injektionsstelle ist durch Pfeile gekennzeichnet. Zusätzlich wird die Position des Lambdas markiert. Maßstabsleiste - 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Die Subarachnoidal-Injektion des Virus führt zu einer großflächigen Infektion von Neuronen der Schichten 2/3 und 5 des Neokortex. (A) Vergleich der Transduktionsbereiche (in mediolateraler (m/l) und rostrocaudaler (r/c) Richtung) nach intrakortikaler (i) und Subarachnoidal(s) Virusinjektion. Die Balken stellen den Mittelwert dar; Die Whisker bezeichnen die Standardabweichung (**** - p < 0,0001; *** - p < 0,001; t-Test). (B) Konfokale Mikroskopische Aufnahme, die die Venusexpression im Neokortex der Maus nach Subarachnoidal-Injektion von AAV2_CaMKII_Venus Viren zeigt. Layergrenzen werden schematisch dargestellt (L1 - L6). (C) Ein Fragment des Bildes (B), das mit unterschiedlichen Helligkeits- und Kontrasteinstellungen gezeigt wird, um zu demonstrieren, wie sich fluoreszierende Axone durch Schicht 6 und die weiße Substanz (WM) bewegen. Der Maßstabsbalken beträgt 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
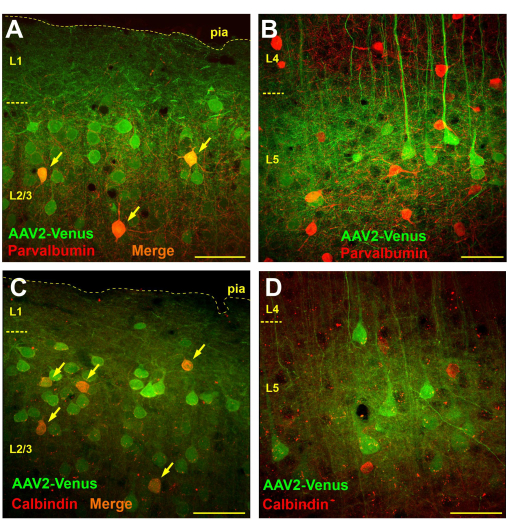
Abbildung 4: Die Injektion des Subarachnoidalvirus führt zur Transduktion von Interneuronen in supra- aber nicht in subgranularen Schichten des Neokortex. (A, B) Immunchemische Färbung von Hirnschnitten einer Maus, transduziert durch Subarachnoidal-Injektion des AAV2_CaMKII_Venus-Virus mit Antikörpern gegen Parvalbumin (Alexa594-konjugierte Sekundärantikörper). Neuronen, die sowohl grüne als auch rote Markierungen tragen, erscheinen orange (gekennzeichnet durch Pfeile). (C, D) Mikroskopische Aufnahmen eines Hirnschnitts einer Maus nach Subarachnoidal-Injektion von AAV2_CaMKII_Venus, die mit Antikörpern gegen Calbindin gefärbt waren. Beachten Sie das Fehlen von doppelt markierten Neuronen in L5. Der Maßstabsbalken beträgt 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir haben eine neue Methode zur Transduzierung neokortikaler Neuronen der Maus entwickelt, indem wir eine Suspension von AAV2-Viruspartikeln in den Subarachnoidalraum des Gehirns injizieren. Dies sorgt für eine weit verbreitete Virusverteilung, die fast viermal größer ist als das infizierte Gewebevolumen, wenn die gleiche Virusmenge direkt in das Hirnparenchym injiziert wird.
Die Injektion von Virusvektoren direkt in die Zerebrospinalflüssigkeit (CSF) über verschiedene Wege (z. B. intrazerebroventrikulär, intrathekal oder intrazisternal) ist eine beliebte Strategie für eine weit verbreitete Genverabreichung im gesamten ZNS 33,34,35. Die intrazerebroventrikuläre oder intrathekale Verabreichung von AAV2-Vektoren im erwachsenen Gehirn führt jedoch aufgrund ihrer hohen Affinität zu den Ependymzellen zu einer eingeschränkten Hirntransduktion 28,33,36,37. Ependymzellen befinden sich als Monoschicht, die den dritten und vierten Ventrikel sowie den zentralen Kanal des Rückenmarks auskleidet38. Das Vorhandensein von Tight Junctions zwischen ependymalen Zellen im Ventrikel ist eine signifikante Barriere für einige AAV-Serotypen, die diese Zellen aus dem Ventrikel passieren müssen, um eine intraparenchymale Ausbreitung zu erzielen39.
In unserer Arbeit führte die Injektion des AAV2-Virusvektors in den Subarachnoidalraum durch die Gehirnoberfläche zu einer weit verbreiteten Transduktion neokortikaler Neuronen bei erwachsenen Mäusen. Es gibt Hinweise darauf, dass die Pia-Materie in verschiedenen Bereichen des ZNS unterschiedlich strukturiert ist. Die Membran in der spinalen Pia mater (die das Rückenmark umgibt) ist aufgrund der zweischichtigen Natur der Piamembranviel dicker als die kraniale Pia mater (die das Gehirn umgibt). Es wurde auch gezeigt, dass ventrikulärer Liquor nur minimal in das Hirnparenchym eindringt, während der subarachnoidale Liquor schnell entlang der paravaskulären Räume in das Hirnparenchym eindringt41. Es ist daher wahrscheinlich, dass unterschiedliche Wege der Abgabe des viralen Vektors in den Liquor zu unterschiedlichen Ergebnissen führen können.
Es ist zu beachten, dass Intra-Liquor-Injektionen einiger AAV-Varianten mit bestimmten Nebenwirkungen verbunden sind. Es wurde gezeigt, dass die intrathekale oder intrazerebroventrikuläre Verabreichung von AAV9 nicht nur im ZNS, sondern auch in peripheren Organen zu einer Genexpression führt42,43. Für eine effizientere Transduktion von Neuronen durch das Gehirn sind hohe Vektordosen erforderlich. Zum Beispiel erhielten erwachsene Sprague-Dawley-Ratten eine einseitige Injektion von AAV9 in den lateralen Ventrikel in drei Dosen: 3,1 μl, 15,5 μl und 77,5 μl42. Mäuse erhielten AAV9 in einem Gesamtvolumen von 10 μl in der Cisterna magna43. Der Vorteil unserer Methode der Virusinjektion besteht darin, dass wir ein geringeres Vektorvolumen (1 μl) verwendet haben als bei der intrathekalen oder intrazerebroventrikulären Verabreichung von AAV. Ein geringeres Volumen des Virus verringert das Risiko einer Virusexpression außerhalb des Gehirns und auch die Toxizität erheblich.
Obwohl wir die virale Expression außerhalb des Gehirns nicht untersucht haben, ist es sehr wahrscheinlich, dass die Subarachnoidal-Verabreichung von AAV2 über die Gehirnoberfläche zu einer viralen Expression ausschließlich im Gehirn (insbesondere im Neokortex) führte. Unsere Annahme beruht auf den folgenden Gründen. AAV9 ist ein rekombinantes Adeno-assoziiertes Virus, das die Blut-Hirn-Schranke (BHS) überwinden kann und häufig für die globale ZNS-Transduktion verwendet wird37,44. Die BHS-Penetration und die Transduktion von Hirngewebe sind bei AAV2 jedoch begrenzt45. Darüber hinaus zeigte die Analyse von Schnitten aus dem Gehirn von Mäusen nach Subarachnoidal-Injektion des Virus, dass sich die transduzierten Zellen ausschließlich im Neokortex der ipsilateralen (injizierten) Hemisphäre befanden. Es wurden keine transduzierten Zellen im kontralateralen Neokortex oder anderen Gehirnstrukturen gefunden, was darauf hindeutet, dass eine Transduktion peripherer Organe durch diese Injektionsmethode sehr unwahrscheinlich ist.
Neben einem großen Infektionsbereich ermöglicht die Methode der Subarachnoidalvirus-Injektion die selektive Transduktion von Pyramidenneuronen der fünften Schicht, auch unter Verwendung von starken nicht-selektiven Promotoren wie CAG. Es ist allgemein bekannt, dass es recht schwierig ist, eine selektive Expression auch mit spezifischen Promotoren zu gewährleisten 1,26. Zum Beispiel sollte der von uns verwendete CaMKII-Promotor theoretisch bevorzugt glutamaterge Neuronen infizieren. Wie jedoch in den Ergebnissen hier und anderen Studien gezeigt wird, kommt es bei der Anwendung auch zu einer Transduktion anderer Zelltypen, insbesondere von GABAergen Interneuronen46. Da bei Subarachnoidal-Injektionen die Zelltransduktion in erheblichem Abstand zur Injektionsstelle stattfindet, hilft diese Methode, das Hirngewebe für spätere optische oder elektrophysiologische Aufzeichnungen der neuronalen Aktivität zu erhalten. Wir haben Subarachnoidalvirus-Injektionen erfolgreich in Experimenten mit optogenetischer Stimulation und extrazellulärer Aufzeichnung der Aktivität von L5-Pyramidenneuronen des visuellen Kortex der Maus in vivo eingesetzt 32.
Diese Arbeit ist ein Spin-off unserer groß angelegten Studie über die Mechanismen der Plastizität im visuellen Kortex, in der wir AAV2 verwendet haben, um Kanalrhodopsin in den pyramidalen Neuronen des visuellen Kortex der Maus zu exprimieren32. Mit diesem Serotyp haben wir viele Statistiken gewonnen und tatsächlich die Methode der Subarachnoidal-Injektion entwickelt. In Pilotversuchen versuchten wir auch eine Subarachnoidal-Injektion des Virus mit Serotyp 2/9 und erhielten ähnliche Ergebnisse, obwohl wir in diesem Fall keine detaillierte morphometrische Analyse durchführten. Leider ist es unmöglich vorherzusagen, wie sich andere Serotypen nach der Subarachnoidalverabreichung verhalten und welcher Virus-Serotyp den größten Transduktionsbereich bietet; Dies kann nur empirisch festgestellt werden, was einen erheblichen Arbeitsaufwand erfordert. In dieser Arbeit haben wir überzeugend gezeigt, dass AAV2 in den Subarachnoidalraum des adulten Mausgehirns injiziert werden kann, was zu einer weit verbreiteten Transduktion mit selektiver Expression des Zielgens in pyramidalen Neuronen der fünften Schicht des Neokortex und einer nicht-selektiven Expression in supragranularen Schichten führt.
Der wichtigste Schritt bei der Anwendung dieser Methode der Subarachnoidalvirus-Injektion besteht darin, die optimale Größe des Lochs in der Duramasse sicherzustellen, die genau dem Durchmesser der Injektionsnadel entsprechen muss. Die Dura sollte die Nadel fest umschließen und somit den Rückfluss des Virus während der Injektion verhindern. Wir haben diese Methode die Subarachnoidal-Injektion genannt, aber es ist nicht klar, ob das Virus neben dem Subarachnoidalraum auch in den Subduralraum (den Raum zwischen der Arachnoidea und der Dura mater) eindringt und sich dort ausbreitet. Es ist auch nicht klar, ob diese Methode bei anderen Tieren, insbesondere bei Ratten, oder bei anderen AAV-Serotypen funktionieren würde.
Zuvor hatten Xinjian Li und Kollegen eine neuronale Transduktionsmethode beschrieben, die auf einer viralen Infusion an der kortikalen Oberfläche basiert. Sie verwendeten eine Glaspipette mit großem Durchmesser an der kortikalen Oberfläche, um den viralen Kalziumreporter AAV-GCaMP6 in den Kortex zu infundieren. Bei dieser Methode gelangen Viruspartikel, vermutlich ähnlich wie in diesem Fall, in die oberen Schichten des Neokortex, wo sie von Neuronen eingefangen werden. Die Autoren fanden heraus, dass die Infusion von kortikalen Oberflächenviren Neuronen in den oberflächlichen Schichten effizient markierte, während Neuronen in der tiefen Schicht vermiedenwurden 47. Es ist nicht ganz klar, warum die zitierte Arbeit die Transduktion von Pyramidenneuronen der fünften Schicht nicht zeigte, ähnlich wie wir es in unserer Studie beobachtet haben.
Unsere Hypothese, dass das Virus nach der Subarachnoidalverabreichung von den Dendriten der Neuronen eingefangen wird, die sich in den supragranularen Schichten verzweigen, hat eine bemerkenswerte Schwäche. Zusätzlich zu den großen Pyramiden der fünften Schicht weisen die pyramidalen Neuronen der vierten Schicht48 und die Claustrum-projizierenden L6-Pyramidenzellen49 im visuellen Kortex der Maus Dendriten auf, die bis zur ersten Schicht reichen. Daher ist nicht klar, warum diese Zellen nicht mit einer Subarachnoidalvirus-Injektion transduziert werden. Eine mögliche Erklärung ist, dass nur diejenigen Zellen infiziert sind, deren Dendriten dick genug sind, um das Viruspartikel in den Zellkörper zu transportieren – also L5-Pyramiden. Es wurde gezeigt, dass im visuellen Kortex von Mäusen die pyramidalen Neuronen der vierten Schicht nur einen dünnen Dendriten an die erste Schicht des Neokortex senden48. Es sind jedoch weitere Studien erforderlich, um die Ursache des beobachteten Infektionsmusters nach Subarachnoidalvirus-Injektion zu bestimmen.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Die Arbeit wurde mit finanzieller Unterstützung der Russischen Wissenschaftsstiftung, Zuschuss 20-15-00398P, durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
Referenzen
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten