Method Article
AAV2のくも膜下注射によるマウス新皮質ニューロンの広範な形質導入
要約
くも膜下ウイルスの注入を使用するアデノ随伴ウイルスの広範な送達のための新しい技術が記載されています。この方法は、マウス新皮質ニューロンの表層への広範な形質導入を保証するだけでなく、非選択的プロモーターを使用した場合でも、第5層錐体ニューロンにおける導入遺伝子の選択的発現をもたらします。
要約
組換えアデノ随伴ウイルスは、実験生物学の多くの分野、特に神経科学において、関心のあるさまざまな遺伝子の送達と発現のための柔軟で強力なツールです。特定の脳領域で目的の導入遺伝子の発現を促進する最も一般的な方法は、AAVベクターを脳実質に直接注入することです。しかし、この方法では、一部の in vivo 実験に必要な広範なニューロン形質導入は可能ではありません。この記事では、脳のくも膜下腔へのウイルス注入に基づいて、マウス新皮質で広範囲に遺伝子発現を行う新しい技術を紹介します。このニューロン標識法は、成体マウス表在性新皮質層におけるニューロンの広範な形質導入を保証するだけでなく、CAGのような強力な非選択的プロモーターを使用する場合でも、高い特異性を持つ第5層錐体ニューロンの大規模な集団における導入遺伝子の発現をもたらします。さらに、細胞形質導入は注射部位からかなり離れた場所で行われるため、この方法は、その後のニューロン活動の光学的または電気生理学的記録のために脳組織を保存するのに役立ちます。
概要
哺乳類の脳は、数兆のシナプス1によって回路に相互接続された多くの抑制性、興奮性、および調節性の細胞で構成されています1。神経科学の中心的な課題の1つは、脳の回路と行動の組織と機能における異なる細胞タイプの役割を解読することです。脳内の遺伝的に定義された細胞を操作するには、導入遺伝子を導入して発現させる方法が必要です。ウイルスベースの遺伝子導入システムは、中枢神経系への遺伝子導入のための最も効果的で簡単な方法です2。ウイルス送達システムは、遺伝情報を宿主細胞に送達する能力を持つ複製ウイルス(アデノウイルス、アデノ随伴ウイルス(AAV)、レンチウイルス、レトロウイルス)に基づいています2,3。
AAVベースのベクターは、現在、基礎神経科学研究と神経疾患の遺伝子治療開発の両方を目的として、脳内の細胞に目的の導入遺伝子を送達するための最も広く使用されているツールの1つになっています。他のウイルスと比較すると、複製欠損AAVは、これらの目的に理想的なベクターとなる多くの特徴を備えています。最も注目すべきは、AAVベクターがニューロンやグリア細胞などの非分裂性(末端分化型)細胞を効率的に形質導入し、in vivo2で高レベルの導入遺伝子発現をもたらすことです。ベクターは、in vivoでの使用に適した高機能力価で容易に作製できます3,4,5。重要なことに、in vivoでのアデノ随伴ウイルス媒介遺伝子導入は、病理組織学的変化やベクター関連毒性を引き起こさない6。アデノウイルスベクターとは異なり、動物モデルにAAVベクターをin vivoで投与しても、通常、形質導入細胞に対する宿主免疫応答は引き起こされず、脳実質内で長期間にわたって安定した導入遺伝子発現が可能になります2,7,8。
AAVベクターが人気のもう一つの理由は、独自の組織および細胞型指向性9,10,11,12,13,14を有する広範なAAV血清型である。異なるAAV血清型によって発現される異なるカプシドタンパク質は、細胞侵入のための異なる細胞表面受容体の使用をもたらし、したがって、特異的な指向性10,14をもたらす。
AAVの親和性は、カプシドタンパク質だけでなく、他の多くの因子によっても決定される14。AAV血清型1、2、6、7、8、および9は、初代培養15,16でニューロンとアストロサイトの両方を形質導入したが、実質内脳注射17,18後には強いニューロン親和性を示したことが示されている。AAVベクターの調製に使用される方法は、同じ血清型であっても、神経細胞の親和性にも影響を与える可能性があります。例えば、CsCl精製されたAAV8は、実質内脳注射後に強い天球膠学的親和性を有していたが、同じ条件下で注射されたイオジキサノール精製AAV8は、ニューロンのみを形質導入した19。AAV向性は、注射された用量とボリューム14によっても影響を受ける可能性があります。.例えば、高力価のrAAV2/1は、皮質興奮性ニューロンと抑制性ニューロンの両方を効率的に形質導入したが、低力価の使用は、皮質抑制性ニューロンの形質導入に対する強い選好性を明らかにした20。
したがって、カプシド血清型のみに基づいて堅牢な細胞型特異性を達成することはできません。細胞型特異的プロモーターは、AAVキャプシドの広範な自然親和性を克服するために使用できます。例えば、ヒトシナプシンIはニューロンを標的とするために使用され21、CaMKIIプロモーターはグルタミン酸作動性興奮性ニューロンにおける導入遺伝子発現を高い特異性で駆動することができ20、ppHcrtプロモーターは視床下部外側のヒポクレチン(HCRT)発現ニューロンを標的とし22、PRSx8プロモーターはドーパミンβ-ヒドロキシラーゼを発現するノルアドレナリン作動性およびアドレナリン作動性ニューロンを標的とし23、GFAPプロモーターはアストロサイト特異的発現を駆動することができる24。しかし、一部の細胞特異的プロモーターは転写活性が弱く、十分なレベルの導入遺伝子発現を駆動することができません25。さらに、AAVウイルスベクターに適合する短いプロモーターは、多くの場合、細胞タイプの特異性を保持しません1,26。例えば、CaMKIIコンストラクトは、抑制性ニューロン12も形質導入することが示されている。
細胞型の特異性(親和性)に加えて、AAVのもう一つの重要な特徴は形質導入効率です。さまざまなAAV血清型は、異なる拡散特性を持っています。AAV2および4つのウイルスベクターは、脳実質を通じて拡散しにくく、したがって、より小さな領域17,27で形質導入を媒介する。最も広範なニューロン伝達は、AAV血清型1、9、およびrh.10 11,17,18,19,28で観察されます。
特定の脳領域における所望の導入遺伝子の発現を促進する最も一般的な方法は、AAVベクターを関心のある脳領域(実質)に直接注入することです3。実質内注射後、脳を通じてより効果的な拡散を有するAAV血清型でさえも、典型的には注射部位の周囲の局所領域のみを形質導入する12。さらに、実質内注射は侵襲的な手順であり、関心領域に隣接する組織損傷を引き起こします。したがって、このウイルス注入方法は、一部の実験タスクには適していません。例えば、細胞の広範な標識は、1光子顕微鏡または2光子顕微鏡29,30,31,32の使用を含む、自由に動く動物の皮質ニューロン機能を研究することを目的とした実験において非常に望ましい。
ここでは、くも膜下ウイルス注入を使用して成体マウスの新皮質ニューロンの広範な形質導入を提供し、その後のニューロン活動の光学的または電気生理学的記録のために脳組織を保存する新しいアデノ随伴ウイルス注入技術について説明します。この方法は、表在性新皮質層におけるニューロンの広範な形質導入を確保しただけでなく、CAGのような強力な非選択的プロモーターを使用した場合でも、高い特異性を持つ第5層錐体ニューロンの大規模な集団における導入遺伝子の発現をもたらした。
プロトコル
実験は、雌雄ともに生後2〜4ヶ月の成体C57Black/6マウス(Pushchino Breeding Center, Branch of the Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry of RAS)で行いました。マウスは、温度制御されたビバリウム(22°C±2°C、12時間の明暗サイクル、08.00時間に点灯)に収容され、餌と水が 自由自在に行われました。すべての実験手順は、動物実験に関するARRIVEガイドラインおよび指令2010/63/EUに従って実施されました。研究プロトコルは、IHNA RAS の倫理委員会によって承認されました (2022 年 2 月 1 日からのプロトコル N1)。動物の苦痛を最小限に抑え、結果の信頼性を確保するために、あらゆる努力が払われました。
1. 手術の準備
- 手術を開始する前に、すべての手術器具を滅菌してください。70%エタノールを使用して手術部位を清掃します。
- 麻酔システムのイソフルランレベルを確認し、必要に応じて満たします。誘導チャンバーの底に清潔なペーパータオルを置きます。
- 脳定位固定装置フレームに加熱パッドを置きます。パッドを清潔なペーパータオルで覆います。
- 2%漂白剤のボトルを準備して、ウイルスと接触するマイクロピペットの先端、チューブ、綿棒、その他のアイテムを収集します。
- -80°Cの冷凍庫からAAVのアリコートを取り出し、氷の上に置いて解凍します。
2. シリンジの準備
- 5 μL の Hamilton マイクロシリンジを 33G の鈍い RN 針で洗浄します。吸引してから、70%エタノールを分注します。新鮮なエタノールで3回繰り返します。シリンジを蒸留水ですすいで、余分なエタノールを取り除きます。3回繰り返します。
- プランジャーを取り出し、インスリン注射器を使用してフランジからバレルにワセリンオイルを充填します。マイクロシリンジに気泡がないことを確認してください。
注:閉じ込められた空気は圧縮性であり、シリンジの精度と精度に影響を与えます。 - プランジャーをマイクロシリンジに戻し、オイルを一滴分注します。シリンジを定位固定装置インジェクターに入れて、分注された溶液の量を監視するためのスケールが見えるようにします。
3.手術用マウスの準備
- マウスの重さを量ります。マウスをイソフルランに接続された麻酔導入チャンバーに入れます。5%に設定したイソフルラン気化器の電源を入れ、流量を250mL / minに調整します。適切な麻酔の深さは5〜7分以内に達成されます。
- 麻酔の外科的レベルを確認するには、後足の痛みを伴うつまみの間に泡立て器と離脱反射がないこと、および目がついたときにまばたきがないことを確認します。
- 気化器のアウトフローバルブを誘導室から定位固定マスクに切り替えます。イソフルランを1.8%〜2.0%に減らし、マウスの体重に応じて流量を設定します(体重が25〜35 gのマウスの場合は70〜90 mL / min)。
- マウスを誘導チャンバーから取り外し、加熱パッド(37°C)の上の定位装置に置き、外科的麻酔中の低体温を防ぎます。前歯を歯のバーに置き、アニマルマスクを取り付けます。
- 動物をイヤーバーに慎重に配置します。定位装置の正しい頭部位置は、頭部の垂直方向の動きを可能にしますが、横方向の動きは許可しません。動物のポジショニングが苦痛を引き起こさないようにしてください。手術中は、麻酔の深さ、動物の呼吸、体温を注意深く監視します。
- 目から耳の後ろまで頭を剃ります。70%エタノールで綿棒を拭き、続いてヨウ素の5%アルコール溶液で綿棒を拭いて、頭の剃った表面をきれいにします。
- 眼の乾燥を防ぐために眼科用ジェルを塗布します。4%リドカイン溶液を局所的に適用し、デキサメタゾン(4 mg / mLで0.02 mL)を皮下に適用して、手術関連の痛みを防ぎ、可能な炎症反応を減らします。.
- 滅菌メスの刃とハサミで、頭の正中線に沿って4〜5 mmの長さの切開を行い、頭皮を開きます。耳の間に小さな切開から始めて、頭蓋骨の損傷を避けるためにハサミを使ってそれを広げます。
- 頭蓋骨の表面を少量の3%過酸化水素で綿棒で拭き取り、定位固定のランドマークであるブレグマとラムダを視覚化します。0.9%NaCl生理食塩水で反応を直ちに停止します。骨スクレーパーで頭蓋骨の上のティッシュをこすり落とします。
- 事前に準備した電動インジェクターをハミルトンシリンジで定位固定アームに取り付けます。露出した頭蓋骨に手術用光源を向け、顕微鏡をブレグマに焦点を合わせます。
- 顕微鏡を覗いて、定位装置のアームを操作して、針の上部をブレグマの真上に中央に配置します。
- 針の先端を使用して、bregmaとlambdaを水平に合わせ、アームをbregmaに戻して座標を記録します。これらの bregma 座標と関心領域のアトラス座標を使用して、対象領域の相対座標を計算します。
- 針を目的の領域に移動します。新しい座標で針を下げ、この位置に印を付けます。ウイルスマイクロインジェクションの部位は、ウイルスの拡散を考慮しながら、対象地域に近接して選択してください。
注:これにより、対象領域の組織に損傷を与えるのを防ぐことができます。関心領域には AP-3.4、ML -2.0、ウイルスマイクロインジェクションには AP-2.0、ML -1.4 の座標を使用しました。上記の座標は、一次視覚野ニューロンが感染する場合に最適です。 - 可能であれば、血管の大きい領域は避けてください。手術用顕微鏡、明るい冷光照明、および0.9%のNaCl生理食塩水浸漬下では、頭蓋骨と脳表面の大きな血管が明らかになるはずです。
4. ウイルスインジェクション
- 滅菌済みの歯科用バー(直径0.5〜0.8mm)を取ります。手術用顕微鏡で頭蓋骨の表面を観察し、手動(手作業)またはマイクロドリルを使用して小さな開頭術をドリルで開けます。頭蓋骨に過度の圧力がかからないように注意してください。
- 開頭術(穴)の穴あけ中にマイクロシリンジ針が損傷するのを防ぐために、アームを邪魔にならないように動かします。0.9%のNaCl生理食塩水浸漬を適用し、骨の加熱や硬膜の損傷を避けるために断続的に一時停止します。加圧空気を使用して骨の粉塵を吹き飛ばします。
注:次のタイプの超硬デンタルバーが適しています:洋ナシ型(好ましくは)、丸みを帯びたシリンダー、および丸い。- バーで骨を薄くするときは、全周で薄くなるのが均一であることを確認してください。これにより、硬膜を傷つけずに骨を切除しやすくなります。これを行うには、最初に先端が丸いバーを使用し、次に先端が平らなバーを使用します。バーを骨に対して垂直に保ちます。そうしないと、一方の面がもう一方の面よりも薄くなります。
注:さらに、バーのサイズが小さく、開頭術が小さいほど、操作は複雑になります。動物をさらに in vivo 作業に使用する場合は、より小さな直径(0.5〜0.6 mm)の開頭術を実施することをお勧めします。動物の脳を 生体外 治療に使用することを計画している場合は、手順を簡素化するために開頭術の直径を大きくすることができます。
- バーで骨を薄くするときは、全周で薄くなるのが均一であることを確認してください。これにより、硬膜を傷つけずに骨を切除しやすくなります。これを行うには、最初に先端が丸いバーを使用し、次に先端が平らなバーを使用します。バーを骨に対して垂直に保ちます。そうしないと、一方の面がもう一方の面よりも薄くなります。
- 薄くなった骨が柔らかく透明になったら、穴あけを止めます。骨に十分に大きなくぼみが形成された場合は、頻繁に回転を停止し、骨の厚さを監視します。骨に亀裂が見られることは、薄くするのに十分であることを示しています。
- 滅菌生理食塩水で穴を浸し、綿棒で余分な生理食塩水を取り除きます。残りの骨の層は、フック状の先端が付いた27G針または先端の細いピンセットを使用して除去します。硬膜の損傷を避けてください。
- 生理食塩水で湿らせた滅菌済みのペーパータオルで頭蓋骨の表面を覆います。紙の上のマウスの頭蓋骨の表面に、清潔で透明なフィルムを置きます。
- 脳定位固定装置アームを後ろに動かし、マイクロシリンジの針をフィルムの真上に配置します。余分なオイルを2μLの容量に達するまで分注します。
注意: オイルの最終的な容量は、マイクロシリンジの容量によって異なる場合があります。5 μL 75-RN Hamilton マイクロシリンジを使用しました。 - 注入した容量+ 2μLに等しい量のウイルスを透明フィルムにピペットで移します。
- 手術用顕微鏡を覗いて、針の先端がウイルスの滴の中心に来るまで腕を下げます。電動インジェクターを使用してウイルスをマイクロシリンジにロードします。マイクロピペットの先端と透明フィルムを2%漂白剤でボトルに捨てます。
- 生理食塩水で湿らせた紙を頭蓋骨の表面から取り除き、綿棒で頭蓋骨を乾かします。脳定位固定装置アームを使用して、針を挿入部位の上に配置します。
- 針が詰まっていないことを確認するために、ウイルスを一滴分注します。先端がフック状になった30Gの針を使って硬膜に小さなスリットをあけます。
注:硬膜にできるだけ小さなスリットを入れ、ウイルスが漏れる可能性のある針と硬膜との間に隙間を残さずに針が入るようにすることが重要です。 - シリンジの針を硬膜まで下げ、深さを適切に計算します。針が最初に皮質の表面に触れた点に対する挿入の皮質の深さを推定します。
- 針先を皮質にゆっくりと300μmの深さまで挿入します。硬膜が針に付着するまで2〜3分待ってから、針をゆっくりと200μmの深さまで引っ込めます。脳組織が落ち着くまでさらに2〜3分待ちます。これにより、針が硬膜を引き上げ、ウイルスが拡散するための硬膜下腔を作り出します。
注意: 皮質の損傷を最小限に抑えるには、33Gの針を使用するか、Gの針を下回ってください。先端の内径が小さいほど、組織の逆流が詰まる可能性が高くなることに注意してください。鈍い針はより制御されたウイルス溶液の滴を排出するため、斜めではなく鈍い針を使用することが重要です。- 針を150〜200μmに下げたときに硬膜を通過せず、代わりに針を曲げた場合は、下げを停止します。針を持ち上げて硬膜を少し大きく切開してから、もう一度針を下げてみてください。
- 針を下げているときに切開部から脳脊髄液が活発に漏れ始めた場合は、漏れが止まるまで待ちます。そうしないと、硬膜を通過する針を制御するのが困難です。余分な脳脊髄液をティッシュチップで拭き取ります。液体の流れが止まったら、針を持ち上げて再試行してください。
- 分注量を監視しながら、0.06 μL/分の速度でウイルス懸濁液の注入を開始します。1μLのウイルスを注入します。針と皮質組織の間のシールを壊さないように、ウイルスを単一の深さで注入します。
- トラブルシューティング:注射の開始時に、脳表面へのウイルスの逆流が発生する可能性があります。注射を止め、2〜3分待ってから、ウイルス注射を続けます。ウイルスの逆流が止まるまで、これらのアクション(手順)を繰り返します。ウイルスや脳脊髄液が針に付着し、逆流を防ぎます。
- ウイルスの逆流を止める別の方法は、皮質の表面に少量のアガロースを置くことです。それは皮質の脈動を抑制し、また針を密封するのを助けます。ただし、ピペットがアガロースに詰まっていないことを確認してください。
- 針を下げたときに硬膜を完全に通過するのではなく、部分的にしか通過しない場合があるため、針の片側が硬膜にしっかりとフィットせず、ウイルスの逆流を引き起こす可能性があります。この場合、針をゆっくりと組織から引き抜き、再度下げてみてください。
- 注入が完了したら、針を目標位置にさらに10分間保持します。これにより、ウイルスは注射部位から分散します。ウイルスが針路から逆流するのを防ぐために、針をゆっくりと脳から引き抜きます。
- 針の抜去が完了したら、ウイルスを少量分注して目詰まりしていないか確認します。5-0の吸収性または非吸収性の縫合糸を使用して皮膚の切開を閉じます。
5. 術後のケア
- 切開部を閉じた後、抗菌軟膏を局所的に塗布します。生理食塩水(5 mL / kg)と5%グルコース(5 mL / kg)の混合物を皮下に注入して、脱水症を防ぎ、麻酔後の回復を促進します。.ケトプロフェンを筋肉内(2.5 mg / kg)に注射して痛みを軽減します。.
- 動物を加熱パッドの上の新しいケージに入れ、麻酔から回復するまで監視します。マウスが反応した後、動物を自宅のケージに入れます。
6.組織学
- ステップ3で説明したように、ウイルス注射後21日以内にマウスにイソフルランで深く麻酔をかけます。
- 狭いハサミを使用して胸部に沿って正中線切開(10〜15 mm)を行い、胸腔を露出させます。横隔膜を慎重に分離し、ハサミで胸を開きます。
- 22G 1 1/2針を左心室に挿入し、ハサミで右心房を切開します。50 mLの予冷済み100 mMリン酸緩衝生理食塩水(PBS)で灌流し、続いて予冷済み10%緩衝ホルマリン100 mLで灌流します。
- マウスの脳全体を慎重に抽出します。これを行うには、はさみを使用して頭皮の中心に沿って矢状切開を行います。次に、矢状縫合糸とラムドイド縫合糸の交点から鼻骨に向かって、先端が平らな骨ペンチを使用して頭蓋骨を一つずつ取り除きます。脳が露出したら、嗅球を切り取り、湾曲したヘラで脳を緩め、10%緩衝ホルマリンを含む50mLのチューブに落とします。
- 一晩で脳を固定します。組織接着剤を使用して、ビブラトームの金属プラットフォームに脳組織を取り付けます。炭素鋼の刃を使用して、前頭部を50μmの厚さで切断します。
7. 免疫染色
- 1日目
- 0.3% Triton X-100 (PBS-T) を含む 1x PBS で、脳スライスを 3 回、5 分間それぞれ洗浄します。PBS-Tで切片を室温(RT)で20分間インキュベートします。
- 1x PBS中の5%Normal Goat Serum(NGS)と0.3% Triton X-100からなるブロッキングバッファーを用いて、RTで1時間非特異的結合をブロックします。
- ブロッキングバッファー(1x PBS中の5% NGSおよび0.3% Triton X-100)で1:500に希釈したパルブアルブミンまたはカルビンジンに対する一次抗体を用いて、切片を4°Cで一晩インキュベートします。
- 2日目
- 切片をPBS-Tで10分間3回洗浄します。ブロッキングバッファー(5% NGSおよび0.3% Triton X-100 in 1x PBS)で1:500に希釈した二次抗体(Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 546)を用いて、室温で暗所で2時間インキュベートします。
- 切片を1x PBSでそれぞれ5分間3回洗浄します。柔らかいブラシを使用して、脳のスライスをスライドガラスに移します。
- 直ちに0.1 mLの退色防止用封入剤を各切片に加えます。スライスを22 mm x 50 mmのカバースリップで覆います。
- 共焦点顕微鏡を20倍または60倍(A / 1.4、オイル)の倍率に構成します。波長488nmおよび594nmのレーザーを使用して、関心のある脳領域のマルチチャンネル画像を取得します。
結果
パイロットシリーズの実験では、従来の皮質内注射法を使用して、CaMKIIプロモーターの下でEGFP蛍光タンパク質と融合した 高速チャネルロドプシン(oChIEF) 遺伝子を運ぶAAV2によって、マウス新皮質の5層目錐体ニューロンを形質導入しました。AAV212の特徴と一致して、幅が1mmを超えない比較的小さな感染領域が得られました(図1A)。しかし、いくつかの実験では、AAV2が異常に大きく広がり、場合によっては脳半球の半分以上の新皮質を覆っていることが観察されました(図1B)。私たちは、ウイルスがくも膜下腔に侵入し、脳脊髄液(CSF)の流れがウイルスベクターを脳表面全体に広げると、このような広範なウイルス分布が発生する可能性があるという仮説を立てました。これは、注射針の挿入深さが小さく(<200μm)、硬膜の穴のサイズが針の直径と正確に一致している場合に発生し、ウイルス粒子の懸濁液が逆流するのを防ぐことに注目しました。このプロセスを可視化するために、注入したウイルス粒子の懸濁液(n = 3マウス)に赤色蛍光ナノ粒子を添加しました。注射後3週間で、マウスに10%緩衝ホルマリンを経心的に灌流し、硬膜を傷つけることなく脳を頭蓋骨から慎重に除去しました。落射蛍光双眼顕微鏡で脳全体を検査したところ、赤色蛍光粒子が広範囲に分布しており、緑色蛍光チャネルで見えるニューロン感染領域をわずかに超えていることが明らかになりました(図2)。これらのマウスの脳からの矢状切片の解析により、蛍光粒子は脳実質の深部に浸透することなく、軟膜に沿った薄い層に位置していることが示されました。一方、金星を発現するニューロンは、これまでの実験と同様に、第2/3層と第5層に大量に発見されました。
AAV2_CaMKII_oChIEF EGFPウイルス(1.49 x 1012 vg/mLの濃度で使用)に加えて、AAV2_CaMKII_Venusウイルス(7.31 x 1012 vg/mL)およびAAV2_CAG_GCamp6s(7.3 x 1013 vg/mL)のくも膜下投与を行い、同様の結果を得ました。なぜなら、示されているように、同じ血清型のウイルスは、使用されるプロモーターおよび標的遺伝子によって異なるサイズの形質導入領域を提供できるからである12。
従来のくも膜下ウイルス投与後の形質導入領域を系統的に比較するために、脳の連続50μm厚切片における中外側および吻尾方向の感染領域の大きさを計算した。ウイルスのくも膜下投与は、実質内投与と比較して感染領域のほぼ4倍の増加につながることがわかりました(1.7 ± 0.52 mm(n = 15マウス)対0.46 ± 0.22 mm(n = 6マウス)、p < 0.00001、中外側方向のt検定、2.35 ± 0.8 mm(n = 14マウス)対0.84 ± 0.29 mm(n = 6マウス)p < 0.0003、 吻尾方向のt検定。 図3A)。
くも膜下ウイルス注射により形質導入したマウスの脳切片を顕微鏡で観察したところ、層2/3および5では非常に広範な形質導入が明らかになりましたが、層4および6では形質導入された細胞は事実上存在しませんでした(図3B)。レイヤー4では、レイヤー5ピラミッドの蛍光樹状突起のみがはっきりと見えました(図3B)。蛍光軸索は、第6層と白質で追跡されました(図3C)。くも膜下注射後のこのような形質導入パターンは、くも膜下腔から神経細胞の樹状突起がそれを捕捉する皮質の第1層(おそらくより深い)へのウイルス拡散によるものである可能性があります。したがって、上層で活発に分岐しているニューロンのみが感染します。GABA作動性介在ニューロンは主に局所的に分岐することが知られています。私たちの仮説が正しければ、ウイルスのくも膜下投与は、顆粒上層の介在ニューロンの形質導入につながるはずですが、顆粒下層では形質導入されないはずです。この仮説を検証するために、AAV2_CaMKII_Venusくも膜下ウイルスをくも膜下ウイルスに注射した後、GABA作動性介在ニューロンの2つの異なる機能クラスであるパルブアルブミンとカルビンジンのマーカーに対する抗体を用いて、マウスの脳切片を免疫化学的に染色しました。
ウイルスのくも膜下注射によって形質導入された介在ニューロンの数を決定するために、750 x 750 μmの切片(50 μmの切片の厚さ)で、形質導入された細胞の総数(緑色染色)、免疫陽性ニューロンの数(赤色染色)、および二重標識細胞の数をカウントする形態測定解析を行いました。
パルブアルブミンに対する抗体で染色した脳切片では、顆粒上層において、緑色で標識されたニューロンの数は平均57.4±9.8個、赤色で標識されたパルブアルブミン陽性の介在ニューロンの数は9.6個±3.8個で、そのうち4.1個±2.4個(42.7%)が二重標識された(n=10製剤)。対照的に、新皮質の第5層では、4.8個のウイルス形質導入ニューロン±14個、4.5個のパルブアルブミン陽性ニューロンを19.1個±4.5個数え、二重標識細胞は検出されませんでした(n = 10調製物)。
カルビンジンについて免疫化学的に染色された切片を調べたところ、顆粒上層には、平均21.1個±4.5個のウイルス形質導入ニューロンと6.1個±2.6個のカルビンジン陽性細胞があり、そのうち4.2±1.9個の細胞が両方の標識を持っていたことがわかりました(69.1%、n = 10製剤)。第5層では、形質導入されたニューロン±19個、2.1個の形質導入ニューロン、15.9個±5.7個のカルビンジン介在ニューロンをカウントし、そのうち1.1個±1.5個(6.9%)が二重染色を示しました。しかし、第5層の二重標識ニューロンの100%がはっきりと見えるピラミッド型の形状をしており、これはカルビンジン陽性のピラミッド型ニューロンの存在または抗体の何らかの非特異性を示している可能性があることに注意してください。したがって、ウイルスのくも膜下注射によって形質導入された真のカルビンジン介在ニューロンは、第5層では観察されませんでした。
したがって、パルブアルブミンおよびカルビンジン陽性細胞は、第2層/第3層の形質導入ニューロンに実際に存在していたが(図4A、C)、第5層では形質導入された介在ニューロンは検出されず、すべてのEGFP発現細胞は錐体ニューロンとして視覚的に同定された(図4B、D)。

図1:従来の皮質内ウイルス注射後およびくも膜下ウイルス注射後のAAV2形質導入領域の比較 (A)脳実質への注射後21日後のCaMKII_oChieff_EGFP構築物の広がりは500〜600μmの深さまで (B)くも膜下投与後の同じ動物の他の半球でのCaMKII_oChieff_EGFPの広がり。注射部位から吻尾方向に200〜300μmの距離にある前頭部が示されています。スケールバー - 1 mm. この図の拡大版を表示するには、ここをクリックしてください。

図2:硬膜物質が無傷で、AAV2_CaMKII_Venusウイルスとくも膜下に注入された赤いFluoSpheresの広がりを示す全脳の写真。 (A)注入されたウイルス懸濁液に添加された赤色ナノ粒子の蛍光は、くも膜下腔における注入された体積の物理的広がりを示す。(B)緑色の蛍光チャネルの同じ脳半球は、金星の発現領域を示しています。注入部位は矢印で示されます。さらに、ラムダの位置がマークされます。スケールバー - 1 mm. この図の拡大版を表示するには、ここをクリックしてください。

図3:くも膜下ウイルスの注射は、新皮質の層2/3および5のニューロンの広範な感染をもたらします. (A)皮質内(i)およびくも膜下(s)ウイルス注射後の形質導入領域(中外側(m / l)および遠尾側(r / c)方向)の比較。バーは平均を表します。ひげは標準偏差を示します (**** - p < 0.0001; *** - p < 0.001; t 検定)。(B)くも膜下ウイルス注入後のマウス新皮質における金星発現を示す共焦点顕微鏡写真AAV2_CaMKII_Venus。レイヤー境界は概略的に示されています(L1 - L6)。(C)画像(B)の断片を、異なる明るさとコントラスト設定で示し、第6層と白質(WM)を横切って移動する蛍光軸索を示しています。スケールバーは100μmです。 この図の拡大版を表示するには、ここをクリックしてください。
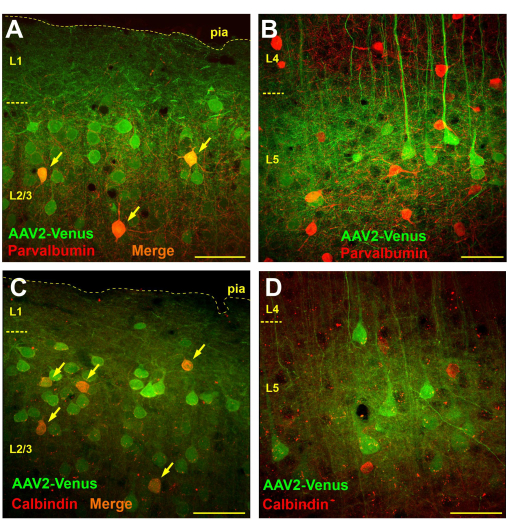
図4:くも膜下ウイルスの注射は、新皮質の顆粒下層に介在ニューロンの形質導入をもたらしますが、新皮質の顆粒下層には形質導入をもたらしません。 (A、B)くも膜下ウイルスにパルブアルブミンに対する抗体(Alexa594標識二次抗体)をくも膜下注射したマウスの脳切片の免疫化学的染色 AAV2_CaMKII_Venus。緑と赤の両方のラベルを持つニューロンはオレンジ色に見えます(矢印で示されています)。(C、D)カルビンジンに対する抗体で染色されたAAV2_CaMKII_Venusのくも膜下注射後のマウスの脳切片の顕微鏡写真。L5に二重標識ニューロンがないことに注意してください。スケールバーは50μmです。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
私たちは、AAV2ウイルス粒子の懸濁液を脳のくも膜下腔に注入することにより、マウス新皮質ニューロンを形質導入する新しい方法を開発しました。これにより、ウイルスの分布が広範囲に広がり、同量のウイルスが脳実質に直接注入された場合に感染する組織の体積の約4倍になります。
ウイルスベクターをさまざまな経路(例えば、脳室内、髄腔内、または槽内)を介して脳脊髄液(CSF)に直接注入することは、CNS全体に広範な遺伝子送達のための一般的な戦略です33,34,35。しかし、成体の脳におけるAAV2ベクターの脳室内または髄腔内投与は、上衣細胞28,33,36,37に対するそれらの高い親和性のために、限定的な脳形質導入をもたらす。上衣細胞は、第3および第4の脳室および脊髄38の中央管を覆う単層として見出される。心室における上衣細胞間のタイトジャンクションの存在は、一部のAAV血清型にとって大きな障壁であり、これらの細胞が心室からこれらの細胞を通過しなければならないのは、実質内が広がるためである39。
私たちの研究では、AAV2ウイルスベクターを脳表面を介してくも膜下腔に注入すると、成体マウスの新皮質ニューロンの広範な形質導入がもたらされました。pia物質は、CNSの異なる領域で異なる構造を持っているという証拠があります。脊髄膜40の二重構造の性質により、脊髄膜(脊髄を囲む)の膜は、頭蓋膜(脳を囲む)よりもはるかに厚い。また、心室CSFは脳実質に最小限に侵入するのに対し、くも膜下CSFは傍血管腔に沿って脳実質に急速に入ることも示されている41。したがって、ウイルスベクターのCSFへの送達経路が異なれば、結果も異なる可能性があります。
一部のAAVバリアントのCSF内注射は、特定の副作用と関連していることに注意する必要があります。.AAV9の髄腔内または脳室内送達は、CNSだけでなく末梢器官でも遺伝子発現をもたらすことが示されています42,43。脳全体のニューロンのより効率的な形質導入のためには、高ベクター線量が必要です。例えば、成体のSprague-Dawleyラットは、3.1μL、15.5μL、および77.5μLの3回投与で、側脳室にAAV9の片側注射を受けた42。マウスは、大槽43に総容量10μLのAAV9を投与された。私たちのウイルス注射方法の利点は、AAVの髄腔内または脳室内送達に使用されたものよりも少ないベクター容量(1μL)を使用したことです。ウイルスの量が少ないと、脳外でのウイルス発現のリスクや毒性も大幅に減少します。
脳外でのウイルス発現については調べていませんが、AAV2が脳表面を通じてくも膜下投与されたことで、もっぱら脳内(特に新皮質)でウイルスが発現した可能性が高いと考えられます。以下の理由により想定しております。AAV9は、血液脳関門(BBB)を通過できる組換えアデノ随伴ウイルスであり、一般的なCNS形質導入に広く使用されています37,44。しかし、脳組織のBBB浸透と形質導入はAAV245では制限されています。さらに、くも膜下ウイルス注射後のマウス脳切片の解析により、形質導入細胞は同側(注射)半球の新皮質にのみ位置していることが示されました。対側新皮質や他の脳構造には形質導入細胞は見つからず、この注射方法による末梢臓器の形質導入は非常にありそうにないことを示唆しています。
大きな感染領域に加えて、くも膜下ウイルス注射の方法は、CAGなどの強力な非選択的プロモーターを使用しても、第5層錐体ニューロンの選択的形質導入を可能にします。特定のプロモーターを用いても選択的発現を確保することは非常に難しいことはよく知られている1,26。例えば、私たちが使用したCaMKIIプロモーターは、理論的にはグルタミン酸作動性ニューロンに優先的に感染するはずです。しかし、本研究の結果や他の研究で示されているように、それを使用すると、他の種類の細胞、特にGABA作動性介在ニューロン46の形質導入も起こる。さらに、くも膜下注射では、細胞形質導入が注射部位からかなり離れた場所で行われるため、この方法は、その後のニューロン活動の光学的または電気生理学的記録のために脳組織を保存するのに役立ちます。私たちは、光遺伝学的刺激の実験や、マウス視覚野のL5錐体ニューロンの活性の細胞外記録におけるくも膜下ウイルス注射を成功裏に使用しました32。
本研究は、視覚野の可塑性メカニズムに関する大規模な研究の副産物であり、AAV2を用いてマウス視覚野の錐体ニューロンにチャネルロドプシンを発現させた32。この血清型により、私たちは多くの統計を取得し、実際にはくも膜下注射の方法を開発しました。パイロット実験では、血清型2/9を用いたウイルスのくも膜下注射も試み、同様の結果を得ましたが、この場合、詳細な形態学的解析は行わなかった。残念ながら、くも膜下投与後に他の血清型がどのように振る舞うか、およびどのウイルス血清型が最大の形質導入領域を提供するかを予測することは不可能です。これは経験的にしか決定できず、かなりの作業量が必要です。本研究では、成体マウスのくも膜下腔にAAV2を注入し、新皮質の第5層錐体ニューロンに標的遺伝子を選択的に発現させ、顆粒上層に非選択的に発現する広範な形質導入が可能であることを示しました。
このくも膜下ウイルス注射の方法を使用する際の最も重要なステップは、硬膜の穴の最適なサイズを確保することであり、これは注射針の直径と正確に一致する必要があります。硬膜は針をしっかりと取り囲む必要があるため、注射中のウイルスの逆流を防ぐことができます。この方法をくも膜下注射と呼んでいますが、くも膜下腔に加えて、ウイルスが硬膜下腔(くも膜と硬膜の間の空間)にも侵入して広がるかどうかは明らかではありません。また、この方法が他の動物、特にラットで有効かどうか、または他のAAV血清型で有効かどうかも明らかではありません。
今回、Xinjian Liたちは以前、皮質表面へのウイルス注入に基づくニューロン形質導入法について発表した。彼らは、ウイルスカルシウムレポーターAAV-GCaMP6を皮質に注入するために、皮質表面に大口径ガラスピペットを使用しました。この方法を使用すると、ウイルス粒子は、おそらくこの場合と同様に、新皮質の上層に入り、そこでニューロンによって捕捉されます。著者らは、皮質表面ウイルス注入が、深層ニューロンを避けながら、表層のニューロンを効率的に標識することを発見した47。引用された研究が、私たちの研究で観察されたものと同様に、第5層錐体ニューロンの形質導入を示さなかった理由は完全には明らかではありません。
くも膜下投与後、ウイルスは顆粒上層で分岐するニューロンの樹状突起によって捕捉されるという私たちの仮説には、1つの顕著な弱点があります。第5層の大きなピラミッドに加えて、マウス視覚野の第4層錐体ニューロン48 および閉所に突出するL6錐体細胞49 は、第1層に達する樹状突起を有する。したがって、これらの細胞がくも膜下ウイルス注射で形質導入されない理由は明らかではありません。考えられる説明の1つは、ウイルス粒子を細胞体に輸送するのに十分な厚さの樹状突起を持つ細胞、つまりL5ピラミッドのみが感染しているということです。マウスの視覚野では、第4層の錐体ニューロンが1つの薄い樹状突起のみを新皮質48の第1層に送ることが示されている。ただし、くも膜下ウイルス注射後に観察された感染パターンの原因を特定するには、さらなる研究が必要です。
開示事項
著者は、利益相反を宣言しません。
謝辞
この作業は、ロシア科学財団(助成金20-15-00398P)からの財政支援を受けて実施されました。
資料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
参考文献
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved