Method Article
Trasduzione diffusa dei neuroni neocorticali di topo mediante iniezione subaracnoidea di AAV2
In questo articolo
Riepilogo
Viene descritta una nuova tecnica per la somministrazione diffusa di virus adeno-associato che utilizza l'infusione di virus subaracnoideo. Questo metodo non solo garantisce una diffusa trasduzione dei neuroni neocorticali di topo negli strati superficiali, ma si traduce anche in un'espressione selettiva del transgene nei neuroni piramidali di quinto strato, anche quando si utilizza un promotore non selettivo.
Abstract
I virus adeno-associati ricombinanti sono uno strumento flessibile e potente per la consegna e l'espressione di vari geni di interesse in molte aree della biologia sperimentale, in particolare nelle neuroscienze. Il metodo più popolare per guidare l'espressione di un transgene desiderato in una particolare area del cervello è quello di iniettare un vettore AAV direttamente nel parenchima cerebrale. Tuttavia, questo metodo non consente una trasduzione neuronale diffusa che è necessaria per alcuni esperimenti in vivo . In questo articolo, presentiamo una nuova tecnica per l'espressione genica diffusa nella neocorteccia murina basata sull'infusione virale nello spazio subaracnoideo del cervello. Questo metodo di marcatura neuronale non solo garantisce una diffusa trasduzione dei neuroni negli strati neocorticali superficiali del topo adulto, ma provoca anche l'espressione del transgene in un'ampia popolazione di neuroni piramidali di quinto strato con elevata specificità anche quando si utilizza un forte promotore non selettivo come la CAG. Inoltre, poiché la trasduzione cellulare avviene a una distanza significativa dal sito di iniezione, questo metodo può aiutare a preservare il tessuto cerebrale per le successive registrazioni ottiche o elettrofisiologiche dell'attività neuronale.
Introduzione
Il cervello dei mammiferi è costituito da molte cellule inibitorie, eccitatorie e modulatorie interconnesse in circuiti da trilioni di sinapsi1. Una delle sfide centrali delle neuroscienze è quella di decodificare il ruolo di tipi di cellule distinte nell'organizzazione e nella funzione dei circuiti cerebrali e del comportamento. La manipolazione di cellule geneticamente definite all'interno del cervello richiede metodi per introdurre ed esprimere i transgeni. I sistemi di consegna genica su base virale sono di gran lunga il metodo più efficace e semplice per la consegna di geni nel sistema nervoso centrale2. I sistemi di rilascio virale si basano su virus replicanti (adenovirus, virus adeno-associati (AAV), lentivirus e retrovirus) che hanno la capacità di fornire informazioni genetiche in una cellula ospite 2,3.
I vettori basati su AAV sono ora diventati uno degli strumenti più utilizzati per la consegna dei transgeni desiderati alle cellule all'interno del cervello, sia per scopi di ricerca neuroscientifica di base che per sviluppare la terapia genica per le malattie neurologiche. Rispetto ad altri virus, gli AAV difettosi di replicazione possiedono molte caratteristiche che li rendono vettori ideali per questi scopi. In particolare, i vettori AAV trasducono in modo efficiente le cellule non in divisione (differenziate terminalmente) come i neuroni e le cellule gliali, determinando alti livelli di espressione transgenica nel vivo2. I vettori possono essere facilmente prodotti ad un alto titolo funzionale adatto per l'uso in vivo 3,4,5. È importante sottolineare che la somministrazione genica mediata da virus adeno-associati in vivo non produce alterazioni istopatologiche e tossicità correlata al vettore6. A differenza dei vettori adenovirali, la somministrazione in vivo di vettori AAV in modelli animali di solito non suscita risposte immunitarie dell'ospite contro le cellule trasdotte, consentendo un'espressione transgenica stabile all'interno del parenchima cerebrale per lunghi periodi di tempo 2,7,8.
Un'altra ragione per la popolarità dei vettori AAV è l'ampia gamma di sierotipi AAV con tropismi unici di tipo tissutale e cellulare 9,10,11,12,13,14. Proteine del capside distinte espresse da diversi sierotipi di AAV determinano l'uso di diversi recettori di superficie cellulare per l'ingresso cellulare e, quindi, tropismi specifici10,14.
Il tropismo degli AAV è determinato non solo dalle proteine del capside, ma da molti altri fattori14. E' stato dimostrato che i sierotipi AAV 1, 2, 6, 7, 8 e 9 trasducono sia i neuroni che gli astrociti in coltura primaria15,16, ma mostrano un forte trofismo neuronale dopo l'iniezione cerebrale intraparenchimale17,18. Il metodo utilizzato per la preparazione del vettore AAV può anche influenzare il tropismo delle cellule nervose, anche per lo stesso sierotipo. Ad esempio, l'AAV8 purificato con CsCl possedeva un forte tropismo astrogliale dopo l'iniezione cerebrale intraparenchimale, mentre l'AAV8 purificato con iodixanolo, iniettato in condizioni identiche, trasduceva solo i neuroni19. Il tropismo dell'AAV può anche essere influenzato dalla dose iniettata e dal volume14. Ad esempio, rAAV2/1 ad alto titolo ha trasdotto in modo efficiente sia i neuroni eccitatori corticali che quelli inibitori, ma l'uso di titoli più bassi ha esposto una forte preferenza per la trasduzione dei neuroni inibitori corticali20.
Pertanto, non è possibile ottenere una robusta specificità del tipo cellulare basata esclusivamente sul sierotipo del capside. I promotori specifici del tipo di cellula possono essere utilizzati per superare l'ampio tropismo naturale del capside AAV. Ad esempio, la sinapsina I umana viene utilizzata per colpire i neuroni21, il promotore CaMKII può guidare l'espressione transgenica nei neuroni eccitatori glutammatergici con elevata specificità20, il promotore ppHcrt prende di mira i neuroni che esprimono l'ipocretina (HCRT) nell'ipotalamo laterale22, il promotore PRSx8 prende di mira i neuroni noradrenergici e adrenergici che esprimono dopamina beta-idrossilasi23 e il promotore GFAP può guidare l'espressione astrocitaria-specifica24. Tuttavia, alcuni promotori cellulo-specifici hanno una debole attività trascrizionale e non possono guidare livelli sufficienti di espressione transgenica25. Inoltre, i promotori corti che si adattano ai vettori virali AAV spesso non mantengono la specificità del tipo cellulare 1,26. Ad esempio, è stato dimostrato che un costrutto CaMKII trasduce anche i neuroni inibitori12.
Oltre alla specificità del tipo cellulare (tropismo), un'altra caratteristica significativa degli AAV è l'efficienza di trasduzione. I vari sierotipi di AAV hanno proprietà diffusionali diverse. AAV2 e quattro vettori virali si diffondono meno facilmente attraverso il parenchima cerebrale e, quindi, mediano la trasduzione su un'area più piccola17,27. La trasduzione neuronale più diffusa si osserva con i sierotipi AAV 1, 9 e rh.10 11,17,18,19,28.
Il metodo più popolare per guidare l'espressione di un transgene desiderato in una particolare area cerebrale consiste nell'iniettare il vettore AAV direttamente nella regione cerebrale di interesse (parenchima)3. Dopo l'iniezione intraparenchimale, anche i sierotipi di AAV con una diffusione più efficace attraverso il cervello trasducono tipicamente solo un'area locale intorno al sito di iniezione 12. Inoltre, l'iniezione intraparenchimale è una procedura invasiva e porta a danni tissutali adiacenti alla regione di interesse. Pertanto, questo metodo di iniezione del virus non è adatto per alcuni compiti sperimentali. Ad esempio, l'etichettatura estesa delle cellule è altamente desiderabile negli esperimenti volti a studiare le funzioni dei neuroni corticali in animali che si muovono liberamente, anche con l'uso della microscopia a uno o due fotoni 29,30,31,32.
Qui, descriviamo una nuova tecnica di iniezione di virus adeno-associato che utilizza l'infusione di virus subaracnoideo per fornire una trasduzione diffusa dei neuroni neocorticali nei topi adulti e preservare il tessuto cerebrale per le successive registrazioni ottiche o elettrofisiologiche dell'attività neuronale. Questo metodo non solo ha assicurato una diffusa trasduzione dei neuroni negli strati neocorticali superficiali, ma ha portato all'espressione del transgene in un'ampia popolazione di neuroni piramidali di quinto strato con elevata specificità anche quando si utilizza un forte promotore non selettivo come la CAG.
Protocollo
Gli esperimenti sono stati eseguiti su topi adulti C57Black/6, di età compresa tra 2 e 4 mesi, di entrambi i sessi (Pushchino Breeding Center, Branch of the Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry of RAS). I topi sono stati alloggiati in un vivaio a temperatura controllata (22 °C ± 2 °C, ciclo luce/buio di 12 ore, luci accese alle 08.00) con cibo e acqua ad libitum. Tutte le procedure sperimentali sono state condotte in conformità con le linee guida ARRIVE e la direttiva 2010/63/UE per gli esperimenti sugli animali. Il protocollo di studio è stato approvato dal Comitato Etico dell'IHNA RAS (protocollo N1 del 01.02.2022). È stato fatto ogni sforzo per ridurre al minimo la sofferenza degli animali e per garantire l'affidabilità dei risultati.
1. Preparazione per l'intervento chirurgico
- Sterilizzare tutti gli strumenti chirurgici prima dell'inizio dell'intervento. Pulire l'area chirurgica utilizzando etanolo al 70%.
- Controllare il livello di isoflurano nel sistema di anestesia e riempirlo se necessario. Posizionare un tovagliolo di carta pulito sul fondo della camera di induzione.
- Posizionare un termoforo sul telaio stereotassico. Copri il tampone con un tovagliolo di carta pulito.
- Prepara un flacone con il 2% di candeggina per raccogliere puntali per micropipette, tubi, tamponi di cotone e altri oggetti che entrano in contatto con il virus.
- Togliere un'aliquota di AAV dal congelatore a -80 °C e metterla sul ghiaccio per scongelarla.
2. Preparazione della siringa
- Pulire una microsiringa Hamilton da 5 μL con un ago RN smussato da 33G. Aspirare e poi erogare etanolo al 70%. Ripetere 3 volte con etanolo fresco. Sciacquare la siringa con acqua distillata per rimuovere l'etanolo in eccesso. Ripeti 3 volte.
- Estrarre lo stantuffo e riempire il fusto con olio di vaselina attraverso la flangia utilizzando una siringa da insulina. Assicurarsi che non vi siano bolle d'aria nella microsiringa.
NOTA: L'aria intrappolata è comprimibile e influisce sull'accuratezza e la precisione della siringa. - Rimettere lo stantuffo nella microsiringa ed erogare una goccia di olio. Posizionare la siringa nell'iniettore stereotassico in modo che la scala sia visibile per monitorare il volume di soluzione erogata.
3. Preparazione dei topi per la chirurgia
- Pesa un topo. Posizionare il topo nella camera di induzione dell'anestesia collegata all'isoflurano. Accendi il vaporizzatore di isoflurano impostato al 5% e regola la portata a 250 ml/min. Un'adeguata profondità di anestesia si ottiene entro 5-7 minuti.
- Per verificare il livello chirurgico di anestesia, verificare l'assenza di battito e riflesso di ritiro durante un pizzico doloroso della zampa posteriore e l'assenza di battito di ciglia al contatto visivo.
- Commutare la valvola di deflusso del vaporizzatore dalla camera di induzione alla maschera stereotassica. Ridurre l'isoflurano all'1,8%-2,0% e impostare la portata in base al peso del topo (70-90 ml/min per topi di peso compreso tra 25 e 35 g).
- Estrarre il topo dalla camera di induzione e posizionarlo nell'apparecchio stereotassico sopra un termoforo (37 °C) per prevenire l'ipotermia durante l'anestesia chirurgica. Posizionare i denti anteriori nella barra dei denti e quindi montare la maschera per animali.
- Posizionare con cura l'animale sulle barre auricolari. La corretta posizione della testa nell'apparato stereotassico consente il movimento verticale ma non laterale della testa. Assicurarsi che il posizionamento dell'animale non causi angoscia. Monitorare attentamente la profondità dell'anestesia, la respirazione degli animali e la temperatura corporea durante l'operazione.
- Radere la testa dagli occhi a dietro le orecchie. Pulire la superficie rasata della testa tamponando con etanolo al 70%, seguito da tampone con una soluzione alcolica al 5% di iodio.
- Applicare il gel oftalmico per prevenire la secchezza degli occhi. Applicare una soluzione di lidocaina al 4% per via topica e desametasone (0,02 ml a 4 mg/ml) per via sottocutanea per prevenire il dolore correlato all'intervento chirurgico e ridurre la possibile risposta infiammatoria.
- Con una lama di bisturi sterile e delle forbici, praticare un'incisione lunga 4-5 mm lungo la linea mediana della testa per aprire il cuoio capelluto. Inizia con una piccola incisione tra le orecchie e poi espandila usando le forbici per evitare danni al cranio.
- Tampona la superficie del cranio con una piccola quantità di perossido di idrogeno al 3% per visualizzare i punti di riferimento stereotassici: bregma e lambda. Interrompere immediatamente la reazione con soluzione salina di NaCl allo 0,9%. Raschiare via i tessuti sulla parte superiore del cranio con un raschietto osseo.
- Montare l'iniettore motorizzato pre-preparato con la siringa Hamilton sul braccio stereotassico. Dirigere una fonte di luce chirurgica sul cranio esposto e focalizzare il microscopio sul bregma.
- Guardando attraverso il microscopio, manipolare il braccio dell'apparato stereotassico per centrare la parte superiore dell'ago direttamente sopra il bregma.
- Usando la punta dell'ago, allinea orizzontalmente la bregma e la lambda, quindi riporta il braccio alla bregma e registra le coordinate. Utilizzare queste coordinate bregma e le coordinate dell'atlante della regione di interesse per calcolare le coordinate relative dell'area di destinazione.
- Sposta l'ago nell'area mirata. Abbassa l'ago alle nuove coordinate e segna questa posizione. Selezionare il sito per la microiniezione virale in prossimità dell'area bersaglio, considerando la diffusione del virus.
NOTA: In questo modo si eviterà di danneggiare il tessuto nella regione di interesse. Abbiamo utilizzato le seguenti coordinate per la regione di interesse: AP-3.4, ML -2.0 e per la microiniezione virale: AP-2.0, ML -1.4. Le coordinate di cui sopra sono ottimali se i neuroni primari della corteccia visiva devono essere infettati. - Se possibile, evitare le regioni con vasi sanguigni di grandi dimensioni. Sotto un microscopio operatorio, un'illuminazione a luce fredda e intensa e un'immersione salina di NaCl allo 0,9%, dovrebbero diventare evidenti grandi vasi sanguigni nel cranio e sulla superficie del cervello.
4. Iniezione di virus
- Prendi una fresa dentale sterile (0,5 - 0,8 mm di diametro). Osservando la superficie del cranio attraverso il microscopio operatorio, praticare una piccola craniotomia manualmente (a mano) o utilizzando un microtrapano. Fare attenzione a non esercitare una pressione eccessiva sul cranio.
- Spostare il braccio in modo che non sia d'intralcio per evitare danni all'ago della microsiringa durante la perforazione della craniotomia (foro). Applicare l'immersione salina di NaCl allo 0,9% e fare una pausa intermittente per evitare di riscaldare l'osso e danneggiare la dura madre. Utilizzare aria pressurizzata per soffiare via la polvere ossea.
NOTA: Sono adatti i seguenti tipi di frese dentali in metallo duro: a forma di pera (preferibilmente), cilindrica arrotondata e rotonda.- Quando si assottiglia l'osso con la fresa, assicurarsi che il diradamento sia uniforme su tutta la circonferenza. In questo modo sarà più facile rimuovere l'osso senza danneggiare la dura madre. Per fare ciò, utilizzare inizialmente una fresa con una punta rotonda e poi una fresa con una punta piatta. Tenere la fresa perpendicolare all'osso; in caso contrario, un lato sarà più sottile dell'altro.
NOTA: Inoltre, minore è la dimensione della fresa e più piccola è la craniotomia eseguita, più complessa sarà la manipolazione. Si raccomanda di eseguire una craniotomia di diametro inferiore (0,5-0,6 mm) quando si utilizza ulteriormente l'animale per il lavoro in vivo . Se si prevede di utilizzare il cervello dell'animale per lavori ex vivo , è accettabile un diametro della craniotomia maggiore per semplificare la procedura.
- Quando si assottiglia l'osso con la fresa, assicurarsi che il diradamento sia uniforme su tutta la circonferenza. In questo modo sarà più facile rimuovere l'osso senza danneggiare la dura madre. Per fare ciò, utilizzare inizialmente una fresa con una punta rotonda e poi una fresa con una punta piatta. Tenere la fresa perpendicolare all'osso; in caso contrario, un lato sarà più sottile dell'altro.
- Quando l'osso assottigliato è morbido e trasparente, smetti di perforare. Quando si forma una rientranza sufficientemente grande nell'osso, interrompere frequentemente la rotazione e monitorare lo spessore dell'osso. La comparsa di crepe nell'osso indica che l'assottigliamento è sufficiente.
- Bagnare il foro con soluzione fisiologica sterile e quindi rimuovere la soluzione salina in eccesso con un batuffolo di cotone. Rimuovere lo strato rimanente di osso utilizzando un ago da 27 G con punta a forma di uncino e/o utilizzando una pinzetta a punta fine. Evitare di danneggiare la dura.
- Copri la superficie del cranio con un pezzo di carta assorbente sterile inumidito con soluzione fisiologica. Posiziona un pezzo di pellicola trasparente e pulita sulla superficie del teschio del topo sopra la carta.
- Spostare indietro il braccio stereotassico e posizionare l'ago della microsiringa in posizione direttamente sopra la pellicola. Erogare l'olio in eccesso fino a raggiungere un volume di 2 μl.
NOTA: Il volume finale dell'olio può variare in base al volume della micro siringa. Abbiamo utilizzato una micro siringa Hamilton 75-RN da 5 μl. - Pipettare un volume di virus pari al volume iniettato + 2 μL su un pezzo di pellicola trasparente.
- Guardando attraverso il microscopio operatorio, abbassa il braccio fino a quando la punta dell'ago non si trova al centro della goccia del virus. Caricare il virus nella microsiringa utilizzando un iniettore motorizzato. Smaltire la punta della micropipetta e la pellicola trasparente nel flacone con il 2% di candeggina.
- Rimuovere la carta inumidita con soluzione fisiologica dalla superficie del cranio e asciugare il cranio con un batuffolo di cotone. Utilizzare il braccio stereotassico per posizionare l'ago sopra il sito di inserimento.
- Erogare una goccia del virus per assicurarsi che l'ago non sia ostruito. Fai una piccola fessura nella dura madre usando un ago da 30 g con punta a forma di uncino.
NOTA: È importante praticare la fessura più piccola possibile nella dura madre, consentendo all'ago di entrare senza lasciare uno spazio tra l'ago e la dura madre, da cui il virus potrebbe fuoriuscire. - Abbassare l'ago della siringa fino alla dura madre ed effettuare i calcoli appropriati per la profondità. Stimare la profondità corticale dell'inserzione rispetto al punto in cui l'ago ha toccato per la prima volta la superficie della corteccia.
- Inserire lentamente la punta dell'ago nella corteccia fino a una profondità di 300 μm. Attendere 2-3 minuti per consentire alla dura madre di aderire all'ago, quindi ritrarre lentamente l'ago fino a una profondità di 200 μm. Attendere altri 2-3 minuti per consentire al tessuto cerebrale di stabilizzarsi. Ciò fa sì che l'ago tiri verso l'alto la dura madre, creando uno spazio subdurale per la diffusione del virus.
NOTA: Per ridurre al minimo il danno corticale, utilizzare un ago da 33 G o aghi con G inferiore. Tieni presente che più piccolo è il diametro interno della punta, maggiore è la possibilità che il riflusso dei tessuti la ostruisca. È importante utilizzare un ago smussato invece di smussato perché un ago smussato espelle una goccia più controllata di soluzione virale.- Se l'ago non passa attraverso la dura madre quando viene abbassato a 150-200 μm e invece la piega, interrompere l'abbassamento. Solleva l'ago e fai un'incisione leggermente più grande nella dura madre, quindi prova ad abbassare di nuovo l'ago.
- Se il liquido cerebrospinale inizia a fuoriuscire attivamente dall'incisione durante l'abbassamento dell'ago, attendere che smetta di fuoriuscire; In caso contrario, è difficile controllare l'ago che passa attraverso la dura. Tamponare il liquido cerebrospinale in eccesso con la punta di un fazzoletto. Una volta che il fluido smette di scorrere, sollevare l'ago e riprovare.
- Iniziare a iniettare la sospensione virale a una velocità di 0,06 μL/min monitorando il volume erogato. Iniettare 1 μL di virus. Iniettare il virus a una singola profondità per non rompere il sigillo tra l'ago e il tessuto della corteccia.
- Risoluzione dei problemi: all'inizio dell'iniezione, può verificarsi un riflusso del virus sulla superficie cerebrale. Interrompere l'iniezione, attendere 2-3 minuti e quindi continuare l'iniezione del virus. Ripetere queste azioni (passaggi) fino a quando il riflusso del virus non si interrompe. Il virus e i liquidi cerebrospinali si attaccheranno all'ago e impediranno il riflusso.
- Un altro modo per fermare il riflusso del virus, mettere una piccola quantità di agarosio sulla superficie della corteccia. Sopprimerà la pulsazione della corteccia e aiuterà anche a sigillare l'ago. Ma assicurati che la pipetta non sia ostruita dall'agarosio.
- Poiché l'ago potrebbe non passare completamente attraverso la dura madre quando viene abbassato, ma solo parzialmente, un lato dell'ago potrebbe non aderire perfettamente alla dura madre, il che può causare il riflusso del virus. In questo caso, ritirare lentamente l'ago dal tessuto e provare ad abbassarlo di nuovo.
- Una volta completata l'infusione, tenere l'ago nella posizione target per altri 10 minuti. Ciò consente al virus di disperdersi lontano dal sito di iniezione. Ritrarre lentamente l'ago dal cervello per evitare che il virus fuoriesca dal tratto dell'ago.
- Una volta completato il prelievo dell'ago, verificare che non sia ostruito dispensando una piccola goccia di virus. Chiudere l'incisione cutanea utilizzando suture 5-0 assorbibili o non assorbibili.
5. Assistenza post-operatoria
- Dopo aver chiuso l'incisione, applicare l'unguento antibatterico per via topica. Iniettare una miscela di soluzione fisiologica (5 ml/kg) e glucosio al 5% (5 ml/kg) per via sottocutanea per prevenire la disidratazione e facilitare il recupero dopo l'anestesia. Iniettare ketoprofene per via intramuscolare (2,5 mg/kg) per ridurre il dolore.
- Metti l'animale in una gabbia fresca sopra un termoforo e monitora fino a quando non si riprende dall'anestesia. Dopo che il topo è reattivo, metti l'animale nella gabbia di casa.
6. Istologia
- Non prima di 21 giorni dopo l'iniezione del virus, anestetizzare profondamente i topi con isoflurano come descritto nel passaggio 3.
- Praticare un'incisione sulla linea mediana (10-15 mm) lungo la regione toracica utilizzando forbici strette ed esporre la cavità toracica. Separare con cura il diaframma e aprire il torace usando le forbici.
- Inserire un ago da 22G 1 1/2 nel ventricolo sinistro e praticare un'incisione nell'atrio destro con le forbici. Perfondere con 50 mL di soluzione salina tamponata con fosfato (PBS) 100 mM pre-refrigerata, seguiti da 100 mL di formalina tamponata al 10% pre-refrigerata.
- Estrai con cura l'intero cervello del topo. Per fare questo, fai un'incisione sagittale lungo il centro del cuoio capelluto usando le forbici. Quindi, rimuovere l'osso cranico pezzo per pezzo utilizzando una pinza per ossa con punte piatte iniziando dall'intersezione delle suture sagittale e lambdoidea e procedendo in avanti fino all'osso nasale. Quando il cervello è esposto, tagliare i bulbi olfattivi, allentare il cervello con una spatola curva e immergerlo in una provetta da 50 ml contenente il 10% di formalina tamponata.
- Ripara il cervello durante la notte. Montare il tessuto cerebrale su una piattaforma metallica di un vibratomo utilizzando un adesivo per tessuti. Tagliare sezioni frontali ad uno spessore di 50 μm utilizzando lame in acciaio al carbonio.
7. Immunocolorazione
- Giorno 1
- Lavare le fette di cervello 3 volte per 5 minuti ciascuna con 1 PBS contenente lo 0,3% di Triton X-100 (PBS-T). Incubare le sezioni in PBS-T per 20 minuti a temperatura ambiente (RT).
- Bloccare il legame aspecifico per 1 ora a RT utilizzando un tampone bloccante composto al 5% da siero normale di capra (NGS) e allo 0,3% da Triton X-100 in 1x PBS.
- Incubare le sezioni per una notte a 4 °C con anticorpi primari contro parvalbumina o calbindina diluiti 1:500 nel tampone bloccante (5% NGS e 0,3% Triton X-100 in 1x PBS).
- Giorno 2
- Lavare le sezioni 3 volte per 10 minuti in PBS-T. Incubare al buio per 2 ore a RT con anticorpi secondari (Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 546) diluiti 1:500 nel tampone bloccante (5% NGS e 0,3% Triton X-100 in 1x PBS).
- Lavare le sezioni 3 volte per 5 minuti ciascuna in 1 PBS. Trasferire le fette di cervello su vetrini usando un pennello morbido.
- Aggiungere immediatamente 0,1 mL di terreno di montaggio antisbiadimento a ciascuna sezione. Coprire le fette con un vetrino coprioggetti da 22 mm x 50 mm.
- Configurare il microscopio confocale su un ingrandimento di 20x o 60x (A/1,4, olio). Utilizza laser con lunghezza d'onda di 488 nm e 594 nm per acquisire immagini multicanale delle regioni cerebrali di interesse.
Risultati
In una serie pilota di esperimenti, abbiamo utilizzato il tradizionale metodo di iniezione intracorticale per trasdurre i neuroni piramidali dello strato cinque nella neocorteccia murina mediante AAV2 che trasporta il gene della canalrodopsina veloce (oChIEF) fuso con la proteina fluorescente EGFP sotto il promotore CaMKII. Coerentemente con la caratteristica di AAV212, abbiamo ottenuto un'area di infezione relativamente piccola, non superiore a 1 mm di larghezza (Figura 1A). Tuttavia, in alcuni esperimenti, abbiamo osservato una diffusione insolitamente ampia di AAV2, in alcuni casi coprendo la neocorteccia di oltre la metà dell'emisfero cerebrale (Figura 1B). Abbiamo ipotizzato che tale distribuzione diffusa del virus possa verificarsi quando il virus entra nello spazio subaracnoideo e il flusso di liquido cerebrospinale (CSF) diffonde il vettore virale attraverso la superficie cerebrale. Abbiamo notato che ciò accade quando la profondità di inserimento dell'ago per iniezione è piccola (<200 μm) e la dimensione del foro nella dura madre corrisponde esattamente al diametro dell'ago, impedendo la sospensione delle particelle virali dal riflusso. Per visualizzare questo processo, abbiamo aggiunto nanoparticelle fluorescenti rosse alla sospensione iniettata di particelle virali (n = 3 topi). A 3 settimane dall'iniezione, i topi sono stati perfusi per via transcardiaca con formalina tamponata al 10% e il cervello è stato accuratamente rimosso dal cranio senza danneggiare la dura madre. L'esame di interi cervelli al microscopio binoculare a epifluorescenza ha rivelato l'ampia distribuzione di particelle fluorescenti rosse che superavano leggermente l'area di infezione neuronale visibile nel canale di fluorescenza verde (Figura 2). L'analisi delle sezioni sagittali del cervello di questi topi ha mostrato che le particelle fluorescenti si trovavano in uno strato sottile lungo la pia madre, senza penetrare in profondità nel parenchima cerebrale, mentre i neuroni che esprimono Venere, come negli esperimenti precedenti, sono stati trovati in gran numero negli strati 2/3 e 5.
Oltre al virus EGFP AAV2_CaMKII_oChIEF (utilizzato a una concentrazione di 1,49 x 1012 vg/mL), abbiamo anche eseguito la somministrazione subaracnoidea dei virus AAV2_CaMKII_Venus (7,31 x 1012 vg/mL) e AAV2_CAG_GCamp6s (7,3 x 1013 vg/ml) e abbiamo ottenuto risultati simili. Questo è importante perché, come è stato dimostrato, i virus dello stesso sierotipo possono fornire diverse dimensioni dell'area di trasduzione a seconda del promotore e del gene bersaglio utilizzato12.
Per confrontare sistematicamente le aree di trasduzione dopo somministrazione tradizionale e subaracnoidea di virus, abbiamo calcolato la dimensione dell'area di infezione nelle direzioni mediolaterale e rostrocaudale in sezioni seriali di cervello spesse 50 μm. È stato riscontrato che la somministrazione subaracnoidea del virus ha portato a un aumento di quasi quattro volte nell'area di infezione, rispetto alla somministrazione di intraparenchimale (1,7 ± 0,52 mm (n = 15 topi) rispetto a 0,46 ± 0,22 mm (n = 6 topi), p < 0,00001, t-test in direzione mediolaterale e 2,35 ± 0,8 mm (n = 14 topi) rispetto a 0,84 ± 0,29 mm (n = 6 topi) p < 0,0003, t-test in direzione rostrocaudale; Figura 3A).
L'osservazione microscopica di fette di cervello di topi trasdotte mediante iniezione di virus subaracnoideo ha rivelato una trasduzione molto diffusa negli strati 2/3 e 5, mentre non c'erano praticamente cellule trasdotte negli strati 4 e 6 (Figura 3B). Nello strato 4, solo i dendriti fluorescenti delle piramidi di strato 5 erano chiaramente visibili (Figura 3B). Gli assoni fluorescenti sono stati tracciati nello strato 6 e nella sostanza bianca (Figura 3C). Un tale modello di trasduzione dopo l'iniezione subaracnoidea potrebbe essere dovuto alla diffusione del virus dallo spazio subaracnoideo nello strato 1 della corteccia (forse più profondo), dove i dendriti neuronali lo catturano. Pertanto, solo i neuroni che hanno una ramificazione vigorosa negli strati superiori sono infettati. È noto che gli interneuroni GABAergici si ramificano prevalentemente localmente. Se la nostra ipotesi è corretta, allora la somministrazione subaracnoidea del virus dovrebbe portare alla trasduzione degli interneuroni negli strati sopragranulari ma non negli strati subgranulari. Per testare l'ipotesi, abbiamo eseguito la colorazione immunochimica di sezioni cerebrali di topi dopo iniezione subaracnoidea del virus AAV2_CaMKII_Venus con anticorpi contro marcatori di due diverse classi funzionali di interneuroni GABAergici: parvalbumina e calbindina.
Per determinare il numero di interneuroni trasdotti mediante iniezione subaracnoidea del virus, abbiamo eseguito un'analisi morfometrica contando il numero totale di cellule trasdotte (colorazione verde), il numero di neuroni immunopositivi (colorazione rossa) e il numero di cellule doppiamente marcate su una sezione di 750 x 750 μm (spessore della sezione 50 μm).
Su fette di cervello colorate con anticorpi contro la parvalbumina, negli strati sopragranulari, il numero di neuroni con marcatura verde era in media 57,4 ± 9,8, interneuroni positivi alla parvalbumina con marcatura rossa 9,6 ± 3,8, di cui 4,1 ± 2,4 (42,7%) erano doppiamente marcati (n = 10 preparazioni). Al contrario, abbiamo contato 14 ± 4,8 neuroni trasdotti dal virus e 19,1 ± 4,5 neuroni positivi alla parvalbumina nello strato 5 della neocorteccia e non abbiamo rilevato alcuna cellula doppiamente marcata (n = 10 preparazioni).
Quando abbiamo esaminato le sezioni colorate immunochimicamente per la calbindina, abbiamo scoperto che negli strati sopragranulari c'era una media di 21,1 ± 4,5 neuroni trasdotti viralmente e 6,1 ± 2,6 cellule positive alla calbindina, di cui 4,2 ± 1,9 cellule portavano entrambe le marcature (69,1%; n = 10 preparazioni). Nello strato 5, abbiamo contato 19 ± 2,1 neuroni trasdotti, 15,9 ± 5,7 interneuroni di calbindina, di cui 1,1 ± 1,5 (6,9%) mostravano doppia colorazione. Tuttavia, va notato che il 100% dei neuroni doppiamente marcati nello strato 5 aveva una forma piramidale chiaramente visibile, che può indicare la presenza di neuroni piramidali positivi alla calbindina o una certa non specificità degli anticorpi. Pertanto, nello strato 5 non sono stati osservati interneuroni di calbindina vera trasdotti dall'iniezione subaracnoidea del virus.
Pertanto, mentre le cellule positive alla parvalbumina e alla calbindina erano effettivamente presenti tra i neuroni trasdotti nello strato 2/3 (Figura 4A, C), non sono stati rilevati interneuroni trasdotti nello strato 5 e tutte le cellule che esprimono EGFP sono state identificate visivamente come neuroni piramidali (Figura 4B, D).

Figura 1: Confronto dell'area di trasduzione di AAV2 dopo iniezioni convenzionali di virus intracorticali e subaracnoidee. (A) La diffusione di CaMKII_oChieff_EGFP si costruisce 21 giorni dopo l'iniezione nel parenchima cerebrale a una profondità di 500 - 600 μm. (B) La diffusione di CaMKII_oChieff_EGFP nell'altro emisfero dello stesso animale in seguito alla somministrazione subaracnoidea. Vengono mostrate sezioni frontali a una distanza di 200-300 μm in direzione rostrocaudale dal sito di iniezione. Barra della scala - 1 mm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Fotografia di un intero cervello con materia dura intatta che mostra la diffusione di virus AAV2_CaMKII_Venus e FluoSpheres rosse iniettate in modo subaracnoidale. (A) Fluorescenza di nanoparticelle rosse che sono state aggiunte alla sospensione virale iniettata che mostra la diffusione fisica del volume iniettato nello spazio subaracnoideo. (B) Lo stesso emisfero cerebrale nel canale di fluorescenza verde mostra l'area di espressione di Venere. Il sito di iniezione è indicato da frecce. Inoltre, la posizione della lambda è contrassegnata. Barra della scala - 1 mm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: L'iniezione subaracnoidea del virus provoca un'infezione diffusa dei neuroni degli strati 2/3 e 5 della neocorteccia. (A) Confronto delle aree di trasduzione (nelle direzioni mediolaterale (m/l) e rostrocaudale (r/c)) dopo l'iniezione intracorticale (i) e subaracnoidea (s) del virus. Le barre rappresentano la media; I baffi indicano la deviazione standard (**** - p < 0,0001; *** - p < 0,001; test t). (B) Micrografia confocale che mostra l'espressione di Venere nella neocorteccia murina dopo iniezione subaracnoidea di virus AAV2_CaMKII_Venus. I contorni dei layer sono mostrati schematicamente (L1 - L6). (C) Un frammento di immagine (B), mostrato con diverse impostazioni di luminosità e contrasto per dimostrare gli assoni fluorescenti che viaggiano attraverso lo strato 6 e la sostanza bianca (WM). La barra della scala è di 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.
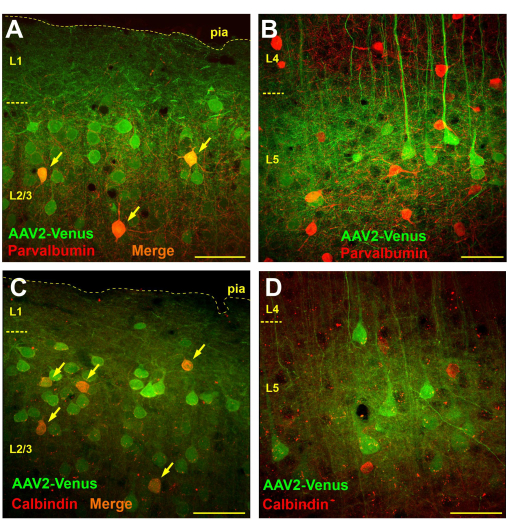
Figura 4: L'iniezione del virus subaracnoide provoca la trasduzione degli interneuroni negli strati sopra- ma non in quelli subgranulari della neocorteccia. (A, B) Colorazione immunochimica di sezioni cerebrali di un topo trasdotte mediante iniezione subaracnoidea del virus AAV2_CaMKII_Venus con anticorpi contro la parvalbumina (anticorpi secondari coniugati con Alexa594). I neuroni che portano sia l'etichetta verde che quella rossa appaiono arancioni (indicati da frecce). (C, D) Micrografie di una sezione cerebrale di un topo dopo iniezione subaracnoidea di AAV2_CaMKII_Venus colorato con anticorpi contro la calbindina. Si noti l'assenza di neuroni doppiamente marcati in L5. La barra della scala è di 50 μm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Abbiamo sviluppato un nuovo metodo per trasdurre i neuroni neocorticali di topo iniettando una sospensione di particelle virali AAV2 nello spazio subaracnoideo del cervello. Ciò fornisce una distribuzione diffusa del virus, quasi quattro volte maggiore del volume del tessuto infettato quando la stessa quantità di virus viene iniettata direttamente nel parenchima cerebrale.
L'iniezione di vettori virali direttamente nel liquido cerebrospinale (CSF) attraverso diverse vie (ad esempio, intracerebroventricolare, intratecale o intracisternale) è una strategia popolare per la consegna diffusa di geni in tutto il SNC 33,34,35. Tuttavia, la somministrazione intracerebroventricolare o intratecale di vettori AAV2 nel cervello adulto provoca una trasduzione cerebrale limitata a causa della loro elevata affinità per le cellule ependimali 28,33,36,37. Le cellule ependimali si trovano come un monostrato che riveste il terzo e il quarto ventricolo e il canale centrale del midollo spinale38. La presenza di giunzioni strette tra le cellule ependimali nel ventricolo è una barriera significativa per alcuni sierotipi di AAV, che devono passare attraverso queste cellule dal ventricolo per avere una diffusione intraparenchimale39.
Nel nostro lavoro, l'iniezione del vettore virale AAV2 nello spazio subaracnoideo attraverso la superficie cerebrale ha provocato una diffusa trasduzione dei neuroni neocorticali nei topi adulti. Ci sono prove che la materia pia ha strutture diverse in diverse aree del SNC. La membrana nella pia madre spinale (che circonda il midollo spinale) è molto più spessa della pia madre cranica (che circonda il cervello) a causa della natura a due strati della membrana della pia40. È stato anche dimostrato che il liquido cerebrospinale ventricolare entra minimamente nel parenchima cerebrale, mentre il liquido cerebrospinale subaracnoideo entra rapidamente nel parenchima cerebrale lungo gli spazi paravascolari41. È quindi probabile che diverse vie di somministrazione del vettore virale nel liquido cerebrospinale possano dare risultati diversi.
Va notato che le iniezioni intra-CSF di alcune varianti di AAV sono associate a determinati effetti collaterali. È stato dimostrato che la somministrazione intratecale o intracerebroventricolare di AAV9 provoca l'espressione genica non solo nel SNC ma anche negli organi periferici42,43. Per una trasduzione più efficiente dei neuroni in tutto il cervello, sono necessarie alte dosi di vettori. Ad esempio, i ratti adulti di Sprague-Dawley hanno ricevuto un'iniezione unilaterale di AAV9 nel ventricolo laterale in tre dosi: 3,1 μl, 15,5 μl e 77,5 μl42. I topi hanno ricevuto AAV9 in volume totale di 10 μL nella cisterna magna43. Il vantaggio del nostro metodo di iniezione del virus è che abbiamo utilizzato un volume di vettore inferiore (1 μL) rispetto a quelli utilizzati per la somministrazione intratecale o intracerebroventricolare di AAV. Un volume inferiore del virus riduce significativamente il rischio di espressione virale al di fuori del cervello e anche la tossicità.
Sebbene non abbiamo esaminato le espressioni virali al di fuori del cervello, è molto probabile che la somministrazione subaracnoidea di AAV2 attraverso la superficie cerebrale abbia provocato l'espressione virale esclusivamente nel cervello (in particolare nella neocorteccia). La nostra ipotesi si basa sui seguenti motivi. AAV9 è un virus adeno-associato ricombinante che può attraversare la barriera emato-encefalica (BEE) ed è comunemente usato per la trasduzione globale del SNC37,44. Tuttavia, la penetrazione e la trasduzione della BBB nel tessuto cerebrale sono limitate con AAV245. Inoltre, l'analisi delle fette di cervello di topo dopo l'iniezione subaracnoidea del virus ha mostrato che le cellule trasdotte erano localizzate esclusivamente nella neocorteccia dell'emisfero omolaterale (iniettato). Non sono state trovate cellule trasdotte nella neocorteccia controlaterale o in altre strutture cerebrali, suggerendo che la trasduzione degli organi periferici con questo metodo di iniezione è molto improbabile.
Oltre a un'ampia area di infezione, il metodo di iniezione del virus subaracnoideo consente la trasduzione selettiva dei neuroni piramidali dello strato cinque, anche con l'uso di forti promotori non selettivi come la CAG. È noto che garantire un'espressione selettiva anche con promotori specifici è piuttosto difficile 1,26. Ad esempio, il promotore CaMKII che abbiamo usato dovrebbe teoricamente infettare preferenzialmente i neuroni glutammatergici. Tuttavia, come mostrato nei risultati qui e in altri studi, quando viene utilizzato, si verifica anche la trasduzione di altri tipi di cellule, in particolare gli interneuroni GABAergici46. Inoltre, poiché con le iniezioni subaracnoidee, la trasduzione cellulare avviene a una distanza significativa dal sito di iniezione, questo metodo aiuta a preservare il tessuto cerebrale per le successive registrazioni ottiche o elettrofisiologiche dell'attività neuronale. Abbiamo utilizzato con successo iniezioni di virus subaracnoidei in esperimenti con stimolazione optogenetica e registrazione extracellulare dell'attività dei neuroni piramidali L5 della corteccia visiva del topo in vivo32.
Questo lavoro è uno spin-off del nostro studio su larga scala sui meccanismi di plasticità nella corteccia visiva, in cui abbiamo utilizzato AAV2 per esprimere il canale rodopsina nei neuroni piramidali della corteccia visiva del topo32. Con questo sierotipo, abbiamo acquisito molte statistiche e, infatti, abbiamo sviluppato il metodo dell'iniezione subaracnoidea. Negli esperimenti pilota, abbiamo anche provato l'iniezione subaracnoidea del virus con sierotipo 2/9 e abbiamo ottenuto risultati simili, anche se in questo caso non abbiamo eseguito un'analisi morfometrica dettagliata. Sfortunatamente, è impossibile prevedere come si comporteranno gli altri sierotipi dopo la somministrazione di subaracnoidi e quale sierotipo virale fornirà la più ampia area di trasduzione; Questo può essere determinato solo empiricamente, il che richiede una notevole quantità di lavoro. In questo lavoro, abbiamo dimostrato in modo convincente che AAV2 può essere iniettato nello spazio subaracnoideo del cervello del topo adulto, determinando una trasduzione diffusa con espressione selettiva del gene bersaglio nei neuroni piramidali di strato cinque della neocorteccia ed espressione non selettiva negli strati sopragranulari.
Il passaggio più critico nell'utilizzo di questo metodo di iniezione del virus subaracnoideo è garantire la dimensione ottimale del foro nella dura materia, che deve corrispondere esattamente al diametro dell'ago di iniezione. La dura madre deve avvolgere strettamente l'ago e, quindi, impedire il riflusso del virus durante l'iniezione. Abbiamo chiamato questo metodo iniezione subaracnoidea, ma non è chiaro se, oltre allo spazio subaracnoideo, il virus entri e si diffonda anche nello spazio subdurale (lo spazio tra l'aracnoide e la dura madre). Inoltre, non è chiaro se questo metodo funzionerebbe in altri animali, in particolare nei ratti, o con altri sierotipi di AAV.
In precedenza, Xinjian Li e colleghi hanno descritto un metodo di trasduzione neuronale basato sull'infusione virale sulla superficie corticale. Hanno usato una pipetta di vetro di ampio diametro sulla superficie corticale per infondere il reporter virale del calcio AAV-GCaMP6 nella corteccia. Utilizzando questo metodo, le particelle virali, presumibilmente, in modo simile a questo caso, entrano negli strati superiori della neocorteccia, dove vengono catturate dai neuroni. Gli autori hanno scoperto che l'infusione di virus sulla superficie corticale ha etichettato in modo efficiente i neuroni negli strati superficiali, evitando i neuroni degli strati profondi47. Non è del tutto chiaro il motivo per cui il lavoro citato non abbia mostrato la trasduzione dei neuroni piramidali dello strato cinque, simile a quella che abbiamo osservato nel nostro studio.
La nostra ipotesi che in seguito alla somministrazione di subaracnoideo, il virus venga catturato dai dendriti dei neuroni ramificati negli strati sopragranulari ha una notevole debolezza. Oltre alle grandi piramidi dello strato cinque, i neuroni piramidali dello strato quattro48 e le cellule piramidali L6 che proiettano il claustro49 nella corteccia visiva del topo hanno dendriti che raggiungono lo strato uno. Pertanto, non è chiaro il motivo per cui queste cellule non vengono trasdotte con l'iniezione di virus subaracnoideo. Una possibile spiegazione è che solo quelle cellule i cui dendriti sono abbastanza spessi da trasportare la particella virale al corpo cellulare sono infette, cioè le piramidi L5. È stato dimostrato che nella corteccia visiva dei topi, i neuroni piramidali dello strato quattro inviano solo un dendrite sottile allo strato uno della neocorteccia48. Tuttavia, sono necessari ulteriori studi per determinare la causa del modello di infezione osservato dopo l'iniezione del virus subaracnoideo.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Il lavoro è stato svolto con il sostegno finanziario della Russian Science Foundation, sovvenzione 20-15-00398P.
Materiali
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
Riferimenti
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon