Method Article
Transduction généralisée des neurones néocorticaux de souris par injection sous-arachnoïdienne d’AAV2
Dans cet article
Résumé
Une nouvelle technique d’administration généralisée d’un virus adéno-associé qui utilise la perfusion de virus sous-arachnoïdien est décrite. Cette méthode assure non seulement une transduction généralisée des neurones néocorticaux de souris dans les couches superficielles, mais entraîne également une expression sélective du transgène dans les neurones pyramidaux de la couche cinq, même en utilisant un promoteur non sélectif.
Résumé
Les virus adéno-associés recombinants sont un outil flexible et puissant pour la délivrance et l’expression de divers gènes d’intérêt dans de nombreux domaines de la biologie expérimentale, en particulier en neurosciences. La méthode la plus populaire pour stimuler l’expression d’un transgène souhaité dans une zone cérébrale particulière consiste à injecter un vecteur AAV directement dans le parenchyme cérébral. Cependant, cette méthode ne permet pas la transduction neuronale généralisée qui est nécessaire pour certaines expériences in vivo . Dans cet article, nous présentons une nouvelle technique d’expression génique généralisée dans le néocortex de la souris basée sur l’infusion virale dans l’espace sous-arachnoïdien du cerveau. Cette méthode de marquage neuronal assure non seulement une transduction généralisée des neurones dans les couches néocorticales superficielles de souris adultes, mais entraîne également l’expression du transgène dans une grande population de neurones pyramidaux de couche cinq avec une spécificité élevée, même en utilisant un promoteur non sélectif fort tel que le CAG. De plus, comme la transduction cellulaire a lieu à une distance significative du site d’injection, cette méthode peut aider à préserver le tissu cérébral pour les enregistrements optiques ou électrophysiologiques ultérieurs de l’activité neuronale.
Introduction
Le cerveau des mammifères se compose de nombreuses cellules inhibitrices, excitatrices et modulatrices interconnectées en circuits par des milliards de synapses1. L’un des principaux défis des neurosciences est de décoder le rôle des différents types de cellules dans l’organisation et la fonction des circuits cérébraux et du comportement. La manipulation de cellules génétiquement définies dans le cerveau nécessite des méthodes pour introduire et exprimer des transgènes. Les systèmes d’administration de gènes basés sur des virus sont de loin la méthode la plus efficace et la plus simple pour l’administration de gènes dans le système nerveux central2. Les systèmes d’administration virale sont basés sur la réplication de virus (adénovirus, virus adéno-associés (AAV), lentivirus et rétrovirus) qui ont la capacité de délivrer des informations génétiques dans une cellule hôte 2,3.
Les vecteurs basés sur les AAV sont maintenant devenus l’un des outils les plus largement utilisés pour l’administration des transgènes souhaités aux cellules du cerveau, à la fois à des fins de recherche fondamentale en neurosciences et pour développer une thérapie génique pour les maladies neurologiques. Comparés à d’autres virus, les AAV défectueux possèdent de nombreuses caractéristiques qui en font des vecteurs idéaux à ces fins. Plus particulièrement, les vecteurs AAV transduisent efficacement les cellules non divisées (différenciées en phase terminale) telles que les neurones et les cellules gliales, ce qui entraîne des niveaux élevés d’expression du transgène in vivo2. Les vecteurs peuvent être facilement produits à un titre fonctionnel élevé adapté à une utilisation in vivo 3,4,5. Il est important de noter que l’administration de gènes adéno-associés par le virus in vivo ne produit pas d’altérations histopathologiques ni de toxicité liée aux vecteurs6. Contrairement aux vecteurs adénoviraux, l’administration in vivo de vecteurs AAV dans des modèles animaux ne provoque généralement pas de réponses immunitaires de l’hôte contre les cellules transduites, ce qui permet une expression stable du transgène dans le parenchyme cérébral pendant de longues périodes de temps 2,7,8.
Une autre raison de la popularité des vecteurs AAV est le large éventail de sérotypes AAV avec des tropismes tissulaires et cellulaires uniques 9,10,11,12,13,14. Des protéines de capside distinctes exprimées par différents sérotypes AAV entraînent l’utilisation de différents récepteurs de surface cellulaire pour l’entrée cellulaire et, par conséquent, des tropismes spécifiques10,14.
Le tropisme AAV est déterminé non seulement par les protéines de la capside, mais aussi par de nombreux autres facteurs14. Il a été démontré que les sérotypes AAV 1, 2, 6, 7, 8 et 9 transduisaient à la fois les neurones et les astrocytes en culture primaire15,16, mais présentaient un fort tropisme neuronal après injection intraparenchymateuse dans le cerveau17,18. La méthode utilisée pour la préparation des vecteurs AAV peut également influencer le tropisme des cellules nerveuses, même pour le même sérotype. Par exemple, l’AAV8 purifié par CsCl possédait un fort tropisme astroglial après injection intraparenchymateuse dans le cerveau, tandis que l’AAV8 purifié par l’iodixanol, injecté dans des conditions identiques, ne transduisait que les neurones19. Le tropisme AAV peut également être affecté par la dose injectée et le volume14. Par exemple, un titre élevé rAAV2/1 a efficacement transduit à la fois les neurones excitateurs et inhibiteurs corticaux, mais l’utilisation de titres plus faibles a révélé une forte préférence pour la transduction des neurones inhibiteurs corticaux20.
Ainsi, il n’est pas possible d’obtenir une spécificité de type cellulaire robuste basée uniquement sur le sérotype de la capside. Des promoteurs spécifiques au type cellulaire peuvent être utilisés pour surmonter le large tropisme naturel de la capside de l’AAV. Par exemple, la synapsine I humaine est utilisée pour cibler les neurones21, le promoteur CaMKII peut piloter l’expression du transgène dans les neurones excitateurs glutamatergiques à haute spécificité20, le promoteur ppHcrt cible les neurones exprimant l’hypocrétine (HCRT) dans l’hypothalamuslatéral 22, le promoteur PRSx8 cible les neurones noradrénergiques et adrénergiques qui expriment la dopamine bêta-hydroxylase23, et le promoteur GFAP peut piloter l’expression spécifique des astrocytes24. Cependant, certains promoteurs spécifiques des cellules ont une faible activité transcriptionnelle et ne peuvent pas entraîner des niveaux suffisants d’expression du transgène25. De plus, les promoteurs courts qui s’adaptent aux vecteurs viraux AAV ne conservent souvent pas la spécificité du type cellulaire 1,26. Par exemple, il a été démontré qu’une construction CaMKII transduisait également les neurones inhibiteurs12.
Outre la spécificité du type de cellule (tropisme), une autre caractéristique importante des AAV est l’efficacité de la transduction. Les différents sérotypes AAV ont des propriétés de diffusion différentes. L’AAV2 et quatre vecteurs viraux se diffusent moins facilement à travers le parenchyme cérébral et, par conséquent, médient la transduction sur une zone plus petite17,27. La transduction neuronale la plus répandue est observée avec les sérotypes AAV 1, 9 et rh.10 11,17,18,19,28.
La méthode la plus populaire pour stimuler l’expression d’un transgène souhaité dans une zone cérébrale particulière consiste à injecter le vecteur AAV directement dans la région cérébrale d’intérêt (parenchyme)3. Après une injection intra-parenchymateuse, même les sérotypes AAV avec une diffusion plus efficace à travers le cerveau ne transduisent généralement qu’une zone locale autour du site d’injection 12. De plus, l’injection intraparenchymateuse est une procédure invasive qui entraîne des lésions tissulaires adjacentes à la région d’intérêt. Ainsi, cette méthode d’injection de virus est inadaptée à certaines tâches expérimentales. Par exemple, un marquage approfondi des cellules est hautement souhaitable dans les expériences visant à étudier les fonctions des neurones corticaux chez les animaux en mouvement libre, y compris avec l’utilisation de la microscopie à un ou deux photons 29,30,31,32.
Ici, nous décrivons une nouvelle technique d’injection de virus adéno-associé qui utilise la perfusion de virus sous-arachnoïdien pour fournir une transduction généralisée des neurones néocorticaux chez les souris adultes et préserver le tissu cérébral pour les enregistrements optiques ou électrophysiologiques ultérieurs de l’activité neuronale. Cette méthode a non seulement assuré une transduction généralisée des neurones dans les couches néocorticales superficielles, mais a également entraîné l’expression du transgène dans une grande population de neurones pyramidaux de couche cinq avec une spécificité élevée, même en utilisant un promoteur non sélectif fort tel que le CAG.
Protocole
Les expériences ont été réalisées sur des souris adultes C57Black/6, âgées de 2 à 4 mois, des deux sexes (Centre d’élevage de Pushchino, branche de l’Institut de chimie bioorganique Shemyakin-Ovchinnikov de l’ASR). Les souris ont été logées dans un vivarium à température contrôlée (22 °C ± 2 °C, cycle lumière/obscurité de 12 h, lumières allumées à 08h00) avec de la nourriture et de l’eau à volonté. Toutes les procédures expérimentales ont été menées conformément aux directives ARRIVE et à la directive 2010/63/UE pour l’expérimentation animale. Le protocole d’étude a été approuvé par la Commission d’éthique de l’IHNA RAS (protocole N1 du 01.02.2022). Tous les efforts ont été déployés pour minimiser la souffrance animale et assurer la fiabilité des résultats.
1. Préparation à l’opération
- Stérilisez tous les instruments chirurgicaux avant le début de la chirurgie. Nettoyez la zone chirurgicale avec de l’éthanol à 70 %.
- Vérifiez le taux d’isoflurane dans le système d’anesthésie et remplissez-le si nécessaire. Placez une serviette en papier propre au fond de la chambre d’induction.
- Placez un coussin chauffant sur le cadre stéréotaxique. Couvrez le tampon avec une serviette en papier propre.
- Préparez une bouteille avec de l’eau de Javel à 2 % pour recueillir les pointes de micropipettes, les tubes, les cotons-tiges et autres articles qui entrent en contact avec le virus.
- Retirez une aliquote d’AAV du congélateur à -80 °C et placez-la sur de la glace pour la décongeler.
2. Préparation de la seringue
- Nettoyez une microseringue Hamilton de 5 μL avec une aiguille RN émoussée de 33 G. Aspirez puis distribuez 70 % d’éthanol. Répétez 3 fois avec de l’éthanol frais. Rincez la seringue à l’eau distillée pour éliminer l’excès d’éthanol. Répétez l’opération 3 fois.
- Sortez le piston et remplissez le baril d’huile de vaseline à travers la bride à l’aide d’une seringue à insuline. Assurez-vous qu’il n’y a pas de bulles d’air dans la microseringue.
REMARQUE : L’air emprisonné est compressible et affecte l’exactitude et la précision de la seringue. - Remettez le piston dans la microseringue et versez une goutte d’huile. Placez la seringue dans l’injecteur stéréotaxique de manière à ce que la balance soit visible pour surveiller le volume de solution distribué.
3. Préparation des souris à la chirurgie
- Pesez une souris. Placez la souris dans la chambre d’induction de l’anesthésie reliée à l’isoflurane. Allumez le vaporisateur d’isoflurane réglé à 5 % et réglez le débit à 250 mL/min. Une profondeur d’anesthésie adéquate est atteinte en 5 à 7 min.
- Pour vérifier le niveau chirurgical de l’anesthésie, vérifiez l’absence de fouet et de réflexe de retrait lors d’un pincement douloureux de la patte arrière, et l’absence de clignement des yeux au contact visuel.
- Basculez la soupape de sortie du vaporisateur de la chambre d’induction au masque stéréotaxique. Réduire l’isoflurane à 1,8 %-2,0 % et régler le débit en fonction du poids de la souris (70-90 mL/min pour les souris pesant entre 25 et 35 g).
- Retirez la souris de la chambre d’induction et placez-la dans l’appareil stéréotaxique sur un coussin chauffant (37 °C) pour éviter l’hypothermie pendant l’anesthésie chirurgicale. Placez les dents de devant dans la barre de dents, puis montez le masque animal.
- Positionnez soigneusement l’animal sur les barres d’oreille. La position correcte de la tête dans l’appareil stéréotaxique permet un mouvement vertical mais pas latéral de la tête. Assurez-vous que le positionnement de l’animal ne cause pas de détresse. Surveillez attentivement la profondeur de l’anesthésie, la respiration de l’animal et la température corporelle tout au long de l’opération.
- Rasez la tête des yeux jusqu’à l’arrière des oreilles. Nettoyez la surface rasée de la tête avec un tampon d’éthanol à 70 %, suivi d’un écouvillonnage avec une solution d’alcool à 5 % d’iode.
- Appliquez un gel ophtalmique pour éviter le dessèchement des yeux. Appliquer une solution topique de lidocaïne à 4 % et de la dexaméthasone (0,02 mL à 4 mg/mL) par voie sous-cutanée pour prévenir la douleur liée à la chirurgie et réduire la réponse inflammatoire possible.
- À l’aide d’une lame de scalpel stérile et de ciseaux, faites une incision de 4 à 5 mm de long le long de la ligne médiane de la tête pour ouvrir le cuir chevelu. Commencez par une petite incision entre les oreilles, puis élargissez-la à l’aide de ciseaux pour éviter d’endommager le crâne.
- Frottez la surface du crâne avec une petite quantité de peroxyde d’hydrogène à 3 % pour visualiser les repères stéréotaxiques : bregma et lambda. Arrêtez immédiatement la réaction avec une solution saline NaCl à 0,9 %. Grattez les tissus sur le dessus du crâne avec un grattoir à os.
- Montez l’injecteur motorisé pré-préparé avec la seringue Hamilton sur le bras stéréotaxique. Dirigez une source lumineuse chirurgicale sur le crâne exposé et focalisez le microscope sur le bregma.
- En regardant à travers le microscope, manipulez le bras de l’appareil stéréotaxique pour centrer le haut de l’aiguille directement sur le bregma.
- À l’aide de la pointe de l’aiguille, alignez le bregma et le lambda horizontalement, puis ramenez le bras vers le bregma et notez les coordonnées. Utilisez ces coordonnées bregma et les coordonnées de l’atlas de la région d’intérêt pour calculer les coordonnées relatives de la zone ciblée.
- Déplacez l’aiguille vers la zone ciblée. Abaissez l’aiguille aux nouvelles coordonnées et marquez cette position. Sélectionnez le site de micro-injection virale à proximité de la zone cible tout en tenant compte de la propagation du virus.
REMARQUE : Cela évitera d’endommager les tissus dans la région d’intérêt. Nous avons utilisé les coordonnées suivantes pour la région d’intérêt : AP-3.4, ML -2.0, et pour la micro-injection virale : AP-2.0, ML -1.4. Les coordonnées ci-dessus sont optimales si les neurones primaires du cortex visuel doivent être infectés. - Si possible, évitez les régions avec de gros vaisseaux sanguins. Sous un microscope chirurgical, un éclairage à lumière vive et froide et une immersion saline à 0,9 % de NaCl, de gros vaisseaux sanguins dans le crâne et à la surface du cerveau devraient devenir apparents.
4. Injection de virus
- Prenez une fraise dentaire stérile (0,5 à 0,8 mm de diamètre). En observant la surface du crâne à l’aide du microscope chirurgical, percez une petite craniotomie manuellement (à la main) ou à l’aide d’une micro-perceuse. Veillez à ne pas exercer une pression excessive sur le crâne.
- Écartez le bras pour éviter d’endommager l’aiguille de la microseringue lors du perçage de la craniotomie (trou). Appliquez une solution saline NaCl à 0,9 % et faites une pause par intermittence pour éviter de chauffer l’os et d’endommager la dure-mère. Utilisez de l’air sous pression pour souffler la poussière d’os.
REMARQUE : Les types suivants de fraises dentaires en carbure conviennent : en forme de poire (de préférence), cylindre arrondi et ronde.- Lorsque vous amincissez l’os avec la fraise, assurez-vous que l’amincissement est uniforme sur toute la circonférence. Cela facilitera l’ablation de l’os sans endommager la dure-mère. Pour ce faire, utilisez d’abord une fraise à pointe ronde, puis une fraise à pointe plate. Gardez la fraise perpendiculaire à l’os ; Sinon, un côté sera plus mince que l’autre.
REMARQUE : De plus, plus la taille de la fraise est petite et plus la craniotomie effectuée est petite, plus la manipulation sera complexe. Il est recommandé d’effectuer une craniotomie de plus petit diamètre (0,5-0,6 mm) lors de l’utilisation ultérieure de l’animal pour des travaux in vivo . Si vous prévoyez d’utiliser le cerveau de l’animal pour un travail ex vivo , un diamètre de craniotomie plus grand est acceptable pour simplifier la procédure.
- Lorsque vous amincissez l’os avec la fraise, assurez-vous que l’amincissement est uniforme sur toute la circonférence. Cela facilitera l’ablation de l’os sans endommager la dure-mère. Pour ce faire, utilisez d’abord une fraise à pointe ronde, puis une fraise à pointe plate. Gardez la fraise perpendiculaire à l’os ; Sinon, un côté sera plus mince que l’autre.
- Lorsque l’os aminci est mou et transparent, arrêtez de percer. Lorsqu’une indentation suffisamment grande se forme dans l’os, arrêtez fréquemment la rotation et surveillez l’épaisseur de l’os. L’apparition de fissures dans l’os indique qu’un amincissement est suffisant.
- Baignez le trou avec une solution saline stérile, puis retirez l’excédent de solution saline avec un coton-tige. Retirez la couche d’os restante à l’aide d’une aiguille de 27 G avec une pointe en forme de crochet et/ou à l’aide d’une pince à épiler à pointe fine. Évitez d’endommager la dure-mère.
- Couvrez la surface du crâne avec un morceau stérile d’essuie-tout imbibé de solution saline. Placez un morceau de film propre et transparent sur la surface du crâne de la souris au-dessus du papier.
- Déplacez le bras stéréotaxique vers l’arrière et positionnez l’aiguille de la microseringue en place directement au-dessus du film. Distribuez l’excès d’huile jusqu’à ce qu’un volume de 2 μL soit atteint.
REMARQUE : Le volume final de l’huile peut varier en fonction du volume de la micro-seringue. Nous avons utilisé une micro-seringue Hamilton de 5 μL 75-RN. - Pipeter un volume de virus égal au volume injecté + 2 μL sur un morceau de film transparent.
- En regardant à travers le microscope chirurgical, abaissez le bras jusqu’à ce que la pointe de l’aiguille soit au centre de la goutte du virus. Chargez le virus dans la microseringue à l’aide d’un injecteur motorisé. Jetez l’embout de la micropipette et le film transparent dans le flacon avec 2 % d’eau de Javel.
- Retirez le papier imbibé de solution saline de la surface du crâne et séchez le crâne avec un coton-tige. Utilisez le bras stéréotaxique pour positionner l’aiguille au-dessus du site d’insertion.
- Distribuez une goutte du virus pour vous assurer que l’aiguille n’est pas bouchée. Faites une petite fente dans la dure-mère à l’aide d’une aiguille de 30 G avec une pointe en forme de crochet.
REMARQUE : Il est important de faire la plus petite fente possible dans la dure-mère, permettant à l’aiguille d’entrer sans laisser d’espace entre l’aiguille et la dure-mère, d’où le virus pourrait s’échapper. - Abaissez l’aiguille de la seringue jusqu’à la dure-mère et faites les calculs de profondeur appropriés. Estimez la profondeur corticale de l’insertion par rapport au point où l’aiguille a touché pour la première fois la surface du cortex.
- Insérez lentement la pointe de l’aiguille dans le cortex jusqu’à une profondeur de 300 μm. Attendez 2-3 minutes pour permettre à la dure-mère d’adhérer à l’aiguille, puis rétractez lentement l’aiguille jusqu’à une profondeur de 200 μm. Attendez encore 2 à 3 minutes pour permettre au tissu cérébral de se stabiliser. L’aiguille tire la dure-mère vers le haut, créant ainsi un espace sous-dural propice à la propagation du virus.
REMARQUE : Pour minimiser les dommages corticaux, utilisez une aiguille de 33 G ou des aiguilles G inférieures. Gardez à l’esprit que plus le diamètre intérieur de l’embout est petit, plus le risque de refoulement des tissus l’obstrue est élevé. Il est important d’utiliser une aiguille émoussée au lieu d’une aiguille biseautée, car une aiguille émoussée expulse une goutte plus contrôlée de solution virale.- Si l’aiguille ne traverse pas la dure-mère lorsqu’elle est abaissée à 150-200 μm et qu’elle la plie au contraire, arrêtez de l’abaisser. Soulevez l’aiguille et faites une incision légèrement plus grande dans la dure-mère, puis essayez à nouveau d’abaisser l’aiguille.
- Si le liquide céphalo-rachidien commence à s’écouler activement de l’incision pendant que l’aiguille s’abaisse, attendez qu’il cesse de fuir ; Sinon, il est difficile de contrôler le passage de l’aiguille à travers la dure-mère. Épongez l’excès de liquide céphalo-rachidien avec une pointe de tissu. Une fois que le liquide cesse de couler, soulevez l’aiguille et réessayez.
- Commencer l’injection de la suspension virale à un débit de 0,06 μL/min tout en surveillant le volume distribué. Injecter 1 μL de virus. Injectez le virus à une seule profondeur afin de ne pas briser le sceau entre l’aiguille et le tissu du cortex.
- Dépannage : Au début de l’injection, un reflux du virus vers la surface du cerveau peut se produire. Arrêtez l’injection, attendez 2-3 min, puis continuez l’injection du virus. Répétez ces actions (étapes) jusqu’à ce que le reflux du virus s’arrête. Le virus et les fluides céphalorachidiens colleront à l’aiguille et empêcheront le reflux.
- Une autre façon d’arrêter le reflux du virus est de mettre une petite quantité d’agarose à la surface du cortex. Il supprimera la pulsation du cortex et aidera également à sceller l’aiguille. Mais assurez-vous que la pipette n’est pas obstruée par l’agarose.
- Étant donné que l’aiguille peut ne pas traverser complètement la dure-mère lorsqu’elle est abaissée, mais seulement partiellement, un côté de l’aiguille peut ne pas être bien ajusté contre la dure-mère, ce qui peut provoquer un reflux du virus. Dans ce cas, retirez lentement l’aiguille du tissu et essayez de l’abaisser à nouveau.
- Une fois la perfusion terminée, maintenez l’aiguille à l’endroit cible pendant 10 minutes supplémentaires. Cela permet au virus de se disperser loin du site d’injection. Rétractez lentement l’aiguille du cerveau pour empêcher le virus de revenir hors du conduit de l’aiguille.
- Une fois le retrait de l’aiguille terminé, vérifiez qu’elle n’est pas obstruée en distribuant une petite goutte de virus. Fermez l’incision cutanée à l’aide de sutures résorbables ou non résorbables 5-0.
5. Soins postopératoires
- Après avoir fermé l’incision, appliquez une pommade antibactérienne par voie topique. Injecter un mélange de solution saline (5 mL/kg) et de glucose à 5 % (5 mL/kg) par voie sous-cutanée pour prévenir la déshydratation et faciliter la récupération après l’anesthésie. Injecter du kétoprofène par voie intramusculaire (2,5 mg/kg) pour réduire la douleur.
- Placez l’animal dans une cage fraîche sur un coussin chauffant et surveillez-le jusqu’à ce qu’il se remette de l’anesthésie. Une fois que la souris est réactive, placez l’animal dans sa cage domestique.
6. Histologie
- Au plus tôt 21 jours après l’injection du virus, anesthésier profondément les souris avec de l’isoflurane comme décrit à l’étape 3.
- Faites une incision médiane (10 à 15 mm) le long de la région thoracique à l’aide de ciseaux étroits et exposez la cavité thoracique. Séparez soigneusement le diaphragme et ouvrez la poitrine à l’aide de ciseaux.
- Insérez une aiguille 22G 1 1/2 dans le ventricule gauche et faites une incision dans l’oreillette droite avec des ciseaux. Perfuser avec 50 mL de solution saline tamponnée au phosphate (PBS) pré-refroidie, suivie de 100 mL de formol tamponné à 10 % pré-refroidi.
- Extrayez soigneusement l’intégralité du cerveau de la souris. Pour ce faire, faites une incision sagittale le long du centre du cuir chevelu à l’aide de ciseaux. Ensuite, retirez l’os crânien morceau par morceau à l’aide d’une pince à os à pointes plates en commençant à l’intersection des sutures sagittale et lambdoïde et en allant vers l’avant jusqu’à l’os nasal. Lorsque le cerveau est exposé, coupez à travers les bulbes olfactifs, relâchez le cerveau avec une spatule incurvée et déposez-le dans un tube de 50 ml contenant 10 % de formol tamponné.
- Réparez le cerveau pendant la nuit. Montez le tissu cérébral sur une plate-forme métallique d’un Vibratome à l’aide d’un adhésif tissulaire. Coupez des sections frontales d’une épaisseur de 50 μm à l’aide de lames en acier au carbone.
7. Immunomarquage
- Jour 1
- Lavez les tranches de cerveau 3 fois pendant 5 minutes chacune avec 1 PBS contenant 0,3 % de Triton X-100 (PBS-T). Incuber les sections dans du PBS-T pendant 20 min à température ambiante (RT).
- Bloquez la liaison non spécifique pendant 1 h à l’aide d’un tampon de blocage composé de 5 % de sérum de chèvre normal (NGS) et de 0,3 % de Triton X-100 dans 1x PBS.
- Incuber les sections pendant la nuit à 4 °C avec des anticorps primaires contre la parvalbumine ou la calbindine dilués à 1:500 dans le tampon bloquant (5 % NGS et 0,3 % Triton X-100 dans 1x PBS).
- Jour 2
- Lavez les sections 3 fois pendant 10 min dans PBS-T. Incuber dans l’obscurité pendant 2 h à RT avec des anticorps secondaires (anticorps secondaires anti-Rabbit IgG (H+L) Cross Adsorbed Secondary Antibody, Alexa Fluor 546) dilués 1:500 dans le tampon de blocage (5 % NGS et 0,3 % Triton X-100 dans 1x PBS).
- Lavez les sections 3x pendant 5 min chacune dans 1x PBS. Transférez des tranches de cerveau sur des lames de verre à l’aide d’une brosse douce.
- Ajouter immédiatement 0,1 ml de produit de montage anti-évanouissement dans chaque section. Recouvrez les tranches d’une lamelle de 22 mm x 50 mm.
- Configurez le microscope confocal sur un grossissement de 20x ou 60x (A/1.4, huile). Utilisez des lasers de longueur d’onde de 488 nm et 594 nm pour acquérir des images multicanaux des régions cérébrales d’intérêt.
Résultats
Dans une série pilote d’expériences, nous avons utilisé la méthode d’injection intracorticale traditionnelle pour transduire la couche cinq neurones pyramidaux dans le néocortex de la souris par AAV2 portant le gène de la channelrhodopsine rapide (oChIEF) fusionné avec la protéine fluorescente EGFP sous le promoteur CaMKII. Conformément à la caractéristique de l’AAV212, nous avons obtenu une zone d’infection relativement petite, ne dépassant pas 1 mm de largeur (Figure 1A). Cependant, dans certaines expériences, nous avons observé une propagation inhabituellement importante de l’AAV2, couvrant dans certains cas le néocortex de plus de la moitié de l’hémisphère cérébral (Figure 1B). Nous avons émis l’hypothèse qu’une telle distribution généralisée du virus peut se produire lorsque le virus pénètre dans l’espace sous-arachnoïdien et que le flux de liquide céphalo-rachidien (LCR) propage le vecteur viral à la surface du cerveau. Nous avons noté que cela se produit lorsque la profondeur d’insertion de l’aiguille d’injection est faible (<200 μm) et que la taille du trou dans la dure-mère correspond exactement au diamètre de l’aiguille, empêchant ainsi la suspension des particules virales de refluer. Afin de visualiser ce processus, nous avons ajouté des nanoparticules fluorescentes rouges à la suspension injectée de particules virales (n = 3 souris). À 3 semaines après l’injection, les souris ont été perfusées par voie transcardiale avec du formol tamponné à 10 %, et les cerveaux ont été soigneusement retirés du crâne sans endommager la dure-mère. L’examen de cerveaux entiers au microscope binoculaire à épifluorescence a révélé une distribution étendue de particules fluorescentes rouges qui dépassaient légèrement la zone d’infection neuronale visible dans le canal de fluorescence vert (Figure 2). L’analyse des coupes sagittales du cerveau de ces souris a montré que les particules fluorescentes étaient situées en une fine couche le long de la pie-mère, sans pénétrer profondément dans le parenchyme cérébral, tandis que les neurones exprimant Vénus, comme dans les expériences précédentes, étaient trouvés en grand nombre dans les couches 2/3 et 5.
En plus du virus EGFP AAV2_CaMKII_oChIEF (utilisé à une concentration de 1,49 x 1012 vg/mL), nous avons également effectué l’administration sous-arachnoïdienne des virus AAV2_CaMKII_Venus (7,31 x 1012 vg/mL) et AAV2_CAG_GCamp6s (7,3 x 1013 vg/ml) et obtenu des résultats similaires. Ceci est important car, comme on l’a montré, les virus d’un même sérotype peuvent fournir des surfaces de transduction de tailles différentes selon le promoteur et le gène cible utilisés12.
Pour comparer systématiquement les zones de transduction après l’administration traditionnelle et sous-arachnoïdienne de virus, nous avons calculé la taille de la zone d’infection dans les directions médiolatérale et rostrocaudale dans des sections en série de 50 μm d’épaisseur du cerveau. Il a été constaté que l’administration sous-arachnoïdienne du virus entraînait une augmentation de près de quatre fois de la zone d’infection, par rapport à l’administration intraparenchymateuse (1,7 ± 0,52 mm (n = 15 souris) contre 0,46 ± 0,22 mm (n = 6 souris), p < 0,00001, test t dans le sens médiolatéral et 2,35 ± 0,8 mm (n = 14 souris) contre 0,84 ± 0,29 mm (n = 6 souris) p < 0,0003, test t dans la direction rostrocaudale ; Figure 3A).
L’observation microscopique de coupes de cerveau de souris transduites par injection de virus sous-arachnoïdien a révélé une transduction très répandue dans les couches 2/3 et 5, alors qu’il n’y avait pratiquement aucune cellule transduite dans les couches 4 et 6 (Figure 3B). Dans la couche 4, seules les dendrites fluorescentes des pyramides de la couche 5 étaient clairement visibles (figure 3B). Les axones fluorescents ont été tracés dans la couche 6 et la substance blanche (Figure 3C). Un tel schéma de transduction après l’injection sous-arachnoïdienne pourrait être dû à la diffusion du virus de l’espace sous-arachnoïdien dans la couche 1 du cortex (peut-être plus profondément), où les dendrites neuronales le capturent. Ainsi, seuls les neurones qui ont une ramification vigoureuse dans les couches supérieures sont infectés. Il est connu que les interneurones GABAergiques se ramifient principalement localement. Si notre hypothèse est correcte, alors l’administration sous-arachnoïdienne du virus devrait conduire à la transduction des interneurones dans les couches supragranulaires mais pas dans les couches subgranulaires. Pour tester l’hypothèse, nous avons effectué une coloration immunochimique de sections cérébrales de souris après injection sous-arachnoïdienne du virus AAV2_CaMKII_Venus avec des anticorps contre des marqueurs de deux classes fonctionnelles différentes d’interneurones GABAergiques : la parvalbumine et la calbindine.
Pour déterminer le nombre d’interneurones transduits par injection sous-arachnoïdienne du virus, nous avons effectué une analyse morphométrique en comptant le nombre total de cellules transduites (coloration verte), le nombre de neurones immunopositifs (coloration rouge) et le nombre de cellules doublement marquées sur une section de 750 x 750 m (épaisseur de section de 50 m).
Sur des tranches de cerveau colorées avec des anticorps contre la parvalbumine, dans les couches supragranulaires, le nombre de neurones avec un marquage vert était en moyenne de 57,4 ± 9,8, les interneurones positifs à la parvalbumine avec un marquage rouge de 9,6 ± 3,8, dont 4,1 ± 2,4 (42,7 %) étaient doublement marqués (n = 10 préparations). En revanche, nous avons compté 14 ± 4,8 neurones transduits par le virus et 19,1 ± 4,5 neurones positifs à la parvalbumine dans la couche 5 du néocortex et n’avons détecté aucune cellule doublement marquée (n = 10 préparations).
Lorsque nous avons examiné des coupes immunochimiquement colorées pour la calbindine, nous avons constaté que dans les couches supragranulaires, il y avait en moyenne 21,1 ± 4,5 neurones transduits viralement et 6,1 ± 2,6 cellules positives à la calbindine, dont 4,2 ± 1,9 cellules portaient les deux marqueurs (69,1 % ; n = 10 préparations). Dans la couche 5, nous avons compté 19 ± 2,1 neurones transduits, 15,9 ± 5,7 interneurones calbindines, dont 1,1 ± 1,5 (6,9 %) ont montré une double coloration. Cependant, il convient de noter que 100 % des neurones doublement marqués dans la couche 5 avaient une forme pyramidale clairement visible, ce qui peut indiquer la présence de neurones pyramidaux positifs à la calbindine ou une certaine non-spécificité des anticorps. Ainsi, aucun véritable interneurone de calbindine transduit par injection sous-arachnoïdienne du virus n’a été observé dans la couche 5.
Par conséquent, alors que des cellules positives à la parvalbumine et à la calbindine étaient effectivement présentes parmi les neurones transduits dans la couche 2/3 (Figure 4A, C), aucun interneurone transduit n’a été détecté dans la couche 5, et toutes les cellules exprimant l’EGFP ont été identifiées visuellement comme des neurones pyramidaux (Figure 4B, D).

Figure 1 : Comparaison de l’aire de transduction de l’AAV2 après des injections virales intracorticales et sous-arachnoïdiennes conventionnelles. (A) La propagation des constructions de CaMKII_oChieff_EGFP 21 jours après l’injection dans le parenchyme cérébral à une profondeur de 500 à 600 μm. (B) La propagation de CaMKII_oChieff_EGFP dans l’autre hémisphère du même animal après administration sous-arachnoïdienne. Des coupes frontales à une distance de 200-300 μm dans la direction rostrocaudale à partir du site d’injection sont montrées. Barre d’échelle - 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 2 : Photographie d’un cerveau entier avec de la dure-mère intacte montrant la propagation des virus AAV2_CaMKII_Venus et des FluoSphères rouges injectées par voie sous-arachnoïdale. (A) Fluorescence de nanoparticules rouges qui ont été ajoutées à la suspension virale injectée, montrant la propagation physique du volume injecté dans l’espace sous-arachnoïdien. (B) Le même hémisphère cérébral dans le canal de fluorescence vert montre la zone d’expression de Vénus. Le site d’injection est indiqué par des flèches. De plus, l’emplacement de la lambda est marqué. Barre d’échelle - 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3 : L’injection sous-arachnoïdienne du virus entraîne une infection généralisée des neurones des couches 2/3 et 5 du néocortex. (A) Comparaison des zones de transduction (dans les directions médiolatérale (m/l) et rostrocaudale (r/c)) après injection intracorticale (i) et sous-arachnoïdienne (s). Les barres représentent la moyenne ; Les moustaches désignent l’écart-type (**** - P < 0,0001 ; *** - P < 0,001 ; test t). (B) Micrographie confocale montrant l’expression de Vénus dans le néocortex de la souris après injection sous-arachnoïdienne de virus AAV2_CaMKII_Venus. Les limites des couches sont affichées schématiquement (L1 - L6). (C) Un fragment d’image (B), montré avec différents paramètres de luminosité et de contraste pour montrer les axones fluorescents se déplaçant à travers la couche 6 et la substance blanche (WM). La barre d’échelle est de 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
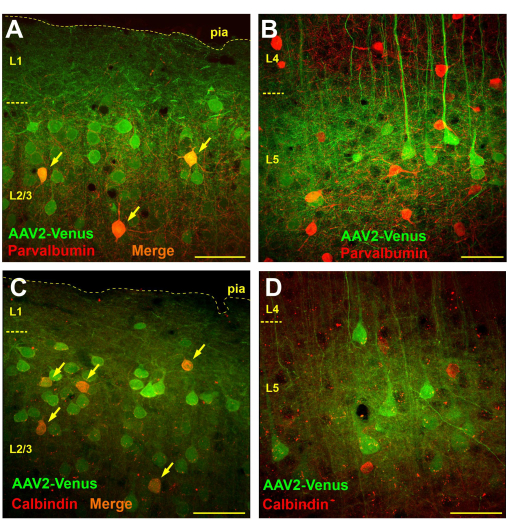
Figure 4 : L’injection du virus sous-arachnoïdien entraîne la transduction des interneurones dans les couches supra-granulaires du néocortex, mais pas dans les couches sous-granulaires. (A, B) Coloration immunochimique de sections cérébrales d’une souris transduite par injection sous-arachnoïdienne du virus AAV2_CaMKII_Venus avec des anticorps contre la parvalbumine (anticorps secondaires conjugués à Alexa594). Les neurones portant des étiquettes vertes et rouges apparaissent en orange (indiqués par des flèches). (C, D) Micrographies d’une section du cerveau d’une souris après injection sous-arachnoïdienne de AAV2_CaMKII_Venus colorée avec des anticorps contre la calbindine. Notez l’absence de neurones doublement marqués dans L5. La barre d’échelle est de 50 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Nous avons mis au point une nouvelle méthode pour transduire les neurones néocorticaux de souris en injectant une suspension de particules virales AAV2 dans l’espace sous-arachnoïdien du cerveau. Cela permet une distribution généralisée du virus, presque quatre fois supérieure au volume tissulaire infecté lorsque la même quantité de virus est injectée directement dans le parenchyme cérébral.
L’injection de vecteurs viraux directement dans le liquide céphalo-rachidien (LCR) par différentes voies (p. ex., intraventriculaire, intrathécale ou intracisternale) est une stratégie populaire pour l’administration généralisée de gènes dans tout le SNC 33,34,35. Cependant, l’administration intra-ventriculaire ou intrathécale de vecteurs AAV2 dans le cerveau adulte entraîne une transduction cérébrale limitée en raison de leur grande affinité pour les cellules épendymaires 28,33,36,37. Les cellules épendymaires se trouvent sous la forme d’une monocouche qui tapisse les troisième et quatrième ventricules et le canal central de la moelle épinière38. La présence de jonctions serrées entre les cellules épendymaires du ventricule constitue une barrière importante pour certains sérotypes AAV, qui doivent passer à travers ces cellules du ventricule pour avoir une propagation intraparenchymateuse39.
Dans nos travaux, l’injection du vecteur viral AAV2 dans l’espace sous-arachnoïdien à travers la surface du cerveau a entraîné une transduction généralisée des neurones néocorticaux chez des souris adultes. Il existe des preuves que la matière pia a des structures différentes dans différentes zones du SNC. La membrane de la pia mater spinale (qui entoure la moelle épinière) est beaucoup plus épaisse que celle de la pia mater crânienne (qui entoure le cerveau) en raison de la nature bicouche de la membrane de la pia40. Il a également été démontré que le LCR ventriculaire pénètre peu dans le parenchyme cérébral, tandis que le LCR sous-arachnoïdien pénètre rapidement dans le parenchyme cérébral le long des espaces paravasculaires41. Il est donc probable que différentes voies d’administration du vecteur viral dans le LCR puissent donner des résultats différents.
Il est à noter que les injections intra-LCR de certains variants de l’AAV sont associées à certains effets secondaires. Il a été démontré que l’administration intrathécale ou intracérébroventriculaire d’AAV9 entraîne l’expression génique non seulement dans le SNC, mais aussi dans les organes périphériques42,43. Pour une transduction plus efficace des neurones dans tout le cerveau, des doses élevées de vecteurs sont nécessaires. Par exemple, des rats Sprague-Dawley adultes ont reçu une injection unilatérale d’AAV9 dans le ventricule latéral en trois doses : 3,1 μL, 15,5 μL et 77,5 μL42. Les souris ont reçu AAV9 dans un volume total de 10 μL dans la citernemagna 43. L’avantage de notre méthode d’injection virale est que nous avons utilisé un volume de vecteur plus faible (1 μL) que ceux utilisés pour l’administration intrathécale ou intra-rébroventriculaire de l’AAV. Un volume plus faible du virus diminue considérablement le risque d’expression virale en dehors du cerveau et la toxicité.
Bien que nous n’ayons pas examiné les expressions virales à l’extérieur du cerveau, il est fort probable que l’administration sous-arachnoïdienne d’AAV2 à travers la surface du cerveau ait entraîné une expression virale exclusivement dans le cerveau (en particulier dans le néocortex). Notre hypothèse est basée sur les raisons suivantes. AAV9 est un virus adéno-associé recombinant qui peut traverser la barrière hémato-encéphalique (BHE) et est couramment utilisé pour la transduction globale du SNC37,44. Cependant, la pénétration de la BHE et la transduction du tissu cérébral sont limitées avec AAV245. De plus, l’analyse de coupes de cerveau de souris après injection sous-arachnoïdienne du virus a montré que les cellules transduites étaient exclusivement situées dans le néocortex de l’hémisphère ipsilatéral (injecté). Aucune cellule transduite n’a été trouvée dans le néocortex controlatéral ou d’autres structures cérébrales, ce qui suggère que la transduction des organes périphériques par cette méthode d’injection est très improbable.
En plus d’une grande zone d’infection, la méthode d’injection du virus sous-arachnoïdien permet la transduction sélective des neurones pyramidaux de la couche cinq, même avec l’utilisation de promoteurs non sélectifs forts tels que le CAG. Il est bien connu qu’il est assez difficile d’assurer une expression sélective même avec des promoteurs spécifiques 1,26. Par exemple, le promoteur CaMKII que nous avons utilisé devrait théoriquement infecter préférentiellement les neurones glutamatergiques. Cependant, comme le montrent les résultats ici et d’autres études, lorsqu’il est utilisé, la transduction d’autres types de cellules se produit également, en particulier les interneurones GABAergiques46. De plus, comme avec les injections sous-arachnoïdiennes, la transduction cellulaire a lieu à une distance significative du site d’injection, cette méthode permet de préserver le tissu cérébral pour les enregistrements optiques ou électrophysiologiques ultérieurs de l’activité neuronale. Nous avons utilisé avec succès des injections de virus sous-arachnoïdien dans des expériences de stimulation optogénétique et d’enregistrement extracellulaire de l’activité des neurones pyramidaux L5 du cortex visuel de souris in vivo32.
Ce travail est un dérivé de notre étude à grande échelle sur les mécanismes de plasticité dans le cortex visuel, dans laquelle nous avons utilisé AAV2 pour exprimer le canal rhodopsine dans les neurones pyramidaux du cortex visuel de souris32. Avec ce sérotype, nous avons obtenu beaucoup de statistiques et, en fait, nous avons développé la méthode d’injection sous-arachnoïdienne. Dans des expériences pilotes, nous avons également essayé l’injection sous-arachnoïdienne du virus avec le sérotype 2/9 et avons obtenu des résultats similaires, bien que nous n’ayons pas effectué d’analyse morphométrique détaillée dans ce cas. Malheureusement, il est impossible de prédire comment les autres sérotypes se comporteront après l’administration sous-arachnoïdienne et quel sérotype viral fournira la plus grande zone de transduction ; Cela ne peut être déterminé qu’empiriquement, ce qui nécessite un travail considérable. Dans ce travail, nous avons montré de manière convaincante que AAV2 peut être injecté dans l’espace sous-arachnoïdien du cerveau de la souris adulte, entraînant une transduction généralisée avec expression sélective du gène cible dans les neurones pyramidaux de la cinquième couche du néocortex et une expression non sélective dans les couches supragranulaires.
L’étape la plus critique dans l’utilisation de cette méthode d’injection du virus sous-arachnoïdien est d’assurer la taille optimale du trou dans la matière dure, qui doit correspondre exactement au diamètre de l’aiguille d’injection. La dure-mère doit entourer étroitement l’aiguille et, par conséquent, empêcher le reflux du virus pendant l’injection. Nous avons appelé cette méthode l’injection sous-arachnoïdienne, mais il n’est pas clair si, en plus de l’espace sous-arachnoïdien, le virus pénètre et se propage également dans l’espace sous-dural (l’espace entre l’arachnoïde et la dure-mère). Il n’est pas clair non plus si cette méthode fonctionnerait chez d’autres animaux, en particulier chez les rats, ou avec d’autres sérotypes d’AAV.
Auparavant, Xinjian Li et ses collègues ont décrit une méthode de transduction neuronale basée sur la perfusion virale à la surface corticale. Ils ont utilisé une pipette en verre de grand diamètre à la surface corticale pour infuser le rapporteur viral de calcium AAV-GCaMP6 dans le cortex. En utilisant cette méthode, les particules virales, vraisemblablement, de la même manière que dans ce cas, pénètrent dans les couches supérieures du néocortex, où elles sont capturées par les neurones. Les auteurs ont constaté que la perfusion de virus à la surface corticale marquait efficacement les neurones dans les couches superficielles tout en évitant les neurones des couches profondes47. Il n’est pas tout à fait clair pourquoi les travaux cités n’ont pas montré la transduction des neurones pyramidaux de la couche cinq, similaire à ce que nous avons observé dans notre étude.
Notre hypothèse selon laquelle, après l’administration sous-arachnoïdienne, le virus est capturé par les dendrites des neurones se ramifiant dans les couches supragranulaires présente une faiblesse notable. En plus des grandes pyramides de la couche cinq, les neurones pyramidaux de la couche quatre48 et les cellules pyramidales L6 projetant du claustrum49 dans le cortex visuel de la souris ont des dendrites qui atteignent la couche un. Par conséquent, il n’est pas clair pourquoi ces cellules ne sont pas transduites par injection de virus sous-arachnoïdien. Une explication possible est que seules les cellules dont les dendrites sont suffisamment épaisses pour transporter la particule virale vers le corps cellulaire sont infectées - c’est-à-dire les pyramides L5. Il a été démontré que dans le cortex visuel de la souris, les neurones pyramidaux de la couche quatre n’envoient qu’une seule dendrite fine à la première couche du néocortex48. Cependant, d’autres études sont nécessaires pour déterminer la cause du profil d’infection observé après l’injection du virus sous-arachnoïdien.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les travaux ont été réalisés avec le soutien financier de la Fondation russe pour la science, subvention 20-15-00398P.
matériels
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
Références
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon