Method Article
Transducción generalizada de neuronas neocorticales de ratón mediante inyección subaracnoidea de AAV2
En este artículo
Resumen
Se describe una nueva técnica para la administración generalizada de virus adenoasociados que utiliza la infusión de virus subaracnoideos. Este método no solo asegura la transducción generalizada de las neuronas neocorticales de ratón en las capas superficiales, sino que también da lugar a la expresión selectiva del transgén en las neuronas piramidales de la capa cinco, incluso cuando se utiliza un promotor no selectivo.
Resumen
Los virus adenoasociados recombinantes son una herramienta flexible y potente para la administración y expresión de varios genes de interés en muchas áreas de la biología experimental, particularmente en neurociencia. El método más popular para impulsar la expresión de un transgén deseado en un área particular del cerebro es inyectar un vector AAV directamente en el parénquima cerebral. Sin embargo, este método no permite la transducción neuronal generalizada que se requiere para algunos experimentos in vivo . En este artículo, presentamos una nueva técnica para la expresión génica generalizada en el neocórtex de ratón basada en la infusión viral en el espacio subaracnoideo del cerebro. Este método de marcaje neuronal no solo garantiza la transducción generalizada de neuronas en las capas neocorticales superficiales de ratones adultos, sino que también da lugar a la expresión del transgén en una gran población de neuronas piramidales de la capa cinco con alta especificidad, incluso cuando se utiliza un promotor fuerte y no selectivo como el CAG. Además, debido a que la transducción celular tiene lugar a una distancia significativa del lugar de la inyección, este método puede ayudar a preservar el tejido cerebral para posteriores registros ópticos o electrofisiológicos de la actividad neuronal.
Introducción
El cerebro de los mamíferos está formado por muchas células inhibidoras, excitadoras y moduladoras interconectadas en circuitos por billones de sinapsis. Uno de los desafíos centrales de la neurociencia es decodificar el papel de los distintos tipos de células en la organización y función de los circuitos cerebrales y el comportamiento. La manipulación de células genéticamente definidas dentro del cerebro requiere métodos para introducir y expresar transgenes. Los sistemas de administración de genes basados en virus son, con mucho, el método más eficaz y sencillo para la entrega de genes en el sistema nervioso central2. Los sistemas de administración viral se basan en la replicación de virus (adenovirus, virus adenoasociados (AAV), lentivirus y retrovirus) que tienen la capacidad de entregar información genética a una célula huésped 2,3.
Los vectores basados en AAV se han convertido en una de las herramientas más utilizadas para la entrega de transgenes deseados a las células dentro del cerebro, tanto para fines de investigación neurocientífica básica como para desarrollar terapia génica para enfermedades neurológicas. Cuando se comparan con otros virus, los AAV con replicación defectuosa poseen muchas características que los convierten en vectores ideales para estos fines. En particular, los vectores AAV transducen de manera eficiente las células no divisorias (terminalmente diferenciadas), como las neuronas y las células gliales, lo que resulta en altos niveles de expresión de transgenes in vivo2. Los vectores se pueden producir fácilmente a un alto título funcional adecuado para uso in vivo 3,4,5. Es importante destacar que la entrega in vivo de genes mediados por virus adenoasociados no produce alteraciones histopatológicas ni toxicidad relacionada con vectores6. A diferencia de los vectores adenovirales, la administración in vivo de vectores AAV en modelos animales generalmente no provoca respuestas inmunes del huésped contra las células transducidas, lo que permite una expresión estable del transgén dentro del parénquima cerebral durante largos períodos de tiempo 2,7,8.
Otra razón de la popularidad de los vectores AAV es la amplia gama de serotipos de AAV con tropismos únicos de tejido y tipo celular 9,10,11,12,13,14. Las distintas proteínas de la cápside expresadas por diferentes serotipos de AAV dan lugar al uso de diferentes receptores de superficie celular para la entrada celular y, por lo tanto, a tropismos específicos10,14.
El tropismo de AAV está determinado no solo por las proteínas de la cápside, sino por muchos otros factores14. Se ha demostrado que los serotipos 1, 2, 6, 7, 8 y 9 de AAV transducieron tanto neuronas como astrocitos en cultivo primario15,16, pero exhibieron un fuerte tropismo neuronal después de la inyección cerebral intraparenquimatosa17,18. El método utilizado para la preparación del vector AAV también puede influir en el tropismo de las células nerviosas, incluso para el mismo serotipo. Por ejemplo, el AAV8 purificado con CsCl poseía un fuerte tropismo astroglial después de la inyección cerebral intraparenquimatosa, mientras que el AAV8 purificado con yodixanol, inyectado en condiciones idénticas, transducía solo neuronas19. El tropismo de AAV también puede verse afectado por la dosis inyectada y el volumen14. Por ejemplo, el título alto de rAAV2/1 transdució eficientemente tanto las neuronas excitadoras corticales como las inhibidoras, pero el uso de títulos más bajos expuso una fuerte preferencia por la transducción de las neuronas inhibidoras corticales20.
Por lo tanto, no es posible lograr una especificidad robusta del tipo de célula basándose únicamente en el serotipo de la cápside. Los promotores específicos del tipo de célula se pueden utilizar para superar el amplio tropismo natural de la cápside del AAV. Por ejemplo, la sinapsina I humana se utiliza para dirigirse a las neuronas21, el promotor CaMKII puede impulsar la expresión transgénica en las neuronas excitadoras glutamatérgicas con alta especificidad20, el promotor ppHcrt se dirige a las neuronas que expresan hipocretina (HCRT) en el hipotálamo lateral22, el promotor PRSx8 se dirige a las neuronas noradrenenérgicas y adrenérgicas que expresan dopamina beta-hidroxilasa23, y el promotor GFAP puede impulsar la expresión específica de astrocitos24. Sin embargo, algunos promotores específicos de células tienen una actividad transcripcional débil y no pueden impulsar niveles suficientes de expresión transgénica25. Además, los promotores cortos que caben en los vectores virales AAV a menudo no conservan la especificidad del tipo celular 1,26. Por ejemplo, se ha demostrado que un constructo de CaMKII también transducía neuronas inhibidoras12.
Además de la especificidad del tipo de célula (tropismo), otra característica importante de los AAV es la eficiencia de la transducción. Los distintos serotipos de AAV tienen diferentes propiedades de difusión. AAV2 y cuatro vectores virales se difunden menos fácilmente a través del parénquima cerebral y, por lo tanto, median la transducción en un área más pequeña17,27. La transducción neuronal más extendida se observa con los serotipos 1, 9 y rh.10 11,17,18,19,28.
El método más popular para impulsar la expresión de un transgén deseado en un área particular del cerebro es inyectar el vector AAV directamente en la región cerebral de interés (parénquima)3. Después de la inyección intraparenquimatosa, incluso los serotipos de AAV con una difusión más efectiva a través del cerebro transducen típicamente solo un área local alrededor del sitio de inyección 12. Además, la inyección intraparenquimatosa es un procedimiento invasivo y provoca daño tisular adyacente a la región de interés. Por lo tanto, este método de inyección de virus no es adecuado para algunas tareas experimentales. Por ejemplo, el marcaje extensivo de las células es muy deseable en experimentos destinados a estudiar las funciones de las neuronas corticales en animales que se mueven libremente, incluso con el uso de microscopía de uno o dos fotones 29,30,31,32.
Aquí, describimos una nueva técnica de inyección de virus adenoasociados que utiliza la infusión de virus subaracnoideo para proporcionar una transducción generalizada de neuronas neocorticales en ratones adultos y preservar el tejido cerebral para registros ópticos o electrofisiológicos posteriores de la actividad neuronal. Este método no solo garantizó la transducción generalizada de neuronas en las capas neocorticales superficiales, sino que dio lugar a la expresión del transgén en una gran población de neuronas piramidales de la capa cinco con alta especificidad, incluso cuando se utilizó un promotor fuerte y no selectivo como el CAG.
Protocolo
Los experimentos se realizaron en ratones adultos C57Black/6, de 2 a 4 meses de edad, de ambos sexos (Centro de Cría de Pushchino, Sucursal del Instituto de Química Bioorgánica Shemyakin-Ovchinnikov de la RAS). Los ratones se alojaron en un vivero a temperatura controlada (22 °C ± 2 °C, ciclo de luz/oscuridad de 12 h, luces encendidas a las 08.00 h) con comida y agua ad libitum. Todos los procedimientos experimentales se llevaron a cabo de acuerdo con las directrices ARRIVE y la Directiva 2010/63/UE para experimentos con animales. El protocolo del estudio fue aprobado por el Comité de Ética de la IHNA RAS (protocolo N1 del 01.02.2022). Se hizo todo lo posible para minimizar el sufrimiento de los animales y garantizar la fiabilidad de los resultados.
1. Preparación para la cirugía
- Esterilice todos los instrumentos quirúrgicos antes del inicio de la cirugía. Limpie el área quirúrgica con etanol al 70%.
- Verifique el nivel de isoflurano en el sistema de anestesia y llénelo si es necesario. Coloque una toalla de papel limpia en el fondo de la cámara de inducción.
- Coloque una almohadilla térmica en el marco estereotáxico. Cubra la almohadilla con una toalla de papel limpia.
- Prepare un frasco con lejía al 2% para recoger puntas de micropipetas, tubos, bastoncillos de algodón y otros artículos que entren en contacto con el virus.
- Retire una alícuota de AAV del congelador a -80 °C y colóquela sobre hielo para descongelar.
2. Preparación de la jeringa
- Limpie una microjeringa Hamilton de 5 μL con una aguja RN roma de 33 G. Aspire y luego dispense etanol al 70%. Repita 3 veces con etanol fresco. Enjuague la jeringa con agua destilada para eliminar el exceso de etanol. Repita 3 veces.
- Saque el émbolo y llene el barril con aceite de vaselina a través de la brida con una jeringa de insulina. Asegúrese de que no haya burbujas de aire en la microjeringa.
NOTA: El aire atrapado es compresible y afecta la exactitud y precisión de la jeringa. - Vuelva a colocar el émbolo en la microjeringa y dispense una gota de aceite. Coloque la jeringa en el inyector estereotáxico de modo que la escala sea visible para controlar el volumen de solución dispensada.
3. Preparación de ratones para cirugía
- Pesa un ratón. Coloque el ratón en la cámara de inducción de anestesia conectada al isoflurano. Encienda el vaporizador de isoflurano al 5% y ajuste el caudal a 250 mL/min. Una profundidad adecuada de la anestesia se logra en 5 a 7 min.
- Para verificar el nivel quirúrgico de anestesia, verifique la ausencia de reflejos de batido y retirada durante un pellizco doloroso de la pata trasera, y la ausencia de parpadeo al contacto visual.
- Cambie la válvula de salida del vaporizador de la cámara de inducción a la máscara estereotáxica. Reduzca el isoflurano a 1,8%-2,0% y ajuste el caudal de acuerdo con el peso del ratón (70-90 mL/min para ratones que pesan entre 25 y 35 g).
- Retire el ratón de la cámara de inducción y colóquelo en el aparato estereotáctico encima de una almohadilla térmica (37 °C) para evitar la hipotermia durante la anestesia quirúrgica. Coloque los dientes frontales en la barra de dientes y luego monte la máscara del animal.
- Coloque con cuidado al animal en las barras de las orejas. La posición correcta de la cabeza en el aparato estereotáxico permite el movimiento vertical pero no lateral de la cabeza. Asegúrese de que la posición del animal no cause angustia. Controle cuidadosamente la profundidad de la anestesia, la respiración de los animales y la temperatura corporal durante toda la operación.
- Afeita la cabeza desde los ojos hasta detrás de las orejas. Limpie la superficie afeitada de la cabeza con un hisopo con etanol al 70%, seguido de un hisopo con una solución de alcohol al 5% de yodo.
- Aplicar gel oftálmico para evitar la sequedad de los ojos. Aplique solución de lidocaína al 4% por vía tópica y dexametasona (0,02 mL a 4 mg/mL) por vía subcutánea para prevenir el dolor relacionado con la cirugía y reducir la posible respuesta inflamatoria.
- Con una hoja de bisturí estéril y unas tijeras, haga una incisión de 4-5 mm de largo a lo largo de la línea media de la cabeza para abrir el cuero cabelludo. Comience con una pequeña incisión entre las orejas y luego expándala con unas tijeras para evitar daños en el cráneo.
- Frote la superficie del cráneo con una pequeña cantidad de peróxido de hidrógeno al 3% para visualizar los puntos de referencia estereotáxicos: bregma y lambda. Detenga la reacción con solución salina de NaCl al 0,9% inmediatamente. Raspe los tejidos de la parte superior del cráneo con un raspador de huesos.
- Monte el inyector motorizado preparado previamente con la jeringa Hamilton en el brazo estereotáxico. Dirija una fuente de luz quirúrgica sobre el cráneo expuesto y enfoque el microscopio en el frotma.
- Mirando a través del microscopio, manipule el brazo del aparato estereotáctico para centrar la parte superior de la aguja directamente sobre el bregma.
- Con la punta de la aguja, alinee el bregma y la lambda horizontalmente y luego mueva el brazo de nuevo al bregma y registre las coordenadas. Utilice estas coordenadas bregma y las coordenadas del atlas de la región de interés para calcular las coordenadas relativas del área objetivo.
- Mueva la aguja al área objetivo. Baje la aguja en las nuevas coordenadas y marque esta posición. Seleccione el sitio para la microinyección viral muy cerca del área objetivo mientras se considera la propagación del virus.
NOTA: Esto evitará dañar el tejido en la región de interés. Se utilizaron las siguientes coordenadas para la región de interés: AP-3.4, ML -2.0, y para la microinyección viral: AP-2.0, ML -1.4. Las coordenadas anteriores son óptimas si se van a infectar las neuronas primarias de la corteza visual. - Si es posible, evite las regiones con vasos sanguíneos grandes. Bajo un microscopio quirúrgico, iluminación con luz fría y brillante, e inmersión salina de NaCl al 0,9%, los vasos sanguíneos grandes en el cráneo y en la superficie del cerebro deben hacerse evidentes.
4. Inyección de virus
- Tome una fresa dental estéril (de 0,5 a 0,8 mm de diámetro). Al observar la superficie del cráneo a través del microscopio quirúrgico, perfore una pequeña craneotomía manualmente (a mano) o con un microtaladro. Tenga cuidado de no ejercer una presión excesiva sobre el cráneo.
- Mueva el brazo para evitar daños en la aguja de la microjeringa durante la perforación de la craneotomía (orificio). Aplique una inmersión salina de NaCl al 0,9% y haga una pausa intermitente para evitar calentar el hueso y dañar la duramadre. Use aire presurizado para soplar el polvo de los huesos.
NOTA: Los siguientes tipos de fresas dentales de carburo son adecuados: en forma de pera (preferiblemente), cilíndricas redondeadas y redondas.- Al adelgazar el hueso con la fresa, asegúrese de que el adelgazamiento sea uniforme en toda la circunferencia. Esto hará que sea más fácil extraer el hueso sin dañar la duramadre. Para hacer esto, use una fresa con una punta redonda inicialmente y luego una fresa con una punta plana. Mantenga la fresa perpendicular al hueso; de lo contrario, un lado será más delgado que el otro.
NOTA: Además, cuanto menor sea el tamaño de la fresa y menor sea la craneotomía realizada, más compleja será la manipulación. Se recomienda realizar una craneotomía de menor diámetro (0,5-0,6 mm) cuando se utilice posteriormente el animal para el trabajo in vivo . Si planea utilizar el cerebro del animal para el trabajo ex vivo , es aceptable un diámetro de craneotomía mayor para simplificar el procedimiento.
- Al adelgazar el hueso con la fresa, asegúrese de que el adelgazamiento sea uniforme en toda la circunferencia. Esto hará que sea más fácil extraer el hueso sin dañar la duramadre. Para hacer esto, use una fresa con una punta redonda inicialmente y luego una fresa con una punta plana. Mantenga la fresa perpendicular al hueso; de lo contrario, un lado será más delgado que el otro.
- Cuando el hueso adelgazado esté blando y transparente, deje de perforar. Cuando se forma una hendidura suficientemente grande en el hueso, detenga con frecuencia la rotación y controle el grosor del hueso. La aparición de grietas en el hueso indica que el adelgazamiento es suficiente.
- Bañe el orificio con solución salina estéril y luego retire el exceso de solución salina con un hisopo de algodón. Retire la capa restante de hueso con una aguja de 27 g con punta en forma de gancho y/o con pinzas de punta fina. Evite dañar la duramadre.
- Cubra la superficie del cráneo con un pedazo estéril de toalla de papel humedecida con solución salina. Coloque un pedazo de película limpia y transparente sobre la superficie del cráneo del ratón sobre el papel.
- Mueva el brazo estereotáxico hacia atrás y coloque la aguja de la microjeringa en su lugar directamente encima de la película. Dispense el exceso de aceite hasta alcanzar un volumen de 2 μL.
NOTA: El volumen final del aceite puede variar según el volumen de la micro jeringa. Utilizamos una microjeringa Hamilton 75-RN de 5 μL. - Pipetear un volumen de virus igual al volumen inyectado + 2 μL sobre un trozo de película transparente.
- Mirando a través del microscopio quirúrgico, baje el brazo hasta que la punta de la aguja esté en el centro de la gota del virus. Cargue el virus en la microjeringa con un inyector motorizado. Deseche la punta de la micropipeta y la película transparente en el frasco con lejía al 2%.
- Retire el papel humedecido con solución salina de la superficie del cráneo y seque el cráneo con un hisopo de algodón. Utilice el brazo estereotáxico para colocar la aguja por encima del sitio de inserción.
- Dispense una gota del virus para asegurarse de que la aguja no esté obstruida. Haz una pequeña hendidura en la duramadre con una aguja de 30 g con punta en forma de gancho.
NOTA: Es importante hacer la menor hendidura posible en la duramadre, permitiendo que la aguja entre sin dejar un espacio entre la aguja y la duramadre, por el cual podría filtrarse el virus. - Baje la aguja de la jeringa hasta la duramadre y haga los cálculos adecuados para la profundidad. Calcule la profundidad cortical de la inserción en relación con el punto en el que la aguja tocó por primera vez la superficie de la corteza.
- Inserte lentamente la punta de la aguja en la corteza hasta una profundidad de 300 μm. Espere 2-3 minutos para permitir que la duramadre se adhiera a la aguja y, a continuación, retraiga lentamente la aguja hasta una profundidad de 200 μm. Espere otros 2-3 minutos para permitir que el tejido cerebral se asiente. Esto hace que la aguja tire de la duramadre hacia arriba, creando un espacio subdural para que el virus se propague.
NOTA: Para minimizar el daño cortical, utilice una aguja de 33 G o agujas de G inferior. Tenga en cuenta que cuanto menor sea el diámetro interior de la punta, mayor será la posibilidad de que el reflujo de tejido la obstruya. Es importante usar una aguja roma en lugar de biselada porque una aguja roma expulsa una gota más controlada de solución viral.- Si la aguja no pasa a través de la duramadre cuando se baja a 150-200 μm y, en cambio, la dobla, deje de bajar. Levante la aguja y haga una incisión un poco más grande en la duramadre, luego intente bajar la aguja nuevamente.
- Si el líquido cefalorraquídeo comienza a gotear activamente de la incisión mientras se baja la aguja, espere hasta que deje de gotear; De lo contrario, es difícil controlar el paso de la aguja a través de la duramadre. Seque el exceso de líquido cefalorraquídeo con una punta de tejido. Una vez que el líquido deje de fluir, levante la aguja y vuelva a intentarlo.
- Comience a inyectar la suspensión viral a una velocidad de 0,06 μL/min mientras controla el volumen dispensado. Inyecte 1 μL de virus. Inyecte el virus a una sola profundidad para no romper el sello entre la aguja y el tejido de la corteza.
- Solución de problemas: Al comienzo de la inyección, puede producirse un reflujo del virus a la superficie del cerebro. Deje de inyectar, espere 2-3 minutos y luego continúe con la inyección del virus. Repita estas acciones (pasos) hasta que se detenga el reflujo del virus. El virus y los líquidos cefalorraquídeos se adherirán a la aguja y evitarán el reflujo.
- Otra forma de detener el reflujo del virus, poner una pequeña cantidad de agarosa en la superficie de la corteza. Suprimirá la pulsación de la corteza y también ayudará a sellar la aguja. Pero asegúrese de que la pipeta no esté obstruida por la agarosa.
- Dado que es posible que la aguja no pase completamente a través de la duramadre cuando se baja, sino solo parcialmente, es posible que un lado de la aguja no encaje firmemente contra la duramadre, lo que puede causar reflujo del virus. En este caso, retire lentamente la aguja del pañuelo e intente bajarla de nuevo.
- Una vez completada la infusión, mantenga la aguja en el lugar objetivo durante 10 minutos más. Esto permite que el virus se disperse lejos del lugar de la inyección. Retraiga la aguja fuera del cerebro lentamente para evitar que el virus vuelva a salir del tracto de la aguja.
- Una vez completada la extracción de la aguja, compruebe que no esté obstruida dispensando una pequeña gota de virus. Cierre la incisión cutánea con suturas 5-0 reabsorbibles o no absorbibles.
5. Cuidados postoperatorios
- Después de cerrar la incisión, aplique un ungüento antibacteriano por vía tópica. Inyectar una mezcla de solución salina (5 mL/kg) y glucosa al 5% (5 mL/kg) por vía subcutánea para prevenir la deshidratación y facilitar la recuperación después de la anestesia. Inyectar ketoprofeno por vía intramuscular (2,5 mg/kg) para reducir el dolor.
- Coloque al animal en una jaula fresca encima de una almohadilla térmica y vigile hasta que se recupere de la anestesia. Después de que el ratón esté reactivo, coloque al animal en su jaula de casa.
6. Histología
- No antes de 21 días después de la inyección del virus, anestesiar profundamente a los ratones con isoflurano como se describe en el paso 3.
- Realice una incisión en la línea media (10 -15 mm) a lo largo de la región torácica con unas tijeras estrechas y exponga la cavidad torácica. Separe con cuidado el diafragma y abra el cofre con unas tijeras.
- Inserte una aguja 22G 1 1/2 en el ventrículo izquierdo y haga una incisión en la aurícula derecha con unas tijeras. Perfundir con 50 mL de solución salina tamponada (PBS) de fosfato (PBS) preenfriada de 100 m, seguida de 100 mL de formalina tamponada al 10% preenfriada.
- Extrae con cuidado todo el cerebro del ratón. Para ello, haz una incisión sagital a lo largo del centro del cuero cabelludo con unas tijeras. A continuación, retire el hueso craneal pieza por pieza con unos alicates para huesos con puntas planas que comiencen en la intersección de las suturas sagital y lambdoidea y avancen hasta el hueso nasal. Cuando el cerebro esté expuesto, corte a través de los bulbos olfativos, extraiga el cerebro con una espátula curva y colóquelo en un tubo de 50 ml que contenga un 10% de formalina tamponada.
- Arregla el cerebro de la noche a la mañana. Monte el tejido cerebral en una plataforma metálica de un vibratomo usando adhesivo para tejidos. Corte secciones frontales con un grosor de 50 μm con cuchillas de acero al carbono.
7. Inmunotinción
- Día 1
- Lave las rodajas de cerebro 3 veces durante 5 minutos cada una con 1x PBS que contenga 0.3% de Triton X-100 (PBS-T). Incubar las secciones en PBS-T durante 20 min a temperatura ambiente (RT).
- Bloquee la unión inespecífica durante 1 h en RT utilizando un tampón de bloqueo compuesto por un 5% de suero de cabra normal (NGS) y un 0,3% de Triton X-100 en 1x PBS.
- Incubar las secciones durante la noche a 4 °C con anticuerpos primarios contra parvalbúmina o calbindina diluidos 1:500 en el tampón de bloqueo (5% NGS y 0,3% Triton X-100 en 1x PBS).
- Día 2
- Lave las secciones 3 veces durante 10 minutos en PBS-T. Incubar en la oscuridad durante 2 h en RT con anticuerpos secundarios (anticuerpo secundario de adsorción cruzada Goat anti-Rabbit IgG (H+L), Alexa Fluor 546) diluidos 1:500 en el tampón de bloqueo (5% NGS y 0,3% Triton X-100 en 1x PBS).
- Lave las secciones 3 veces durante 5 minutos cada una en 1x PBS. Transfiera los trozos de cerebro a portaobjetos de vidrio con un cepillo suave.
- Agregue inmediatamente 0.1 mL de medio de montaje antidecoloración a cada sección. Cubra las rodajas con un cubreobjetos de 22 mm x 50 mm.
- Configure el microscopio confocal con un aumento de 20x o 60x (A/1,4, aceite). Utilice láseres de longitud de onda de 488 nm y 594 nm para adquirir imágenes multicanal de las regiones cerebrales de interés.
Resultados
En una serie piloto de experimentos, utilizamos el método tradicional de inyección intracortical para transducir neuronas piramidales de la capa cinco en el neocórtex del ratón por AAV2 que transporta el gen de la canalrodopsina rápida (oChIEF) fusionado con la proteína fluorescente EGFP bajo el promotor CaMKII. En consonancia con el rasgo característico de AAV212, obtuvimos un área de infección relativamente pequeña, que no superaba 1 mm de ancho (Figura 1A). Sin embargo, en algunos experimentos, observamos una propagación inusualmente grande de AAV2, en algunos casos cubriendo el neocórtex de más de la mitad del hemisferio cerebral (Figura 1B). Planteamos la hipótesis de que tal distribución generalizada del virus puede ocurrir cuando el virus ingresa al espacio subaracnoideo y el flujo de líquido cefalorraquídeo (LCR) propaga el vector viral a través de la superficie cerebral. Observamos que esto sucede cuando la profundidad de inserción de la aguja de inyección es pequeña (<200 μm) y el tamaño del orificio en la duramadre coincide exactamente con el diámetro de la aguja, evitando la suspensión de partículas virales por reflujo. Con el fin de visualizar este proceso, añadimos nanopartículas fluorescentes rojas a la suspensión inyectada de partículas virales (n = 3 ratones). A las 3 semanas después de la inyección, los ratones se perfundieron transcárdicamente con formalina tamponada al 10%, y los cerebros se extrajeron cuidadosamente del cráneo sin dañar la duramadre. El examen de cerebros enteros bajo un microscopio binocular de epifluorescencia reveló la amplia distribución de partículas fluorescentes rojas que excedían ligeramente el área de infección neuronal visible en el canal de fluorescencia verde (Figura 2). El análisis de las secciones sagitales de los cerebros de estos ratones mostró que las partículas fluorescentes estaban ubicadas en una capa delgada a lo largo de la piamadre, sin penetrar profundamente en el parénquima cerebral, mientras que las neuronas que expresan Venus, como en experimentos anteriores, se encontraron en grandes cantidades en las capas 2/3 y 5.
Además del virus EGFP AAV2_CaMKII_oChIEF (utilizado a una concentración de 1,49 x 1012 vg/mL), también realizamos la administración subaracnoidea de los virus AAV2_CaMKII_Venus (7,31 x10 12 vg/mL) y AAV2_CAG_GCamp6s (7,3 x 1013 vg/ml) y obtuvimos resultados similares. Esto es importante porque, como se ha demostrado, los virus del mismo serotipo pueden proporcionar diferentes tamaños de área de transducción dependiendo del promotor y del gen diana utilizado12.
Para comparar sistemáticamente las áreas de transducción después de la administración tradicional y subaracnoidea de virus, calculamos el tamaño del área de infección en las direcciones mediolateral y rostrocaudal en secciones seriadas de 50 μm de espesor de cerebros. Se encontró que la administración subaracnoidea del virus condujo a un aumento de casi cuatro veces en el área de infección, en comparación con la administración intraparenquimatosa (1,7 ± 0,52 mm (n = 15 ratones) versus 0,46 ± 0,22 mm (n = 6 ratones), p < 0,00001, prueba t en la dirección mediolateral y 2,35 ± 0,8 mm (n = 14 ratones) frente a 0,84 ± 0,29 mm (n = 6 ratones) p < 0,0003, prueba t en la dirección rostrocaudal; Figura 3A).
La observación microscópica de cortes de cerebro de ratones transducidos por inyección de virus subaracnoideo reveló una transducción muy generalizada en las capas 2/3 y 5, mientras que prácticamente no había células transducidas en las capas 4 y 6 (Figura 3B). En la capa 4, solo las dendritas fluorescentes de las pirámides de la capa 5 eran claramente visibles (Figura 3B). Se trazaron axones fluorescentes en la capa 6 y en la sustancia blanca (Figura 3C). Tal patrón de transducción después de la inyección subaracnoidea podría deberse a la difusión del virus desde el espacio subaracnoideo a la capa 1 de la corteza (tal vez más profunda), donde las dendritas neuronales lo capturan. Por lo tanto, solo se infectan las neuronas que tienen una ramificación vigorosa en las capas superiores. Se sabe que las interneuronas GABAérgicas se ramifican predominantemente localmente. Si nuestra hipótesis es correcta, entonces la administración subaracnoidea del virus debería conducir a la transducción de interneuronas en las capas supragranulares, pero no en las capas subgranulares. Para probar la hipótesis, realizamos una tinción inmunoquímica de secciones cerebrales de ratones después de la inyección subaracnoidea del virus AAV2_CaMKII_Venus con anticuerpos contra marcadores de dos clases funcionales diferentes de interneuronas GABAérgicas: parvalbúmina y calbindina.
Para determinar el número de interneuronas transducidas por inyección subaracnoidea del virus, realizamos un análisis morfométrico contando el número total de células transducidas (tinción verde), el número de neuronas inmunopositivas (tinción roja) y el número de células doblemente marcadas en una sección de 750 x 750 μm (espesor de sección de 50 μm).
En los cortes de cerebro teñidos con anticuerpos contra la parvalbúmina, en las capas supragranulares, el número de neuronas con marcado verde promedió 57,4 ± 9,8, las interneuronas positivas para parvalbúmina con marcado rojo 9,6 ± 3,8, de las cuales 4,1 ± 2,4 (42,7%) fueron marcadas dos veces (n = 10 preparaciones). Por el contrario, contamos 14 ± 4,8 neuronas transducidas por el virus y 19,1 ± 4,5 neuronas parvalbúmina positivas en la capa 5 del neocórtex y no detectamos ninguna célula doble marcada (n = 10 preparaciones).
Cuando examinamos secciones inmunoquímicamente teñidas para calbindina, encontramos que en las capas supragranulares, había un promedio de 21,1 ± 4,5 neuronas transducidas viralmente y 6,1 ± 2,6 células positivas para calbindina, de las cuales 4,2 ± 1,9 células llevaban ambas etiquetas (69,1%; n = 10 preparaciones). En la capa 5 se contaron 19 ± 2,1 neuronas transducidas, 15,9 ± 5,7 interneuronas de calbindina, de las cuales 1,1 ± 1,5 (6,9%) mostraron doble tinción. Sin embargo, debe tenerse en cuenta que el 100% de las neuronas doblemente marcadas en la capa 5 tenían una forma piramidal claramente visible, lo que puede indicar la presencia de neuronas piramidales positivas para calbindina o alguna no especificidad de los anticuerpos. Por lo tanto, no se observaron verdaderas interneuronas de calbindina transducidas por inyección subaracnoidea del virus en la capa 5.
Por lo tanto, mientras que las células positivas para parvalbúmina y calbindina estaban presentes entre las neuronas transducidas en la capa 2/3 (Figura 4A, C), no se detectaron interneuronas transducidas en la capa 5, y todas las células que expresan EGFP se identificaron visualmente como neuronas piramidales (Figura 4B, D).

Figura 1: Comparación del área de transducción de AAV2 después de inyecciones virales intracorticales y subaracnoideas convencionales. (A) La propagación de CaMKII_oChieff_EGFP construye 21 días después de la inyección en el parénquima cerebral a una profundidad de 500 a 600 μm. (B) La propagación de CaMKII_oChieff_EGFP en el otro hemisferio del mismo animal después de la administración subaracnoidea. Se muestran secciones frontales a una distancia de 200-300 μm en la dirección rostrocaudal desde el lugar de la inyección. Barra de escala - 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Fotografía de un cerebro completo con duramadre intacta que muestra la propagación de AAV2_CaMKII_Venus virus y FluoSpheres rojas inyectadas por vía subaracnoidea. (A) Fluorescencia de las nanopartículas rojas que se agregaron a la suspensión del virus inyectado, mostrando la propagación física del volumen inyectado en el espacio subaracnoideo. (B) El mismo hemisferio cerebral en el canal de fluorescencia verde muestra el área de expresión de Venus. El lugar de inyección se indica con flechas. Además, se marca la ubicación de la lambda. Barra de escala - 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: La inyección subaracnoidea del virus da lugar a una infección generalizada de las neuronas de las capas 2/3 y 5 del neocórtex. (A) Comparación de las áreas de transducción (en las direcciones mediolateral (m/l) y rostrocaudal (r/c)) después de la inyección intracortical (i) y subaracnoidea (s) del virus. Las barras representan la media; Los bigotes denotan la desviación estándar (**** - p < 0,0001; *** - p < 0,001; prueba t). (B) Micrografía confocal que muestra la expresión de Venus en el neocórtex del ratón después de la inyección subaracnoidea de AAV2_CaMKII_Venus virus. Los límites de las capas se muestran esquemáticamente (L1 - L6). (C) Un fragmento de la imagen (B), mostrado con diferentes ajustes de brillo y contraste para demostrar los axones fluorescentes que viajan a través de la capa 6 y la materia blanca (WM). La barra de escala es de 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
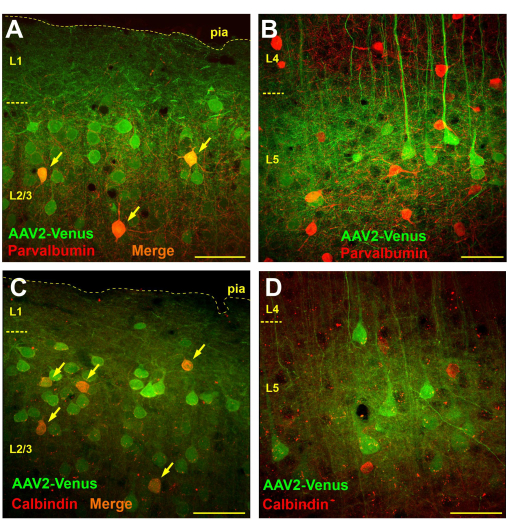
Figura 4: La inyección del virus subaracnoideo da lugar a la transducción de interneuronas en las capas supragranulares, pero no en las subgranulares del neocórtex. (A, B) Tinción inmunoquímica de secciones cerebrales de un ratón transducidas por inyección subaracnoidea del virus AAV2_CaMKII_Venus con anticuerpos contra la parvalbúmina (anticuerpos secundarios conjugados con Alexa594). Las neuronas que llevan etiquetas verdes y rojas aparecen en naranja (indicadas por flechas). (C, D) Micrografías de una sección del cerebro de un ratón después de la inyección subaracnoidea de AAV2_CaMKII_Venus teñido con anticuerpos contra la calbindina. Nótese la ausencia de neuronas doblemente marcadas en L5. La barra de escala es de 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hemos desarrollado un nuevo método para transducir neuronas neocorticales de ratón mediante la inyección de una suspensión de partículas virales AAV2 en el espacio subaracnoideo del cerebro. Esto proporciona una distribución generalizada del virus, casi cuatro veces mayor que el volumen de tejido infectado cuando se inyecta la misma cantidad de virus directamente en el parénquima cerebral.
La inyección de vectores virales directamente en el líquido cefalorraquídeo (LCR) a través de diferentes rutas (por ejemplo, intracerebroventricular, intratecal o intracisternal) es una estrategia popular para la administración generalizada de genes en todo el SNC 33,34,35. Sin embargo, la administración intracerebroventricular o intratecal de vectores AAV2 en el cerebro adulto resulta en una transducción cerebral limitada debido a su alta afinidad por las células ependimarias 28,33,36,37. Las células ependimarias se encuentran como una monocapa que recubre el tercer y cuarto ventrículo y el canal central de la médula espinal38. La presencia de uniones estrechas entre las células ependimarias en el ventrículo es una barrera importante para algunos serotipos de AAV, que deben pasar a través de estas células desde el ventrículo para tener diseminación intraparenquimatosa39.
En nuestro trabajo, la inyección del vector viral AAV2 en el espacio subaracnoideo a través de la superficie del cerebro resultó en una transducción generalizada de neuronas neocorticales en ratones adultos. Existe evidencia de que la materia pia tiene diferentes estructuras en diferentes áreas del SNC. La membrana de la piamadre espinal (que rodea la médula espinal) es mucho más gruesa que la piamadre craneal (que rodea el cerebro) debido a la naturaleza de dos capas de la membrana pia. También se ha demostrado que el LCR ventricular ingresa mínimamente al parénquima cerebral, mientras que el LCR subaracnoideo ingresa rápidamente al parénquima cerebral a lo largo de los espacios paravasculares41. Por lo tanto, es probable que las diferentes rutas de administración del vector viral en el LCR puedan dar resultados diferentes.
Cabe señalar que las inyecciones intra-LCR de algunas variantes de AAV se asocian con ciertos efectos secundarios. Se ha demostrado que la administración intratecal o intracerebroventricular de AAV9 produce expresión génica no solo en el SNC, sino también en los órganos periféricos42,43. Para una transducción más eficiente de las neuronas a todo el cerebro, se requieren altas dosis vectoriales. Por ejemplo, ratas Sprague-Dawley adultas recibieron una inyección unilateral de AAV9 en el ventrículo lateral en tres dosis: 3,1 μL, 15,5 μL y 77,5 μL42. Los ratones recibieron AAV9 en un volumen total de 10 μL en la cisterna magna43. El beneficio de nuestro método de inyección de virus es que utilizamos un volumen de vector más bajo (1 μL) que los utilizados para la administración intratecal o intracerebroventricular de AAV. Un volumen más bajo del virus disminuye significativamente el riesgo de expresión viral fuera del cerebro y también de toxicidad.
Aunque no examinamos las expresiones virales fuera del cerebro, es muy probable que la administración subaracnoidea de AAV2 a través de la superficie cerebral resultara en la expresión viral exclusivamente en el cerebro (específicamente en el neocórtex). Nuestra suposición se basa en las siguientes razones. El AAV9 es un virus adenoasociado recombinante que puede atravesar la barrera hematoencefálica (BHE) y se utiliza habitualmente para la transducción global del SNC37,44. Sin embargo, la penetración de la BHE y la transducción del tejido cerebral están limitadas con AAV245. Además, el análisis de cortes de cerebro de ratón después de la inyección subaracnoidea del virus mostró que las células transducidas se localizaban exclusivamente en el neocórtex del hemisferio ipsilateral (inyectado). No se encontraron células transducidas en el neocórtex contralateral u otras estructuras cerebrales, lo que sugiere que la transducción de órganos periféricos por este método de inyección es muy poco probable.
Además de una gran área de infección, el método de inyección de virus subaracnoideo permite la transducción selectiva de neuronas piramidales de la capa cinco, incluso con el uso de promotores no selectivos fuertes como CAG. Es bien sabido que asegurar la expresión selectiva incluso con promotores específicos es bastante difícil 1,26. Por ejemplo, el promotor de CaMKII que utilizamos debería, en teoría, infectar preferentemente a las neuronas glutamatérgicas. Sin embargo, como se muestra en los resultados aquí y en otros estudios, cuando se utiliza, también se produce la transducción de otros tipos de células, en particular, las interneuronas GABAérgicas46. Además, debido a que con las inyecciones subaracnoideas, la transducción celular tiene lugar a una distancia significativa del lugar de la inyección, este método ayuda a preservar el tejido cerebral para registros ópticos o electrofisiológicos posteriores de la actividad neuronal. Hemos utilizado con éxito inyecciones de virus subaracnoideos en experimentos con estimulación optogenética y registro extracelular de la actividad de las neuronas piramidales L5 de la corteza visual del ratón in vivo32.
Este trabajo es una derivación de nuestro estudio a gran escala sobre los mecanismos de plasticidad en la corteza visual, en el que utilizamos AAV2 para expresar el canal rodopsina en las neuronas piramidales de la corteza visual del ratón32. Con este serotipo, obtuvimos muchas estadísticas y, de hecho, desarrollamos el método de inyección subaracnoidea. En experimentos piloto, también probamos la inyección subaracnoidea del virus con el serotipo 2/9 y obtuvimos resultados similares, aunque no realizamos un análisis morfométrico detallado en este caso. Desafortunadamente, es imposible predecir cómo se comportarán otros serotipos después de la administración de subaracnoideos y qué serotipo del virus proporcionará la mayor área de transducción; Esto solo se puede determinar empíricamente, lo que requiere una cantidad considerable de trabajo. En este trabajo, hemos demostrado de manera convincente que AAV2 se puede inyectar en el espacio subaracnoideo del cerebro de ratón adulto, lo que resulta en una transducción generalizada con expresión selectiva del gen objetivo en las neuronas piramidales de la capa cinco del neocórtex y expresión no selectiva en capas supragranulares.
El paso más crítico en el uso de este método de inyección de virus subaracnoideos es garantizar el tamaño óptimo del orificio en la duramadre, que debe coincidir exactamente con el diámetro de la aguja de inyección. La duramadre debe rodear firmemente la aguja y, por lo tanto, evitar el reflujo del virus durante la inyección. Hemos llamado a este método inyección subaracnoidea, pero no está claro si, además del espacio subaracnoideo, el virus también entra y se propaga en el espacio subdural (el espacio entre la aracnoidea y la duramadre). Tampoco está claro si este método funcionaría en otros animales, particularmente en ratas, o con otros serotipos de AAV.
Anteriormente, Xinjian Li y sus colegas describieron un método de transducción neuronal basado en la infusión viral en la superficie cortical. Utilizaron una pipeta de vidrio de gran diámetro en la superficie cortical para infundir el reportero de calcio viral AAV-GCaMP6 en la corteza. Con este método, las partículas virales, presumiblemente, de manera similar a este caso, ingresan a las capas superiores del neocórtex, donde son capturadas por las neuronas. Los autores encontraron que la infusión de virus de superficie cortical etiquetó eficientemente las neuronas en las capas superficiales, mientras que evitó las neuronas de la capa profunda. No está del todo claro por qué el trabajo citado no mostró la transducción de neuronas piramidales de la capa cinco, similar a lo que observamos en nuestro estudio.
Nuestra hipótesis de que después de la administración subaracnoidea, el virus es capturado por las dendritas de las neuronas que se ramifican en las capas supragranulares tiene una debilidad notable. Además de las grandes pirámides de la capa cinco, las neuronas piramidales de la capa cuatro48 y las células piramidales L6 que proyectan claustro49 en la corteza visual del ratón tienen dendritas que alcanzan la capa uno. Por lo tanto, no está claro por qué estas células no se transducen con la inyección del virus subaracnoideo. Una posible explicación es que solo aquellas células cuyas dendritas son lo suficientemente gruesas como para transportar la partícula viral al cuerpo celular están infectadas, es decir, pirámides L5. Se ha demostrado que en la corteza visual de ratones, las neuronas piramidales de la capa cuatro envían solo una dendrita delgada a la capa uno del neocórtex48. Sin embargo, se necesitan más estudios para determinar la causa del patrón de infección observado después de la inyección del virus subaracnoideo.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
El trabajo se llevó a cabo con el apoyo financiero de la Fundación Rusa para la Ciencia, subvención 20-15-00398P.
Materiales
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 10 µL Gastight Syringe Model 1701 RN (5 uL 75 RN Hamilton microsyringe) | Hamilton Company | Part/REF # 7634-01, Hamilton or cat no. HAM7634-01, Merck | |
| 33 G RN needle, point style 3 | Hamilton Company | Part/REF # 7803-05, Hamilton | |
| Binocular Microscope | Nikon or Micromed | Model MC-4 ZOOM | |
| Cerna-based laser scanning confocal microscope | ThorLabs | ||
| Cold light source | RWD | Model 76312 | |
| Leica VT1000 S Vibrating blade microtome | Leica Biosystems | 76001-014 | |
| Low-Flow Anesthesia System with starter kit | Kent Scientific Corporation | 13-005-111 (Model SomnoSuite) | |
| Mechanical Pipette 0.1 – 2.5 µL Eppendorf Research plus | Eppendorf | 3123000012 | |
| Mechanical Pipette 10 – 100 µL Eppendorf Research plus | Eppendorf | 3123000047 | |
| Mice Shaver | RWD | Model CP-5200 | |
| Microdrill with drill bits (0.5 mm, round) | RWD | 78001, 78040 | |
| or Desctop Digital Stereotaxic Instrument, Mouse anesthesia Mask, Mouse ear bars (60 Deg) | RWD | Models 68027, 68665, 68306 | |
| Pressurized air | KUDO | ||
| Single Channel Manual Pipette 0.5-10 µL | RAINN | 17008649 | |
| Small Animal Stereotaxic Instrument | KOPF | Model 962 | |
| Stereotaxic Injector | Stoelting | 10-000-004 | |
| Surgical Instruments (Tools) | |||
| 30 G dental needle (Ni-pro) | Biodent Co. Ltd. | To slit the dura | |
| Bone scraper | Fine Science Tools | 10075-16 | |
| Dental bur | DRENDEL + ZWEILING | For craniotomy; Shape: pear shaped/round end cylinder/round; Tip Diameter: 0.55-0.8 mm diameter | |
| Needle holder (Halsey Micro Needle Holder) | Fine Science Tools | 12500-12 | |
| Polypropylene Surgical Suture or Surgical Suture Vicryl (5-0, absorbable) | Walter Products (Ethicon) | S139044 (W9442) | |
| Scalpel handle (#3) with scalpel blades (#11) | Fine Science Tools | 10003-12, 10011-00 | |
| Scissors (Extra Narrow Scissors) | Fine Science Tools | 14088-10 | to cut the skin |
| Scissors (Fine Scissors) | Fine Science Tools | 14094-11 | to cut suture |
| Surgical suture PROLENE (Polyproptlene) | Ethicon (Johnson & Johnson) | ||
| Tweezers (Forceps #5) | Fine Science Tools | 11252-20 | |
| Tweezers (Polished Inox Forceps) | Fine Science Tools | 11210-20 | |
| Disposables | |||
| 1 mL insulin syringe | SITEKMED | To load vaseline oil into a microsyringe, to administer drugs | |
| Cell Culture Plate | SPL Life Science | ||
| Cotton swabs | |||
| Cover Glasses | Fisher Scientific | 12-545E | |
| Insulin syringe needle (27 G) | SITEKMED | To remove debries from a hole (craniotomy) | |
| Lint-free wipes CLEANWIPER | NetLink | ||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Paper towels | Luscan | ||
| Parafilm | StatLab | STLPM996 | |
| Sterile Surgical Gloves | Dermagrip | ||
| Drugs/Chemicals (Reagents) | |||
| 10% buffered formalin or 4% paraformaldehyde | Thermo Scientific Chemicals | J61899.AK | |
| Alcohol solution of iodine (5%)) | Renewal | ||
| Antibiotic ointment Baneocin (bacitracin + neomycin) | Sandoz | Antibacterial agent for external use | |
| Aqua Polymount | Poly-sciences | 18606-20 | |
| Carbomer Eye Gel Vidisic (Ophthalmic gel) | BAUSCH+LOMB (Santen) | ||
| Carboxylate-Modified FluoSphere Microspheres (red) | Thermo Fisher Scientific | F-8801 | |
| Dexamethasone (4 mg/mL) | Ellara (KRKA) | Synthetic glucocorticoid | |
| Distilled H2O | |||
| Ethanol (70%) | |||
| Flexoprofen 2.5% (Ketoprofen) | VIC | Nonsteroidal Anti-Inflammatory Drugs (NSAIDs) | |
| Glucose solution 5% | Solopharm | ||
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed, Alexa Fluor 546 | Thermo Fisher Scientific | A-11010 | |
| Isoflurane | Karizoo | ||
| lidocaine solution (2 % / 4%) | Solopharm | ||
| Normal Goat Serum (NGS) | Abcam | ab7481 | |
| Phosphate Buffered Saline (PBS) | Eco-servis | ||
| Rabbit Anti-Parvalbumin Antibody | Merck Millipore | AB15736 | |
| Rabbit Recombinant Monoclonal anti-Calbindin antibody | Abcam | ab108404 | |
| Saline (0.9% NaCl in H2O) | Solopharm | ||
| Triton X-100 | Sigma-Aldrich | 50-178-1844 | |
| Vaseline oil | Genel |
Referencias
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57 (5), 634-660 (2008).
- Sena-Esteves, M., Gao, G. Introducing Genes into Mammalian Cells: Viral Vectors. Cold Spring Harb Protoc. 2020 (8), (2020).
- Kootstra, N. A., Verma, I. M. Gene Therapy with Viral Vectors. Ann Rev Pharmacol Toxicol. 43 (1), 413-439 (2003).
- Paterna, J. C., Feldon, J., Büeler, H. Transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats. J Virol. 78 (13), 6808-6817 (2004).
- Monahan, P. E., Samulski, R. J. Adeno-associated virus vectors for gene therapy: more pros than cons. Mol Med Today. 6 (11), 433-440 (2000).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 21 (4), 583-593 (2008).
- Jooss, K., Chirmule, N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 10 (11), 955-963 (2003).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs. 31 (4), 317-334 (2017).
- Gao, G., Vandenberghe, L., Wilson, J. New Recombinant Serotypes of AAV Vectors. Curr Gene Ther. 5 (3), 285-297 (2005).
- Büning, H., Perabo, L., Coutelle, O., Quadt-Humme, S., Hallek, M. Recent developments in adeno-associated virus vector technology. J Gene Med. 10 (7), 717-733 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PloS One. 8 (9), e76310-e76310 (2013).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- de Solis, C. A., et al. Adeno-associated viral serotypes differentially transduce inhibitory neurons within the rat amygdala. Brain Res. 1672, 148-162 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV Tropism in the Nervous System with Natural and Engineered Capsids. Meth Mol Biol. 1382, 133-149 (2016).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Royo, N. C., et al. Specific AAV serotypes stably transduce primary hippocampal and cortical cultures with high efficiency and low toxicity. Brain Res. 1190, 15-22 (2008).
- Burger, C., et al. Recombinant AAV Viral Vectors Pseudotyped with Viral Capsids from Serotypes 1, 2, and 5 Display Differential Efficiency and Cell Tropism after Delivery to Different Regions of the Central Nervous System. Mol Ther. 10 (2), 302-317 (2004).
- Cearley, C. N., Wolfe, J. H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol Ther. 13 (3), 528-537 (2006).
- Klein, R. L., Dayton, R. D., Tatom, J. B., Henderson, K. M., Henning, P. P. AAV8, 9, Rh10, Rh43 vector gene transfer in the rat brain: effects of serotype, promoter and purification method. Mol Ther. 16 (1), 89-96 (2008).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450 (7168), 420-424 (2007).
- Abbott, S. B. G., et al. Photostimulation of retrotrapezoid nucleus phox2b-expressing neurons in vivo produces long-lasting activation of breathing in rats. J Neurosci. 29 (18), 5806-5819 (2009).
- Lawlor, P. A., Bland, R. J., Mouravlev, A., Young, D., During, M. J. Efficient gene delivery and selective transduction of glial cells in the mammalian brain by AAV serotypes isolated from nonhuman primates. Mol Ther. 17 (10), 1692-1702 (2009).
- Adamantidis, A. R., Zhang, F., de Lecea, L., Deisseroth, K. Optogenetics: Opsins and Optical Interfaces in Neuroscience. Cold Spring Harb Protoc. 2014 (8), (2014).
- Zhang, F., et al. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc. 5 (3), 439-456 (2010).
- Passini, M. A., Watson, D. J., Wolfe, J. H. Gene Delivery to the Mouse Brain with Adeno-Associated Virus. Methods Mol Biol. 246, 225-236 (2004).
- Davidson, B. L., et al. Recombinant adeno-associated virus type 2, 4, and 5 vectors: Transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci. 97 (7), 3428-3432 (2000).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Harris, K. D., Shepherd, G. M. G. The neocortical circuit: themes and variations. Nat Neurosci. 18 (2), 170-181 (2015).
- Carrillo-Reid, L., Yang, W., Kang Miller, J., Peterka, D. S., Yuste, R. Imaging and Optically Manipulating Neuronal Ensembles. Ann Rev Biophy. 46 (1), 271-293 (2017).
- Smirnov, I. V., et al. Plasticity of Response Properties of Mouse Visual Cortex Neurons Induced by Optogenetic Tetanization In Vivo. Curr Issues Mol Biol. 46 (4), 3294-3312 (2024).
- Snyder, B. R., et al. Comparison of Adeno-Associated Viral Vector Serotypes for Spinal Cord and Motor Neuron Gene Delivery. Human Gene Ther. 22 (9), 1129-1135 (2011).
- Schuster, D. J., et al. Biodistribution of adeno-associated virus serotype 9 (AAV9) vector after intrathecal and intravenous delivery in mouse. Front Neuroanat. 8, 42 (2014).
- Bedbrook, C. N., Deverman, B. E., Gradinaru, V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Ann Rev Neurosci. 41 (1), 323-348 (2018).
- Lo, W. D., et al. Adeno-Associated Virus-Mediated Gene Transfer to the Brain: Duration and Modulation of Expression. Human Gene Ther. 10 (2), 201-213 (1999).
- Gray, S. J., Nagabhushan Kalburgi, S., McCown, T. J., Ju de Samulski, R. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther. 20 (4), 450-459 (2013).
- Del Bigio, M. R. Ependymal cells: biology and pathology. Acta Neuropathol. 119 (1), 55-73 (2009).
- Daci, R., Flotte, T. R. Delivery of Adeno-Associated Virus Vectors to the Central Nervous System for Correction of Single Gene Disorders. Int J Mol Sci. 25 (2), 1050 (2024).
- Dasgupta, K., Jeong, J. Developmental biology of the meninges. Genesis. 57 (5), e23288-e23288 (2019).
- Mestre, H., Mori, Y., Nedergaard, M. The Brain's Glymphatic System: Current Controversies. Trends Neurosci. 43 (7), 458-466 (2020).
- Donsante, A., et al. Intracerebroventricular delivery of self-complementary adeno-associated virus serotype 9 to the adult rat brain. Gene Ther. 23 (5), 401-407 (2016).
- Hordeaux, J., et al. Long-term neurologic and cardiac correction by intrathecal gene therapy in Pompe disease. Acta Neuropathol Comm. 5 (1), 66 (2017).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nat Biotechnol. 34 (2), 204-209 (2016).
- Zhang, H., et al. Several rAAV vectors efficiently cross the blood-brain barrier and transduce neurons and astrocytes in the neonatal mouse central nervous system. Mol Ther. 19 (8), 1440-1448 (2011).
- Radhiyanti, P. T., Konno, A., Matsuzaki, Y., Hirai, H. Comparative study of neuron-specific promoters in mouse brain transduced by intravenously administered AAV-PHP.eB. Neurosci Lett. 756, 135956 (2021).
- Li, X., et al. Skin suturing and cortical surface viral infusion improves imaging of neuronal ensemble activity with head-mounted miniature microscopes. J Neurosci Meth. 291, 238-248 (2017).
- Scala, F., et al. Layer 4 of mouse neocortex differs in cell types and circuit organization between sensory areas. Nat Comm. 10 (1), 4174 (2019).
- Thomson, A. M. Neocortical layer 6, a review. Front Neuroanat. 4, 13 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados