Method Article
Gelişmekte Olan ve Olgun Arabidopsis Tohumlarında Endosperm Hücre Tabakasının Mikroskobik Analizi için Sağlam Dokunun Hazırlanması
Bu Makalede
Özet
Bu protokol, Arabidopsis thaliana tohumlarında endosperm hücre tabakasının sağlam örneklerinin hazırlanmasını açıklar. Yöntem, yalnızca enjeksiyon iğnesi ve hassas forseps gibi yaygın laboratuvar ekipmanı gerektirir ve hem gelişmekte olan hem de olgun tohumlardaki endosperm hücrelerinin yüksek çözünürlüklü floresan canlı hücre görüntülemesini sağlar.
Özet
Arabidopsis tohumlarında, embriyo ile testa arasında bulunan tek bir canlı hücre tabakası olan endosperm, tohum olgunlaşması, uyku hali ve çimlenmenin düzenlenmesinde kritik bir rol oynar. Sağlam endosperm hücrelerinin mikroskobik analizi, endospermin hücresel ve moleküler düzeydeki fizyolojik fonksiyonlarını anlamak için gereklidir. Bununla birlikte, Arabidopsis tohumlarının küçük boyutu ve endosperm hücre tabakasının testisin altındaki konumu nedeniyle numune hazırlama zor olmuştur. Bu makale, hem gelişmekte olan hem de olgun tohumlarda mikroskobik gözlem ve analiz için uygun bozulmamış endosperm hücre tabakası örneklerinin hazırlanmasını detaylandırmaktadır. Bu yöntem, fiksasyon veya kesit alma gerektirmeden geniş alanların ve çok sayıda sağlam endosperm hücresinin gözlemlenmesini sağlar. Ek olarak, protokol yalnızca enjeksiyon iğneleri, hassas forsepsler ve stereo mikroskoplar gibi standart laboratuvar ekipmanlarını kullanır. Bu yaklaşım, sağlam endosperm hücrelerinde yeşil floresan proteini (GFP) gibi floresan sinyallerin yüksek çözünürlüklü canlı hücre görüntülemesini başarıyla sağlar. Bu yöntem, farklı Arabidopsis mutantlarının endosperm hücrelerinde hücre içi lokalizasyonun ve çeşitli proteinlerin hareketinin yanı sıra organellerin morfolojisinin gözlemlenmesine izin verir. Bu protokol, yeni endosperm fonksiyonlarının aydınlatılmasına katkıda bulunur ve bu esansiyel dokunun hücresel ve moleküler çalışma potansiyelini genişletir.
Giriş
Bitkiler sapsız organizmalar olduğundan, tohum çimlenmesi kaderlerini belirleyen çok önemli bir olaydır. Çimlenme kararı, birincil tohum uyku hali seviyeleri, sıcaklık, ışık yoğunluğu ve dalga boyu ve nitrojen konsantrasyonu 1,2,3,4,5,6 gibi hem iç hem de çevresel faktörler tarafından sıkı bir şekilde düzenlenir. Tohumlar, birden fazla doku tipinden oluşan karmaşık yapılara sahiptir7. Arabidopsis kuru tohumlarında, bir fide haline gelen embriyo, tek bir endosperm tabakası ve en dış tabakalar olan testa ile çevrilidir. Testa, çok sayıda ölü hücre katmanından oluşurken, embriyo ve endosperm kuru tohumlarda bile canlı kalır. Endosperm genellikle embriyo büyümesi için besin sağlayan bir depolama dokusu olarak kabul edilir ve testa ile birlikte kök çıkıntısına karşı mekanik direnç sağlar 8,9,10,11,12,13.
Son zamanlarda yapılan birkaç çalışma, endospermin optimal tohum çimlenmesinin düzenlenmesinde önemli bir rol oynadığını göstermiştir 14,15,16,17. Örneğin, endosperm hücrelerindeki fotoreseptör fitokrom B (PHYB), çimlenme tepkilerini düzenleyerek kırmızı ( R ) veya uzak kırmızı ( FR) ışığı algılar15 . Endosperm aynı zamanda sıcaklığı algılayan bir doku olarak da işlev görür ve yüksek sıcaklıklarda çimlenme tepkilerini baskılar16. Endospermin kalite kontrolü, özellikle uzun süreli depolanmış tohumlarda optimal tohum çimlenmesi için kritik öneme sahiptir17.
Endospermin fizyolojik fonksiyonlarını daha da aydınlatmak için canlı hücre görüntüleme artık gereklidir. Floresan etiketli proteinleri eksprese eden sağlam endosperm hücrelerinin mikroskobik analizi, endospermin tohum çimlenmesini düzenlediği moleküler mekanizmaların araştırılmasına olanak tanır. Bununla birlikte, sağlam endosperm hücrelerini mikroskobik gözlem için hazırlamak, özellikle Arabidopsis tohumlarında zordur. Tohumların çapı yaklaşık 0,4 mm'dir ve endosperm, embriyo ile testa arasında bulunan tek hücreli bir tabakadır ve hassas manipülasyonu zorlaştırır. Sonuç olarak, önemli fizyolojik rollerine rağmen, endosperm nadiren canlı hücre görüntüleme kullanılarak gözlenmiştir.
Bu makale, hem gelişmekte olan hem de olgun tohumlarda canlı hücre görüntülemeye uygun sağlam endosperm hücre tabakası örneklerinin hızlı bir şekilde hazırlanması için bir protokol sunmaktadır.
Protokol
Bu çalışmada, canlı endosperm hücre tabakası örneklerinin hazırlanması için biri gelişmekte olan tohumlar ve diğeri olgun tohumlar için olmak üzere iki farklı prosedür oluşturulmuştur. Testanın sağlamlığına bağlı olarak biraz farklı yaklaşımlar gereklidir. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Gelişmekte olan tohumlardan sağlam endosperm örneklerinin hazırlanması
- Siliklerin toplanması
- Arabidopsis bitkilerini çiçek açana kadar toprakta veya taşyünü üzerinde büyütün.
- Tamamen açılmış çiçekleri renkli ipliklerle işaretleyin (çiçeklenmeden 0 gün sonra, 0 DAF).
NOT: Çiçekleri işaretlemek için yeşil, sarı veya kahverengi iplikler kullanmaktan kaçının, çünkü bu renkleri büyüyen veya olgun bitkilerden ve siliklerden ayırt etmek zordur. - Pedicelde ( Şekil 1(1)'de gösterilmiştir) işaretli gelişmekte olan silislikleri kesin ve bunları 1,5 mL'lik tüplerde toplayın.
NOT: 12-16 DAF arası geliştirilen silisler, bu protokol kullanılarak hazırlanmak için uygundur.
- Gelişmekte olan tohumların diseksiyonu
NOT: Numunelerin kurumasını önlemek için ıslak filtre kağıdı üzerinde aşağıdaki adımlar gerçekleştirilmelidir. Manipülasyonlar stereo mikroskop altında yapılmalıdır.- İki forseps kullanarak bir valfi ( Şekil 1(2)'de gösterilmiştir) replumdan ( Şekil 1(1)'de gösterilmiştir) ayırın: biri tutmak için kalın uçlara ve diğeri yırtmak için keskin uçlara sahip).
- Tohumlara zarar vermemek için uçları kapalıyken forseps kullanarak silislerden gelişmekte olan tohumları nazikçe toplayın (Şekil 1(2)).
- Tohumu çarpmadan forseps ile tutarak embriyoyu çevreleyen testa ve endosperm üzerinde enjeksiyon iğnesi (27 G, 0.40 mm × 19 mm) büyüklüğünde bir iz açın (Şekil 1(3)).
NOT: Yara izi oluşturmak için en uygun yer, kotiledonların ve kökün birleştiği yerdir. - Tohumu forseps ile sıkıştırarak embriyoyu dışarı itin (Şekil 1(4)). Testa ve endospermden oluşan boş tohum zarfını ezmeyin ve yuvarlak şeklini korumaya çalışın.
- Enjeksiyon iğnesini yara izindeki boş tohum zarfına içten dışa doğru delerek yerleştirin (Şekil 1(5)).
- İğneyi yerinde tutun, uçları kapalıyken forseps kullanarak testanın yüzeyini çizin ve boş tohum zarfının bir tarafını açılmasına izin verecek şekilde kesin (Şekil 1(6)).
- Boş tohum zarfını keskin uçlu forseps kullanarak bir tabaka halinde açın (Şekil 1(7)). Örnek şimdi endosperm ve testa katmanlarından oluşan iki katmanlı bir tabaka olarak izole edilmelidir (Şekil 1(8)).
NOT: Aşağıdaki 3. adımda montaj ortamı olarak su kullanıldığında numune kıvrılma eğilimindeyse, tabaka biçimindeki numuneyi iki parçaya bölün. Yaklaşık 18 DAF'ta siliklerden hasat edilen tohumlar (bu aşamada, testa kahverengidir ancak henüz tamamen kuru değildir) bu protokol kullanılarak da işlenebilir, ancak tohumların hazırlanmadan önce birkaç dakika emilmesi gerekir.
2. Olgun tohumlardan sağlam endosperm örneklerinin hazırlanması
- Olgun tohumların emilmesi
- Kuru Arabidopsis tohumları içeren 1,5 mL'lik bir tüpe 1 mL çift damıtılmış su ekleyin.
- Tohumları oda sıcaklığında en az 40 dakika emilmiş halde tutun (Şekil 2(1)).
NOT: Kuru tohumların ve tohumların emiledikten sonraki 40 dakika içinde testa ve endospermde yara izi bırakması ve 2.2.1 ve 2.2.2 adımlarında boş tohum zarfına zarar vermeden embriyoyu tohumun içinden çıkarması zordur, oysa daha uzun bir emme süresi manipülasyonu kolaylaştırır. - Emilmiş tohumları ıslak filtre kağıdına aktarmak için 1000 μL'lik bir mikropipet kullanın.
- Olgun tohumların diseksiyonu
NOT: Numunelerin kurumasını önlemek için ıslak filtre kağıdı üzerinde aşağıdaki adımlar gerçekleştirilmelidir. Manipülasyonlar stereo mikroskop altında yapılmalıdır.- Tohumu çarpmadan forseps ile tutarak embriyoyu saran testa ve endosperm üzerinde yaklaşık 0.2 mm büyüklüğünde bir iz enjeksiyon iğnesi kullanarak açın (Şekil 2(2)).
- Tohumu forseps ile sıkıştırarak embriyoyu dışarı itin (Şekil 2(3)). Testa ve endospermi içeren boş tohum zarfını ezmeyin. Yuvarlak şeklini korumaya çalışın.
- Boş tohum zarfının üst ve alt taraflarını bir silindir haline getirmek için bir enjeksiyon iğnesi ile kesin (Şekil 2(4)).
- Silindirik şekilli boş tohum zarfını iki parçaya ayırmak için merkezi ekseni boyunca kesin (Şekil 2(5)). Örnekler, endosperm tabakası ve testa tabakasından oluşan iki tabakalı tabakalar halinde izole edilmelidir (Şekil 2(6)).
3. Mikroskobik gözlem
- Endosperm örneklerini bir cam slayt üzerine tabaka halinde yerleştirin ve bunları su veya perflorodekalin (PFD) içine monte edin.
NOT: Numune ile lamel arasında hava kabarcıkları kalırsa, yapraklar18,19 gibi hava cepleri içeren numunelerin görüntülenmesi için özellikle yararlı olduğu bildirilen perflorodekalin (PFD) faydalı olacaktır. PFD'nin en düşük yüzey gerilimine sahip olduğu bilinmektedir ve bu da numune yüzeyindeki hava boşluklarını kolayca doldurmasına olanak tanır. Bununla birlikte, hızlandırılmış görüntüleme için, hücresel sıvılığı korumak için olgun tohumlardaki su içeriğinin bol olması gerektiğinden, montaj ortamı olarak suyun kullanılması önerilir. - Numunenin üzerine nazikçe bir lamel yerleştirin. Endosperm tabakasının lamel ile baktığından emin olun.
NOT: Numunenin ve montaj ortamının kurumasını önlemek için lamel kenarlarını kapatmak için oje veya gres kullanılabilir.
Sonuçlar
Şekil 1'de gösterilen protokol kullanılarak, endosperm örnekleri, 14 DAF'ta siliklerden hasat edilen gelişmekte olan tohumlardan hazırlandı (bu aşamada, testa hala yeşildir). Geniş bir alanda çok sayıda endosperm hücresi ve bunların hücre içi yapıları gözlendi (Şekil 3A). Bu deneyde, C-terminalinde (PHYB-GFP) GFP ile kaynaşmış PHYB eksprese eden tohumlar kullanılmıştır. PHYB'nin kırmızı ışıkla aktivasyon üzerine çekirdeğe yer değiştirdiği ve tohum çimlenmesinde rol oynayan fotokortlar (PB'ler) olarak bilinen PHYB pozitif benekler oluşturduğu iyi bilinmektedir 4,20,21,22. Örnekler, 22 ° C'de sürekli beyaz ışık koşulları altında yetiştirilen bitkilerden hasat edildi. Şekil 3B'de gösterildiği gibi, endosperm hücrelerinde çekirdek içindeki PB'ler tespit edildi. Bu sonuç, endospermdeki PHYB'nin optimal tohum çimlenmesini düzenlediğini gösteren önceki bir çalışmaya karşılık gelir15. Ek olarak, izole edilen endosperm hücrelerinin, fitokrom FR / R foto-tersine çevrilebilirliğini gözlemleyerek numune hazırlandıktan sonra bile biyolojik aktiviteyi koruduğunu doğrulamak için canlı hücre hızlandırılmış görüntüleme yapılmıştır (Şekil 3C). Endosperm örnekleri, 17-18 DAF civarında silislerden hasat edilen gelişmekte olan tohumlardan hazırlandı. PB'ler diseksiyon sırasında çekirdek içinde tespit edilirken, uzak kırmızı ışıkla ışınlamadan sonra tamamen kayboldular. Daha sonra, kırmızı ışık ışınlaması tekrar PB'leri indükledi. Bu fitokrom fotoreversibilitesi iki kez tespit edildi, bu da bu protokol ile izole edilen endosperm hücrelerinin diseksiyondan sonra en az 4.5 saat boyunca biyolojik aktiviteyi koruduğunu gösterdi (Şekil 3C).
Daha sonra, Şekil 2'de gösterildiği gibi olgun tohumlardan (testanın kahverengi olduğu) endosperm örnekleri hazırlandı. Bu deneyde, mitokondri motilitesi, hasattan sonra yaklaşık bir yıl boyunca karanlıkta oda sıcaklığında bir desikatörde saklanan mitokondriyal hedefli GFP (mtGFP)23 eksprese eden tohumlar kullanılarak gözlemlendi. Embriyodaki mitokondrinin embibisyondan ve çimlenme koşullarına geçtikten sonra aktif olarak hareket ettiği ve dinamik olarak morfolojiyi değiştirdiği bildirilmiştir24. 3 saatlik tohum imbibisyonundan sonra sağlam endosperm hücrelerinde mitokondrinin floresan hızlandırılmış görüntülemesi yapıldı ve mitokondriyal hareket tespit edildi (Ek Film 1). Endospermdeki mitokondri, 22 ° C'de kısa bir imbisyon süresinden sonra hemen sitozol içinde hareket etti. 22 ° C'de 1 günlük tohum emmesinden sonra, daha dinamik hareket eden mitokondri gözlendi (Şekil 4 ve Ek Film 2).
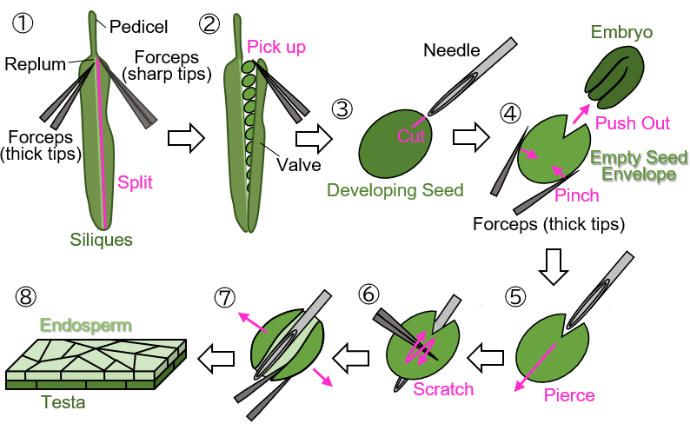
Şekil 1: Gelişmekte olan tohumlardan endosperm örneği hazırlama. Adım 1: Replum'dan bir valf ayrılır. Adım 2: Gelişmekte olan tohumlar toplanır. Adım 3: Bir enjeksiyon iğnesi kullanılarak testa ve endosperm üzerinde bir yara izi oluşturulur. Adım 4: Embriyo, tohum forseps ile sıkıştırılarak çıkarılır. Adım 5: Enjeksiyon iğnesi, boş tohum zarfından içeriden dışarıya doğru sokulur. Adım 6: Testa'nın yüzeyi forseps kullanılarak çizilir. Adım 7: Boş tohum zarfı, forseps kullanılarak bir tabaka formuna açılır. Adım 8: Son endosperm tabakası örneği mikroskobik gözlem için hazırlanır. Tüm adımlar stereo mikroskop altında ıslak filtre kağıdı üzerinde gerçekleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Olgun tohumlardan endosperm örneği hazırlama. Adım 1: Kuru tohumlar 1,5 mL'lik bir tüpte 40 dakikadan fazla suya batırılır. Adım 2: Bir enjeksiyon iğnesi kullanılarak testa ve endosperm üzerinde bir yara izi oluşturulur. Adım 3: Embriyo, tohum forseps ile sıkıştırılarak çıkarılır. Adım 4: Boş tohum zarfının üst ve alt tarafları kesilerek silindir şekline getirilir. Adım 5: Silindirik şekilli boş tohum zarfı, merkezi ekseni boyunca kesilir. Adım 6: Son endosperm tabakası örneği mikroskobik gözlem için hazırlanır. Tüm adımlar stereo mikroskop altında ıslak filtre kağıdı üzerinde gerçekleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Gelişmekte olan tohumlar kullanılarak sağlam bir endosperm hücre tabakasının floresan görüntülemesi. Bozulmamış endosperm hücre tabakası örnekleri, çiçeklenmeden 14 gün sonra (DAF) siliques (A,B) ve 17-18 DAF siliques (C) gelişmekte olan tohumlardan hazırlandı. Mikroskobik görüntüleme, Plan-Apochromat 63× yağa daldırma objektif lensi ve beyaz ışık lazeri ile donatılmış konfokal lazer tarama mikroskobu kullanılarak gerçekleştirildi. (A) Diferansiyel girişim kontrastı (DIC) altında endospermin konfokal görüntüsü, çok sayıda sağlam endosperm hücresi içeren geniş alanları gösterir. Ölçek çubuğu: 20 μm. (B) PHYB-GFP'yi eksprese eden endospermin konfokal görüntüleri, yeşil renkte PHYB-GFP ve camgöbeği içinde klorofil otofloresan ile gösterilmiştir. Bir çekirdekteki fotocisimler (PB'ler) beyaz ok uçları ile gösterilir. Ölçek çubukları: 10 μm; Büyütülmüş görüntü ölçek çubuğu: 2,5 μm. GFP sinyali, floresan ömür mikroskobu (FLIM) kullanılarak protein depolama vakuollerinin (PSV'ler) otofloresansından ayrıldı. Floresan ömürleri TauScan kullanılarak elde edildi ve TauSeparation fonksiyonu kullanılarak ayrıldı. GFP için ortalama floresan ömrü 2.2 ns idi. GFP floresansı 488 nm'de uyarılmış ve 500-530 nm arasında toplanırken, klorofil otofloresansı 405 nm'de uyarılmış ve 688-729 nm arasında toplanmıştır. (C) Sürekli beyaz ışık (cWL), sürekli uzak kırmızı ışık (cFR) veya sürekli kırmızı ışık (cR) altında PHYB-GFP eksprese eden endospermin konfokal görüntüleri sunulur. PHYB-GFP yeşil renkle gösterilir ve PSV otofloresan macenta olarak gösterilir. Ölçek çubukları: 10 μm; Büyütülmüş görüntü ölçek çubuğu: 2,5 μm. Işık yoğunlukları: WL, 46,5 μmol/m2/s; FR, 35,2 μmol/m2/sn; R, 18.6 μmol / m2 / s. PSV otofloresan 561 nm'de uyarıldı ve 565-621 nm arasında toplandı. GFP sinyali, yukarıda açıklanan aynı yöntem kullanılarak ayrıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
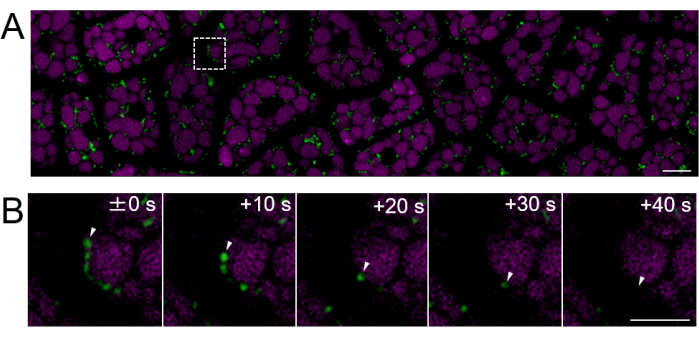
Şekil 4: Olgun tohumlar kullanılarak bozulmamış bir endosperm hücre tabakasının floresan canlı hücre görüntülemesi. Mikroskobik görüntüleme, Şekil 3'te tarif edilen aynı yöntem kullanılarak gerçekleştirildi. (A) Ek Film 2'den elde edilen tüm sağlam endosperm hücre tabakasının konfokal bir görüntüsü gösterilmektedir. Mitokondri yeşil renkle etiketlenmiştir ve PSV otofloresan macenta ile etiketlenmiştir. Ölçek çubuğu: 10 μm. (B) Panel (A)'daki kesikli çizgili kare alandan hızlandırılmış büyütülmüş bir dizi görüntü, beyaz ok uçlarıyla gösterilen bir mitokondrinin hareketini gösterir. Ölçek çubuğu: 5 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Film 1: Embibisyondan 3 saat sonra olgun bir tohumun endosperm hücre tabakasındaki mtGFP'nin hızlandırılmış bir videosu gösterilmektedir. Her 10 saniyede bir kare çekildi ve videonun kare hızı 10 kare/sn'dir. Ölçek çubuğu: 10 μm. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Film 2: Embibisyondan 1 gün sonra olgun bir tohumun endosperm hücre tabakasındaki mtGFP'nin hızlandırılmış bir videosu gösterilmektedir. Her 10 saniyede bir kare çekildi ve videonun kare hızı 10 kare/sn'dir. Ölçek çubuğu: 10 μm. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Endospermin tohum çimlenmesindeki rolleri, gen ekspresyon analizi ve lipitlerin ve fitohormonların miktar tayinigibi ayrılmış tohum dokuları kullanılarak yapılan genetik ve biyokimyasal analizlerle ortaya çıkarılmıştır 9,14,25,26,27. Boş tohum zarfını (endosperm ve testa) farklı Arabidopsis mutantlarından izole edilen bir embriyo ile birleştiren bir in vitro tohum kabuğu yatak testi, çimlenme süreçlerinin altında yatan moleküler mekanizmaları ortaya çıkardı 14,15,16,28. Bununla birlikte, Arabidopsis tohumlarının küçük boyutu ve testisin altındaki endosperm hücre tabakasının konumu nedeniyle mikroskobik gözlem için numune hazırlama zor olmuştur. Özellikle, tohum gelişimi sırasında endosperm hücre tabakasının gözlemlenmesi, kimyasal fiksasyon ve kesit alma olmadan nadiren gerçekleştirilmiştir.
Numune hazırlama sırasında, gelişmekte olan tohumlardan gelen boş tohum zarfı kırılgandır, çünkü testa canlıdır ve bu nedenle yumuşaktır. Burada, gelişmekte olan tohumlarda mikroskobik gözlem ve analize uygun sağlam endosperm hücre tabakası örneklerinin fiksasyon veya kesit alma gerektirmeden hızlı bir şekilde hazırlanması için iki protokol oluşturulmuştur. Olgun tohumlardan numune hazırlanması durumunda, testa ölü ve sağlamdır, bu da boş tohum zarfının bir sürgülü cam üzerine monte edildiğinde eğriliğini korumasına neden olur. Bu eğrilik, endosperm hücre tabakasını geniş bir odak aralığında net bir şekilde gözlemlemeyi zorlaştırır. Bu nedenle, tohum geliştirmek için diseksiyon yöntemi, boş tohum zarfını uygun şekilde kesmek için hafifçe değiştirildi. Bu yöntem kullanılarak iki parçaya ayrılarak, odaklanmayı korurken çok sayıda endosperm hücresinin net bir şekilde gözlemlenmesi sağlandı.
Çeşitli görüntüleme reaktifleri (DNA'yı boyamak, reaktif oksijen türleri, asidik bölmeler vb. için) geliştirilmiş ve bazıları Arabidopsis bitkilerine uygulanmıştır 29,30,31,32. Bu protokol kullanılarak hazırlanan endosperm hücre tabakası örnekleri, LysoTracker ve Propidium Iodide boyama ile mikroskobik gözlem için zaten kullanılmış olup, endosperm fonksiyonunundeğerlendirilmesine katkıda bulunmuştur 17. 1962'de GFP'nin keşfindenbu yana, 33, GFP etiketli proteinler, hücre içi yapıların dinamiklerini aydınlatmak için temel araçlar haline gelmiştir 23,24,34,35,36,37,38. Endosperm örneklerinin bu protokole göre hazırlanması ve yukarıda belirtilen yöntemlerin kullanılmasıyla, Şekil 3 ve Şekil 4'te gösterildiği gibi tohum gelişimi ve çimlenme sırasında endospermin canlı hücre görüntülemesini yapmak, böylece hücre içi olayları ve spesifik proteinlerin lokalizasyonunu aydınlatmak mümkündür. Ayrıca, spesifik inhibitörlerin (proteaz inhibitörleri, protein modifikasyon enzim inhibitörleri ve hücresel dinamik inhibitörleri gibi)39,40,41,42 bu protokolü kullanarak canlı endosperm hücrelerine uygulanmasının, tohum gelişimi ve çimlenme sırasında endosperm fonksiyonunun altında yatan hücre içi olaylar ve moleküler mekanizmalar hakkında daha derin bilgiler sağlaması beklenmektedir.
Bu protokolün bir sınırlaması, tamamen kurutulmuş tohumlardan elde edilen endosperm hücre katmanlarının hazırlanamamasıdır, çünkü tohumları embriyoya ve boş tohum zarfına ayırmak zordur. Şekil 2'de gösterildiği gibi, olgun tohumları ayırmak için en az 40 dakikalık bir emme süresi gereklidir. Endosperm hücreleri içindeki birkaç hücresel olayın imbibisyon üzerine indüklenebileceğini not etmek önemlidir. Diğer bir sınırlama, bu protokolün, tek hücreli endosperm tabakasını gözlemlemek için özel olarak tasarlandığından, tohum gelişiminin erken aşamalarında, özellikle 10 DAF'tan önce endosperm dokusunun gözlemlenmesine izin vermemesidir. Bu erken aşamalarda, tek hücreli endosperm tabakasının oluşumundan önceki doku - tabakasız bir endosperm - gelişmekte olan tohumların43 içini doldurur ve endosperm örneklerinin hazırlanmasını zorlaştırır.
Açıklamalar
Yazarlar, rekabet eden herhangi bir mali çıkarları olmadığını beyan ederler.
Teşekkürler
Kyoto Üniversitesi'nden Dr. Matsushita ve Oka'ya, 35S promotörü tarafından yönlendirilen phyB mutantını eksprese eden PHYB-GFP'yi sağladıkları için teşekkür ederiz. Bu çalışma kısmen Yenilikçi Alanlarda Bilimsel Araştırma için Yardım Hibesi, Önerilen Araştırma Alanında Araştırma (19H05713 - K.Y.) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
Referanslar
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179 (2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202 (2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121 (2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394 (2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732 (2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650 (2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510 (2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -. C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -. H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır