Method Article
Preparação de tecido intacto para análise microscópica da camada de células do endosperma em sementes de Arabidopsis em desenvolvimento e maduras
Neste Artigo
Resumo
Este protocolo descreve a preparação de amostras intactas da camada de células do endosperma em sementes de Arabidopsis thaliana . O método requer apenas equipamentos de laboratório comuns, como agulha de injeção e pinça de precisão, e permite imagens fluorescentes de células vivas de alta resolução de células do endosperma em sementes em desenvolvimento e maduras.
Resumo
Nas sementes de Arabidopsis , o endosperma, uma única camada de células vivas localizada entre o embrião e a testa, desempenha um papel crítico na regulação da maturação, dormência e germinação das sementes. A análise microscópica das células intactas do endosperma é essencial para a compreensão das funções fisiológicas do endosperma nos níveis celular e molecular. No entanto, a preparação da amostra tem sido um desafio devido ao pequeno tamanho das sementes de Arabidopsis e à localização da camada de células do endosperma abaixo da testa. Este artigo detalha a preparação de amostras intactas da camada de células do endosperma adequadas para observação e análise microscópica em sementes em desenvolvimento e maduras. Este método permite a observação de grandes áreas e numerosas células intactas do endosperma sem a necessidade de fixação ou secção. Além disso, o protocolo utiliza apenas equipamentos de laboratório padrão, como agulhas de injeção, pinças de precisão e microscópios estereoscópicos. Essa abordagem permite com sucesso imagens de células vivas de alta resolução de sinais fluorescentes, como proteína fluorescente verde (GFP), em células de endosperma intactas. Este método permite a observação da localização intracelular e do movimento de várias proteínas, bem como a morfologia das organelas, nas células do endosperma de diferentes mutantes de Arabidopsis . Este protocolo contribui para a elucidação de novas funções do endosperma e expande o potencial para estudos celulares e moleculares deste tecido essencial.
Introdução
Como as plantas são organismos sésseis, a germinação das sementes é um evento crucial que determina seu destino. A decisão de germinar é estritamente regulada por fatores internos e ambientais, como níveis de dormência da semente primária, temperatura, intensidade de luz e comprimento de onda e concentração de nitrogênio 1,2,3,4,5,6. As sementes têm estruturas complexas que consistem em vários tipos de tecidos7. Nas sementes secas de Arabidopsis, o embrião, que se desenvolve em uma muda, é circundado por uma única camada de endosperma e as camadas mais externas, a testa. A testa é composta por várias camadas de células mortas, enquanto o embrião e o endosperma permanecem vivos mesmo em sementes secas. O endosperma é comumente considerado como um tecido de armazenamento que fornece nutrientes para o crescimento embrionário e, juntamente com a testa, confere resistência mecânica à protrusão da radícula 8,9,10,11,12,13.
Vários estudos recentes demonstraram que o endosperma desempenha um papel essencial na regulação da germinação ideal das sementes 14,15,16,17. Por exemplo, o fotorreceptor fitocromo B (PHYB) nas células do endosperma detecta luz vermelha (R) ou vermelha distante (FR), regulando as respostas de germinação15. O endosperma também funciona como um tecido sensível à temperatura, suprimindo as respostas de germinação sob altas temperaturas16. O controle de qualidade do endosperma é fundamental para a germinação ideal das sementes, particularmente em sementes armazenadas a longo prazo17.
A imagem de células vivas agora é necessária para elucidar ainda mais as funções fisiológicas do endosperma. A análise microscópica de células intactas do endosperma que expressam proteínas marcadas com fluorescência permite a investigação dos mecanismos moleculares pelos quais o endosperma regula a germinação das sementes. No entanto, preparar células de endosperma intactas para observação microscópica é um desafio, particularmente em sementes de Arabidopsis . As sementes têm aproximadamente 0,4 mm de diâmetro e o endosperma é uma camada unicelular localizada entre o embrião e a testa, dificultando a manipulação precisa. Consequentemente, apesar de seus importantes papéis fisiológicos, o endosperma raramente foi observado usando imagens de células vivas.
Este artigo apresenta um protocolo para a preparação rápida de amostras intactas da camada de células do endosperma adequadas para imagens de células vivas em sementes em desenvolvimento e maduras.
Protocolo
Neste estudo, dois procedimentos diferentes foram estabelecidos para a preparação de amostras vivas da camada de células do endosperma: um para o desenvolvimento de sementes e outro para sementes maduras. Abordagens ligeiramente diferentes são necessárias dependendo da solidez do testa. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Preparação de amostras de endosperma intactas de sementes em desenvolvimento
- Coleção de siliques
- Cultive plantas de Arabidopsis no solo ou lã de rocha até florescer.
- Marque as flores totalmente abertas com fios coloridos (0 dias após a floração, 0 DAF).
NOTA: Evite usar fios verdes, amarelos ou marrons para marcar flores, pois essas cores são difíceis de distinguir de plantas e sílicas em crescimento ou maduras. - Corte as silílicas em desenvolvimento marcadas no pedicelo (indicadas na Figura 1 (1)) e colete-as em tubos de 1,5 mL.
NOTA: Siliques em desenvolvimento de 12-16 DAF são adequados para preparação usando este protocolo.
- Dissecação de sementes em desenvolvimento
NOTA: As etapas a seguir devem ser executadas em papel de filtro úmido para proteger as amostras da dessecação. As manipulações devem ser feitas sob um microscópio estereoscópico.- Separe uma válvula (indicada na Figura 1(2)) do replum (indicado na Figura 1(1)) usando duas pinças: uma com pontas grossas para segurar e outra com pontas afiadas para rasgar).
- Pegue suavemente as sementes em desenvolvimento das sílicas usando uma pinça com as pontas fechadas para evitar danificar as sementes (Figura 1 (2)).
- Segurando a semente com uma pinça sem bater na semente, faça uma cicatriz de aproximadamente 0,2 mm de tamanho na testa e no endosperma ao redor do embrião usando uma agulha de injeção (27 G, 0,40 mm × 19 mm) (Figura 1 (3)).
NOTA: O local ideal para fazer a cicatriz é na junção dos cotilédones e da radícula. - Empurre o embrião beliscando a semente com uma pinça (Figura 1 (4)). Não esmague o envelope vazio da semente, que consiste na testa e no endosperma, e tente manter sua forma redonda.
- Insira a agulha de injeção no envelope vazio da cicatriz, perfurando-o de dentro para fora (Figura 1 (5)).
- Mantenha a agulha na posição, risque a superfície da testa com uma pinça com as pontas fechadas e corte um lado do envelope vazio para permitir que ele se abra (Figura 1 (6)).
- Abra o envelope de sementes vazio em uma folha usando uma pinça com pontas afiadas (Figura 1 (7)). A amostra deve agora ser isolada como uma folha de bicamada consistindo nas camadas de endosperma e testa (Figura 1 (8)).
NOTA: Se a amostra tende a enrolar quando a água é usada como meio de montagem na etapa 3 abaixo, divida a amostra em forma de folha em duas partes. Sementes colhidas de siliques em torno de 18 DAF (nesta fase, a testa é marrom, mas ainda não completamente seca) também podem ser processadas usando este protocolo, embora as sementes devam ser embebidas por vários minutos antes do preparo.
2. Preparação de amostras de endosperma intactas de sementes maduras
- Embebição de sementes maduras
- Adicione 1 mL de água bidestilada a um tubo de 1,5 mL contendo sementes secas de Arabidopsis .
- Mantenha as sementes embebidas por pelo menos 40 min em temperatura ambiente (Figura 2 (1)).
NOTA: Sementes secas e sementes dentro de 40 minutos após a embebição são difíceis de cicatrizar no testa e no endosperma e remover o embrião de dentro da semente sem danificar o envelope vazio da semente nas etapas 2.2.1 e 2.2.2, enquanto um tempo de embebição mais longo facilita a manipulação. - Use uma micropipeta de 1000 μL para transferir as sementes embebidas para papel de filtro úmido.
- Dissecção de sementes maduras
NOTA: As etapas a seguir devem ser executadas em papel de filtro úmido para proteger as amostras da dessecação. As manipulações devem ser realizadas sob um microscópio estereoscópico.- Segurando a semente com uma pinça sem bater na semente, faça uma cicatriz de aproximadamente 0,2 mm de tamanho na testa e no endosperma ao redor do embrião usando uma agulha de injeção (Figura 2 (2)).
- Empurre o embrião beliscando a semente com uma pinça (Figura 2 (3)). Não esmague o envelope vazio da semente, que inclui a testa e o endosperma. Tente manter sua forma redonda.
- Corte os lados superior e inferior do invólucro vazio de sementes com uma agulha de injeção para moldá-lo em um cilindro (Figura 2 (4)).
- Corte o envelope vazio de sementes de forma cilíndrica ao longo de seu eixo central para separá-lo em dois pedaços (Figura 2 (5)). As amostras devem ser isoladas como lâminas de bicamada constituídas pela camada de endosperma e pela camada de testa (Figura 2 (6)).
3. Observação microscópica
- Coloque as amostras de endosperma em forma de folha em uma lâmina de vidro e monte-as em água ou perfluorodecalina (PFD).
NOTA: Se as bolhas de ar permanecerem entre a amostra e a lamínula, a perfluorodecalina (PFD), que foi relatada como particularmente útil para imagens de amostras contendo bolsas de ar, como folhas18,19, seria útil. O PFD é conhecido por ter a menor tensão superficial, permitindo que ele preencha facilmente os espaços de ar na superfície da amostra. Para imagens de lapso de tempo, no entanto, recomenda-se o uso de água como meio de montagem, pois o teor de água nas sementes maduras deve ser abundante para manter a liquidez celular. - Coloque uma lamínula suavemente sobre a amostra. Certifique-se de que a camada de endosperma esteja voltada para a lamínula.
NOTA: Esmalte ou graxa podem ser usados para selar as bordas da lamínula para evitar a dessecação da amostra e do meio de montagem.
Resultados
Utilizando o protocolo mostrado na Figura 1, amostras de endosperma foram preparadas a partir de sementes em desenvolvimento colhidas de siliques a 14 DAF (nesta fase, a testa ainda está verde). Numerosas células do endosperma em uma grande área e suas estruturas intracelulares foram observadas (Figura 3A). Neste experimento, foram utilizadas sementes expressando PHYB fundidas com GFP no terminal C (PHYB-GFP). É bem sabido que o PHYB se transloca para o núcleo após a ativação pela luz vermelha e forma manchas positivas para PHYB, conhecidas como fotocorpos (PBs), que estão envolvidas na germinação das sementes 4,20,21,22. As amostras foram colhidas de plantas cultivadas sob condições contínuas de luz branca a 22 °C. Conforme mostrado na Figura 3B, PBs dentro do núcleo foram detectados em células de endosperma. Este resultado corresponde a um estudo anterior que mostrou que o PHYB no endosperma regula a germinação ideal das sementes15. Além disso, imagens de lapso de tempo de células vivas foram realizadas para confirmar que as células isoladas do endosperma mantiveram a atividade biológica mesmo após a preparação da amostra, observando a fotorreversibilidade FR / R do fitocromo (Figura 3C). Amostras de endosperma foram preparadas a partir de sementes em desenvolvimento colhidas de siliques em torno de 17-18 DAF. Os PBs foram detectados dentro do núcleo após a dissecção, enquanto desapareceram completamente após a irradiação com luz vermelha distante. Posteriormente, a irradiação de luz vermelha novamente induziu PBs. Essa fotorreversibilidade do fitocromo foi detectada duas vezes, indicando que as células do endosperma isoladas por esse protocolo mantiveram atividade biológica por pelo menos 4,5 h após a dissecção (Figura 3C).
Em seguida, foram preparadas amostras de endosperma de sementes maduras (onde a testa é marrom), conforme mostrado na Figura 2. Neste experimento, a motilidade das mitocôndrias foi observada usando sementes que expressam GFP direcionada à mitocôndria (mtGFP)23, que foram armazenadas em um dessecador em temperatura ambiente no escuro por aproximadamente um ano após a colheita. Foi relatado que as mitocôndrias no embrião se movem ativamente e mudam dinamicamente a morfologia após a embebição e transferência para condições de germinação24. Foi realizada uma imagem fluorescente de lapso de tempo das mitocôndrias em células intactas do endosperma após 3 h de embebição da semente e o movimento mitocondrial foi detectado (Filme Suplementar 1). As mitocôndrias no endosperma moveram-se imediatamente dentro do citosol após um curto período de embebição a 22 ° C. Após 1 dia de embebição das sementes a 22 ° C, foram observadas mitocôndrias em movimento mais dinâmico (Figura 4 e Filme Suplementar 2).
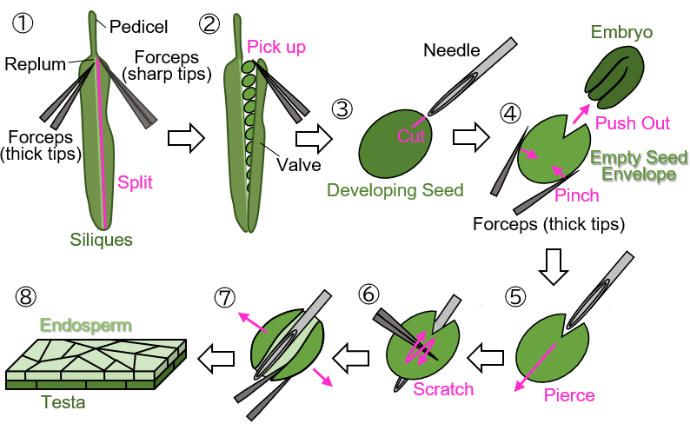
Figura 1: Preparação de amostras de endosperma a partir de sementes em desenvolvimento. Passo 1: Uma válvula é separada do replum. Passo 2: As sementes em desenvolvimento são coletadas. Passo 3: Uma cicatriz é criada no testa e no endosperma usando uma agulha de injeção. Passo 4: O embrião é removido beliscando a semente com uma pinça. Passo 5: A agulha de injeção é inserida através do envelope de sementes vazio de dentro para fora. Passo 6: A superfície da testa é arranhada com uma pinça. Passo 7: O envelope de sementes vazio é aberto em forma de folha usando uma pinça. Passo 8: A amostra final da folha de endosperma é preparada para observação microscópica. Todas as etapas são realizadas em papel de filtro úmido sob um microscópio estéreo. Clique aqui para ver uma versão maior desta figura.

Figura 2: Preparação de amostras de endosperma a partir de sementes maduras. Passo 1: As sementes secas são embebidas em água por mais de 40 min em um tubo de 1,5 mL. Passo 2: Uma cicatriz é criada na testa e no endosperma usando uma agulha de injeção. Passo 3: O embrião é removido beliscando a semente com uma pinça. Passo 4: Os lados superior e inferior do envelope de sementes vazio são cortados para moldá-lo em um cilindro. Passo 5: O envelope de sementes vazio de formato cilíndrico é cortado ao longo de seu eixo central. Passo 6: A amostra final da folha de endosperma é preparada para observação microscópica. Todas as etapas são realizadas em papel de filtro úmido sob um microscópio estéreo. Clique aqui para ver uma versão maior desta figura.

Figura 3: Imagem fluorescente de uma camada de células de endosperma intacta usando sementes em desenvolvimento. Amostras intactas da camada de células do endosperma foram preparadas a partir do desenvolvimento de sementes de siliques 14-day-after-flowering (DAF) (A,B) e 17-18 siliques DAF (C). A imagem microscópica foi realizada usando um microscópio confocal de varredura a laser equipado com uma lente objetiva Plan-Apochromat 63× de imersão em óleo e um laser de luz branca. (A) Uma imagem confocal do endosperma sob contraste de interferência diferencial (DIC) mostra grandes áreas com numerosas células intactas do endosperma. Barra de escala: 20 μm. (B) Imagens confocais do endosperma expressando PHYB-GFP são mostradas, com PHYB-GFP em verde e autofluorescência de clorofila em ciano. Os fotocorpos (PBs) em um núcleo são indicados por pontas de setas brancas. Barras de escala: 10 μm; Barra de escala de imagem ampliada: 2,5 μm. O sinal GFP foi separado da autofluorescência de vacúolos de armazenamento de proteínas (PSVs) usando microscopia de fluorescência (FLIM). Os tempos de vida de fluorescência foram obtidos usando TauScan e separados usando a função TauSeparação. O tempo médio de vida de fluorescência para GFP foi de 2,2 ns. A fluorescência GFP foi excitada a 488 nm e coletada entre 500-530 nm, enquanto a autofluorescência da clorofila foi excitada a 405 nm e coletada entre 688-729 nm. (C) São apresentadas imagens confocais do endosperma expressando PHYB-GFP sob luz branca contínua (cWL), luz vermelha distante contínua (cFR) ou luz vermelha contínua (cR). PHYB-GFP é mostrado em verde e a autofluorescência do PSV é mostrada em magenta. Barras de escala: 10 μm; Barra de escala de imagem ampliada: 2,5 μm. Intensidades de luz: WL, 46,5 μmol/m2/s; FR, 35,2 μmol/m2/s; R, 18,6 μmol/m2/s. A autofluorescência do PSV foi excitada a 561 nm e coletada entre 565-621 nm. O sinal GFP foi separado usando o mesmo método descrito acima. Clique aqui para ver uma versão maior desta figura.
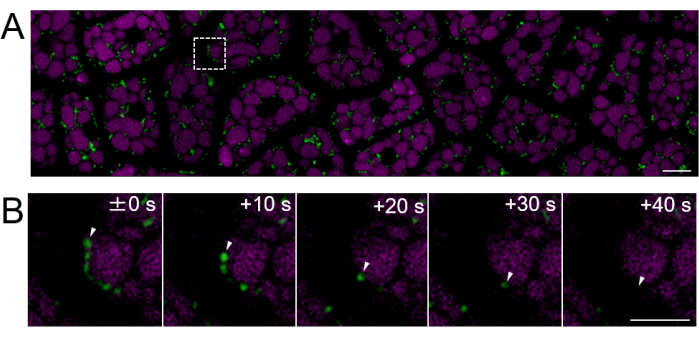
Figura 4: Imagem fluorescente de células vivas de uma camada de células de endosperma intacta usando sementes maduras. A imagem microscópica foi realizada pelo mesmo método descrito na Figura 3. (A) Uma imagem confocal de toda a camada de células do endosperma intacta, obtida do Filme Suplementar 2, é mostrada. As mitocôndrias são marcadas em verde e a autofluorescência do PSV é marcada em magenta. Barra de escala: 10 μm. (B) Uma série de lapso de tempo de imagens ampliadas da área quadrada da linha tracejada no painel (A) mostra o movimento de uma mitocôndria, indicado por pontas de setas brancas. Barra de escala: 5 μm. Clique aqui para ver uma versão maior desta figura.
Filme Suplementar 1: Um vídeo de lapso de tempo de mtGFP na camada de células do endosperma de uma semente madura 3 h após a embebição é mostrado. Um quadro foi tirado a cada 10 s e a taxa de quadros do vídeo é de 10 quadros / s. Barra de escala: 10 μm. Clique aqui para baixar este arquivo.
Filme Suplementar 2: Um vídeo de lapso de tempo de mtGFP na camada de células do endosperma de uma semente madura 1 dia após a embebição é mostrado. Um quadro foi tirado a cada 10 s e a taxa de quadros do vídeo é de 10 quadros / s. Barra de escala: 10 μm. Clique aqui para baixar este arquivo.
Discussão
Os papéis do endosperma na germinação de sementes foram revelados por meio de análises genéticas e bioquímicas usando tecidos separados de sementes, como análise de expressão gênica e quantificação de lipídios e fitohormônios 9,14,25,26,27. Um ensaio de acamamento do tegumento de sementes in vitro, combinando o envelope vazio da semente (endosperma e testa) com um embrião isolado de diferentes mutantes de Arabidopsis, descobriu mecanismos moleculares subjacentes aos processos de germinação 14,15,16,28. No entanto, a preparação da amostra para observação microscópica tem sido um desafio devido ao pequeno tamanho das sementes de Arabidopsis e à localização da camada de células do endosperma abaixo da testa. Em particular, a observação da camada de células do endosperma durante o desenvolvimento da semente raramente foi realizada sem fixação e seccionamento químico.
Durante a preparação da amostra, o envelope vazio das sementes em desenvolvimento é frágil porque a testa está viva e, portanto, macia. Aqui, dois protocolos foram estabelecidos para a preparação rápida de amostras intactas da camada de células do endosperma adequadas para observação e análise microscópica em sementes em desenvolvimento sem a necessidade de fixação ou seccionamento. No caso de preparação de amostras de sementes maduras, a testa é morta e resistente, fazendo com que o envelope vazio da semente retenha sua curvatura quando montado em um vidro deslizante. Essa curvatura dificulta a observação clara da camada de células do endosperma em uma ampla faixa de foco. Portanto, o método de dissecação para o desenvolvimento de sementes foi ligeiramente modificado para aparar adequadamente o envelope vazio das sementes. Ao separá-lo em duas partes usando este método, foi alcançada uma observação clara de numerosas células do endosperma, mantendo o foco.
Vários reagentes de imagem (para coloração de DNA, espécies reativas de oxigênio, compartimentos ácidos, etc.) foram desenvolvidos, e alguns foram aplicados em plantas de Arabidopsis 29,30,31,32. Amostras da camada de células do endosperma preparadas usando este protocolo já foram utilizadas para observação microscópica com coloração LysoTracker e Iodeto de Propídio, contribuindo para a avaliação da função do endosperma17. Desde a descoberta da GFP em 196233, as proteínas marcadas com GFP tornaram-se ferramentas essenciais para elucidar a dinâmica das estruturas intracelulares 23,24,34,35,36,37,38. Preparando amostras de endosperma de acordo com este protocolo e empregando os métodos acima mencionados, é possível realizar imagens de células vivas do endosperma durante o desenvolvimento e germinação das sementes, conforme mostrado na Figura 3 e Figura 4, elucidando assim eventos intracelulares e a localização de proteínas específicas. Além disso, espera-se que a aplicação de inibidores específicos (como inibidores de protease, inibidores de enzimas de modificação de proteínas e inibidores da dinâmica celular) 39 , 40 , 41 , 42 a células vivas do endosperma usando este protocolo forneça informações mais profundas sobre os eventos intracelulares e mecanismos moleculares subjacentes à função do endosperma durante o desenvolvimento e germinação das sementes.
Uma limitação deste protocolo é que as camadas de células do endosperma de sementes completamente secas não podem ser preparadas porque é difícil separar as sementes no embrião e no envelope vazio da semente. Conforme mostrado na Figura 2, é necessário um tempo de embebição de pelo menos 40 min para separar as sementes maduras. É importante notar que vários eventos celulares dentro das células do endosperma podem ser induzidos na embebição. Outra limitação é que este protocolo não permite a observação do tecido do endosperma durante os estágios iniciais do desenvolvimento da semente, particularmente antes dos 10 DAF, pois é projetado especificamente para observar a camada de endosperma unicelular. Durante esses estágios iniciais, o tecido que precede a formação da camada de endosperma unicelular - um endosperma não estratificado - preenche o interior das sementes em desenvolvimento43, dificultando a preparação de amostras de endosperma.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Agradecemos aos Drs. Matsushita e Oka da Universidade de Kyoto por fornecerem o mutante phyB que expressa PHYB-GFP impulsionado pelo promotor 35S. Este estudo foi parcialmente apoiado por uma Bolsa de Auxílio para Pesquisa Científica em Áreas Inovadoras, Pesquisa em uma Área de Pesquisa Proposta (19H05713 para K.Y.).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
Referências
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179 (2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202 (2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121 (2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394 (2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732 (2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650 (2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510 (2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -. C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -. H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados