Method Article
Preparation of intact tissue for microscopic analysis of the endosperm cell layer in Developing and mature Arabidopsis seeds(개발 및 성숙한 애기장대 종자에서 배유 세포층의 현미경 분석을 위한 온전한 조직의 준비)
요약
이 프로토콜은 Arabidopsis thaliana 종자에서 배유 세포층의 온전한 샘플을 준비하는 방법을 설명합니다. 이 방법은 주사 바늘 및 정밀 겸자와 같은 일반적인 실험실 장비만 필요하며 개발 중인 종자와 성숙한 종자 모두에서 배유 세포의 고해상도 형광 라이브 셀 이미징을 가능하게 합니다.
초록
애기장대(Arabidopsis) 종자에서 배아와 고환 사이에 위치한 살아있는 세포의 단일층인 배유(endosperm)는 종자의 성숙, 휴면 및 발아를 조절하는 데 중요한 역할을 합니다. 온전한 배유 세포의 현미경 분석은 세포 및 분자 수준에서 배유의 생리학적 기능을 이해하는 데 필수적입니다. 그러나 애기장대 씨앗의 크기가 작고 고환 아래에 배유 세포층이 있기 때문에 샘플 준비가 어려웠습니다. 이 기사는 개발 중인 종자와 성숙한 종자 모두에서 현미경 관찰 및 분석에 적합한 온전한 배유 세포층 샘플의 준비에 대해 자세히 설명합니다. 이 방법을 사용하면 고정이나 절편 없이 넓은 영역과 수많은 온전한 배유 세포를 관찰할 수 있습니다. 또한 이 프로토콜은 주삿바늘, 정밀 겸자 및 실체 현미경과 같은 표준 실험실 장비만 사용합니다. 이 접근 방식은 온전한 배유 세포에서 녹색 형광 단백질(GFP)과 같은 형광 신호의 고해상도 라이브 셀 이미징을 가능하게 합니다. 이 방법을 사용하면 다양한 애기장대 돌연변이의 배유 세포에서 세포 내 국소화 및 다양한 단백질의 이동뿐만 아니라 세포 소기관의 형태를 관찰할 수 있습니다. 이 프로토콜은 새로운 배유 기능의 규명에 기여하고 이 필수 조직의 세포 및 분자 연구의 잠재력을 확장합니다.
서문
식물은 고착성 유기체이기 때문에 종자 발아는 식물의 운명을 결정하는 중요한 사건입니다. 발아 결정은 1 차 종자 휴면 수준, 온도, 빛의 강도 및 파장, 질소 농도 1,2,3,4,5,6과 같은 내부 및 환경 요인에 의해 엄격하게 규제됩니다. 종자는 여러 조직 유형으로 구성된 복잡한 구조를 가지고 있습니다7. 애기장대(Arabidopsis)의 건조 종자(dry seeds)에서, 묘목으로 발달하는 배아(embryo)는 배유(endosperm)의 단일 층과 가장 바깥쪽 층인 고환(testa)으로 둘러싸여 있습니다. 고환은 여러 층의 죽은 세포로 구성되어 있는 반면, 배아와 배유는 건조한 씨앗에서도 살아 있습니다. 배유는 일반적으로 배아 성장에 영양분을 제공하는 저장 조직으로 간주되며, 고환과 함께 라디클 돌출부에 기계적 저항을 부여합니다 8,9,10,11,12,13.
최근의 여러 연구에서 배유가 최적의 종자 발아를 조절하는 데 필수적인 역할을 한다는 것이 입증되었습니다 14,15,16,17. 예를 들어, 배유 세포의 광수용체 피토크롬 B(PHYB)는 적색(R) 또는 원적외선(FR)을 감지하여 발아 반응을 조절합니다15. 배유는 또한 온도 감지 조직으로 기능하여 고온에서 발아 반응을 억제합니다16. 배유의 품질 관리는 최적의 종자 발아를 위해 매우 중요하며, 특히 장기 저장된 종자에서 중요하다17.
이제 배유의 생리학적 기능을 더 자세히 설명하기 위해 살아있는 세포 이미징이 필요합니다. 형광 표지 단백질을 발현하는 온전한 배유 세포의 현미경 분석을 통해 배유가 종자 발아를 조절하는 분자 메커니즘을 조사할 수 있습니다. 그러나 현미경 관찰을 위해 온전한 배유 세포를 준비하는 것은 특히 애기장대 종자에서 어려운 일입니다. 씨앗은 직경이 약 0.4mm이고 배유는 배아와 고환 사이에 위치한 단세포층으로 정확한 조작이 어렵습니다. 결과적으로, 중요한 생리학적 역할에도 불구하고 배유는 생세포 이미징을 사용하여 거의 관찰되지 않았습니다.
이 논문은 개발 중인 종자와 성숙한 종자 모두에서 살아있는 세포 이미징에 적합한 온전한 배유 세포층 샘플의 신속한 준비를 위한 프로토콜을 제시합니다.
프로토콜
이 연구에서는 살아있는 배유 세포층 샘플의 준비를 위해 두 가지 다른 절차가 확립되었습니다 : 하나는 종자 개발을위한 것이고 다른 하나는 성숙한 종자를위한 것입니다. testa의 견고성에 따라 약간 다른 접근 방식이 필요합니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 종자 개발에서 온전한 배유 샘플 준비
- 실리크 수집
- 꽃이 필 때까지 토양이나 암면에 애기장대 식물을 재배하십시오.
- 색이 있는 실로 꽃을 완전히 연 것으로 표시합니다(개화 후 0일, 0 DAF).
참고: 꽃을 표시하기 위해 녹색, 노란색 또는 갈색 실을 사용하지 마십시오., 이러한 색상은 성장하거나 성숙한 식물 및 실리크와 구별하기 어렵기 때문입니다. - 꽃자루에서 표시된 발달 중인 실리크( 그림 1(1) 참조)를 잘라내고 1.5mL 튜브에 수집합니다.
참고: 12-16 DAF의 발달 실리크는 이 프로토콜을 사용하여 제조하는 데 적합합니다.
- 발달 중인 씨앗의 해부
알림: 샘플을 건조로부터 보호하기 위해 젖은 여과지에서 다음 단계를 수행해야 합니다. 조작은 실체 현미경으로 수행해야 합니다.- 두 개의 집게를 사용하여 replum(그림 1(2) 참조)에서 판막(그림 1(1) 참조)을 분리합니다. 하나는 잡기 위한 두꺼운 끝이 있고 다른 하나는 찢어지기 위한 날카로운 끝이 있습니다.
- 씨앗이 손상되지 않도록 끝을 닫은 상태에서 집게를 사용하여 실리케에서 자라는 씨앗을 부드럽게 집습니다(그림 1(2)).
- 종자를 충돌시키지 않고 집게로 종자를 잡고 주사 바늘(27G, 0.40mm × 19mm)을 사용하여 배아를 둘러싼 고환과 배유에 약 0.2mm 크기의 흉터를 만듭니다(그림 1(3)).
참고: 흉터를 만들기위한 최적의 위치는 자엽과 라디클의 접합부입니다. - 집게로 씨앗을 꼬집어 배아를 밀어냅니다(그림 1(4)). 고환과 배유로 구성된 빈 종자 외피를 부수지 말고 둥근 모양을 유지하려고 노력하십시오.
- 흉터의 빈 종자 봉투에 주사 바늘을 삽입하고 안쪽에서 바깥쪽으로 뚫습니다(그림 1(5)).
- 바늘을 제자리에 유지하고 끝을 닫은 상태에서 집게를 사용하여 고환 표면을 긁고 빈 종자 봉투의 한쪽 면을 잘라 열 수 있도록 합니다(그림 1(6)).
- 끝이 날카로운 집게를 사용하여 빈 씨앗 봉투를 시트로 엽니다(그림 1(7)). 이제 샘플은 배유 층과 고환 층으로 구성된 이중층 시트로 분리되어야 합니다(그림 1(8)).
알림: 아래 3단계에서 물을 장착 매체로 사용할 때 샘플이 말리는 경향이 있는 경우 시트 형태의 샘플을 두 조각으로 나눕니다. 약 18 DAF(이 단계에서 testa는 갈색이지만 아직 완전히 건조되지 않음)에서 실리크에서 수확한 종자도 이 프로토콜을 사용하여 처리할 수 있지만 준비하기 전에 몇 분 동안 종자를 흡수해야 합니다.
2. 성숙한 종자에서 온전한 배유 샘플의 준비
- 성숙한 씨앗의 흡수
- 건조 애기장대 씨앗이 들어 있는 1.5mL 튜브에 이중 증류수 1mL를 추가합니다.
- 씨앗을 실온에서 최소 40분 동안 흡수된 상태로 유지합니다(그림 2(1)).
참고: 흡수 후 40분 이내에 건조 종자 및 종자는 고환과 배유에 흉터를 남기고 2.2.1 및 2.2.2 단계에서 빈 종자 외피를 손상시키지 않고 종자 내부에서 배아를 제거하기 어려운 반면, 흡수 시간이 길면 조작이 용이합니다. - 1000μL 마이크로피펫을 사용하여 흡수된 씨앗을 젖은 여과지에 옮깁니다.
- 성숙한 씨앗의 해부
알림: 샘플을 건조로부터 보호하기 위해 젖은 여과지에서 다음 단계를 수행해야 합니다. 조작은 실체 현미경으로 수행해야 합니다.- 종자를 충돌시키지 않고 집게로 종자를 잡고 주사 바늘을 사용하여 배아를 둘러싼 고환과 배유에 약 0.2mm 크기의 흉터를 만듭니다(그림 2(2)).
- 집게로 씨앗을 꼬집어 배아를 밀어냅니다(그림 2(3)). 고환과 배유를 포함하는 빈 종자 봉투를 부수지 마십시오. 둥근 모양을 유지하십시오.
- 빈 종자 봉투의 위쪽과 아래쪽을 주사 바늘로 잘라 실린더 모양으로 만듭니다(그림 2(4)).
- 원통형 모양의 빈 종자 봉투를 중심축을 따라 잘라 두 조각으로 분리합니다(그림 2(5)). 샘플은 배유층(endosperm layer)과 고환층(testa layer)으로 구성된 이중층 시트(bilayer sheet)로 분리되어야 합니다(그림 2(6)).
3. 현미경 관찰
- 배유 샘플을 시트 형태로 유리 슬라이드에 놓고 물 또는 과불화데칼린(PFD)에 장착합니다.
참고: 샘플과 커버슬립 사이에 기포가 남아 있는 경우, 잎18,19와 같은 공기 주머니를 포함하는 샘플을 이미징하는 데 특히 유용한 것으로 보고된 PFD(perfluorodecalin)가 유용할 것입니다. PFD는 표면 장력이 가장 낮은 것으로 알려져 있어 시료 표면의 공기 공간을 쉽게 채울 수 있습니다. 그러나 타임랩스 이미징의 경우 세포 유동성을 유지하기 위해 성숙한 씨앗의 수분 함량이 풍부해야 하므로 물을 장착 매체로 사용하는 것이 좋습니다. - 커버 슬립을 샘플 위에 부드럽게 놓습니다. 배유 층이 커버 슬립을 향하고 있는지 확인하십시오.
알림: 매니큐어나 그리스를 사용하여 커버슬립의 가장자리를 밀봉하여 샘플과 장착 매체의 건조를 방지할 수 있습니다.
결과
그림 1에 표시된 프로토콜을 사용하여 14 DAF에서 실리크에서 수확한 종자를 개발하여 배유 샘플을 준비했습니다(이 단계에서 testa는 여전히 녹색입니다). 넓은 지역에 걸쳐 수많은 배유 세포와 세포 내 구조가 관찰되었습니다(그림 3A). 이 실험에서는 C-말단에서 GFP와 융합된 PHYB를 발현하는 종자(PHYB-GFP)를 사용했습니다. PHYB는 적색광에 의해 활성화될 때 핵으로 전위되고 종자 발아에 관여하는 광체(PB)로 알려진 PHYB 양성 반점을 형성한다는 것은 잘 알려져 있습니다 4,20,21,22. 샘플은 22°C에서 연속적인 백색광 조건에서 자란 식물에서 수확했습니다. 그림 3B에서 볼 수 있듯이, 핵 내의 PB는 배유 세포에서 검출되었습니다. 이 결과는 배유의 PHYB가 최적의 종자 발아를 조절한다는 것을 보여주는 이전 연구와 일치합니다15. 또한, 피토크롬 FR/R 광가역성을 관찰하여 시료 전처리 후에도 분리된 배유 세포가 생물학적 활성을 유지하는지 확인하기 위해 생세포 타임 랩스 이미징을 수행했습니다(그림 3C). 배유 샘플은 약 17-18 DAF에서 실리케에서 수확한 종자를 개발하여 준비되었습니다. PB는 해부 시 핵 내에서 검출된 반면, 원적외선으로 조사된 후에는 완전히 사라졌습니다. 그 후, 적색광 조사는 다시 PB를 유도했습니다. 이 피토크롬 광가역성은 두 번 검출되었으며, 이는 이 프로토콜에 의해 분리된 배유 세포가 해부 후 최소 4.5시간 동안 생물학적 활성을 유지했음을 나타냅니다(그림 3C).
다음으로, 그림 2와 같이 성숙한 종자(고환이 갈색인 경우)의 배유 샘플을 준비했습니다. 이 실험에서는 수확 후 약 1년 동안 실온의 암흑 속 건조제에 보관된 미토콘드리아 표적 GFP(mtGFP)23을 발현하는 씨앗을 사용하여 미토콘드리아의 운동성을 관찰했습니다. 배아의 미토콘드리아는 흡수 후 활발하게 움직이고 형태를 동적으로 변화시켜 발아 조건으로 전환되는 것으로 보고되었습니다24. 종자 흡수 3시간 후 온전한 배유 세포에서 미토콘드리아의 형광 저속 촬영을 수행하고 미토콘드리아 움직임을 감지했습니다(보충 동영상 1). 배유의 미토콘드리아는 22°C에서 짧은 기간 동안 흡수한 후 세포질 내에서 즉시 이동했습니다. 22°C에서 종자를 1일 동안 흡수한 후 보다 동적으로 움직이는 미토콘드리아가 관찰되었습니다(그림 4 및 보충 동영상 2).
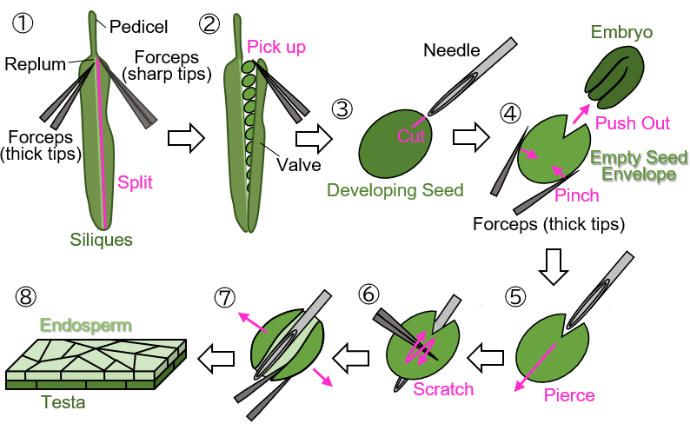
그림 1: 종자 개발로 인한 배유 시료 준비. 1단계: 판막이 replum에서 분리됩니다. 2단계: 발달 중인 씨앗을 수집합니다. 3단계: 주사 바늘을 사용하여 고환과 배유에 흉터를 만듭니다. 4단계: 배아는 집게로 씨앗을 꼬집어 제거합니다. 5단계: 주사 바늘을 빈 종자 봉투를 통해 안쪽에서 바깥쪽으로 삽입합니다. 6단계: 고환의 표면을 겸자를 사용하여 긁습니다. 7단계: 빈 씨앗 봉투를 집게를 사용하여 시트 형태로 엽니다. 8단계: 현미경 관찰을 위해 최종 배유 시트 샘플을 준비합니다. 모든 단계는 실체 현미경으로 젖은 여과지에서 수행됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 성숙한 종자에서 배유 시료 준비. 1단계: 건조 씨앗을 1.5mL 튜브에 40분 이상 물에 담근다. 2단계: 주사 바늘을 사용하여 고환과 배유에 흉터를 만듭니다. 3단계: 집게로 씨앗을 꼬집어 배아를 제거합니다. 4 단계 : 빈 종자 봉투의 위쪽과 아래쪽을 잘라 실린더 모양으로 만듭니다. 5단계: 원통형 모양의 빈 종자 봉투를 중심축을 따라 절단합니다. 6단계: 현미경 관찰을 위해 최종 배유 시트 샘플을 준비합니다. 모든 단계는 실체 현미경으로 젖은 여과지에서 수행됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 개발 중인 씨앗을 사용한 온전한 배유 세포층의 형광 이미징. 14일 개화 후 실리크(DAF) 실리크(A, B) 및 17-18 DAF 실리크(C)의 개발 종자로부터 온전한 배유 세포층 샘플을 준비했습니다. 현미경 이미징은 Plan-Apochromat 63× 오일 이멀젼 대물 렌즈와 백색광 레이저가 장착된 컨포칼 레이저 스캐닝 현미경을 사용하여 수행되었습니다. (A) 미분 간섭 대비(differential interference contrast, DIC) 하에서 배유의 컨포칼 이미지는 수많은 온전한 배유 세포가 있는 넓은 영역을 보여줍니다. 눈금 막대: 20μm. (B) PHYB-GFP를 발현하는 배유의 공초점 이미지가 표시되며, PHYB-GFP는 녹색, 엽록소 자가형광은 청록색입니다. 핵의 광체(PB)는 흰색 화살촉으로 표시됩니다. 눈금 막대 : 10 μm; 확대 이미지 스케일 바 : 2.5 μm. GFP 신호는 FLIM(Fluorescence-Lifetime Microscopy)을 사용하여 단백질 저장 액포(PSV)의 자가형광에서 분리되었습니다. 형광 수명은 TauScan을 사용하여 얻었으며 TauSeparation 기능을 사용하여 분리했습니다. GFP의 평균 형광 수명은 2.2ns였습니다. GFP 형광은 488 nm에서 여기되고 500-530 nm 사이에서 수집되었으며, 엽록소 자가형광은 405 nm에서 여기되고 688-729 nm 사이에서 수집되었습니다. (C) 연속 백색광(cWL), 연속 원적외선(cFR) 또는 연속 적색광(cR) 하에서 PHYB-GFP를 발현하는 배유의 컨포칼 이미지가 제시됩니다. PHYB-GFP는 녹색으로, PSV 자가형광은 자홍색으로 표시됩니다. 눈금 막대 : 10 μm; 확대 이미지 스케일 바 : 2.5 μm. 광도: WL, 46.5 μmol/m2/s; FR, 35.2 μmol / m2 / s; R, 18.6 μmol / m2 / s. PSV 자가형광은 561 nm에서 여기되고 565-621 nm 사이에서 수집되었습니다. GFP 신호는 상술한 동일한 방법을 사용하여 분리하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
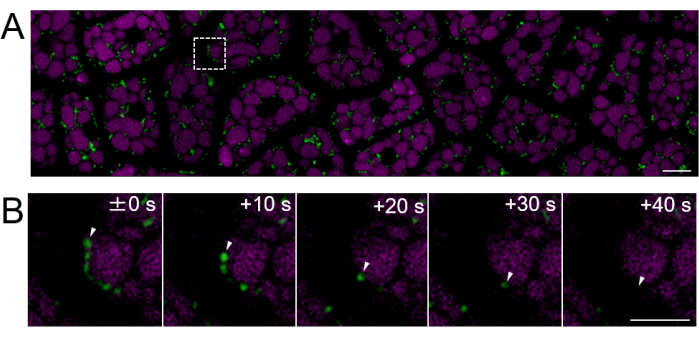
그림 4: 성숙한 씨앗을 사용한 온전한 배유 세포층의 형광 살아있는 세포 이미징. 현미경 이미징은 그림 3에 설명된 것과 동일한 방법을 사용하여 수행되었습니다. (A) 보충 동영상 2에서 얻은 전체 온전한 배유 세포층의 컨포칼 이미지가 표시됩니다. 미토콘드리아는 녹색으로 표시되고 PSV 자가형광은 자홍색으로 표시됩니다. 눈금자: 10 μm. (B) 패널 (A)의 점선 사각형 영역에서 확대된 이미지의 타임랩스 시리즈는 흰색 화살촉으로 표시된 미토콘드리아의 움직임을 보여줍니다. 스케일 바: 5μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 영화 1: 흡수 3시간 후 성숙한 종자의 배유 세포층에 있는 mtGFP의 타임랩스 비디오가 표시됩니다. 10초마다 한 프레임씩 촬영되었으며 비디오의 프레임 속도는 10프레임/초입니다. 눈금 막대 : 10 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 영화 2: 흡수 1일 후 성숙한 종자의 배유 세포층에 있는 mtGFP의 타임랩스 비디오가 표시됩니다. 10초마다 한 프레임씩 촬영되었으며 비디오의 프레임 속도는 10프레임/초입니다. 눈금 막대 : 10 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
종자 발아에서 배유의 역할은 유전자 발현 분석 및 지질 및 식물 호르몬의 정량화와 같은 분리 된 종자 조직을 사용하는 유전 및 생화학 분석을 통해 밝혀졌습니다9 , 14 , 25 , 26 , 27. 빈 종자 외피(배유 및 고환)를 다른 애기장대 돌연변이에서 분리된 배아와 결합한 시험관 내 종피 침구 분석은 발아 과정의 기초가 되는 분자 메커니즘을 밝혔습니다 14,15,16,28. 그러나 현미경 관찰을 위한 샘플 준비는 애기장대 씨앗의 크기가 작고 고환 아래 배유 세포층의 위치로 인해 어려웠습니다. 특히, 종자 발달 중 배유 세포층의 관찰은 화학적 고정 및 절단 없이 거의 수행되지 않았습니다.
시료 전처리 과정에서 발육 중인 종자의 빈 종자 외피는 고환이 살아 있어 부드럽기 때문에 깨지기 쉽습니다. 여기서, 고정 또는 절편을 필요로 하지 않고 종자 개발에서 현미경 관찰 및 분석에 적합한 온전한 배유 세포층 샘플의 신속한 준비를 위해 두 가지 프로토콜이 확립되었습니다. 성숙한 종자에서 시료를 준비하는 경우, testa는 죽고 견고하여 빈 종자 외피가 슬라이드 유리에 장착될 때 곡률을 유지합니다. 이 곡률은 광범위한 초점에서 배유 세포층을 명확하게 관찰하기 어렵게 만듭니다. 따라서 종자를 개발하기 위한 해부 방법은 빈 종자 외피를 적절하게 다듬기 위해 약간 수정되었습니다. 이 방법을 사용하여 두 조각으로 분리함으로써 초점을 유지하면서 수많은 배유 세포를 명확하게 관찰할 수 있었습니다.
다양한 이미징 시약(DNA, 활성 산소 종, 산성 구획 등을 염색하기 위한)이 개발되었으며, 일부는 애기장대 식물에 적용되었습니다 29,30,31,32. 이 프로토콜을 사용하여 준비된 배유 세포층 샘플은 이미 LysoTracker 및 Propidium Iodide 염색을 통한 현미경 관찰에 활용되어 배유 기능 평가에 기여했습니다17. 1962년 33 년 GFP의 발견 이후, GFP 태그를 붙인 단백질은 세포 내 구조 23,24,34,35,36,37,38의 역학을 설명하기위한 필수 도구가되었습니다. 이 프로토콜에 따라 배유 샘플을 준비하고 앞서 언급한 방법을 사용하면 그림 3 및 그림 4와 같이 종자 발달 및 발아 중에 배유의 살아있는 세포 이미징을 수행하여 세포 내 이벤트 및 특정 단백질의 국소화를 설명할 수 있습니다. 또한, 이 프로토콜을 사용하여 살아있는 배유 세포에 특정 억제제(예: 프로테아제 억제제, 단백질 변형 효소 억제제 및 세포 역학 억제제)39,40,41,42를 적용하면 종자 발달 및 발아 중 배유 기능의 기저에 있는 세포 내 사건 및 분자 메커니즘에 대한 더 깊은 통찰력을 제공할 것으로 예상됩니다.
이 프로토콜의 한 가지 한계는 완전히 건조된 종자의 배유 세포층을 준비할 수 없다는 것인데, 이는 종자를 배아와 빈 종자 외피로 분리하는 것이 어렵기 때문입니다. 그림 2에서 볼 수 있듯이 성숙한 씨앗을 분리하려면 최소 40분의 흡수 시간이 필요합니다. 배유 세포 내의 여러 세포 사건이 흡수 시 유도될 수 있다는 점에 유의하는 것이 중요합니다. 또 다른 한계는 이 프로토콜이 단세포 배유층을 관찰하기 위해 특별히 설계되었기 때문에 종자 발달의 초기 단계, 특히 10 DAF 이전에 배유 조직의 관찰을 허용하지 않는다는 것입니다. 이러한 초기 단계에서는 단세포 배유층(single-cell endosperm layer)이 형성되기 전의 조직(층이 없는 배유)이 발달 중인 종자(seed) 43의 내부를 채우고 있어 배유 샘플을 준비하기 어렵게 만듭니다.
공개
저자는 경쟁하는 재정적 이해관계가 없다고 선언합니다.
감사의 말
35S 프로모터에 의해 주도되는 PHYB-GFP를 발현하는 phyB 돌연변이를 제공한 교토 대학의 Matsushita와 Oka 박사에게 감사드립니다. 이 연구는 혁신 분야에 대한 과학 연구를 위한 보조금, 제안된 연구 분야의 연구(19H05713에서 K.Y.)의 일부 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
참고문헌
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179 (2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202 (2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121 (2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394 (2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732 (2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650 (2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510 (2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -. C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -. H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유