Method Article
用于发育中和成熟 拟南芥 种子胚乳细胞层显微分析的完整组织的制备
摘要
该方案描述了拟南 芥 种子中胚乳细胞层完整样品的制备。该方法只需要常见的实验室设备,例如注射针和精密镊子,并能够对发育中和成熟种子中的胚乳细胞进行高分辨率荧光活细胞成像。
摘要
在 拟南芥 种子中,胚乳是位于胚胎和睾丸之间的单层活细胞,在调节种子成熟、休眠和发芽方面起着关键作用。完整胚乳细胞的显微分析对于在细胞和分子水平上了解胚乳的生理功能至关重要。然而,由于 拟南芥 种子的小尺寸和胚乳细胞层位于睾丸下方,样品制备一直具有挑战性。本文详细介绍了适用于发育中和成熟种子的显微镜观察和分析的完整胚乳细胞层样品的制备。这种方法能够观察大面积和大量完整的胚乳细胞,而无需固定或切片。此外,该方案仅使用标准实验室设备,例如注射针、精密镊子和体视显微镜。这种方法成功地实现了完整胚乳细胞中荧光信号的高分辨率活细胞成像,例如绿色荧光蛋白 (GFP)。该方法允许观察不同 拟南芥 突变体的胚乳细胞中各种蛋白质的细胞内定位和运动,以及细胞器的形态。该方案有助于阐明新的胚乳功能,并扩大了这种重要组织的细胞和分子研究的潜力。
引言
因为植物是无柄生物,所以种子发芽是决定其命运的关键事件。发芽的决定受到内部和环境因素的严格控制,例如初级种子休眠水平、温度、光强度和波长以及氮浓度 1,2,3,4,5,6。种子具有由多种组织类型组成的复杂结构7。在拟南芥干种子中,发育成幼苗的胚胎被单层胚乳和最外层的睾丸包围。睾丸由多层死细胞组成,而胚胎和胚乳即使在干燥的种子中也保持活力。胚乳通常被认为是一种储存组织,为胚胎生长提供营养,并与睾丸一起赋予对胚根突出的机械抵抗力 8,9,10,11,12,13。
最近的几项研究表明,胚乳在调节种子最佳发芽中起着至关重要的作用 14,15,16,17。例如,胚乳细胞中的感光器植物色素 B (PHYB) 可检测红光 (R) 或远红光 (FR) 光,从而调节发芽反应15。胚乳还起到温度感应组织的作用,在高温下抑制发芽反应16。胚乳的质量控制对于种子的最佳发芽至关重要,尤其是在长期储存的种子中17。
现在需要活细胞成像来进一步阐明胚乳的生理功能。对表达荧光标记蛋白的完整胚乳细胞进行显微分析,可以研究胚乳调节种子发芽的分子机制。然而,准备用于显微镜观察的完整胚乳细胞是具有挑战性的,尤其是在拟 南芥 种子中。种子直径约为 0.4 毫米,胚乳是位于胚胎和睾丸之间的单细胞层,因此难以精确作。因此,尽管胚乳具有重要的生理作用,但很少使用活细胞成像观察到胚乳。
本文提出了一种用于快速制备完整胚乳细胞层样品的方案,适用于发育中和成熟种子中的活细胞成像。
研究方案
在本研究中,建立了两种不同的程序来制备活的胚乳细胞层样品:一种用于发育种子,一种用于成熟种子。根据 Testa 的坚固性,需要略有不同的方法。所用试剂和设备的详细信息列在 材料表中。
1. 从发育中的种子中制备完整的胚乳样品
- 角果收集
- 在土壤或岩棉上种植 拟南芥 植物直到开花。
- 用彩色线标记完全开放的花(开花后 0 天,0 DAF)。
注意:避免使用绿色、黄色或棕色线来标记花朵,因为这些颜色很难与生长或成熟的植物和角果区分开来。 - 切掉花梗处标记的发育角果(如图 1(1) 所示)并将它们收集在 1.5 mL 管中。
注意:从 12-16 DAF 开发角果适合使用此方案进行制备。
- 解剖发育中的种子
注:必须在湿滤纸上执行以下步骤,以防止样品干燥。作应在立体显微镜下进行。- 使用两个镊子从 replum(如图 1(1) 中所示)中分离一个瓣膜(如图 1(2)所示):一个带有用于固定的粗尖端,另一个带有用于撕裂的尖锐尖端)。
- 使用镊子轻轻地从角果中拾取发育中的种子,尖端关闭,以避免损坏种子(图 1(2))。
- 用镊子夹住种子而不撞击种子,使用注射针(27 G、0.40 mm × 19 mm)在胚胎周围的睾丸和胚乳上留下约 0.2 毫米大小的疤痕(图 1(3))。
注意:形成疤痕的最佳位置是在子叶和胚根的交界处。 - 用镊子捏住种子,将胚胎推出(图 1(4))。不要压碎由睾丸和胚乳组成的空种子包,并尽量保持其圆形。
- 将注射针插入疤痕处的空种子信封中,从内到外刺穿(图 1(5))。
- 保持针头就位,用镊子在尖端闭合的情况下刮擦睾丸表面,然后切开空种子包膜的一侧以使其打开(图 1(6))。
- 使用带有锋利尖端的镊子将空种子信封打开到片材中(图 1(7))。现在应将样品分离为由胚乳和 testa 层组成的双层片状(图 1(8))。
注:如果在下面的步骤 3 中使用水作为封固剂时样品容易卷曲,请将片状样品分成两部分。从大约 18 DAF 的角果中收获的种子(在这个阶段,睾丸是棕色的,但尚未完全干燥)也可以使用该方案进行加工,尽管种子必须在制备前吸收几分钟。
2. 从成熟种子中制备完整的胚乳样品
- 成熟种子的吸收
- 将 1 mL 双蒸水加入含有干燥 拟南芥 种子的 1.5 mL 试管中。
- 将种子在室温下吸收至少 40 分钟(图 2(1))。
注意:干燥的种子和吸收后 40 分钟内的种子很难在睾丸和胚乳处留下疤痕,并且很难在步骤 2.2.1 和 2.2.2 中从种子内部取出胚胎而不会损坏空种子包膜,而较长的吸收时间有利于作。 - 使用 1000 μL 微量移液器将吸收的种子转移到湿滤纸上。
- 解剖成熟种子
注:必须在湿滤纸上执行以下步骤,以防止样品干燥。作应在立体显微镜下进行。- 用镊子夹住种子而不撞碎种子,使用注射针在胚胎周围的睾丸和胚乳上留下约 0.2 毫米大小的疤痕(图 2(2))。
- 用镊子捏住种子,将胚胎推出(图 2(3))。不要压碎空的种子包,其中包括睾丸和胚乳。尽量保持其圆形。
- 用注射针切割空种子包膜的上下侧,使其形成圆柱体(图 2(4))。
- 沿其中心轴切下圆柱形的空种子信封,将其分成两部分(图 2(5))。样品应分离为由胚乳层和 testa 层组成的双层片材 [图 2(6)]。
3. 显微镜观察
- 将胚乳样品以片状形式放在载玻片上,并将它们安装在水或全氟十氢萘 (PFD) 中。
注:如果样品和盖玻片之间仍有气泡,则全氟十氢萘 (PFD) 将很有用,据报道,全氟十氢萘 (PFD) 对于成像含有气穴的样品(如18,19 叶)特别有用。众所周知,PFD 具有最低的表面张力,使其能够轻松填充样品表面的空气空间。然而,对于延时成像,建议使用水作为封固剂,因为成熟种子中的水分含量应该丰富以维持细胞流动性。 - 将盖玻片轻轻地放在样品上。确保胚乳层面向盖玻片。
注:可以使用指甲油或润滑脂密封盖玻片的边缘,以防止样品和封固剂干燥。
结果
使用图 1 所示的方案,从从 14 DAF 的角果收获的发育种子中制备胚乳样品(在此阶段,睾丸仍然是绿色的)。观察到大面积上的大量胚乳细胞及其细胞内结构(图 3A)。在本实验中,使用了在 C 端表达 PHYB 与 GFP 融合的种子 (PHYB-GFP)。众所周知,PHYB 在被红光激活后易位到细胞核并形成 PHYB 阳性斑点,称为光体 (PB),参与种子发芽 4,20,21,22。样品是从 22 °C 连续白光条件下生长的植物中收获的。 如图 3B 所示,在胚乳细胞中检测到细胞核内的 PBs。这一结果与之前的一项研究相吻合,该研究显示胚乳中的 PHYB 调节最佳种子发芽15。此外,通过观察植物色素 FR/R 光可逆性,进行活细胞延时成像以确认即使在样品制备后分离的胚乳细胞仍保留生物活性(图 3C)。胚乳样品是从 17-18 DAF 左右的角果中收获的发育种子制备的。解剖时在细胞核内检测到 PBs,而在远红光照射后它们完全消失。随后,红光照射再次诱导 PBs。这种植物色素光可逆性被检测到两次,表明通过该方案分离的胚乳细胞在解剖后至少保留生物活性 4.5 小时(图 3C)。
接下来,制备来自成熟种子(睾丸是棕色的)的胚乳样品,如图 2 所示。在该实验中,使用表达线粒体靶向 GFP (mtGFP) 的种子观察线粒体的运动性23,该种子在收获后在室温下避光储存在干燥器中约一年。据报道,胚胎中的线粒体在吸水并转移到发芽条件后主动移动并动态改变形态24。对种子吸收 3 小时后完整胚乳细胞中线粒体的荧光延时成像,并检测线粒体运动(补充电影 1)。胚乳中的线粒体在 22 °C 下短暂吸水后立即在胞质溶胶内移动。 在 22 °C 下种子吸收 1 天后,观察到更动态移动的线粒体(图 4 和 补充电影 2)。
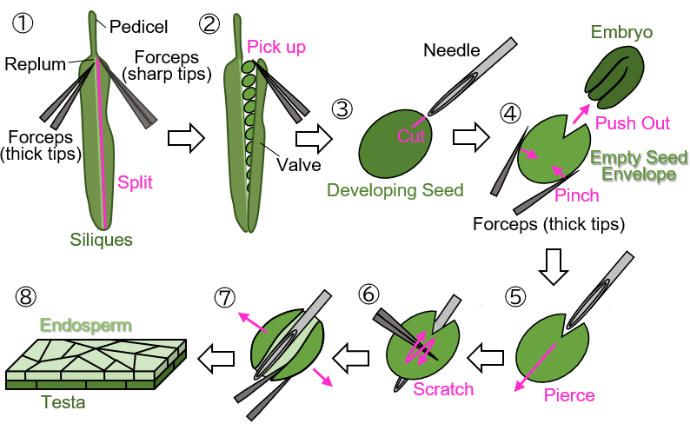
图 1:从发育中的种子制备胚乳样品。 第 1 步:从 replum 中分离出一个阀门。第 2 步:收集发育中的种子。第 3 步:使用注射针在睾丸和胚乳上留下疤痕。第 4 步:用镊子捏住种子取出胚胎。第 5 步:将注射针从内向外穿过空种子信封。第 6 步:用镊子刮擦睾丸表面。第 7 步:使用镊子将空的种子信封打开成片状。第 8 步:准备最终胚乳片状样品进行显微镜观察。所有步骤均在立体显微镜下在湿滤纸上进行。 请单击此处查看此图的较大版本。

图 2:成熟种子的胚乳样品制备。 第 1 步:将干燥的种子放入 1.5 mL 试管中浸入水中 40 分钟以上。第 2 步:使用注射针在睾丸和胚乳上形成疤痕。第 3 步:用镊子捏住种子取出胚胎。第 4 步:将空种子信封的上下两侧切成圆柱体。第 5 步:沿其中心轴线切割圆柱形的空种子包。第 6 步:准备最终胚乳片状样品进行显微镜观察。所有步骤均在立体显微镜下在湿滤纸上进行。 请单击此处查看此图的较大版本。

图 3:使用发育中的种子对完整的胚乳细胞层进行荧光成像。 从开花后 14 天 (DAF) 角果 (A,B) 和 17-18 个 DAF 角果 (C) 的发育种子制备完整的胚乳细胞层样品。使用配备 Plan-Apochromat 63× 油浸物镜和白光激光器的共聚焦激光扫描显微镜进行显微成像。(A) 微分干涉对比 (DIC) 下胚乳的共聚焦图像显示大面积有许多完整的胚乳细胞。比例尺:20 μm。(B) 显示了表达 PHYB-GFP 的胚乳的共聚焦图像,其中 PHYB-GFP 为绿色,叶绿素自发荧光为青色。原子核中的光体 (PB) 由白色箭头表示。比例尺:10 μm;放大的图像比例尺:2.5 μm。使用荧光寿命显微镜 (FLIM) 将 GFP 信号与蛋白质储存液泡 (PSV) 的自发荧光分离。使用 TauScan 获得荧光寿命,并使用 TauSeparation 功能进行分离。GFP 的平均荧光寿命为 2.2 ns。GFP 荧光在 488 nm 处激发并在 500-530 nm 之间收集,而叶绿素自发荧光在 405 nm 处激发并在 688-729 nm 之间收集。(C) 在连续白光 (cWL)、连续远红光 (cFR) 或连续红光 (cR) 下表达 PHYB-GFP 的胚乳的共聚焦图像。PHYB-GFP 显示为绿色,PSV 自发荧光显示为洋红色。比例尺:10 μm;放大的图像比例尺:2.5 μm。光强度:WL,46.5 μmol/m2/s;FR,35.2 μmol/m2/s;R,18.6 μmol/m2/s. PSV 自发荧光在 561 nm 处激发,并在 565-621 nm 之间收集。使用上述相同方法分离 GFP 信号。 请单击此处查看此图的较大版本。
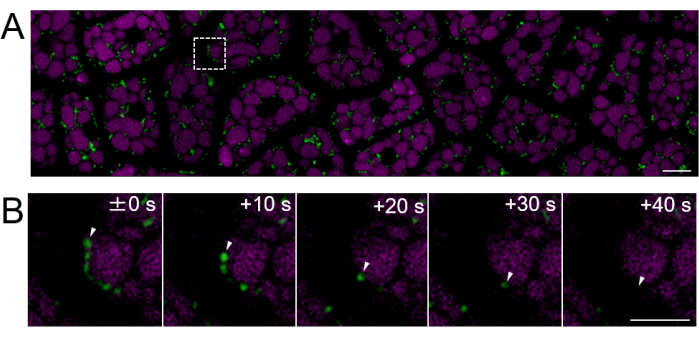
图 4:使用成熟种子的完整胚乳细胞层的荧光活细胞成像。 使用 图 3 中描述的相同方法进行显微成像。(A) 显示了从 Supplementary Movie 2 获得的整个完整胚乳细胞层的共聚焦图像。线粒体标记为绿色,PSV 自发荧光标记为品红色。比例尺:10 μm。(B) 来自面板 (A) 中虚线方形区域的一系列延时放大图像显示了线粒体的运动,由白色箭头表示。比例尺:5 μm。 请点击此处查看此图的较大版本。
补充电影 1: 显示了吸吸后 3 小时成熟种子胚乳细胞层中 mtGFP 的延时视频。每 10 秒拍摄 1 帧,视频帧率为 10 帧/秒。比例尺:10 μm。 请点击此处下载此文件。
补充电影 2: 显示了吸附后 1 天成熟种子胚乳细胞层中 mtGFP 的延时视频。每 10 秒拍摄 1 帧,视频帧率为 10 帧/秒。比例尺:10 μm。 请点击此处下载此文件。
讨论
通过使用分离的种子组织的遗传和生化分析,例如基因表达分析以及脂质和植物激素的定量,已经揭示了胚乳在种子发芽中的作用 9,14,25,26,27。体外种皮垫料测定,将空种子包(胚乳和 testa)与从不同拟南芥突变体分离的胚胎相结合,揭示了发芽过程的分子机制 14,15,16,28。然而,由于拟南芥种子的小尺寸和胚乳细胞层位于睾丸下方,用于显微镜观察的样品制备一直具有挑战性。特别是,在种子发育过程中,很少在没有化学固定和切片的情况下对胚乳细胞层进行观察。
在样品制备过程中,发育中的种子产生的空种子包膜很脆弱,因为睾丸是活的,因此是柔软的。在这里,建立了两种方案,用于快速制备完整的胚乳细胞层样品,适用于发育中的种子的显微镜观察和分析,而无需固定或切片。在用成熟种子制备样品的情况下,睾丸是死的和坚固的,导致空的种子包膜在安装在载玻片上时保持其曲率。这种曲率使得很难在很宽的焦点范围内清楚地观察胚乳细胞层。因此,对发育种子的解剖方法进行了轻微修改,以适当修剪空种子包络。通过使用这种方法将其分成两部分,在保持聚焦的同时,可以清楚地观察大量的胚乳细胞。
已经开发了各种成像试剂(用于染色 DNA、活性氧、酸性隔室等),其中一些已应用于拟南芥植物 29,30,31,32。使用该方案制备的胚乳细胞层样品已用于 LysoTracker 和碘化丙啶染色的显微镜观察,有助于评估胚乳功能17。自 1962 年发现 GFP以来 33,GFP 标签蛋白已成为阐明细胞内结构动力学的重要工具 23,24,34,35,36,37,38。通过根据该方案制备胚乳样品并采用上述方法,可以在种子发育和发芽过程中对胚乳进行活细胞成像,如图 3 和图 4 所示,从而阐明细胞内事件和特定蛋白质的定位。此外,使用该方案将特异性抑制剂(如蛋白酶抑制剂、蛋白质修饰酶抑制剂和细胞动力学抑制剂)39,40,41,42 应用于活胚乳细胞,有望更深入地了解种子发育和发芽过程中胚乳功能的细胞内事件和分子机制。
该方案的一个限制是无法制备来自完全干燥种子的胚乳细胞层,因为很难将种子分离到胚胎和空种子包膜中。如图 2 所示,分离成熟种子需要至少 40 分钟的吸水时间。值得注意的是,吸吸后可能会诱导胚乳细胞内的几种细胞事件。另一个限制是该方案不允许在种子发育的早期阶段观察胚乳组织,特别是在 10 DAF 之前,因为它是专门为观察单细胞胚乳层而设计的。在这些早期阶段,单细胞胚乳层形成之前的组织 - 非分层胚乳 - 填充了发育中的种子43 的内部,使得胚乳样品的制备变得困难。
披露声明
作者声明他们没有相互竞争的经济利益。
致谢
我们感谢京都大学的 Matsushita 和 Oka 博士提供由 35S 启动子驱动的表达 PHYB-GFP 的 phyB 突变体。这项研究部分得到了创新领域科学研究补助金、拟议研究领域研究(19H05713 至 KY)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
参考文献
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179 (2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202 (2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121 (2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394 (2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732 (2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650 (2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510 (2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -. C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -. H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。