Method Article
Подготовка интактной ткани для микроскопического анализа клеточного слоя эндосперма в развивающихся и зрелых семенах арабидопсиса
В этой статье
Резюме
Этот протокол описывает подготовку интактных образцов слоя клеток эндосперма в семенах Arabidopsis thaliana . Метод требует только обычного лабораторного оборудования, такого как инъекционная игла и прецизионные щипцы, и позволяет проводить флуоресцентную визуализацию живых клеток эндосперма с высоким разрешением как в развивающихся, так и в зрелых семенах.
Аннотация
В семенах арабидопсиса эндосперм, один слой живых клеток, расположенный между эмбрионом и семенником, играет решающую роль в регулировании созревания, покоя и прорастания семян. Микроскопический анализ интактных клеток эндосперма имеет важное значение для понимания физиологических функций эндосперма на клеточном и молекулярном уровнях. Тем не менее, подготовка образцов была сложной задачей из-за небольшого размера семян арабидопсиса и расположения слоя эндоспермовых клеток под яичком. В этой статье подробно описывается подготовка образцов слоя интактных эндоспермовых клеток, пригодных для микроскопического наблюдения и анализа как в развивающихся, так и в зрелых семенах. Этот метод позволяет наблюдать большие площади и многочисленные интактные клетки эндосперма без необходимости фиксации или разрезания. Кроме того, в протоколе используется только стандартное лабораторное оборудование, такое как инъекционные иглы, прецизионные щипцы и стереомикроскопы. Этот подход успешно позволяет получать изображения флуоресцентных сигналов с высоким разрешением в живых клетках, таких как зеленый флуоресцентный белок (GFP), в интактных клетках эндосперма. Этот метод позволяет наблюдать за внутриклеточной локализацией и перемещением различных белков, а также за морфологией органелл в клетках эндосперма различных мутантов Arabidopsis. Этот протокол способствует выяснению новых функций эндосперма и расширяет возможности для клеточных и молекулярных исследований этой важной ткани.
Введение
Поскольку растения являются сидячими организмами, прорастание семян является важнейшим событием, определяющим их судьбу. Решение о проращивании строго регулируется как внутренними, так и экологическими факторами, такими как уровень покоя первичного семени, температура, интенсивность света и длина волны, а также концентрация азота 1,2,3,4,5,6. Семена имеют сложную структуру, состоящую из нескольких типов тканей7. У Arabidopsis сухими семенами зародыш, который развивается в проросток, окружен одним слоем эндосперма и самым внешним слоем, семенником. Семенник состоит из нескольких слоев мертвых клеток, в то время как эмбрион и эндосперм остаются живыми даже в сухих семенах. Эндосперм обычно рассматривается как резервирующая ткань, которая обеспечивает питательные вещества для роста эмбриона и, вместе с семенником, придает механическую устойчивость к выступу корешка 8,9,10,11,12,13.
Несколько недавних исследований показали, что эндосперм играет важную роль в регулировании оптимального прорастания семян 14,15,16,17. Например, фоторецептор фитохрома B (PHYB) в клетках эндосперма обнаруживает либо красный (R), либо дальний красный (FR) свет, регулируяреакцию прорастания. Эндосперм также функционирует как температурочувствительная ткань, подавляя реакцию прорастания при высокихтемпературах. Контроль качества эндосперма имеет решающее значение для оптимального прорастания семян, особенно семян длительного хранения17.
В настоящее время необходима визуализация живых клеток для дальнейшего выяснения физиологических функций эндосперма. Микроскопический анализ интактных клеток эндосперма, экспрессирующих флуоресцентные белки, позволяет исследовать молекулярные механизмы, с помощью которых эндосперм регулирует прорастание семян. Тем не менее, подготовка интактных клеток эндосперма к микроскопическому наблюдению является сложной задачей, особенно в семенах арабидопсиса . Семена имеют диаметр около 0,4 мм, а эндосперм представляет собой одноклеточный слой, расположенный между эмбрионом и семенником, что затрудняет точную манипуляцию. Следовательно, несмотря на его важную физиологическую роль, эндосперм редко наблюдался с помощью визуализации живых клеток.
В данной статье представлен протокол быстрой подготовки образцов слоя интактных эндоспермовых клеток, пригодных для визуализации живых клеток как в развивающихся, так и в зрелых семенах.
протокол
В этом исследовании были установлены две различные процедуры для подготовки образцов слоя живых эндоспермовых клеток: одна для развивающихся семян, а другая для зрелых семян. Требуются несколько иные подходы в зависимости от прочности семенника. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Подготовка образцов интактного эндосперма из развивающихся семян
- Коллекция силиков
- Выращивайте растения арабидопсиса на почве или минеральной вате до цветения.
- Полностью раскрывшиеся цветы пометьте цветными нитками (0 дней после цветения, 0 DAF).
ПРИМЕЧАНИЕ: Избегайте использования зеленых, желтых или коричневых нитей для обозначения цветов, так как эти цвета трудно отличить от растущих или зрелых растений и силикатов. - Отрежьте отмеченные развивающиеся силики на ножке (показаны на рисунке 1(1)) и соберите их в пробирки объемом 1,5 мл.
ПРИМЕЧАНИЕ: Для приготовления по этому протоколу подходят проявочные силики из 12-16 DAF.
- Вскрытие развивающихся семян
ПРИМЕЧАНИЕ: Следующие шаги необходимо выполнить на влажной фильтровальной бумаге, чтобы защитить образцы от высыхания. Манипуляции следует проводить под стереомикроскопом.- Отделите клапан (показан на рисунке 1(2)) от слива (показан на рисунке 1(1)) с помощью двух щипцов: один с толстыми наконечниками для удержания, а другой с острыми наконечниками для разрыва).
- Аккуратно соберите развивающиеся семена из силиков с помощью щипцов с закрытыми кончиками, чтобы не повредить семена (Рисунок 1 (2)).
- Удерживая семя щипцами, не раздавливая семя, сделайте рубец размером примерно 0,2 мм на семеннике и эндосперме, окружающем эмбрион, с помощью инъекционной иглы (27 G, 0,40 мм × 19 мм) (рис. 1(3)).
ПРИМЕЧАНИЕ: Оптимальное место для создания рубца – на стыке семядолей и корешка. - Вытолкните зародыш, зажав семя щипцами (Рисунок 1(4)). Не раздавливайте пустую оболочку семени, которая состоит из семенника и эндосперма, и старайтесь сохранять ее круглую форму.
- Вставьте иглу для инъекций в пустую оболочку с семенами у рубца, прокалывая его изнутри наружу (Рисунок 1(5)).
- Удерживайте иглу на месте, поцарапывайте поверхность семенника щипцами с закрытыми кончиками и разрежьте одну сторону пустого конверта с семенами, чтобы он открылся (Рисунок 1 (6)).
- Откройте пустой конверт с семенами в лист с помощью щипцов с острыми кончиками (Рисунок 1(7)). Теперь образец должен быть выделен в виде двухслойного листа, состоящего из слоев эндосперма и теста (рис. 1(8)).
ПРИМЕЧАНИЕ: Если образец имеет тенденцию сворачиваться при использовании воды в качестве монтажной среды на шаге 3 ниже, разделите образец листовой формы на две части. Семена, собранные из силиков при температуре около 18 DAF (на этом этапе семенник коричневый, но еще не полностью высохший), также могут быть обработаны с использованием этого протокола, хотя семена должны быть пропитаны в течение нескольких минут перед подготовкой.
2. Подготовка образцов интактного эндосперма из зрелых семян
- Пропитка зрелых семян
- Добавьте 1 мл дважды дистиллированной воды в 1,5 мл пробирки, содержащей сухие семена арабидопсиса .
- Держите семена впитанными не менее 40 минут при комнатной температуре (Рисунок 2 (1)).
ПРИМЕЧАНИЕ: Сухие семена и семена в течение 40 минут после пропитки трудно оставить в семенах и удалить зародыш изнутри семени, не повреждая пустую оболочку семян в соответствии с шагами 2.2.1 и 2.2.2, в то время как более длительное время пропитывания облегчает манипуляции. - С помощью микропипетки объемом 1000 мкл переложите пропитанные семена на влажную фильтровальную бумагу.
- Вскрытие зрелых семян
ПРИМЕЧАНИЕ: Следующие шаги необходимо выполнить на влажной фильтровальной бумаге, чтобы защитить образцы от высыхания. Манипуляции следует проводить под стереомикроскопом.- Удерживая семя щипцами, не раздавливая семя, сделайте рубец размером примерно 0,2 мм на семеннике и эндосперме, окружающем эмбрион, с помощью инъекционной иглы (рис. 2(2)).
- Вытолкните зародыш, зажав семя щипцами (Рисунок 2(3)). Не раздавливайте пустую оболочку с семенами, в которую входят семенники и эндосперм. Старайтесь сохранять его круглую форму.
- Разрежьте верхнюю и нижнюю стороны пустого конверта с семенами с помощью иглы для инъекций, чтобы придать ему форму цилиндра (Рисунок 2(4)).
- Разрежьте цилиндрическую пустую оболочку семян по центральной оси, чтобы разделить ее на две части (Рисунок 2(5)). Образцы должны быть выделены в виде двухслойных листов, состоящих из слоя эндосперма и слоя теста (рис. 2(6)).
3. Микроскопическое наблюдение
- Поместите образцы эндосперма в виде листа на предметное стекло и поместите их в воду или перфтордекалин (PFD).
ПРИМЕЧАНИЕ: Если между образцом и покровным стеклом остаются пузырьки воздуха, будет полезен перфтордекалин (PFD), который, как сообщается, особенно полезен для визуализации образцов, содержащих воздушные карманы, такие как листья18,19. Известно, что PFD имеет самое низкое поверхностное натяжение, что позволяет ему легко заполнять воздушные пространства на поверхности образца. Однако для покадровой визуализации рекомендуется использовать воду в качестве монтажной среды, так как содержание воды в зрелых семенах должно быть обильным для поддержания клеточной ликвидности. - Аккуратно наденьте на образец покровную крышку. Убедитесь, что слой эндосперма обращен к покровному стеколу.
ПРИМЕЧАНИЕ: Для герметизации краев покровного стекла можно использовать лак для ногтей или смазку, чтобы предотвратить высыхание образца и монтажной среды.
Результаты
Используя протокол, показанный на рисунке 1, образцы эндосперма готовили из развивающихся семян, собранных из силиков при 14 DAF (на этом этапе семенник еще зеленый). Наблюдались многочисленные клетки эндосперма на большой площади и их внутриклеточные структуры (рис. 3А). В этом эксперименте использовались семена, экспрессирующие PHYB, слитые с GFP на С-конце (PHYB-GFP). Хорошо известно, что PHYB перемещается в ядро при активации красным светом и образует PHYB-положительные спеклы, известные как фототела (ПБ), которые участвуют в прорастании семян 4,20,21,22. Образцы были собраны с растений, выращенных в условиях непрерывного белого света при температуре 22 °C. Как показано на рисунке 3B, PB в ядре были обнаружены в клетках эндосперма. Этот результат соответствует предыдущему исследованию, показывающему, что PHYB в эндосперме регулирует оптимальную прорастаемость семян15. Кроме того, была проведена покадровая визуализация живых клеток, чтобы подтвердить, что выделенные эндоспермовые клетки сохраняют биологическую активность даже после подготовки образца, наблюдая за фотообратимостью фитохрома FR/R (рис. 3C). Образцы эндосперма готовили из развивающихся семян, собранных из силиков при температуре около 17-18 DAF. ПБ обнаруживались в ядре при вскрытии, в то время как после облучения дальним красным светом они полностью исчезали. Впоследствии облучение красным светом вновь индуцировало ПБ. Эта фотообратимость фитохрома была обнаружена дважды, что указывает на то, что клетки эндосперма, выделенные по этому протоколу, сохраняли биологическую активность в течение как минимум 4,5 ч после вскрытия (рис. 3C).
Затем были подготовлены образцы эндосперма из зрелых семян (где семенник коричневого цвета), как показано на рисунке 2. В этом эксперименте подвижность митохондрий наблюдалась с использованием семян, экспрессирующих митохондриально-направленную GFP (mtGFP)23, которые хранились в эксикаторе при комнатной температуре в темноте в течение примерно одного года после сбора урожая. Сообщалось, что митохондрии в эмбрионе активно перемещаются и динамически изменяют морфологию после пропитки и перехода в условия прорастания24. Была проведена флуоресцентная покадровая визуализация митохондрий в интактных клетках эндосперма через 3 ч после пропитки семян, и было обнаружено движение митохондрий (дополнительный фильм 1). Митохондрии в эндосперме немедленно перемещаются в цитозоль после короткого периода пропитки при 22 °C. После 1 дня пропитки семян при 22 °C наблюдалось более динамичное движение митохондрий (рис. 4 и дополнительный фильм 2).
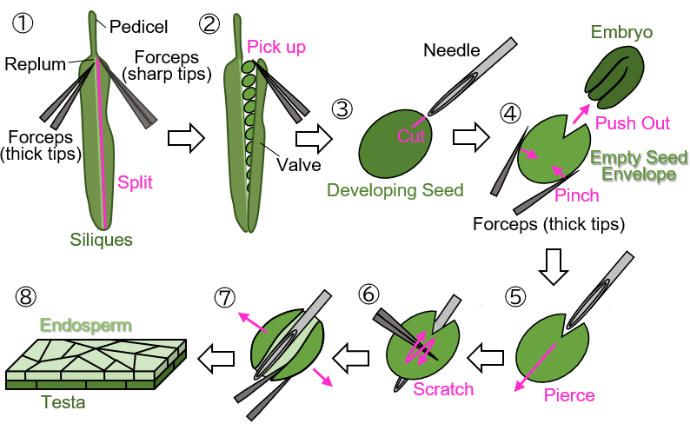
Рисунок 1: Подготовка образца эндосперма из развивающихся семян. Шаг 1: Клапан отделяется от сливы. Шаг 2: Собираются развивающиеся семена. Шаг 3: На яичке и эндосперме создается рубец с помощью инъекционной иглы. Шаг 4: Зародыш удаляется путем защипывания семени щипцами. Шаг 5: Инъекционная игла вводится через пустую оболочку для семян изнутри наружу. Шаг 6: Поверхность яичка процарапывается с помощью щипцов. Шаг 7: Пустой конверт с семенами вскрывается в листовую форму с помощью щипцов. Шаг 8: Окончательный образец листа эндосперма подготавливается к микроскопическому наблюдению. Все этапы выполняются на влажной фильтровальной бумаге под стереомикроскопом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Подготовка образца эндосперма из зрелых семян. Шаг 1: Сухие семена впитывают в воду более 40 минут в пробирке объемом 1,5 мл. Шаг 2: На яичке и эндосперме создается рубец с помощью инъекционной иглы. Шаг 3: Зародыш удаляют путем защипывания семени щипцами. Шаг 4: Верхняя и нижняя стороны пустого семенного конверта разрезаются, чтобы придать ему форму цилиндра. Шаг 5: Пустая оболочка семян цилиндрической формы разрезается по центральной оси. Шаг 6: Окончательный образец листа эндосперма подготавливается к микроскопическому наблюдению. Все этапы выполняются на влажной фильтровальной бумаге под стереомикроскопом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Флуоресцентная визуализация неповрежденного слоя клеток эндосперма с использованием проявляющихся семян. Образцы слоя интактных клеток эндосперма готовили из развивающихся семян силиков DAF, образовавшихся через 14 дней после цветения (A, B) и 17-18 силиков DAF (C). Микроскопическую визуализацию проводили с помощью конфокального лазерного сканирующего микроскопа, оснащенного масляно-иммерсионным объективом Plan-Apochromat 63× и лазером белого света. (A) Конфокальное изображение эндосперма под действием дифференциального интерференционного контраста (ДВС) показывает большие участки с многочисленными интактными клетками эндосперма. Масштабная линейка: 20 мкм. (B) Показаны конфокальные изображения эндосперма, экспрессирующего PHYB-GFP, с PHYB-GFP зеленым цветом и автофлуоресценцией хлорофилла голубым. Фототела (ПБ) в ядре обозначены белыми стрелками. Масштабные линейки: 10 μм; Увеличенная масштабная линейка изображения: 2,5 мкм. Сигнал GFP был отделен от автофлуоресценции вакуолей хранения белка (PSV) с помощью флуоресцентной микроскопии времени жизни (FLIM). Время жизни флуоресценции было получено с помощью TauScan и разделено с помощью функции TauSeparation. Среднее время жизни флуоресценции для GFP составило 2,2 нс. Флуоресценция GFP возбуждалась на длине волны 488 нм и собиралась в диапазоне 500-530 нм, в то время как автофлуоресценция хлорофилла возбуждалась на длине волны 405 нм и собиралась в диапазоне 688-729 нм. (C) Представлены конфокальные изображения эндосперма, экспрессирующего PHYB-GFP в непрерывном белом свете (cWL), непрерывном дальнем красном свете (cFR) или непрерывном красном свете (cR). PHYB-GFP показан зеленым цветом, а автофлуоресценция PSV — пурпурным. Масштабные линейки: 10 μм; Увеличенная масштабная линейка изображения: 2,5 мкм. Интенсивность света: WL, 46,5 мкмоль/м2/с; FR, 35,2 мкмоль/м2/с; R, 18,6 мкмоль/м2/с. Автофлуоресценция ПСВ возбуждалась при 561 нм и собиралась при 565-621 нм. Сигнал GFP был разделен с помощью того же метода, который описан выше. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
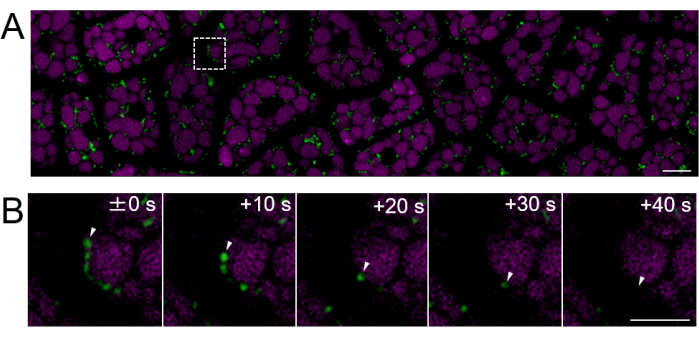
Рисунок 4: Флуоресцентная визуализация неповрежденного слоя клеток эндосперма с использованием зрелых семян. Микроскопическая визуализация была выполнена с использованием того же метода, что и на рисунке 3. (А) Показано конфокальное изображение всего неповрежденного слоя эндоспермовых клеток, полученное из дополнительного фильма 2. Митохондрии помечены зеленым цветом, а аутофлуоресценция ПСВ — пурпурным. Масштабная линейка: 10 мкм. (B) Серия увеличенных изображений с интервальной линией из квадратной области пунктирной линии на панели (A) показывает движение митохондрии, обозначенное белыми стрелками. Масштабная линейка: 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный фильм 1: Показано покадровое видео mtGFP в слое эндоспермных клеток зрелого семени через 3 ч после пропитки. Один кадр делался каждые 10 секунд, а частота кадров видео составляет 10 кадров/с. Масштабная линейка: 10 мкм. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный фильм 2: Показано покадровое видео mtGFP в слое эндоспермовых клеток зрелого семени через 1 день после пропитки. Один кадр делался каждые 10 секунд, а частота кадров видео составляет 10 кадров/с. Масштабная линейка: 10 мкм. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Роль эндосперма в прорастании семян была выявлена с помощью генетического и биохимического анализа с использованием разделенных тканей семян, такого как анализ экспрессии генов и количественная оценка липидов и фитогормонов 9,14,25,26,27. Анализ слоя семенной оболочки in vitro, сочетающий пустую оболочку семян (эндосперм и теста) с эмбрионом, выделенным из различных мутантов Arabidopsis, выявил молекулярные механизмы, лежащие в основе процессов прорастания 14,15,16,28. Тем не менее, подготовка образцов для микроскопического наблюдения была сложной задачей из-за небольшого размера семян Arabidopsis и расположения слоя эндоспермовых клеток под яичком. В частности, наблюдение за слоем клеток эндосперма во время развития семян редко проводилось без химической фиксации и секции.
Во время подготовки образца пустая оболочка семян из развивающихся семян становится хрупкой, потому что семенник живой и поэтому мягкий. Здесь были разработаны два протокола для быстрой подготовки образцов неповрежденных слоев эндоспермоменных клеток, пригодных для микроскопического наблюдения и анализа в развивающихся семенах без необходимости фиксации или разрезания. В случае подготовки образца из зрелых семян семенник является мертвым и прочным, в результате чего пустая оболочка семян сохраняет свою кривизну при установке на предметное стекло. Эта кривизна затрудняет четкое наблюдение за слоем клеток эндосперма в широком диапазоне фокуса. Поэтому метод вскрытия для развития семян был немного модифицирован для соответствующей обрезки пустого семенного конверта. Разделяя его на две части с помощью этого метода, было достигнуто четкое наблюдение за многочисленными клетками эндосперма с сохранением фокуса.
Были разработаны различные реагенты для визуализации (для окрашивания ДНК, активных форм кислорода, кислотных компартментов и т.д.), и некоторые из них были применены к растениям Arabidopsis 29,30,31,32. Образцы слоя клеток эндосперма, подготовленные с использованием этого протокола, уже были использованы для микроскопических наблюдений с помощью LysoTracker и окрашивания йодидом пропидиума, что способствовало оценке функции эндосперма17. С момента открытия GFP в 1962-33 гг. GFP-меченые белки стали важными инструментами для выяснения динамики внутриклеточных структур 23,24,34,35,36,37,38. Препарируя образцы эндосперма в соответствии с этим протоколом и используя вышеупомянутые методы, можно выполнить визуализацию эндосперма в живых клетках во время развития и прорастания семян, как показано на рисунках 3 и 4, тем самым выясняя внутриклеточные события и локализацию специфических белков. Кроме того, ожидается, что применение специфических ингибиторов (таких как ингибиторы протеазы, ингибиторы ферментов модификации белка и ингибиторы клеточной динамики)39,40,41,42 к живым клеткам эндосперма с использованием этого протокола обеспечит более глубокое понимание внутриклеточных событий и молекулярных механизмов, лежащих в основе функции эндосперма во время развития и прорастания семян.
Одним из ограничений этого протокола является то, что слои эндоспермовых клеток из полностью высушенных семян не могут быть приготовлены, потому что трудно разделить семена на зародыш и пустую оболочку семени. Как показано на рисунке 2, для отделения зрелых семян необходимо время пропитки не менее 40 минут. Важно отметить, что несколько клеточных событий в клетках эндосперма могут быть вызваны после пропитки. Еще одним ограничением является то, что этот протокол не позволяет наблюдать за тканью эндосперма на ранних стадиях развития семян, особенно до 10 DAF, поскольку он специально разработан для наблюдения за одноклеточным слоем эндосперма. На этих ранних стадиях ткань, предшествующая образованию слоя одноклеточного эндосперма – неслоистого эндосперма – заполняет внутреннюю часть развивающихся семян43, что затрудняет подготовку образцов эндосперма.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Мы благодарим докторов Мацуситу и Оку из Киотского университета за предоставление мутанта phyB , экспрессирующего PHYB-GFP, управляемого промотором 35S. Данное исследование было частично поддержано грантом на научные исследования в инновационных областях, исследования в предлагаемой области исследований (19H05713 to K.Y.).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
Ссылки
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179 (2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202 (2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121 (2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394 (2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732 (2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650 (2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510 (2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -. C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -. H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены