Method Article
Préparation de tissu intact pour l’analyse microscopique de la couche de cellules de l’endosperme dans des graines d’Arabidopsis en développement et matures
Dans cet article
Résumé
Ce protocole décrit la préparation d’échantillons intacts de la couche de cellules de l’endosperme dans les graines d’Arabidopsis thaliana . La méthode ne nécessite que l’équipement de laboratoire courant, tel qu’une aiguille d’injection et des pinces de précision, et permet l’imagerie fluorescente haute résolution de cellules vivantes de cellules endospermiennes dans les graines en développement et matures.
Résumé
Dans les graines d’Arabidopsis , l’endosperme, une seule couche de cellules vivantes située entre l’embryon et le testa, joue un rôle essentiel dans la régulation de la maturation, de la dormance et de la germination des graines. L’analyse microscopique des cellules intactes de l’endosperme est essentielle pour comprendre les fonctions physiologiques de l’endosperme aux niveaux cellulaire et moléculaire. Cependant, la préparation des échantillons a été difficile en raison de la petite taille des graines d’Arabidopsis et de l’emplacement de la couche de cellules de l’endosperme sous le testa. Cet article détaille la préparation d’échantillons de couches cellulaires d’endosperme intactes adaptés à l’observation et à l’analyse microscopiques dans les graines en développement et matures. Cette méthode permet d’observer de grandes surfaces et de nombreuses cellules endospermiennes intactes sans nécessiter de fixation ou de section. De plus, le protocole n’utilise que des équipements de laboratoire standard, tels que des aiguilles d’injection, des pinces de précision et des stéréomicroscopes. Cette approche permet d’imager avec succès des signaux fluorescents à haute résolution dans des cellules endospermiennes intactes. Cette méthode permet d’observer la localisation intracellulaire et le mouvement de diverses protéines, ainsi que la morphologie des organites, dans les cellules endospermiennes de différents mutants d’Arabidopsis . Ce protocole contribue à l’élucidation de nouvelles fonctions de l’endosperme et élargit le potentiel d’études cellulaires et moléculaires de ce tissu essentiel.
Introduction
Parce que les plantes sont des organismes sessiles, la germination des graines est un événement crucial qui détermine leur destin. La décision de germer est strictement régulée par des facteurs internes et environnementaux, tels que les niveaux de dormance primaire des graines, la température, l’intensité lumineuse et la longueur d’onde, et la concentration d’azote 1,2,3,4,5,6. Les graines ont des structures complexes composées de plusieurs types de tissus7. Chez les graines sèches d’Arabidopsis, l’embryon, qui se développe en plantule, est entouré d’une seule couche d’endosperme et des couches les plus externes, le testa. Le testa est composé de plusieurs couches de cellules mortes, tandis que l’embryon et l’endosperme restent vivants même dans les graines sèches. L’endosperme est généralement considéré comme un tissu de stockage qui fournit des nutriments pour la croissance de l’embryon et, avec le testa, confère une résistance mécanique à la protrusion radiculaire 8,9,10,11,12,13.
Plusieurs études récentes ont démontré que l’endosperme joue un rôle essentiel dans la régulation de la germination optimale des graines 14,15,16,17. Par exemple, le photorécepteur phytochrome B (PHYB) dans les cellules de l’endosperme détecte la lumière rouge (R) ou rouge lointain (FR), régulant les réponses de germination15. L’endosperme fonctionne également comme un tissu sensible à la température, supprimant les réponses de germination à des températures élevées16. Le contrôle de la qualité de l’endosperme est essentiel pour une germination optimale des graines, en particulier dans les graines stockées à long terme17.
L’imagerie de cellules vivantes est maintenant nécessaire pour élucider davantage les fonctions physiologiques de l’endosperme. L’analyse microscopique de cellules endospermiennes intactes exprimant des protéines marquées par fluorescence permet d’étudier les mécanismes moléculaires par lesquels l’endosperme régule la germination des graines. Cependant, la préparation de cellules endospermiennes intactes pour l’observation microscopique est un défi, en particulier dans les graines d’Arabidopsis . Les graines ont un diamètre d’environ 0,4 mm, et l’endosperme est une couche unicellulaire située entre l’embryon et le testa, ce qui rend difficile une manipulation précise. Par conséquent, malgré ses rôles physiologiques importants, l’endosperme a rarement été observé à l’aide de l’imagerie de cellules vivantes.
Cet article présente un protocole pour la préparation rapide d’échantillons de couches cellulaires d’endosperme intactes adaptées à l’imagerie de cellules vivantes dans les graines en développement et matures.
Protocole
Dans cette étude, deux procédures différentes ont été établies pour la préparation d’échantillons de couches de cellules endospermiennes vivantes : l’une pour les graines en développement et l’autre pour les graines matures. Des approches légèrement différentes sont nécessaires en fonction de la solidité du testa. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans le tableau des matériaux.
1. Préparation d’échantillons d’endosperme intact à partir de graines en développement
- Collection de siliques
- Cultivez les plantes d’Arabidopsis sur du sol ou de la laine de roche jusqu’à la floraison.
- Marquez les fleurs complètement ouvertes avec des fils colorés (0 jours après la floraison, 0 DAF).
REMARQUE : Évitez d’utiliser des fils verts, jaunes ou bruns pour marquer les fleurs, car ces couleurs sont difficiles à distinguer des plantes et siliques en croissance ou matures. - Coupez les siliques en développement marquées au niveau du pédicelle (indiquées à la figure 1(1)) et recueillez-les dans des tubes de 1,5 mL.
REMARQUE : Les siliques en développement de 12 à 16 DAF conviennent à la préparation à l’aide de ce protocole.
- Dissection des graines en développement
REMARQUE : Les étapes suivantes doivent être effectuées sur du papier filtre humide pour protéger les échantillons de la dessiccation. Les manipulations doivent être effectuées au microscope stéréoscopique.- Séparez une valve (illustrée à la figure 1(2)) de la plume (indiquée à la figure 1(1)) à l’aide de deux pinces : l’une avec des pointes épaisses pour la tenue et l’autre avec des pointes pointues pour la déchirure).
- Ramassez délicatement les graines en développement des siliques à l’aide d’une pince avec les pointes fermées pour éviter d’endommager les graines (Figure 1(2)).
- En tenant la graine à l’aide d’une pince sans l’écraser, faites une cicatrice d’environ 0,2 mm sur le testa et l’endosperme entourant l’embryon à l’aide d’une aiguille d’injection (27 G, 0,40 mm × 19 mm) (figure 1(3)).
REMARQUE : L’emplacement optimal pour faire la cicatrice est à la jonction des cotylédons et de la radicule. - Poussez l’embryon vers l’extérieur en pinçant la graine à l’aide d’une pince (figure 1(4)). N’écrasez pas l’enveloppe de graine vide, qui se compose du testa et de l’endosperme, et essayez de conserver sa forme ronde.
- Insérez l’aiguille d’injection dans l’enveloppe vide de la cicatrice, en la perçant de l’intérieur vers l’extérieur (Figure 1(5)).
- Maintenez l’aiguille en place, grattez la surface du testa à l’aide d’une pince avec les pointes fermées et coupez un côté de l’enveloppe de graines vide pour lui permettre de s’ouvrir (figure 1(6)).
- Ouvrez l’enveloppe de graines vide en une feuille à l’aide d’une pince à pointes pointues (figure 1(7)). L’échantillon doit maintenant être isolé sous la forme d’une feuille bicouche composée des couches d’endosperme et de testa (Figure 1(8)).
REMARQUE : Si l’échantillon a tendance à se recroqueviller lorsque de l’eau est utilisée comme support de montage à l’étape 3 ci-dessous, divisez l’échantillon en feuille en deux morceaux. Les graines récoltées sur des siliques à environ 18 DAF (à ce stade, le testa est brun mais pas encore complètement sec) peuvent également être traitées selon ce protocole, bien que les graines doivent être imbibées pendant plusieurs minutes avant d’être préparées.
2. Préparation d’échantillons d’endosperme intact à partir de graines matures
- Imbibition de graines mûres
- Ajouter 1 mL d’eau bi-distillée dans un tube de 1,5 mL contenant des graines sèches d’Arabidopsis .
- Conservez les graines pendant au moins 40 minutes à température ambiante (Figure 2(1)).
REMARQUE : Les graines sèches et les graines dans les 40 minutes suivant l’imbibition sont difficiles à cicatriser au niveau du testa et de l’endosperme et à retirer l’embryon de l’intérieur de la graine sans endommager l’enveloppe vide de la graine aux étapes 2.2.1 et 2.2.2, tandis qu’un temps d’imbibition plus long facilite la manipulation. - À l’aide d’une micropipette de 1000 μL, transférez les graines imbibées sur du papier filtre humide.
- Dissection des graines mûres
REMARQUE : Les étapes suivantes doivent être effectuées sur du papier filtre humide pour protéger les échantillons de la dessiccation. Les manipulations doivent être effectuées au microscope stéréoscopique.- En tenant la graine à l’aide d’une pince sans l’écraser, faites une cicatrice d’environ 0,2 mm sur le testa et l’endosperme entourant l’embryon à l’aide d’une aiguille d’injection (figure 2(2)).
- Poussez l’embryon vers l’extérieur en pinçant la graine à l’aide d’une pince (figure 2(3)). N’écrasez pas l’enveloppe vide des graines, qui comprend le testa et l’endosperme. Essayez de conserver sa forme ronde.
- Coupez les côtés supérieur et inférieur de l’enveloppe de semence vide à l’aide d’une aiguille d’injection pour en faire un cylindre (figure 2(4)).
- Coupez l’enveloppe de graines vides de forme cylindrique le long de son axe central pour la séparer en deux morceaux (figure 2(5)). Les échantillons doivent être isolés sous forme de feuillets bicouches constitués de la couche d’endosperme et de la couche de testa (figure 2(6)).
3. Observation microscopique
- Placez les échantillons d’endosperme sous forme de feuille sur une lame de verre et montez-les dans de l’eau ou de la perfluorodécaline (PFD).
REMARQUE : S’il reste des bulles d’air entre l’échantillon et la lamelle, la perfluorodécaline (PFD), qui s’est avérée particulièrement utile pour l’imagerie d’échantillons contenant des poches d’air, telles que les feuilles18 et 19, serait utile. Le PFD est connu pour avoir la tension superficielle la plus faible, ce qui lui permet de remplir facilement les espaces d’air à la surface de l’échantillon. Pour l’imagerie time-lapse, cependant, l’utilisation de l’eau comme milieu de montage est recommandée, car la teneur en eau des graines matures doit être abondante pour maintenir la liquidité cellulaire. - Placez doucement une lamelle sur l’échantillon. Assurez-vous que la couche d’endosperme fait face à la lamelle.
REMARQUE : Du vernis à ongles ou de la graisse peuvent être utilisés pour sceller les bords de la lamelle afin d’éviter la dessiccation de l’échantillon et du support de montage.
Résultats
Selon le protocole de la figure 1, des échantillons d’endosperme ont été préparés à partir de graines en développement récoltées sur des siliques à 14 DAF (à ce stade, le testa est encore vert). De nombreuses cellules endospermiennes sur une grande surface et leurs structures intracellulaires ont été observées (Figure 3A). Dans cette expérience, des graines exprimant PHYB fusionnée avec la GFP à l’extrémité C-terminale (PHYB-GFP) ont été utilisées. Il est bien connu que PHYB se déplace vers le noyau lors de l’activation par la lumière rouge et forme des taches positives pour PHYB, appelées photocorps (PB), qui sont impliquées dans la germination des graines 4,20,21,22. Les échantillons ont été récoltés sur des plantes cultivées dans des conditions de lumière blanche continue à 22 °C. Comme le montre la figure 3B, des PB dans le noyau ont été détectés dans les cellules de l’endosperme. Ce résultat correspond à une étude antérieure montrant que le PHYB dans l’endosperme régule la germination optimale des graines15. De plus, une imagerie time-lapse de cellules vivantes a été réalisée pour confirmer que les cellules endospermiennes isolées conservaient une activité biologique même après la préparation de l’échantillon en observant la photoréversibilité du phytochrome FR/R (Figure 3C). Des échantillons d’endosperme ont été préparés à partir de graines en développement récoltées sur des siliques à environ 17-18 DAF. Les PB ont été détectés dans le noyau lors de la dissection, alors qu’ils ont complètement disparu après irradiation avec une lumière rouge lointaine. Par la suite, l’irradiation à la lumière rouge a de nouveau induit des PB. Cette photoréversibilité phytochrome a été détectée deux fois, indiquant que les cellules de l’endosperme isolées par ce protocole ont conservé une activité biologique pendant au moins 4,5 h après la dissection (Figure 3C).
Ensuite, des échantillons d’endosperme provenant de graines matures (où le testa est brun) ont été préparés, comme le montre la figure 2. Dans cette expérience, la motilité des mitochondries a été observée à l’aide de graines exprimant la GFP ciblée mitochondriale (mtGFP)23, qui avaient été stockées dans un dessiccateur à température ambiante dans l’obscurité pendant environ un an après la récolte. Il a été rapporté que les mitochondries de l’embryon se déplacent activement et changent dynamiquement de morphologie après l’imbibition et le transfert dans des conditions de germination24. Une imagerie fluorescente en accéléré des mitochondries dans des cellules endospermiennes intactes après 3 h d’imbibition des graines a été réalisée et un mouvement mitochondrial a été détecté (film supplémentaire 1). Les mitochondries de l’endosperme se sont déplacées immédiatement dans le cytosol après une courte période d’imbibition à 22 °C. Après 1 jour d’imbibition des graines à 22 °C, des mitochondries se déplaçant plus dynamiquement ont été observées (figure 4 et vidéo supplémentaire 2).
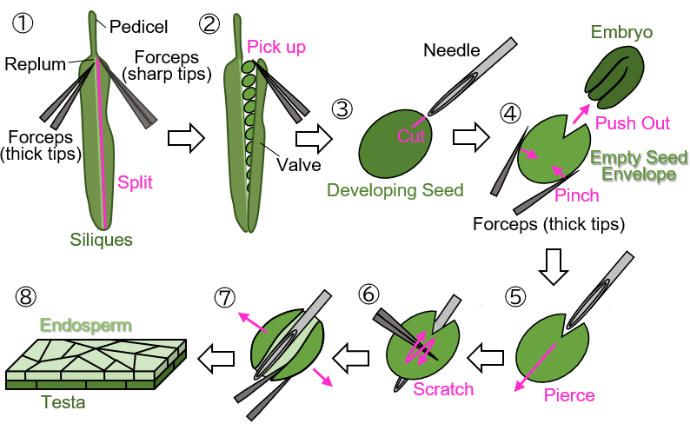
Figure 1 : Préparation d’un échantillon d’endosperme à partir de graines en développement. Étape 1 : Une valve est séparée du replum. Étape 2 : Les graines en développement sont récoltées. Étape 3 : Une cicatrice est créée sur le testa et l’endosperme à l’aide d’une aiguille d’injection. Étape 4 : L’embryon est retiré en pinçant la graine avec une pince. Étape 5 : L’aiguille d’injection est insérée à travers l’enveloppe de semence vide de l’intérieur vers l’extérieur. Étape 6 : La surface du testa est grattée à l’aide d’une pince. Étape 7 : L’enveloppe de graines vide est ouverte en forme de feuille à l’aide d’une pince. Étape 8 : L’échantillon final de la feuille d’endosperme est préparé pour l’observation microscopique. Toutes les étapes sont effectuées sur du papier filtre humide sous un stéréomicroscope. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Préparation d’un échantillon d’endosperme à partir de graines mûres. Étape 1 : Les graines sèches sont imbibées dans l’eau pendant plus de 40 minutes dans un tube de 1,5 ml. Étape 2 : Une cicatrice est créée sur le testa et l’endosperme à l’aide d’une aiguille d’injection. Étape 3 : L’embryon est retiré en pinçant la graine avec une pince. Étape 4 : Les côtés supérieur et inférieur de l’enveloppe de graines vide sont coupés pour en faire un cylindre. Étape 5 : L’enveloppe de graines vides de forme cylindrique est coupée le long de son axe central. Étape 6 : L’échantillon final de la feuille d’endosperme est préparé pour l’observation microscopique. Toutes les étapes sont effectuées sur du papier filtre humide sous un stéréomicroscope. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Imagerie fluorescente d’une couche de cellules endospermiennes intacte à l’aide de graines en développement. Des échantillons de couches cellulaires d’endosperme intactes ont été préparés à partir de graines en développement de siliques (A, B) et de 17 à 18 siliques DAF (C) 14 jours après la floraison (DAF). L’imagerie microscopique a été réalisée à l’aide d’un microscope confocal à balayage laser équipé d’un objectif à immersion dans l’huile Plan-Apochromat 63× et d’un laser à lumière blanche. (A) Une image confocale de l’endosperme sous contraste interférentiel différentiel (CIVD) montre de grandes zones avec de nombreuses cellules endospermiennes intactes. Barre d’échelle : 20 μm. (B) Des images confocales de l’endosperme exprimant PHYB-GFP sont présentées, avec PHYB-GFP en vert et autofluorescence de la chlorophylle en cyan. Les photocorps (PB) d’un noyau sont indiqués par des pointes de flèches blanches. Barres d’échelle : 10 μm ; Barre d’échelle d’image agrandie : 2,5 μm. Le signal GFP a été séparé de l’autofluorescence des vacuoles de stockage de protéines (PSV) à l’aide de la microscopie à durée de vie de fluorescence (FLIM). Les durées de vie de la fluorescence ont été obtenues à l’aide de TauScan et séparées à l’aide de la fonction TauSeplacement. La durée de vie moyenne de la fluorescence de la GFP était de 2,2 ns. La fluorescence GFP a été excitée à 488 nm et collectée entre 500 et 530 nm, tandis que l’autofluorescence de la chlorophylle a été excitée à 405 nm et collectée entre 688 et 729 nm. (C) Des images confocales de l’albumen exprimant PHYB-GFP sous lumière blanche continue (cWL), lumière rouge lointaine continue (cFR) ou lumière rouge continue (cR) sont présentées. PHYB-GFP est représenté en vert et l’autofluorescence PSV est indiquée en magenta. Barres d’échelle : 10 μm ; Barre d’échelle d’image agrandie : 2,5 μm. Intensités lumineuses : WL, 46,5 μmol/m2/s ; FR, 35,2 μmol/m2/s ; R, 18,6 μmol/m2/s. L’autofluorescence du PSV a été excitée à 561 nm et collectée entre 565 et 621 nm. Le signal GFP a été séparé à l’aide de la même méthode que celle décrite ci-dessus. Veuillez cliquer ici pour voir une version agrandie de cette figure.
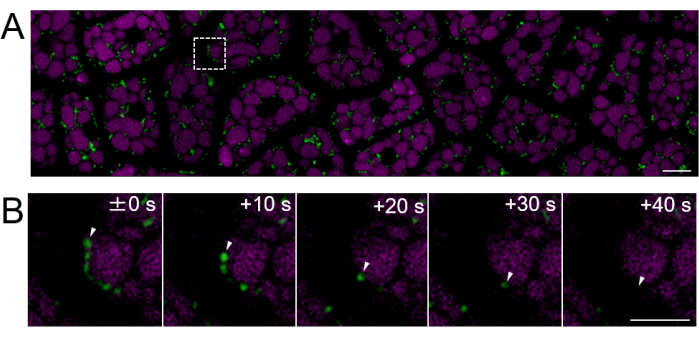
Figure 4 : Imagerie fluorescente de cellules vivantes d’une couche de cellules endospermiennes intacte à l’aide de graines matures. L’imagerie microscopique a été réalisée à l’aide de la même méthode que celle décrite à la figure 3. (A) Une image confocale de l’ensemble de la couche de cellules de l’endosperme intacte, obtenue à partir de la vidéo supplémentaire 2, est montrée. Les mitochondries sont marquées en vert et l’autofluorescence du PSV est marquée en magenta. Barre d’échelle : 10 μm. (B) Une série d’images agrandies en accéléré de la zone carrée de la ligne pointillée dans le panneau (A) montre le mouvement d’une mitochondrie, indiqué par des pointes de flèches blanches. Barre d’échelle : 5 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Film supplémentaire 1 : Une vidéo en accéléré de la mtGFP dans la couche de cellules de l’endosperme d’une graine mature 3 h après l’imbibition est montrée. Une image a été prise toutes les 10 s et la fréquence d’images de la vidéo est de 10 images/s. Barre d’échelle : 10 μm. Veuillez cliquer ici pour télécharger ce fichier.
Film supplémentaire 2 : Une vidéo en accéléré de la mtGFP dans la couche de cellules endospermiennes d’une graine mature 1 jour après l’imbibition est montrée. Une image a été prise toutes les 10 s et la fréquence d’images de la vidéo est de 10 images/s. Barre d’échelle : 10 μm. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le rôle de l’endosperme dans la germination des graines a été révélé par des analyses génétiques et biochimiques utilisant des tissus de graines séparés, telles que l’analyse de l’expression génique et la quantification des lipides et des phytohormones 9,14,25,26,27. Un test in vitro de litage du tégument des graines, combinant l’enveloppe vide des graines (endosperme et testa) avec un embryon isolé de différents mutants d’Arabidopsis, a révélé des mécanismes moléculaires sous-jacents aux processus de germination 14,15,16,28. Cependant, la préparation des échantillons pour l’observation microscopique a été difficile en raison de la petite taille des graines d’Arabidopsis et de l’emplacement de la couche de cellules de l’endosperme sous le testa. En particulier, l’observation de la couche de cellules de l’endosperme pendant le développement des graines a rarement été réalisée sans fixation chimique et sectionnement.
Lors de la préparation de l’échantillon, l’enveloppe vide des graines en développement est fragile car le testa est vivant et donc mou. Ici, deux protocoles ont été établis pour la préparation rapide d’échantillons de couches cellulaires d’endosperme intactes adaptées à l’observation et à l’analyse microscopiques dans les graines en développement sans nécessiter de fixation ou de section. Dans le cas de la préparation d’échantillons à partir de graines mûres, le testa est mort et solide, ce qui fait que l’enveloppe vide des graines conserve sa courbure lorsqu’elle est montée sur une vitre de diapositive. Cette courbure rend difficile l’observation claire de la couche de cellules de l’endosperme sur une large plage de foyer. Par conséquent, la méthode de dissection pour le développement des graines a été légèrement modifiée afin de couper correctement l’enveloppe vide des graines. En le séparant en deux morceaux à l’aide de cette méthode, l’observation claire de nombreuses cellules de l’endosperme tout en maintenant la concentration a été obtenue.
Divers réactifs d’imagerie (pour la coloration de l’ADN, des espèces réactives de l’oxygène, des compartiments acides, etc.) ont été développés, et certains ont été appliqués à des plantes Arabidopsis 29,30,31,32. Des échantillons de couches cellulaires de l’endosperme préparés à l’aide de ce protocole ont déjà été utilisés pour l’observation microscopique avec LysoTracker et la coloration à l’iodure de propidium, contribuant ainsi à l’évaluation de la fonction de l’endosperme17. Depuis la découverte de la GFP en 196233, les protéines marquées à la GFP sont devenues des outils essentiels pour élucider la dynamique des structures intracellulaires 23,24,34,35,36,37,38. En préparant des échantillons d’endosperme selon ce protocole et en utilisant les méthodes susmentionnées, il est possible d’effectuer une imagerie de l’endosperme sur cellules vivantes pendant le développement et la germination des graines, comme le montrent les figures 3 et 4, élucidant ainsi les événements intracellulaires et la localisation de protéines spécifiques. De plus, l’application d’inhibiteurs spécifiques (tels que les inhibiteurs de protéase, les inhibiteurs d’enzymes de modification des protéines et les inhibiteurs de la dynamique cellulaire)39,40,41,42 sur des cellules endospermiennes vivantes à l’aide de ce protocole devrait fournir des informations plus approfondies sur les événements intracellulaires et les mécanismes moléculaires sous-jacents à la fonction de l’endosperme pendant le développement et la germination des graines.
L’une des limites de ce protocole est que les couches de cellules de l’endosperme à partir de graines complètement séchées ne peuvent pas être préparées car il est difficile de séparer les graines dans l’embryon et l’enveloppe vide de la graine. Comme le montre la figure 2, un temps d’imbibition d’au moins 40 min est nécessaire pour séparer les graines matures. Il est important de noter que plusieurs événements cellulaires au sein des cellules de l’endosperme peuvent être induits lors de l’imbibition. Une autre limitation est que ce protocole ne permet pas l’observation du tissu endospermen pendant les premiers stades du développement des graines, en particulier avant 10 DAF, car il est spécifiquement conçu pour l’observation de la couche d’endosperme unicellulaire. Au cours de ces premiers stades, le tissu précédant la formation de la couche d’endosperme unicellulaire - un endosperme non stratifié - remplit l’intérieur des graines en développement43, ce qui rend difficile la préparation d’échantillons d’endosperme.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Nous remercions les Drs Matsushita et Oka de l’Université de Kyoto d’avoir fourni le mutant phyB exprimant PHYB-GFP piloté par le promoteur 35S. Cette étude a été financée en partie par une subvention pour la recherche scientifique dans des domaines innovants, Recherche dans un domaine de recherche proposé (19H05713 à K.Y.).
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
Références
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179 (2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202 (2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121 (2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394 (2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732 (2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650 (2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510 (2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -. C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -. H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon