Method Article
הכנת רקמה שלמה לאנליזה מיקרוסקופית של שכבת תאי האנדוספרם בזרעי ארבידופסיס מתפתחים ובוגרים
In This Article
Summary
פרוטוקול זה מתאר הכנת דגימות שלמות של שכבת תאי האנדוספרם בזרעי Arabidopsis thaliana . השיטה דורשת רק ציוד מעבדה נפוץ, כגון מחט הזרקה ומלקחיים מדויקים, ומאפשרת הדמיה של תאים חיים פלואורסצנטיים ברזולוציה גבוהה של תאי אנדוספרם בזרעים מתפתחים ובוגרים כאחד.
Abstract
בזרעי ארבידופסיס , האנדוספרם, שכבה אחת של תאים חיים הממוקמת בין העובר לאשכה, ממלא תפקיד קריטי בוויסות הבשלת הזרעים, תרדמתם ונביטתם. ניתוח מיקרוסקופי של תאי אנדוספרם שלמים חיוני להבנת התפקודים הפיזיולוגיים של האנדוספרם ברמה התאית והמולקולרית. עם זאת, הכנת הדגימה הייתה מאתגרת בשל גודלם הקטן של זרעי ארבידופסיס ומיקום שכבת תאי האנדוספרם מתחת לאשכה. מאמר זה מפרט את הכנת דגימות שכבת תאי אנדוספרם שלמות המתאימות לתצפית וניתוח מיקרוסקופי הן בזרעים מתפתחים והן בזרעים בוגרים. שיטה זו מאפשרת תצפית על שטחים גדולים ותאי אנדוספרם שלמים רבים ללא צורך בקיבוע או חתך. בנוסף, הפרוטוקול משתמש רק בציוד מעבדה סטנדרטי, כגון מחטי הזרקה, מלקחיים מדויקים ומיקרוסקופים סטריאו. גישה זו מאפשרת בהצלחה הדמיה ברזולוציה גבוהה של תאים חיים של אותות פלואורסצנטיים, כגון חלבון פלואורסצנטי ירוק (GFP), בתאי אנדוספרם שלמים. שיטה זו מאפשרת התבוננות בלוקליזציה ותנועה תוך תאית של חלבונים שונים, כמו גם מורפולוגיה של אברונים, בתאי האנדוספרם של מוטציות Arabidopsis שונות. פרוטוקול זה תורם להבהרת תפקודי אנדוספרם חדשים ומרחיב את הפוטנציאל למחקרים תאיים ומולקולריים של רקמה חיונית זו.
Introduction
מכיוון שצמחים הם אורגניזמים יושבים, נביטת זרעים היא אירוע מכריע הקובע את גורלם. ההחלטה לנבוט מוסדרת בקפדנות על ידי גורמים פנימיים וסביבתיים כאחד, כגון רמות תרדמת זרעים ראשוניים, טמפרטורה, עוצמת אור ואורך גל וריכוז חנקן 1,2,3,4,5,6. לזרעים מבנים מורכבים המורכבים ממספר סוגי רקמות7. בזרעים יבשים של Arabidopsis, העובר, המתפתח לשתיל, מוקף בשכבה אחת של אנדוספרם והשכבות החיצוניות ביותר, האשך. האשך מורכב משכבות מרובות של תאים מתים, בעוד שהעובר והאנדוספרם נשארים בחיים גם בזרעים יבשים. האנדוספרם נחשב בדרך כלל כרקמת אחסון המספקת חומרים מזינים לצמיחת העובר, ויחד עם האשך, מעניקה עמידות מכנית לבליטת רדיקל 8,9,10,11,12,13.
מספר מחקרים שנערכו לאחרונה הראו כי האנדוספרם ממלא תפקיד חיוני בוויסות נביטת זרעים אופטימלית 14,15,16,17. לדוגמה, קולטן האור פיטוכרום B (PHYB) בתאי אנדוספרם מזהה אור אדום (R) או אדום רחוק (FR), ומווסת את תגובות הנביטה15. האנדוספרם מתפקד גם כרקמה חישת טמפרטורה, ומדכא תגובות נביטה בטמפרטורות גבוהות16. בקרת איכות של האנדוספרם היא קריטית לנביטת זרעים אופטימלית, במיוחד בזרעים המאוחסנים לטווח ארוך17.
הדמיית תאים חיים נחוצה כעת כדי להבהיר עוד יותר את התפקודים הפיזיולוגיים של האנדוספרם. ניתוח מיקרוסקופי של תאי אנדוספרם שלמים המבטאים חלבונים מתויגים פלואורסצנטיים מאפשר לחקור את המנגנונים המולקולריים שבאמצעותם האנדוספרם מווסת את נביטת הזרעים. עם זאת, הכנת תאי אנדוספרם שלמים לתצפית מיקרוסקופית היא מאתגרת, במיוחד בזרעי ארבידופסיס . קוטר הזרעים הוא כ-0.4 מ"מ, והאנדוספרם הוא שכבה חד-תאית הממוקמת בין העובר לאשכה, מה שמקשה על מניפולציה מדויקת. כתוצאה מכך, למרות תפקידיו הפיזיולוגיים החשובים, האנדוספרם נצפה לעתים רחוקות באמצעות הדמיית תאים חיים.
מאמר זה מציג פרוטוקול להכנה מהירה של דגימות שכבת תאי אנדוספרם שלמות המתאימות להדמיית תאים חיים הן בזרעים מתפתחים והן בזרעים בוגרים.
Protocol
במחקר זה נקבעו שני נהלים שונים להכנת דגימות שכבת תאי אנדוספרם חיים: אחד לפיתוח זרעים ואחד לזרעים בוגרים. נדרשות גישות שונות במקצת בהתאם למוצקות האשך. פרטי הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים.
1. הכנת דגימות אנדוספרם שלמות מזרעים מתפתחים
- אוסף סיליקיות
- גדל צמחי Arabidopsis על אדמה או צמר סלעים עד לפריחה.
- סמן פרחים שנפתחו במלואם בחוטים צבעוניים (0 ימים לאחר הפריחה, 0 DAF).
הערה: הימנע משימוש בחוטים ירוקים, צהובים או חומים לסימון פרחים, מכיוון שקשה להבחין בין צבעים אלה לבין צמחים גדלים או בוגרים וסיליקות. - חותכים את הסיליקיות המתפתחות המסומנות בפדיקל (מצוין באיור 1(1)) ואוספים אותם בצינורות של 1.5 מ"ל.
הערה: פיתוח סיליקיות מ-12-16 DAF מתאים להכנה באמצעות פרוטוקול זה.
- דיסקציה של זרעים מתפתחים
הערה: יש לבצע את השלבים הבאים על נייר סינון רטוב כדי להגן על הדגימות מפני התייבשות. מניפולציות צריכות להיעשות תחת מיקרוסקופ סטריאו.- פיצול שסתום (מצוין באיור 1(2)) מהשסתום (מצוין באיור 1(1)) באמצעות שני מלקחיים: האחד עם קצות עבים לאחיזה והשני עם קצות חדים לקריעה).
- אספו בעדינות זרעים מתפתחים מהסיליקיות באמצעות מלקחיים כשהקצוות סגורים כדי להימנע מפגיעה בזרעים (איור 1(2)).
- החזיקו את הזרע עם מלקחיים מבלי לרסק את הזרע, צרו צלקת בגודל של כ-0.2 מ"מ על האשך והאנדוספרם המקיפים את העובר באמצעות מחט הזרקה (27 גרם, 0.40 מ"מ × 19 מ"מ) (איור 1(3)).
הערה: המיקום האופטימלי ליצירת הצלקת הוא בצומת הקוטילדון והרדיקל. - דחפו את העובר החוצה על ידי צביטת הזרע עם מלקחיים (איור 1(4)). אל תמעכו את מעטפת הזרע הריקה, המורכבת מהאשך והאנדוספרם, ונסו לשמור על צורתה העגולה.
- הכניסו את מחט ההזרקה לתוך מעטפת הזרעים הריקה בצלקת, ונקבו אותה מבפנים החוצה (איור 1(5)).
- שמור את המחט במקומה, גרד את פני האשך באמצעות מלקחיים כשהקצוות סגורים, וחתוך צד אחד של מעטפת הזרעים הריקה כדי לאפשר לה להיפתח (איור 1(6)).
- פתחו את מעטפת הזרעים הריקה לתוך גיליון באמצעות מלקחיים עם קצוות חדים (איור 1(7)). כעת יש לבודד את הדגימה כיריעה דו-שכבתית המורכבת משכבות האנדוספרם והאשך (איור 1(8)).
הערה: אם הדגימה נוטה להתכרבל כאשר מים משמשים כאמצעי ההרכבה בשלב 3 להלן, חלקו את הדגימה בצורת גיליון לשני חלקים. זרעים שנקטפו מסיליקים בסביבות 18 DAF (בשלב זה, האשך חום אך עדיין לא יבש לחלוטין) ניתנים לעיבוד באמצעות פרוטוקול זה, אם כי יש לספוג את הזרעים מספר דקות לפני ההכנה.
2. הכנת דגימות אנדוספרם שלמות מזרעים בוגרים
- ספיגת זרעים בוגרים
- הוסף 1 מ"ל מים מזוקקים כפולים לצינור של 1.5 מ"ל המכיל זרעי ארבידופסיס יבשים.
- שמור את הזרעים ספוגים לפחות 40 דקות בטמפרטורת החדר (איור 2(1)).
הערה: זרעים יבשים וזרעים תוך 40 דקות מרגע ההטמעה קשים לצלקת באשך ובאנדוספרם ולהוציא את העובר מתוך הזרע מבלי לפגוע במעטפת הזרעים הריקה בשלבים 2.2.1 ו-2.2.2, בעוד שזמן ספיגה ארוך יותר מקל על מניפולציה. - השתמש במיקרופיפטה של 1000 מיקרוליטר כדי להעביר את הזרעים הספוגים על נייר סינון רטוב.
- חיתוך זרעים בוגרים
הערה: יש לבצע את השלבים הבאים על נייר סינון רטוב כדי להגן על הדגימות מפני התייבשות. מניפולציות צריכות להתבצע תחת מיקרוסקופ סטריאו.- החזיקו את הזרע עם מלקחיים מבלי לרסק את הזרע, צרו צלקת בגודל של כ-0.2 מ"מ על האשך והאנדוספרם שמקיפים את העובר באמצעות מחט הזרקה (איור 2(2)).
- דחפו את העובר החוצה על ידי צביטה של הזרע עם מלקחיים (איור 2(3)). אין לרסק את מעטפת הזרע הריקה, הכוללת את האשך והאנדוספרם. נסו לשמור על צורתו העגולה.
- חותכים את הצדדים העליונים והתחתונים של מעטפת הזרעים הריקה בעזרת מחט הזרקה כדי לעצב אותה לגליל (איור 2(4)).
- חתכו את מעטפת הזרעים הריקה בצורת גליל לאורך הציר המרכזי שלה כדי להפריד אותה לשני חלקים (איור 2(5)). יש לבודד את הדגימות כיריעות דו-שכבתיות המורכבות משכבת האנדוספרם ושכבת האשך (איור 2(6)).
3. תצפית מיקרוסקופית
- הנח את דגימות האנדוספרם בצורת יריעה על מגלשת זכוכית והרכיב אותן במים או בפרפלואורודקלין (PFD).
הערה: אם נשארות בועות אוויר בין הדגימה לכיסוי, פרפלואורודקלין (PFD), שדווח כשימושי במיוחד להדמיית דגימות המכילות כיסי אוויר, כגון עלים18,19, יהיה שימושי. ידוע כי ל-PFD יש את מתח הפנים הנמוך ביותר, המאפשר לו למלא בקלות את חללי האוויר על משטח הדגימה. עם זאת, עבור הדמיית זמן-lapse, מומלץ להשתמש במים כמדיום הרכבה, שכן תכולת המים בזרעים בוגרים צריכה להיות בשפע כדי לשמור על נזילות התאים. - הנח כיסוי בעדינות מעל הדגימה. ודא ששכבת האנדוספרם פונה לכיסוי.
הערה: ניתן להשתמש בלק או גריז לאיטום קצוות הכיסוי כדי למנוע ייבוש של הדגימה ואמצעי ההרכבה.
תוצאות
באמצעות הפרוטוקול שמוצג באיור 1, דגימות אנדוספרם הוכנו מפיתוח זרעים שנקטפו מסיליקים ב-14 DAF (בשלב זה, האשך עדיין ירוק). תאי אנדוספרם רבים על פני שטח גדול והמבנים התוך-תאיים שלהם נצפו (איור 3A). בניסוי זה נעשה שימוש בזרעים המבטאים PHYB שהתמזגו עם GFP בקצה C (PHYB-GFP). ידוע היטב ש-PHYB עובר טרנסלוקציה לגרעין עם הפעלה על ידי אור אדום ויוצר כתמים חיוביים ל-PHYB, הידועים בשם פוטו-גופים (PBs), המעורבים בנביטת זרעים 4,20,21,22. הדגימות נאספו מצמחים שגדלו בתנאי אור לבן רציף בטמפרטורה של 22 מעלות צלזיוס. כפי שמוצג באיור 3B, PBs בתוך הגרעין זוהו בתאי אנדוספרם. תוצאה זו תואמת למחקר קודם שהראה כי PHYB באנדוספרם מווסת את נביטת הזרעים האופטימלית15. בנוסף, נערכה הדמיית זמן-lapse של תאים חיים כדי לאשר שתאי האנדוספרם המבודדים שמרו על פעילות ביולוגית גם לאחר הכנת הדגימה על ידי התבוננות בפוטו-הפיכות FR/R של פיטוכרום (איור 3C). דגימות אנדוספרם הוכנו מפיתוח זרעים שנקטפו מסיליקים בסביבות 17-18 DAF. PBs התגלו בתוך הגרעין בעת הדיסקציה, בעוד שהם נעלמו לחלוטין לאחר הקרנה באור אדום רחוק. לאחר מכן, קרינת אור אדום גרמה שוב ל-PBs. הפיכות הפוטוכרום הזו זוהתה פעמיים, מה שמצביע על כך שתאי האנדוספרם שבודדו על ידי פרוטוקול זה שמרו על פעילות ביולוגית לפחות 4.5 שעות לאחר הדיסקציה (איור 3C).
לאחר מכן, הוכנו דגימות אנדוספרם מזרעים בוגרים (שבהם האשך חום), כפי שמוצג באיור 2. בניסוי זה, התנועתיות של המיטוכונדריה נצפתה באמצעות זרעים המבטאים GFP ממוקד מיטוכונדריה (mtGFP)23, שאוחסנו בחומר ייבוש בטמפרטורת החדר בחושך במשך כשנה לאחר הקטיף. דווח כי המיטוכונדריה בעובר נעים באופן פעיל ומשנים באופן דינמי את המורפולוגיה לאחר אימביביטציה והעברה לתנאי נביטה24. הדמיה פלואורסצנטית של המיטוכונדריה בתאי אנדוספרם שלמים לאחר 3 שעות של ספיגת זרעים בוצעה, וזוהתה תנועה מיטוכונדריאלית (סרטון משלים 1). המיטוכונדריה באנדוספרם נעה מיד בתוך הציטוזול לאחר תקופה קצרה של ספיגה ב-22 מעלות צלזיוס. לאחר יום אחד של ספיגת זרעים ב-22 מעלות צלזיוס, נצפו מיטוכונדריה הנעים באופן דינמי יותר (איור 4 וסרטון משלים 2).
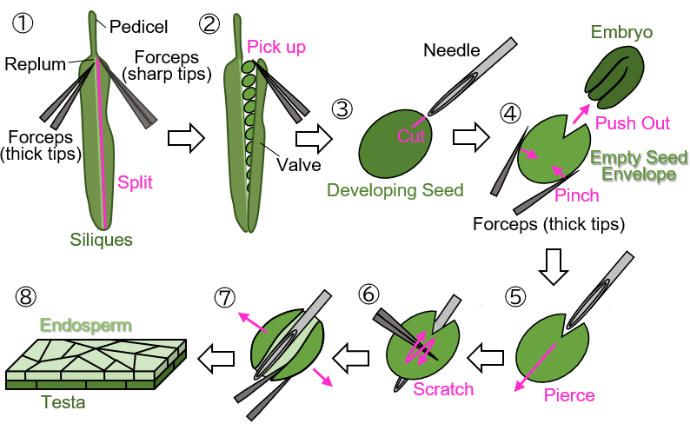
איור 1: הכנת דגימת אנדוספרם מפיתוח זרעים. שלב 1: שסתום מפוצל מהשזיף. שלב 2: הזרעים המתפתחים נאספים. שלב 3: נוצרת צלקת על האשך והאנדוספרם באמצעות מחט הזרקה. שלב 4: מסירים את העובר על ידי צביטת הזרע בעזרת מלקחיים. שלב 5: מחט ההזרקה מוחדרת דרך מעטפת הזרע הריקה מבפנים כלפי חוץ. שלב 6: משטח האשך נשרט באמצעות מלקחיים. שלב 7: מעטפת הזרעים הריקה נפתחת לצורת גיליון באמצעות מלקחיים. שלב 8: דגימת גיליון האנדוספרם הסופית מוכנה לתצפית מיקרוסקופית. כל השלבים מבוצעים על נייר סינון רטוב תחת מיקרוסקופ סטריאו. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הכנת דגימת אנדוספרם מזרעים בוגרים. שלב 1: זרעים יבשים נספגים במים במשך יותר מ -40 דקות בצינור של 1.5 מ"ל. שלב 2: נוצרת צלקת על האשך והאנדוספרם באמצעות מחט הזרקה. שלב 3: מסירים את העובר על ידי צביטת הזרע בעזרת מלקחיים. שלב 4: הצדדים העליונים והתחתונים של מעטפת הזרעים הריקה נחתכים כדי לעצב אותה לגליל. שלב 5: מעטפת הזרעים הריקה בצורת גליל נחתכת לאורך הציר המרכזי שלה. שלב 6: דגימת גיליון האנדוספרם הסופית מוכנה לתצפית מיקרוסקופית. כל השלבים מבוצעים על נייר סינון רטוב תחת מיקרוסקופ סטריאו. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: הדמיה פלואורסצנטית של שכבת תאי אנדוספרם שלמה באמצעות זרעים מתפתחים. דגימות שכבת תאי אנדוספרם שלמות הוכנו מפיתוח זרעים של סיליקיות 14 יום לאחר הפריחה (DAF) (A,B) ו-17-18 סיליקיות DAF (C). הדמיה מיקרוסקופית בוצעה באמצעות מיקרוסקופ סריקת לייזר קונפוקלי המצויד בעדשת אובייקטיבית לטבילה בשמן Plan-Apochromat 63× ולייזר אור לבן. (A) תמונה קונפוקלית של האנדוספרם תחת ניגוד הפרעות דיפרנציאלי (DIC) מראה אזורים גדולים עם מספר רב של תאי אנדוספרם שלמים. סרגל קנה מידה: 20 מיקרומטר. (B) מוצגות תמונות קונפוקליות של האנדוספרם המבטא PHYB-GFP, עם PHYB-GFP בירוק ואוטופלואורסצנטי כלורופיל בציאן. גופי פוטו (PBs) בגרעין מסומנים על ידי ראשי חץ לבנים. פסי קנה מידה: 10 מיקרומטר; סרגל קנה מידה מוגדל: 2.5 מיקרומטר. אות ה-GFP הופרד מהאוטופלואורסצנציה של ואקואולים לאחסון חלבונים (PSVs) באמצעות מיקרוסקופ פלואורסצנטי-לכל החיים (FLIM). תקופות חיים פלואורסצנטיות הושגו באמצעות TauScan והופרדו באמצעות פונקציית TauSeparation. אורך החיים הממוצע של הקרינה עבור GFP היה 2.2 ns. הקרינה של GFP התעוררה ב-488 ננומטר ונאספה בין 500-530 ננומטר, בעוד שאוטופלואורסצנציה של כלורופיל התעוררה ב-405 ננומטר ונאספה בין 688-729 ננומטר. (C) מוצגות תמונות קונפוקליות של האנדוספרם המבטא PHYB-GFP תחת אור לבן רציף (cWL), אור אדום רחוק מתמשך (cFR) או אור אדום מתמשך (cR). PHYB-GFP מוצג בירוק, ואוטופלואורסצנטיות PSV מוצגת במג'נטה. פסי קנה מידה: 10 מיקרומטר; סרגל קנה מידה מוגדל: 2.5 מיקרומטר. עוצמות אור: WL, 46.5 מיקרומול/מ"ר 2/s; FR, 35.2 מיקרומול/מ"ר לשנייה; R, 18.6 מיקרומול/מ"ר 2/s. אוטופלואורסצנציה של PSV נרגשה ב-561 ננומטר ונאספה בין 565-621 ננומטר. אות ה-GFP הופרד באותה שיטה שתוארה לעיל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
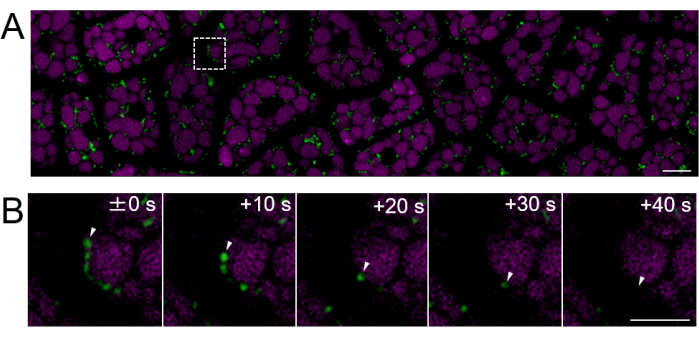
איור 4: הדמיית תאים חיים פלואורסצנטיים של שכבת תאי אנדוספרם שלמה באמצעות זרעים בוגרים. הדמיה מיקרוסקופית בוצעה באותה שיטה המתוארת באיור 3. (A) מוצגת תמונה קונפוקלית של כל שכבת תאי האנדוספרם השלמה, שהתקבלה מסרט משלים 2. מיטוכונדריה מסומנת בירוק, ואוטופלואורסצנטיות PSV מסומנת במג'נטה. סרגל קנה מידה: 10 מיקרומטר. (B) סדרה של תמונות מוגדלות מהאזור הריבועי של הקו המקווקו בלוח (A) מציגה את התנועה של מיטוכונדריון, המסומנת על ידי ראשי חץ לבנים. סרגל קנה מידה: 5 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרט משלים 1: מוצג סרטון זמן-lapse של mtGFP בשכבת תאי האנדוספרם של זרע בוגר 3 שעות לאחר ההטמעה. פריים אחד צולם כל 10 שניות, וקצב הפריימים של הסרטון הוא 10 פריימים לשנייה. סרגל קנה מידה: 10 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
סרט משלים 2: מוצג סרטון זמן-lapse של mtGFP בשכבת תאי האנדוספרם של זרע בוגר יום אחד לאחר ההטמעה. פריים אחד צולם כל 10 שניות, וקצב הפריימים של הסרטון הוא 10 פריימים לשנייה. סרגל קנה מידה: 10 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
Discussion
תפקידי האנדוספרם בנביטת הזרעים התגלו באמצעות ניתוחים גנטיים וביוכימיים באמצעות רקמות זרעים מופרדות, כגון ניתוח ביטוי גנים וכימות של ליפידים ופיטוהורמונים 9,14,25,26,27. בדיקת מצע מעיל זרעים במבחנה, המשלבת את מעטפת הזרעים הריקה (אנדוספרם וטסטה) עם עובר מבודד ממוטציות שונות של Arabidopsis, חשפה מנגנונים מולקולריים העומדים בבסיס תהליכי נביטה 14,15,16,28. עם זאת, הכנת הדגימה לתצפית מיקרוסקופית הייתה מאתגרת בשל גודלם הקטן של זרעי ארבידופסיס ומיקום שכבת תאי האנדוספרם מתחת לאשכה. בפרט, תצפית על שכבת תאי האנדוספרם במהלך התפתחות הזרע נערכה לעתים רחוקות ללא קיבוע וחתך כימי.
במהלך הכנת הדגימה, מעטפת הזרעים הריקה מהתפתחות הזרעים שבירה מכיוון שהאשך חי ולכן רך. כאן, נקבעו שני פרוטוקולים להכנה מהירה של דגימות שכבת תאי אנדוספרם שלמות המתאימות לתצפית וניתוח מיקרוסקופי בפיתוח זרעים ללא צורך בקיבוע או חתך. במקרה של הכנת דגימה מזרעים בוגרים, האשך מת ויציב, מה שגורם למעטפת הזרעים הריקה לשמור על עקמומיות כאשר היא מותקנת על זכוכית שקופית. עקמומיות זו מקשה על התבוננות בשכבת תאי האנדוספרם בבירור על פני טווח רחב של מיקוד. לכן, שיטת הנתיחה לפיתוח זרעים שונתה מעט כדי לקצץ כראוי את מעטפת הזרעים הריקה. על ידי הפרדתו לשני חלקים בשיטה זו, הושגה תצפית ברורה על תאי אנדוספרם רבים תוך שמירה על מיקוד.
פותחו ריאגנטים שונים להדמיה (לצביעת DNA, מיני חמצן תגובתיים, תאים חומציים וכו'), וחלקם יושמו על צמחי Arabidopsis 29,30,31,32. דגימות שכבת תאי אנדוספרם שהוכנו באמצעות פרוטוקול זה כבר שימשו לתצפית מיקרוסקופית עם צביעת LysoTracker ו-Propidium Iodide, מה שתורם להערכת תפקוד האנדוספרם17. מאז גילוי ה-GFP ב-196233, חלבונים המתויגים ב-GFP הפכו לכלים חיוניים להבהרת הדינמיקה של מבנים תוך-תאיים 23,24,34,35,36,37,38. על ידי הכנת דגימות אנדוספרם על פי פרוטוקול זה ושימוש בשיטות הנ"ל, ניתן לבצע הדמיה של תאים חיים של האנדוספרם במהלך התפתחות הזרעים ונביטתם, כפי שמוצג באיור 3 ובאיור 4, ובכך להבהיר אירועים תוך-תאיים ולוקליזציה של חלבונים ספציפיים. יתר על כן, יישום של מעכבים ספציפיים (כגון מעכבי פרוטאז, מעכבי אנזים לשינוי חלבון ומעכבי דינמיקה תאית)39,40,41,42 על תאי אנדוספרם חיים באמצעות פרוטוקול זה צפוי לספק תובנות עמוקות יותר לגבי האירועים התוך תאיים והמנגנונים המולקולריים העומדים בבסיס תפקוד האנדוספרם במהלך התפתחות הזרעים והנביטה.
מגבלה אחת של פרוטוקול זה היא שלא ניתן להכין שכבות של תאי אנדוספרם מזרעים מיובשים לחלוטין מכיוון שקשה להפריד את הזרעים לעובר ולמעטפת הזרעים הריקה. כפי שמוצג באיור 2, זמן שתייה של לפחות 40 דקות נחוץ כדי להפריד זרעים בוגרים. חשוב לציין כי מספר אירועים תאיים בתוך תאי האנדוספרם עשויים להיגרם בעת ספיגה. מגבלה נוספת היא שפרוטוקול זה אינו מאפשר תצפית על רקמת אנדוספרם בשלבים המוקדמים של התפתחות הזרע, במיוחד לפני 10 DAF, מכיוון שהוא תוכנן במיוחד לתצפית על שכבת האנדוספרם של תא בודד. בשלבים מוקדמים אלה, הרקמה הקודמת להיווצרות שכבת האנדוספרם החד-תאית - אנדוספרם לא שכבתי - ממלאת את החלק הפנימי של הזרעים המתפתחים43, מה שמקשה על הכנת דגימות אנדוספרם.
Disclosures
המחברים מצהירים שאין להם אינטרסים פיננסיים מתחרים.
Acknowledgements
אנו מודים לד"ר מטסושיטה ולד"ר אוקה מאוניברסיטת קיוטו על שסיפקו את מוטנט ה-phyB המבטא PHYB-GFP המונע על ידי מקדם 35S. מחקר זה נתמך בחלקו על ידי מענק סיוע למחקר מדעי בתחומים חדשניים, מחקר באזור מחקר מוצע (19H05713 עד K.Y.).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
References
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179 (2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202 (2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121 (2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394 (2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732 (2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650 (2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510 (2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -. C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -. H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved