Method Article
Preparazione del tessuto intatto per l'analisi microscopica dello strato cellulare dell'endosperma nei semi di Arabidopsis in via di sviluppo e maturi
In questo articolo
Riepilogo
Questo protocollo descrive la preparazione di campioni intatti dello strato cellulare dell'endosperma nei semi di Arabidopsis thaliana . Il metodo richiede solo le comuni attrezzature di laboratorio, come un ago per iniezione e una pinza di precisione, e consente l'imaging fluorescente ad alta risoluzione delle cellule dell'endosperma sia nei semi in via di sviluppo che in quelli maturi.
Abstract
Nei semi di Arabidopsis , l'endosperma, un singolo strato di cellule viventi situato tra l'embrione e la testa, svolge un ruolo fondamentale nella regolazione della maturazione, della dormienza e della germinazione dei semi. L'analisi microscopica delle cellule dell'endosperma intatte è essenziale per comprendere le funzioni fisiologiche dell'endosperma a livello cellulare e molecolare. Tuttavia, la preparazione del campione è stata difficile a causa delle piccole dimensioni dei semi di Arabidopsis e della posizione dello strato cellulare dell'endosperma sotto la testa. Questo articolo descrive in dettaglio la preparazione di campioni di strato di cellule dell'endosperma intatto adatti per l'osservazione e l'analisi microscopica sia in semi in via di sviluppo che maturi. Questo metodo consente l'osservazione di ampie aree e di numerose cellule endospermatiche intatte senza richiedere fissazione o sezionamento. Inoltre, il protocollo utilizza solo apparecchiature di laboratorio standard, come aghi per iniezione, pinze di precisione e stereomicroscopi. Questo approccio consente con successo l'imaging di cellule vive ad alta risoluzione di segnali fluorescenti, come la proteina fluorescente verde (GFP), in cellule endospermatiche intatte. Questo metodo consente l'osservazione della localizzazione intracellulare e del movimento di varie proteine, nonché della morfologia degli organelli, nelle cellule endospermatiche di diversi mutanti di Arabidopsis . Questo protocollo contribuisce a chiarire le nuove funzioni dell'endosperma e amplia il potenziale per gli studi cellulari e molecolari di questo tessuto essenziale.
Introduzione
Poiché le piante sono organismi sessili, la germinazione dei semi è un evento cruciale che determina il loro destino. La decisione di germinare è strettamente regolata da fattori interni e ambientali, come i livelli di dormienza del seme primario, la temperatura, l'intensità e la lunghezza d'onda della luce e la concentrazione di azoto 1,2,3,4,5,6. I semi hanno strutture complesse costituite da più tipi di tessuto7. Nei semi secchi di Arabidopsis, l'embrione, che si sviluppa in una piantina, è circondato da un singolo strato di endosperma e dagli strati più esterni, la testa. La testa è composta da più strati di cellule morte, mentre l'embrione e l'endosperma rimangono in vita anche nei semi secchi. L'endosperma è comunemente considerato come un tessuto di riserva che fornisce nutrienti per la crescita dell'embrione e, insieme alla testa, conferisce resistenza meccanica alla protrusione della radichetta 8,9,10,11,12,13.
Diversi studi recenti hanno dimostrato che l'endosperma svolge un ruolo essenziale nella regolazione della germinazione ottimale dei semi 14,15,16,17. Ad esempio, il fotorecettore fitocromo B (PHYB) nelle cellule dell'endosperma rileva la luce rossa (R) o la luce rossa lontana (FR), regolando le risposte di germinazione15. L'endosperma funziona anche come tessuto sensibile alla temperatura, sopprimendo le risposte di germinazione ad alte temperature16. Il controllo di qualità dell'endosperma è fondamentale per una germinazione ottimale dei semi, in particolare nei semi conservati a lungo termine17.
L'imaging di cellule vive è ora necessario per chiarire ulteriormente le funzioni fisiologiche dell'endosperma. L'analisi microscopica di cellule endosperme intatte che esprimono proteine marcate con fluorescenza consente lo studio dei meccanismi molecolari con cui l'endosperma regola la germinazione dei semi. Tuttavia, la preparazione di cellule endospermatiche intatte per l'osservazione microscopica è impegnativa, in particolare nei semi di Arabidopsis . I semi hanno un diametro di circa 0,4 mm e l'endosperma è uno strato unicellulare situato tra l'embrione e la testa, il che rende difficile una manipolazione precisa. Di conseguenza, nonostante i suoi importanti ruoli fisiologici, l'endosperma è stato raramente osservato utilizzando l'imaging di cellule vive.
Questo articolo presenta un protocollo per la preparazione rapida di campioni di strato di cellule endospermatiche intatte adatto per l'imaging di cellule vive sia in semi in via di sviluppo che maturi.
Protocollo
In questo studio, sono state stabilite due diverse procedure per la preparazione di campioni di strato di cellule di endosperma viventi: una per lo sviluppo dei semi e una per i semi maturi. Sono necessari approcci leggermente diversi a seconda della solidità della testa. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Preparazione di campioni di endosperma intatti da semi in via di sviluppo
- Collezione di silique
- Coltiva le piante di Arabidopsis sul terreno o sulla lana di roccia fino alla fioritura.
- Segna i fiori completamente aperti con fili colorati (0 giorni dopo la fioritura, 0 DAF).
NOTA: Evita di usare fili verdi, gialli o marroni per contrassegnare i fiori, poiché questi colori sono difficili da distinguere dalle piante in crescita o mature e dalle silique. - Tagliare le silique marcate in via di sviluppo sul pedicello (indicato nella Figura 1(1)) e raccoglierle in provette da 1,5 mL.
NOTA: Le silique in via di sviluppo da 12-16 DAF sono adatte per la preparazione utilizzando questo protocollo.
- Dissezione dei semi in via di sviluppo
NOTA: I seguenti passaggi devono essere eseguiti su carta da filtro bagnata per proteggere i campioni dall'essiccazione. Le manipolazioni devono essere eseguite sotto uno stereomicroscopio.- Separare una valvola (indicata nella figura 1.2)) dal replum (indicato nella figura 1.1)) utilizzando due pinze: una con punte spesse per la tenuta e l'altra con punte affilate per lo strappo).
- Raccogliere delicatamente i semi in via di sviluppo dalle silique usando una pinza con le punte chiuse per evitare di danneggiare i semi (Figura 1(2)).
- Tenendo il seme con una pinza senza schiacciare il seme, praticare una cicatrice di circa 0,2 mm sulla testa e sull'endosperma che circonda l'embrione utilizzando un ago per iniezione (27 G, 0,40 mm × 19 mm) (Figura 1(3)).
NOTA: La posizione ottimale per realizzare la cicatrice è all'incrocio tra i cotiledoni e la radichetta. - Spingere fuori l'embrione pizzicando il seme con una pinza (Figura 1(4)). Non schiacciare l'involucro del seme vuoto, che consiste nella testa e nell'endosperma, e cerca di mantenere la sua forma rotonda.
- Inserire l'ago per iniezione nell'involucro vuoto del seme in corrispondenza della cicatrice, perforandola dall'interno verso l'esterno (Figura 1(5)).
- Tenere l'ago in posizione, grattare la superficie della testa con una pinza con le punte chiuse e tagliare un lato dell'involucro del seme vuoto per consentirne l'apertura (Figura 1(6)).
- Aprire la busta vuota del seme in un foglio utilizzando una pinza con punte affilate (Figura 1(7)). Il campione dovrebbe ora essere isolato come un foglio a doppio strato costituito dagli strati dell'endosperma e della testa (Figura 1(8)).
NOTA: Se il campione tende ad arricciarsi quando si utilizza l'acqua come mezzo di montaggio al punto 3 di seguito, dividere il campione in due pezzi. Anche i semi raccolti dalle silique a circa 18 DAF (in questa fase, la testa è marrone ma non ancora completamente secca) possono essere lavorati utilizzando questo protocollo, anche se i semi devono essere assorbiti per diversi minuti prima della preparazione.
2. Preparazione di campioni di endosperma intatti da semi maturi
- Iniezione di semi maturi
- Aggiungere 1 ml di acqua distillata doppia in una provetta da 1,5 ml contenente semi secchi di Arabidopsis .
- Conservare i semi imbevuti per almeno 40 minuti a temperatura ambiente (Figura 2(1)).
NOTA: I semi secchi e i semi entro 40 minuti dall'imbibizione sono difficili da cicatrizzare sulla testa e sull'endosperma e rimuovere l'embrione dall'interno del seme senza danneggiare l'involucro vuoto del seme nei passaggi 2.2.1 e 2.2.2, mentre un tempo di imbibizione più lungo facilita la manipolazione. - Utilizzare una micropipetta da 1000 μl per trasferire i semi imbevuti su carta da filtro bagnata.
- Dissezione di semi maturi
NOTA: I seguenti passaggi devono essere eseguiti su carta da filtro bagnata per proteggere i campioni dall'essiccazione. Le manipolazioni devono essere condotte sotto uno stereomicroscopio.- Tenendo il seme con una pinza senza schiacciare il seme, fare una cicatrice di circa 0,2 mm sulla testa e sull'endosperma che circonda l'embrione usando un ago per iniezione (Figura 2(2)).
- Spingere fuori l'embrione pizzicando il seme con una pinza (Figura 2(3)). Non schiacciare l'involucro vuoto del seme, che include la testa e l'endosperma. Cerca di mantenere la sua forma rotonda.
- Tagliare i lati superiore e inferiore dell'involucro di semi vuoto con un ago per iniezione per modellarlo in un cilindro (Figura 2(4)).
- Tagliare l'involucro di semi vuoti di forma cilindrica lungo il suo asse centrale per separarlo in due pezzi (Figura 2(5)). I campioni devono essere isolati come fogli a doppio strato costituiti dallo strato dell'endosperma e dallo strato della testa (Figura 2(6)).
3. Osservazione microscopica
- Posizionare i campioni di endosperma in forma di foglio su un vetrino e montarli in acqua o perfluorodecalina (PFD).
NOTA: Se rimangono bolle d'aria tra il campione e il vetrino coprioggetti, la perfluorodecalina (PFD), che è stata segnalata come particolarmente utile per l'imaging di campioni contenenti sacche d'aria, come le foglie18,19, sarebbe utile. Il PFD è noto per avere la tensione superficiale più bassa, che gli consente di riempire facilmente gli spazi d'aria sulla superficie del campione. Per l'imaging time-lapse, tuttavia, si raccomanda l'uso di acqua come mezzo di montaggio, poiché il contenuto di acqua nei semi maturi dovrebbe essere abbondante per mantenere la liquidità cellulare. - Posizionare delicatamente un vetrino coprioggetti sul campione. Assicurarsi che lo strato di endosperma sia rivolto verso il vetrino coprioggetti.
NOTA: È possibile utilizzare smalto per unghie o grasso per sigillare i bordi del vetrino coprioggetti per evitare l'essiccazione del campione e del mezzo di montaggio.
Risultati
Utilizzando il protocollo mostrato nella Figura 1, sono stati preparati campioni di endosperma da semi in via di sviluppo raccolti da silique a 14 DAF (in questa fase, la testa è ancora verde). Sono state osservate numerose cellule endospermatiche in un'ampia area e le loro strutture intracellulari (Figura 3A). In questo esperimento, sono stati utilizzati semi che esprimono PHYB fusi con GFP al C-terminale (PHYB-GFP). È noto che il PHYB trasloca nel nucleo dopo l'attivazione da parte della luce rossa e forma macchie PHYB-positive, note come fotocorpi (PB), che sono coinvolte nella germinazione dei semi 4,20,21,22. I campioni sono stati raccolti da piante coltivate in condizioni di luce bianca continua a 22 °C. Come mostrato nella Figura 3B, i PB all'interno del nucleo sono stati rilevati nelle cellule dell'endosperma. Questo risultato corrisponde a uno studio precedente che dimostra che il PHYB nell'endosperma regola la germinazione ottimale dei semi15. Inoltre, è stato condotto un time-lapse imaging su cellule vive per confermare che le cellule endospermatiche isolate mantenevano l'attività biologica anche dopo la preparazione del campione, osservando la fotoreversibilità del fitocromo FR/R (Figura 3C). I campioni di endosperma sono stati preparati da semi in via di sviluppo raccolti da silique a circa 17-18 DAF. I PB sono stati rilevati all'interno del nucleo dopo la dissezione, mentre sono completamente scomparsi dopo l'irradiazione con luce rossa lontana. Successivamente, l'irradiazione con luce rossa ha nuovamente indotto PB. Questa fotoreversibilità del fitocromo è stata rilevata due volte, indicando che le cellule dell'endosperma isolate da questo protocollo hanno mantenuto l'attività biologica per almeno 4,5 ore dopo la dissezione (Figura 3C).
Successivamente, sono stati preparati campioni di endosperma da semi maturi (dove la testa è marrone), come mostrato nella Figura 2. In questo esperimento, la motilità dei mitocondri è stata osservata utilizzando semi che esprimono GFP mitocondriale mirata (mtGFP)23, che erano stati conservati in un essiccatore a temperatura ambiente al buio per circa un anno dopo la raccolta. È stato riportato che i mitocondri nell'embrione si muovono attivamente e cambiano dinamicamente la morfologia dopo l'imbibizione e il trasferimento alle condizioni di germinazione24. È stato eseguito l'imaging time-lapse fluorescente dei mitocondri in cellule endospermatiche intatte dopo 3 ore di imbibizione del seme ed è stato rilevato il movimento mitocondriale (Filmato supplementare 1). I mitocondri nell'endosperma si sono spostati immediatamente all'interno del citosol dopo un breve periodo di imbibizione a 22 °C. Dopo 1 giorno di imbibizione del seme a 22 °C, sono stati osservati mitocondri in movimento più dinamico (Figura 4 e Filmato supplementare 2).
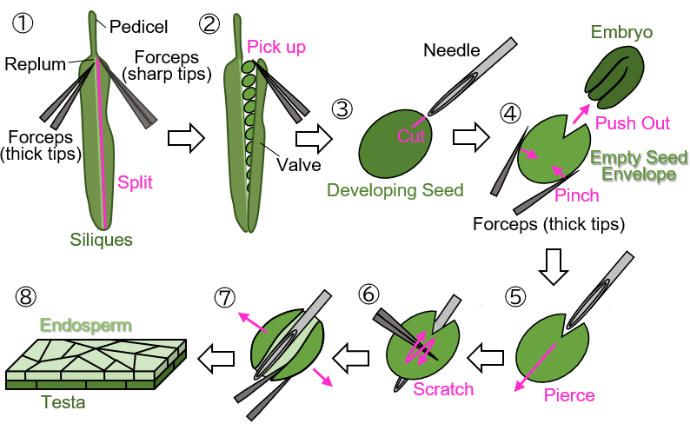
Figura 1: Preparazione del campione di endosperma da semi in via di sviluppo. Passaggio 1: una valvola viene divisa dal replum. Passaggio 2: i semi in via di sviluppo vengono raccolti. Passaggio 3: viene creata una cicatrice sulla testa e sull'endosperma utilizzando un ago per iniezione. Passaggio 4: l'embrione viene rimosso pizzicando il seme con una pinza. Passaggio 5: l'ago per iniezione viene inserito attraverso la busta del seme vuota dall'interno verso l'esterno. Passaggio 6: la superficie della testa viene graffiata con una pinza. Passaggio 7: la busta del seme vuota viene aperta in un foglio utilizzando una pinza. Fase 8: Il campione finale del foglio di endosperma viene preparato per l'osservazione microscopica. Tutti i passaggi vengono eseguiti su carta da filtro bagnata sotto uno stereomicroscopio. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Preparazione del campione di endosperma da semi maturi. Fase 1: I semi secchi vengono immersi in acqua per più di 40 minuti in una provetta da 1,5 ml. Fase 2: Viene creata una cicatrice sulla testa e sull'endosperma utilizzando un ago per iniezione. Passaggio 3: l'embrione viene rimosso pizzicando il seme con una pinza. Passaggio 4: i lati superiore e inferiore della busta di semi vuoti vengono tagliati per modellarla in un cilindro. Passaggio 5: l'involucro di semi vuoto di forma cilindrica viene tagliato lungo il suo asse centrale. Fase 6: Il campione finale del foglio di endosperma viene preparato per l'osservazione microscopica. Tutti i passaggi vengono eseguiti su carta da filtro bagnata sotto uno stereomicroscopio. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Imaging fluorescente di uno strato di cellule endospermatiche intatte utilizzando semi in via di sviluppo. Campioni di strato cellulare di endosperma intatti sono stati preparati da semi in via di sviluppo di siliques (A,B) 14-day-after-flowering (DAF) (A,B) e siliques (C) 17-18 DAF. L'imaging microscopico è stato eseguito utilizzando un microscopio a scansione laser confocale dotato di un obiettivo a immersione in olio Plan-Apochromat 63× e di un laser a luce bianca. (A) Un'immagine confocale dell'endosperma sotto contrasto interferenziale differenziale (DIC) mostra ampie aree con numerose cellule endospermatiche intatte. Barra della scala: 20 μm. (B) Vengono mostrate immagini confocali dell'endosperma che esprime PHYB-GFP, con PHYB-GFP in verde e autofluorescenza clorofilliana in ciano. I fotocorpi (PB) in un nucleo sono indicati da punte di freccia bianche. Barre di scala: 10 μm; Barra della scala dell'immagine ingrandita: 2,5 μm. Il segnale GFP è stato separato dall'autofluorescenza dei vacuoli di accumulo proteico (PSV) utilizzando la microscopia a fluorescenza-tempo di vita (FLIM). I tempi di vita della fluorescenza sono stati ottenuti utilizzando TauScan e separati utilizzando la funzione TauSeparation. La durata media della fluorescenza per GFP è stata di 2,2 ns. La fluorescenza GFP è stata eccitata a 488 nm e raccolta tra 500-530 nm, mentre l'autofluorescenza clorofilliana è stata eccitata a 405 nm e raccolta tra 688-729 nm. (C) Vengono presentate immagini confocali dell'endosperma che esprime PHYB-GFP in condizioni di luce bianca continua (cWL), luce rossa lontana continua (cFR) o luce rossa continua (cR). PHYB-GFP è mostrato in verde e l'autofluorescenza PSV è mostrata in magenta. Barre di scala: 10 μm; Barra della scala dell'immagine ingrandita: 2,5 μm. Intensità della luce: WL, 46,5 μmol/m2/s; FR, 35,2 μmol/m2/s; R, 18,6 μmol/m2/s. L'autofluorescenza del PSV è stata eccitata a 561 nm e raccolta tra 565-621 nm. Il segnale GFP è stato separato utilizzando lo stesso metodo descritto sopra. Clicca qui per visualizzare una versione più grande di questa figura.
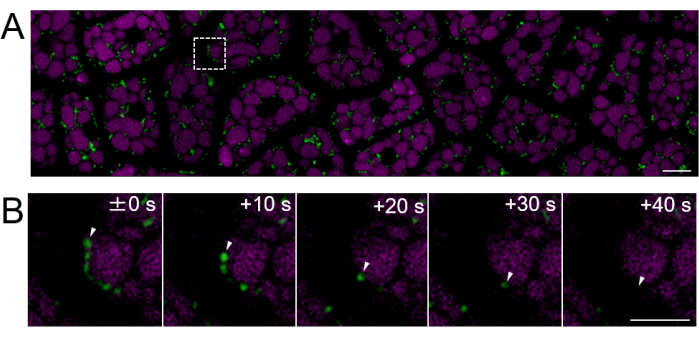
Figura 4: Imaging fluorescente di cellule vive di uno strato di cellule endospermatiche intatte utilizzando semi maturi. L'imaging microscopico è stato eseguito utilizzando lo stesso metodo descritto nella Figura 3. (A) Viene mostrata un'immagine confocale dell'intero strato di cellule endospermiche intatte, ottenuta dal filmato supplementare 2. I mitocondri sono etichettati in verde e l'autofluorescenza PSV è etichettata in magenta. Barra della scala: 10 μm. (B) Una serie time-lapse di immagini ingrandite dall'area quadrata tratteggiata nel pannello (A) mostra il movimento di un mitocondrio, indicato da punte di freccia bianche. Barra della scala: 5 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Film supplementare 1: Viene mostrato un video time-lapse di mtGFP nello strato cellulare dell'endosperma di un seme maturo 3 ore dopo l'imbibizione. È stato acquisito un fotogramma ogni 10 s e la frequenza dei fotogrammi del video è di 10 fotogrammi/s. Barra di scala: 10 μm. Clicca qui per scaricare questo file.
Film supplementare 2: Viene mostrato un video time-lapse di mtGFP nello strato cellulare dell'endosperma di un seme maturo 1 giorno dopo l'imbibizione. È stato acquisito un fotogramma ogni 10 s e la frequenza dei fotogrammi del video è di 10 fotogrammi/s. Barra di scala: 10 μm. Clicca qui per scaricare questo file.
Discussione
I ruoli dell'endosperma nella germinazione dei semi sono stati rivelati attraverso analisi genetiche e biochimiche utilizzando tessuti separati del seme, come l'analisi dell'espressione genica e la quantificazione di lipidi e fitormoni 9,14,25,26,27. Un saggio in vitro sulla lettiera del rivestimento del seme, combinando l'involucro del seme vuoto (endosperma e testa) con un embrione isolato da diversi mutanti di Arabidopsis, ha scoperto i meccanismi molecolari alla base dei processi di germinazione 14,15,16,28. Tuttavia, la preparazione del campione per l'osservazione microscopica è stata impegnativa a causa delle piccole dimensioni dei semi di Arabidopsis e della posizione dello strato di cellule dell'endosperma sotto la testa. In particolare, l'osservazione dello strato cellulare dell'endosperma durante lo sviluppo del seme è stata raramente condotta senza fissazione chimica e sezionamento.
Durante la preparazione del campione, l'involucro vuoto dei semi in via di sviluppo è fragile perché la testa è viva e quindi morbida. In questo caso, sono stati stabiliti due protocolli per la preparazione rapida di campioni di strato di cellule di endosperma intatti adatti per l'osservazione e l'analisi microscopica nei semi in via di sviluppo senza richiedere fissazione o sezionamento. Nel caso della preparazione di campioni da semi maturi, la testa è morta e robusta, facendo sì che l'involucro del seme vuoto mantenga la sua curvatura quando viene montato su un vetrino. Questa curvatura rende difficile osservare chiaramente lo strato cellulare dell'endosperma in un'ampia gamma di punti focali. Pertanto, il metodo di dissezione per lo sviluppo dei semi è stato leggermente modificato per tagliare in modo appropriato l'involucro di semi vuoto. Separandolo in due parti con questo metodo, è stata ottenuta una chiara osservazione di numerose cellule endospermatiche mantenendo la concentrazione.
Sono stati sviluppati vari reagenti di imaging (per la colorazione del DNA, delle specie reattive dell'ossigeno, dei compartimenti acidi, ecc.) e alcuni sono stati applicati alle piante di Arabidopsis 29,30,31,32. I campioni di strato cellulare dell'endosperma preparati utilizzando questo protocollo sono già stati utilizzati per l'osservazione microscopica con LysoTracker e colorazione con ioduro di propidio, contribuendo alla valutazione della funzione dell'endosperma17. Dalla scoperta della GFP nel 196233, le proteine marcate con GFP sono diventate strumenti essenziali per chiarire le dinamiche delle strutture intracellulari 23,24,34,35,36,37,38. Preparando campioni di endosperma secondo questo protocollo e impiegando i metodi sopra menzionati, è possibile eseguire l'imaging su cellule vive dell'endosperma durante lo sviluppo e la germinazione del seme, come mostrato in Figura 3 e Figura 4, chiarendo così gli eventi intracellulari e la localizzazione di proteine specifiche. Inoltre, si prevede che l'applicazione di inibitori specifici (come inibitori della proteasi, inibitori dell'enzima di modificazione delle proteine e inibitori della dinamica cellulare)39,40,41,42 a cellule di endosperma vive utilizzando questo protocollo fornisca informazioni più approfondite sugli eventi intracellulari e sui meccanismi molecolari alla base della funzione dell'endosperma durante lo sviluppo e la germinazione dei semi.
Una limitazione di questo protocollo è che gli strati di cellule dell'endosperma da semi completamente essiccati non possono essere preparati perché è difficile separare i semi nell'embrione e nell'involucro vuoto del seme. Come mostrato nella Figura 2, è necessario un tempo di imbibizione di almeno 40 minuti per separare i semi maturi. È importante notare che diversi eventi cellulari all'interno delle cellule endospermatiche possono essere indotti dopo l'imbibizione. Un'altra limitazione è che questo protocollo non consente l'osservazione del tessuto endospermatico durante le prime fasi di sviluppo del seme, in particolare prima del 10 DAF, poiché è specificamente progettato per osservare lo strato di endosperma unicellulare. Durante queste prime fasi, il tessuto che precede la formazione dello strato di endosperma unicellulare - un endosperma non stratificato - riempie l'interno dei semi in via di sviluppo43, rendendo difficile la preparazione di campioni di endosperma.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Ringraziamo i dottori Matsushita e Oka dell'Università di Kyoto per aver fornito il mutante phyB che esprime PHYB-GFP guidato dal promotore 35S. Questo studio è stato in parte sostenuto da una sovvenzione per la ricerca scientifica su aree innovative, ricerca in un'area di ricerca proposta (19H05713 a K.Y.).
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
Riferimenti
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179(2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Jr Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202(2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121(2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394(2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732(2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650(2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510(2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1(2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon