Method Article
Aufbereitung von intaktem Gewebe für die mikroskopische Analyse der Endosperm-Zellschicht in sich entwickelnden und reifen Arabidopsis-Samen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Aufbereitung von intakten Proben der Endosperm-Zellschicht in Arabidopsis thaliana-Samen . Die Methode erfordert nur gängige Laborgeräte wie eine Injektionsnadel und eine Präzisionszange und ermöglicht eine hochauflösende fluoreszierende Bildgebung von Endospermzellen sowohl in sich entwickelnden als auch in reifen Samen.
Zusammenfassung
In Arabidopsis-Samen spielt das Endosperm , eine einzelne Schicht lebender Zellen, die sich zwischen dem Embryo und der Testa befindet, eine entscheidende Rolle bei der Regulierung der Samenreifung, der Ruhephase und der Keimung. Die mikroskopische Analyse intakter Endospermzellen ist unerlässlich, um die physiologischen Funktionen des Endosperms auf zellulärer und molekularer Ebene zu verstehen. Die Probenvorbereitung war jedoch aufgrund der geringen Größe der Arabidopsis-Samen und der Lage der Endosperm-Zellschicht unter dem Testa eine Herausforderung. In diesem Artikel wird die Aufbereitung von intakten Endosperm-Zellschichtproben beschrieben, die für die mikroskopische Beobachtung und Analyse sowohl in sich entwickelnden als auch in reifen Samen geeignet sind. Diese Methode ermöglicht die Betrachtung großer Areale und zahlreicher intakter Endospermzellen, ohne dass eine Fixierung oder Sektion erforderlich ist. Darüber hinaus werden für das Protokoll nur Standard-Laborgeräte wie Injektionsnadeln, Präzisionszangen und Stereomikroskope verwendet. Dieser Ansatz ermöglicht erfolgreich die hochauflösende Bildgebung von Fluoreszenzsignalen, wie z. B. grün fluoreszierendem Protein (GFP), in intakten Endospermzellen. Diese Methode ermöglicht die Beobachtung der intrazellulären Lokalisation und Bewegung verschiedener Proteine sowie der Morphologie von Organellen in den Endospermzellen verschiedener Arabidopsis-Mutanten . Dieses Protokoll trägt zur Aufklärung neuer Endosperm-Funktionen bei und erweitert das Potenzial für zelluläre und molekulare Studien dieses essentiellen Gewebes.
Einleitung
Da Pflanzen sessile Organismen sind, ist die Keimung von Samen ein entscheidendes Ereignis, das über ihr Schicksal entscheidet. Die Entscheidung für die Keimung wird sowohl von internen als auch von Umweltfaktoren streng reguliert, wie z. B. der Ruhephase des primären Samens, der Temperatur, der Lichtintensität und -wellenlänge sowie der Stickstoffkonzentration 1,2,3,4,5,6. Samen haben komplexe Strukturen, die aus mehreren Gewebetypen bestehen7. Bei den trockenen Samen von Arabidopsis ist der Embryo, der sich zu einem Keimling entwickelt, von einer einzigen Schicht Endosperm und der äußersten Schicht, der Testa, umgeben. Die Testa besteht aus mehreren Schichten abgestorbener Zellen, während der Embryo und das Endosperm auch in trockenen Samen am Leben bleiben. Das Endosperm wird allgemein als Speichergewebe angesehen, das Nährstoffe für das Wachstum des Embryos liefert und zusammen mit der Testa eine mechanische Beständigkeit gegen den Radialvorsprung verleiht 8,9,10,11,12,13.
Mehrere neuere Studien haben gezeigt, dass das Endosperm eine wesentliche Rolle bei der Regulierung einer optimalen Samenkeimung spielt 14,15,16,17. Zum Beispiel erkennt der Photorezeptor Phytochrom B (PHYB) in Endospermzellen entweder rotes (R) oder dunkelrotes (FR) Licht und reguliert so die Keimreaktionen15. Das Endosperm fungiert auch als temperaturempfindliches Gewebe und unterdrückt die Keimreaktion bei hohen Temperaturen16. Die Qualitätskontrolle des Endosperms ist entscheidend für eine optimale Keimung der Samen, insbesondere bei langfristig gelagerten Samen17.
Die Bildgebung lebender Zellen ist nun notwendig, um die physiologischen Funktionen des Endosperms weiter aufzuklären. Die mikroskopische Analyse intakter Endospermzellen, die fluoreszenzmarkierte Proteine exprimieren, ermöglicht die Untersuchung der molekularen Mechanismen, durch die das Endosperm die Samenkeimung reguliert. Die Vorbereitung intakter Endospermzellen für die mikroskopische Betrachtung ist jedoch eine Herausforderung, insbesondere bei Arabidopsis-Samen . Die Samen haben einen Durchmesser von etwa 0,4 mm, und das Endosperm ist eine einzellige Schicht, die sich zwischen dem Embryo und der Testa befindet, was eine präzise Manipulation erschwert. Folglich wurde das Endosperm trotz seiner wichtigen physiologischen Rolle nur selten mit Hilfe von Lebendzell-Bildgebung beobachtet.
In diesem Artikel wird ein Protokoll für die schnelle Präparation von intakten Endosperm-Zellschichtproben vorgestellt, die für die Bildgebung lebender Zellen sowohl in sich entwickelnden als auch in reifen Samen geeignet sind.
Protokoll
In dieser Studie wurden zwei verschiedene Verfahren für die Präparation von lebenden Endosperm-Zellschichtproben etabliert: eines für die Entwicklung von Seeds und eines für reife Samen. Je nach Festigkeit des Testas sind leicht unterschiedliche Ansätze erforderlich. Die Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Aufbereitung von intakten Endospermproben aus sich entwickelnden Samen
- Sammlung von Siliques
- Ziehen Sie Arabidopsis-Pflanzen bis zur Blüte auf Erde oder Steinwolle an.
- Vollständig geöffnete Blüten mit farbigen Fäden markieren (0 Tage nach der Blüte, 0 DAF).
HINWEIS: Vermeiden Sie die Verwendung von grünen, gelben oder braunen Fäden zum Markieren von Blumen, da diese Farben schwer von wachsenden oder reifen Pflanzen und Siliques zu unterscheiden sind. - Schneiden Sie die markierten sich entwickelnden Siliquen am Stiel ab (siehe Abbildung 1(1)) und sammeln Sie sie in 1,5-ml-Röhrchen.
HINWEIS: Die Entwicklung von Siliques von 12-16 DAF ist für die Zubereitung mit diesem Protokoll geeignet.
- Zerlegung von sich entwickelnden Samen
HINWEIS: Die folgenden Schritte müssen auf nassem Filterpapier durchgeführt werden, um die Proben vor dem Austrocknen zu schützen. Manipulationen sollten unter einem Stereomikroskop durchgeführt werden.- Trennen Sie ein Ventil (siehe Abbildung 1(2)) von der Feder (siehe Abbildung 1(1)) mit zwei Pinzetten: eine mit dicken Spitzen zum Halten und die andere mit scharfen Spitzen zum Reißen).
- Nehmen Sie die sich entwickelnden Samen vorsichtig mit einer Pinzette und geschlossenen Spitzen von den Siliquen auf, um eine Beschädigung der Samen zu vermeiden (Abbildung 1(2)).
- Halten Sie den Samen mit einer Pinzette, ohne den Samen zu zerstoßen, und machen Sie mit einer Injektionsnadel eine etwa 0,2 mm große Narbe auf der Hode und dem Endosperm, die den Embryo umgibt (27 G, 0,40 mm × 19 mm) (Abbildung 1(3)).
HINWEIS: Die optimale Stelle für die Narbe befindet sich an der Verbindungsstelle zwischen Keimblättern und Keimwurzel. - Schieben Sie den Embryo heraus, indem Sie den Samen mit einer Zange einklemmen (Abbildung 1(4)). Zerdrücken Sie die leere Samenhülle, die aus Testa und Endosperm besteht, nicht und versuchen Sie, ihre runde Form beizubehalten.
- Führen Sie die Injektionsnadel in die leere Samenhülle an der Narbe ein und stechen Sie sie von innen nach außen ein (Abbildung 1(5)).
- Halten Sie die Nadel in Position, kratzen Sie mit geschlossenen Spitzen mit einer Pinzette auf die Oberfläche des Hodens und schneiden Sie eine Seite der leeren Samenhülle ab, damit sie sich öffnen kann (Abbildung 1(6)).
- Öffnen Sie die leere Samenhülle mit einer Pinzette mit scharfen Spitzen in ein Blatt (Abbildung 1(7)). Die Probe sollte nun als Doppelschicht, bestehend aus der Endosperm- und der Hodenschicht, isoliert werden (Abbildung 1(8)).
HINWEIS: Wenn die Probe dazu neigt, sich zusammenzurollen, wenn Wasser als Einbettmedium in Schritt 3 verwendet wird, teilen Sie die blattförmige Probe in zwei Stücke. Samen, die von Siliken bei etwa 18 DAF geerntet wurden (zu diesem Zeitpunkt ist die Testa braun, aber noch nicht vollständig trocken), können ebenfalls nach diesem Protokoll verarbeitet werden, obwohl die Samen vor der Zubereitung einige Minuten lang getrunken werden müssen.
2. Aufbereitung von intakten Endospermproben aus reifen Samen
- Imbibition von reifem Saatgut
- Geben Sie 1 ml doppelt destilliertes Wasser in ein 1,5-ml-Röhrchen mit trockenen Arabidopsis-Samen .
- Bewahren Sie die Samen mindestens 40 Minuten lang bei Raumtemperatur auf (Abbildung 2(1)).
HINWEIS: Bei trockenen Samen und Samen, die innerhalb von 40 Minuten nach der Imbibition liegen, ist es schwierig, an der Testa und dem Endosperm zu vernarben und den Embryo aus dem Inneren des Samens zu entfernen, ohne die leere Samenhülle in den Schritten 2.2.1 und 2.2.2 zu beschädigen, während eine längere Imbibitionszeit die Manipulation erleichtert. - Verwenden Sie eine 1000-μl-Mikropipette, um die aufgenommenen Samen auf nasses Filterpapier zu übertragen.
- Zerlegung von reifem Saatgut
HINWEIS: Die folgenden Schritte müssen auf nassem Filterpapier durchgeführt werden, um die Proben vor dem Austrocknen zu schützen. Manipulationen sollten unter einem Stereomikroskop durchgeführt werden.- Halten Sie den Samen mit einer Pinzette, ohne den Samen zu zerstoßen, und machen Sie mit einer Injektionsnadel eine etwa 0,2 mm große Narbe auf der Hode und dem Endosperm, die den Embryo umgeben (Abbildung 2(2)).
- Schieben Sie den Embryo heraus, indem Sie den Samen mit einer Zange einklemmen (Abbildung 2(3)). Zerdrücken Sie nicht die leere Samenhülle, die die Testa und das Endosperm enthält. Versuchen Sie, die runde Form beizubehalten.
- Schneiden Sie die Ober- und Unterseite der leeren Saatguthülle mit einer Injektionsnadel zu einem Zylinder ab (Abbildung 2(4)).
- Schneiden Sie die zylindrische leere Saatguthülle entlang ihrer Mittelachse in zwei Stücke (Abbildung 2(5)). Die Proben sollten als Doppelschichten, bestehend aus der Endospermschicht und der Testaschicht, isoliert werden (Abbildung 2(6)).
3. Mikroskopische Betrachtung
- Legen Sie die Endospermproben in Blattform auf einen Objektträger und montieren Sie sie in Wasser oder Perfluordecalin (PFD).
HINWEIS: Wenn Luftblasen zwischen der Probe und dem Deckglas verbleiben, wäre Perfluordecalin (PFD), das sich als besonders nützlich für die Abbildung von Proben mit Lufteinschlüssen wie Blättern18, 19 erwiesen hat, nützlich. PFD ist dafür bekannt, die niedrigste Oberflächenspannung zu haben, so dass es die Lufträume auf der Probenoberfläche leicht füllen kann. Für die Zeitraffer-Bildgebung wird jedoch die Verwendung von Wasser als Eindeckmedium empfohlen, da der Wassergehalt in reifen Samen reichlich vorhanden sein sollte, um die zelluläre Liquidität zu erhalten. - Legen Sie vorsichtig ein Deckglas über die Probe. Stellen Sie sicher, dass die Endospermschicht dem Deckglas zugewandt ist.
HINWEIS: Nagellack oder Fett können verwendet werden, um die Ränder des Deckglases zu versiegeln, um ein Austrocknen der Probe und des Einbettmediums zu verhindern.
Ergebnisse
Unter Verwendung des in Abbildung 1 gezeigten Protokolls wurden Endospermproben aus sich entwickelnden Samen hergestellt, die bei 14 DAF aus Siliquen geerntet wurden (zu diesem Zeitpunkt ist die Testa noch grün). Es wurden zahlreiche großflächige Endospermzellen und ihre intrazellulären Strukturen beobachtet (Abbildung 3A). In diesem Experiment wurden Seeds verwendet, die PHYB exprimieren und mit GFP am C-Terminus (PHYB-GFP) fusionieren. Es ist allgemein bekannt, dass PHYB bei Aktivierung durch rotes Licht in den Zellkern transloziert und PHYB-positive Speckles bildet, die als Photobodies (PBs) bekannt sind und an der Samenkeimung beteiligt sind 4,20,21,22. Die Proben wurden von Pflanzen geerntet, die unter kontinuierlichen weißen Lichtbedingungen bei 22 °C angebaut wurden. Wie in Abbildung 3B gezeigt, wurden PBs im Zellkern in Endospermzellen nachgewiesen. Dieses Ergebnis entspricht einer früheren Studie, die zeigte, dass PHYB im Endosperm die optimale Samenkeimung reguliert15. Zusätzlich wurde eine Zeitrafferbildgebung von lebenden Zellen durchgeführt, um zu bestätigen, dass die isolierten Endospermzellen auch nach der Probenvorbereitung ihre biologische Aktivität beibehielten, indem die Photoreversibilität von Phytochrom FR/R beobachtet wurde (Abbildung 3C). Endospermproben wurden aus Entwicklungssamen hergestellt, die bei etwa 17-18 DAF aus Siliquen geerntet wurden. PBs wurden bei der Dissektion im Zellkern nachgewiesen, während sie nach Bestrahlung mit dunkelrotem Licht vollständig verschwanden. In der Folge induzierte die Rotlichtbestrahlung erneut PBs. Diese Photoreversibilität des Phytochroms wurde zweimal nachgewiesen, was darauf hindeutet, dass die nach diesem Protokoll isolierten Endospermzellen ihre biologische Aktivität für mindestens 4,5 Stunden nach der Dissektion beibehielten (Abbildung 3C).
Als nächstes wurden Endospermproben von reifen Samen (bei denen die Testa braun ist) vorbereitet, wie in Abbildung 2 gezeigt. In diesem Experiment wurde die Motilität der Mitochondrien anhand von Samen beobachtet, die mitochondrial-targeted GFP (mtGFP)23 exprimieren und nach der Ernte etwa ein Jahr lang in einem Exsikkator bei Raumtemperatur im Dunkeln gelagert worden waren. Es wurde berichtet, dass sich die Mitochondrien im Embryo aktiv bewegen und die Morphologie nach der Aufnahme und dem Übergang zu den Keimbedingungen dynamisch verändern24. Es wurde eine fluoreszierende Zeitrafferbildgebung von Mitochondrien in intakten Endospermzellen nach 3 Stunden Samenaufnahme durchgeführt und die mitochondriale Bewegung nachgewiesen (Ergänzender Film 1). Die Mitochondrien im Endosperm bewegten sich unmittelbar innerhalb des Zytosols nach einer kurzen Periode der Imbibition bei 22 °C. Nach 1 Tag Samenaufnahme bei 22 °C wurden dynamischere Mitochondrien beobachtet (Abbildung 4 und ergänzender Film 2).
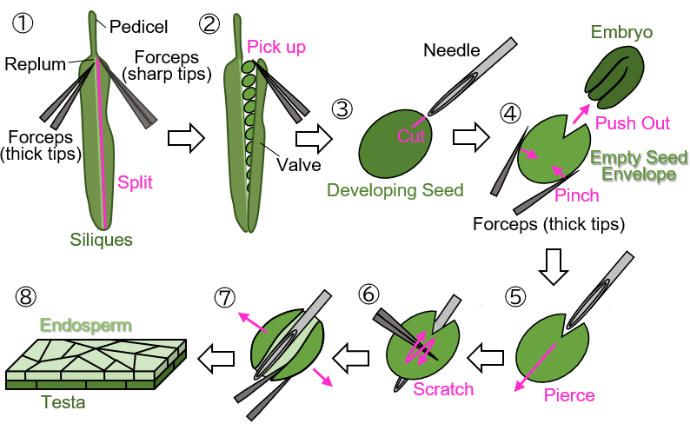
Abbildung 1: Vorbereitung der Endosperm-Probe aus sich entwickelnden Samen. Schritt 1: Ein Ventil wird von der Replum getrennt. Schritt 2: Die sich entwickelnden Samen werden gesammelt. Schritt 3: Mit einer Injektionsnadel wird eine Narbe auf der Hode und dem Endosperm erzeugt. Schritt 4: Der Embryo wird entnommen, indem der Samen mit einer Pinzette eingeklemmt wird. Schritt 5: Die Injektionsnadel wird von innen nach außen durch die leere Saatguthülle eingeführt. Schritt 6: Die Oberfläche der Testa wird mit einer Pinzette zerkratzt. Schritt 7: Der leere Samenumschlag wird mit einer Pinzette in Bogenform geöffnet. Schritt 8: Die endgültige Probe des Endospermblattes wird für die mikroskopische Betrachtung vorbereitet. Alle Arbeitsschritte werden auf nassem Filterpapier unter einem Stereomikroskop durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Vorbereitung der Endosperm-Probe aus reifen Samen. Schritt 1: Trockene Samen werden mehr als 40 Minuten lang in einem 1,5-ml-Röhrchen in Wasser getränkt. Schritt 2: Mit einer Injektionsnadel wird eine Narbe auf der Hode und dem Endosperm erzeugt. Schritt 3: Der Embryo wird entnommen, indem der Samen mit einer Pinzette eingeklemmt wird. Schritt 4: Die Ober- und Unterseite der leeren Saatguthülle werden zu einem Zylinder geschnitten. Schritt 5: Die zylindrisch geformte leere Saatguthülle wird entlang ihrer Mittelachse geschnitten. Schritt 6: Die endgültige Probe des Endospermblatts wird für die mikroskopische Betrachtung vorbereitet. Alle Arbeitsschritte werden auf nassem Filterpapier unter einem Stereomikroskop durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Fluoreszierende Bildgebung einer intakten Endosperm-Zellschicht unter Verwendung von sich entwickelnden Samen. Intakte Endosperm-Zellschichtproben wurden aus sich entwickelnden Samen von 14-Tage-nach-Blüte (DAF) Siliques (A, B) und 17-18 DAF-Siliques (C) hergestellt. Die mikroskopische Bildgebung wurde mit einem konfokalen Laser-Scanning-Mikroskop durchgeführt, das mit einer Öl-Immersionsobjektiv Plan-Apochromat 63× und einem Weißlichtlaser ausgestattet war. (A) Ein konfokales Bild des Endosperms unter differentiellem Interferenzkontrast (DIC) zeigt große Flächen mit zahlreichen intakten Endospermzellen. Maßstabsbalken: 20 μm. (B) Es werden konfokale Bilder des Endosperms gezeigt, das PHYB-GFP exprimiert, mit PHYB-GFP in grün und Chlorophyll-Autofluoreszenz in Cyan. Photokörper (PBs) in einem Zellkern sind durch weiße Pfeilspitzen gekennzeichnet. Maßstab: 10 μm; Vergrößerter Bildmaßstab: 2,5 μm. Das GFP-Signal wurde mittels Fluoreszenz-Lebensdauermikroskopie (FLIM) von der Autofluoreszenz der Proteinspeichervakuolen (PSVs) getrennt. Die Fluoreszenzlebensdauer wurde mit TauScan ermittelt und mit der TauSeparation-Funktion getrennt. Die durchschnittliche Fluoreszenzlebensdauer für GFP betrug 2,2 ns. Die GFP-Fluoreszenz wurde bei 488 nm angeregt und zwischen 500 und 530 nm gesammelt, während die Chlorophyll-Autofluoreszenz bei 405 nm angeregt und zwischen 688 und 729 nm gesammelt wurde. (C) Konfokale Bilder des Endosperms, das PHYB-GFP exprimiert, unter kontinuierlichem weißem Licht (cWL), kontinuierlichem fernrotem Licht (cFR) oder kontinuierlichem rotem Licht (cR) werden präsentiert. PHYB-GFP ist in Grün dargestellt, und PSV-Autofluoreszenz ist in Magenta dargestellt. Maßstab: 10 μm; Vergrößerter Bildmaßstab: 2,5 μm. Lichtintensitäten: WL, 46,5 μmol/m2/s; FR, 35,2 μmol/m2/s; R, 18,6 μmol/m2/s. Die PSV-Autofluoreszenz wurde bei 561 nm angeregt und zwischen 565-621 nm gesammelt. Das GFP-Signal wurde mit der gleichen Methode wie oben beschrieben getrennt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
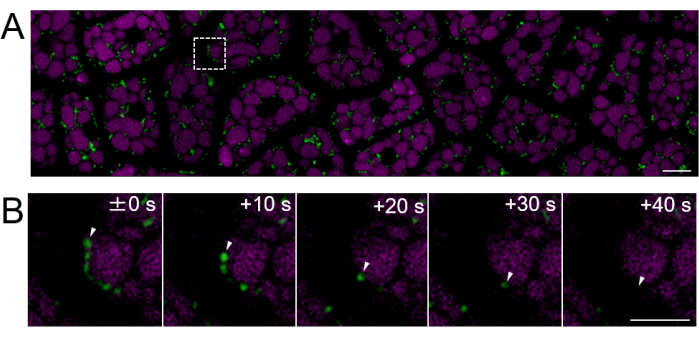
Abbildung 4: Fluoreszierende Lebendzellbildgebung einer intakten Endosperm-Zellschicht unter Verwendung reifer Samen. Die mikroskopische Bildgebung wurde mit der gleichen Methode durchgeführt, die in Abbildung 3 beschrieben ist. (A) Es wird ein konfokales Bild der gesamten intakten Endospermzellschicht gezeigt, das aus dem ergänzenden Film 2 entnommen wurde. Mitochondrien sind grün markiert und PSV-Autofluoreszenz ist magenta markiert. Maßstabsbalken: 10 μm. (B) Eine Zeitrafferserie von vergrößerten Bildern aus dem gestrichelten quadratischen Bereich in Feld (A) zeigt die Bewegung eines Mitochondriums, angezeigt durch weiße Pfeilspitzen. Maßstabsleiste: 5 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzender Film 1: Es wird ein Zeitraffervideo von mtGFP in der Endospermzellschicht eines reifen Samens 3 h nach der Imbibition gezeigt. Alle 10 s wurde ein Bild aufgenommen, und die Bildrate des Videos beträgt 10 Bilder/s. Maßstab: 10 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzender Film 2: Es wird ein Zeitraffervideo von mtGFP in der Endosperm-Zellschicht eines reifen Samens 1 Tag nach der Imbibition gezeigt. Alle 10 s wurde ein Bild aufgenommen, und die Bildrate des Videos beträgt 10 Bilder/s. Maßstab: 10 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Rolle des Endosperms bei der Samenkeimung wurde durch genetische und biochemische Analysen unter Verwendung von getrennten Samengeweben aufgedeckt, wie z. B. die Genexpressionsanalyse und die Quantifizierung von Lipiden und Phytohormonen 9,14,25,26,27. Ein in vitro Assay der Samenhülle, bei dem die leere Samenhülle (Endosperm und Testa) mit einem Embryo kombiniert wurde, der aus verschiedenen Arabidopsis-Mutanten isoliert wurde, deckte molekulare Mechanismen auf, die den Keimprozessen zugrunde liegen 14,15,16,28. Die Probenvorbereitung für die mikroskopische Betrachtung war jedoch aufgrund der geringen Größe der Arabidopsis-Samen und der Lage der Endosperm-Zellschicht unter dem Testa eine Herausforderung. Insbesondere die Beobachtung der Endosperm-Zellschicht während der Samenentwicklung wurde bisher selten ohne chemische Fixierung und Sektion durchgeführt.
Während der Probenvorbereitung ist die leere Samenhülle von sich entwickelnden Samen zerbrechlich, da die Testa lebendig und daher weich ist. Hier wurden zwei Protokolle für die schnelle Präparation von intakten Endosperm-Zellschichtproben etabliert, die für die mikroskopische Beobachtung und Analyse in der Entwicklung von Seeds geeignet sind, ohne dass eine Fixierung oder Sektion erforderlich ist. Bei der Probenvorbereitung von reifem Saatgut ist der Testa tot und stabil, so dass die leere Samenhülle ihre Wölbung behält, wenn sie auf einem Objektträgerglas montiert ist. Diese Krümmung macht es schwierig, die Endosperm-Zellschicht über einen weiten Fokusbereich hinweg klar zu beobachten. Daher wurde die Präpariermethode zur Entwicklung von Samen leicht modifiziert, um die leere Samenhülle angemessen zu beschneiden. Durch die Trennung in zwei Teile mit dieser Methode wurde eine klare Beobachtung zahlreicher Endospermzellen bei gleichzeitiger Beibehaltung des Fokus erreicht.
Es wurden verschiedene bildgebende Reagenzien (für die Färbung von DNA, reaktiven Sauerstoffspezies, sauren Kompartimenten usw.) entwickelt, von denen einige auf Arabidopsis-Pflanzen angewendet wurden 29,30,31,32. Endosperm-Zellschichtproben, die mit diesem Protokoll hergestellt wurden, wurden bereits für die mikroskopische Betrachtung mit LysoTracker und Propidiumiodid-Färbung verwendet und trugen zur Bewertung der Endosperm-Funktion bei17. Seit der Entdeckung von GFP im Jahr 196233 sind GFP-markierte Proteine zu unverzichtbaren Werkzeugen für die Aufklärung der Dynamik intrazellulärer Strukturen geworden 23,24,34,35,36,37,38. Durch die Präparation von Endospermproben gemäß diesem Protokoll und die Anwendung der oben genannten Verfahren ist es möglich, eine Lebendzellbildgebung des Endosperms während der Samenentwicklung und Keimung durchzuführen, wie in Abbildung 3 und Abbildung 4 gezeigt, wodurch intrazelluläre Ereignisse und die Lokalisierung spezifischer Proteine aufgeklärt werden. Darüber hinaus wird erwartet, dass die Anwendung spezifischer Inhibitoren (wie Proteaseinhibitoren, Proteinmodifikationsenzym-Inhibitoren und Inhibitoren der Zelldynamik)39,40,41,42 auf lebende Endospermzellen unter Verwendung dieses Protokolls tiefere Einblicke in die intrazellulären Ereignisse und molekularen Mechanismen liefert, die der Endospermfunktion während der Samenentwicklung und Keimung zugrunde liegen.
Eine Einschränkung dieses Protokolls besteht darin, dass Endosperm-Zellschichten aus vollständig getrockneten Samen nicht hergestellt werden können, da es schwierig ist, die Samen in den Embryo und die leere Samenhülle zu trennen. Wie in Abbildung 2 gezeigt, ist eine Imbibitionszeit von mindestens 40 Minuten erforderlich, um reife Samen zu trennen. Es ist wichtig zu beachten, dass mehrere zelluläre Ereignisse innerhalb der Endospermzellen bei der Aufnahme induziert werden können. Eine weitere Einschränkung besteht darin, dass dieses Protokoll die Beobachtung von Endospermgewebe in den frühen Stadien der Samenentwicklung, insbesondere vor 10 DAF, nicht zulässt, da es speziell für die Beobachtung der einzelligen Endospermschicht konzipiert ist. Während dieser frühen Stadien füllt das Gewebe, das der Bildung der einzelligen Endospermschicht vorausgeht - ein nicht geschichtetes Endosperm - das Innere der sich entwickelnden Samen43 aus, was die Vorbereitung von Endospermproben erschwert.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Wir danken Dr. Matsushita und Dr. Oka von der Universität Kyoto für die Bereitstellung der phyB-Mutante , die PHYB-GFP exprimiert und vom 35S-Promotor angetrieben wird. Diese Studie wurde teilweise durch einen Zuschuss für wissenschaftliche Forschung in innovativen Bereichen, Forschung in einem vorgeschlagenen Forschungsbereich (19H05713 an K.Y.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
Referenzen
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179 (2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202 (2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121 (2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394 (2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732 (2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650 (2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510 (2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -. C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -. H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten