Method Article
Preparación de tejido intacto para el análisis microscópico de la capa de células endospermas en semillas de Arabidopsis en desarrollo y maduras
En este artículo
Resumen
Este protocolo describe la preparación de muestras intactas de la capa de células endospermas en semillas de Arabidopsis thaliana . El método solo requiere equipo de laboratorio común, como una aguja de inyección y pinzas de precisión, y permite obtener imágenes fluorescentes de células vivas de alta resolución de células endospermas tanto en semillas en desarrollo como maduras.
Resumen
En las semillas de Arabidopsis , el endospermo, una sola capa de células vivas ubicada entre el embrión y la testa, desempeña un papel fundamental en la regulación de la maduración, latencia y germinación de las semillas. El análisis microscópico de las células del endospermo intactas es esencial para comprender las funciones fisiológicas del endospermo a nivel celular y molecular. Sin embargo, la preparación de la muestra ha sido un desafío debido al pequeño tamaño de las semillas de Arabidopsis y la ubicación de la capa de células endospermas debajo de la testa. Este artículo detalla la preparación de muestras de capas de endospermo intactas adecuadas para la observación y el análisis microscópico tanto en semillas en desarrollo como maduras. Este método permite la observación de grandes áreas y numerosas células endospermas intactas sin necesidad de fijación o seccionamiento. Además, el protocolo utiliza solo equipos de laboratorio estándar, como agujas de inyección, pinzas de precisión y microscopios estereoscópicos. Este enfoque permite con éxito la obtención de imágenes de células vivas de alta resolución de señales fluorescentes, como la proteína fluorescente verde (GFP), en células de endospermo intactas. Este método permite observar la localización intracelular y el movimiento de diversas proteínas, así como la morfología de los orgánulos, en las células del endospermo de diferentes mutantes de Arabidopsis . Este protocolo contribuye a la elucidación de nuevas funciones del endospermo y amplía el potencial para estudios celulares y moleculares de este tejido esencial.
Introducción
Debido a que las plantas son organismos sésiles, la germinación de las semillas es un evento crucial que determina su destino. La decisión de germinar está estrictamente regulada por factores internos y ambientales, como los niveles de latencia de las semillas primarias, la temperatura, la intensidad y la longitud de onda de la luz, y la concentración de nitrógeno 1,2,3,4,5,6. Las semillas tienen estructuras complejas que consisten en múltiples tipos de tejidos7. En las semillas secas de Arabidopsis, el embrión, que se convierte en una plántula, está rodeado por una sola capa de endospermo y las capas más externas, la testa. La testa está compuesta por múltiples capas de células muertas, mientras que el embrión y el endospermo permanecen vivos incluso en semillas secas. El endospermo es comúnmente considerado como un tejido de almacenamiento que proporciona nutrientes para el crecimiento embrionario y, junto con la testa, confiere resistencia mecánica a la protrusión de la radícula 8,9,10,11,12,13.
Varios estudios recientes han demostrado que el endospermo desempeña un papel esencial en la regulación de la germinación óptima de las semillas 14,15,16,17. Por ejemplo, el fotorreceptor fitocromo B (PHYB) en las células del endospermo detecta la luz roja (R) o roja lejana (FR), regulando las respuestas de germinación15. El endospermo también funciona como un tejido sensible a la temperatura, suprimiendo las respuestas de germinación a altastemperaturas. El control de calidad del endospermo es fundamental para la germinación óptima de las semillas, especialmente en las semillas almacenadas a largo plazo17.
Ahora es necesario obtener imágenes de células vivas para dilucidar aún más las funciones fisiológicas del endospermo. El análisis microscópico de células endospermas intactas que expresan proteínas marcadas con fluorescencia permite investigar los mecanismos moleculares por los cuales el endospermo regula la germinación de las semillas. Sin embargo, la preparación de células de endospermo intactas para la observación microscópica es un desafío, particularmente en semillas de Arabidopsis . Las semillas tienen aproximadamente 0,4 mm de diámetro y el endospermo es una capa unicelular ubicada entre el embrión y la testa, lo que dificulta la manipulación precisa. En consecuencia, a pesar de sus importantes funciones fisiológicas, el endospermo rara vez se ha observado utilizando imágenes de células vivas.
Este artículo presenta un protocolo para la preparación rápida de muestras de capas de células endospermas intactas adecuadas para la obtención de imágenes de células vivas tanto en semillas en desarrollo como maduras.
Protocolo
En este estudio, se establecieron dos procedimientos diferentes para la preparación de muestras de capas de células endospermas vivas: uno para semillas en desarrollo y otro para semillas maduras. Se requieren enfoques ligeramente diferentes dependiendo de la solidez de la testa. Los detalles de los reactivos y equipos utilizados se enumeran en la Tabla de Materiales.
1. Preparación de muestras de endospermo intactas a partir de semillas en desarrollo
- Colección de silicuas
- Cultive plantas de Arabidopsis en tierra o lana de roca hasta que florezcan.
- Marque las flores completamente abiertas con hilos de colores (0 días después de la floración, 0 DAF).
NOTA: Evite usar hilos verdes, amarillos o marrones para marcar las flores, ya que estos colores son difíciles de distinguir de las plantas en crecimiento o maduras y las silicuas. - Corte las sílicas en desarrollo marcadas en el pedicelo (indicadas en la Figura 1 (1)) y recójalas en tubos de 1,5 mL.
NOTA: Las siliquitas en desarrollo de 12-16 DAF son adecuadas para la preparación utilizando este protocolo.
- Disección de semillas en desarrollo
NOTA: Los siguientes pasos deben realizarse en papel de filtro húmedo para proteger las muestras de la desecación. Las manipulaciones deben realizarse bajo un microscopio estereoscópico.- Separe una válvula (indicada en la Figura 1 (2)) del replum (indicado en la Figura 1 (1)) usando dos pinzas: una con puntas gruesas para sujetar y la otra con puntas afiladas para desgarrar).
- Recoja suavemente las semillas en desarrollo de las sílicas con pinzas con las puntas cerradas para evitar dañar las semillas (Figura 1 (2)).
- Sosteniendo la semilla con pinzas sin chocar la semilla, haga una cicatriz de aproximadamente 0,2 mm de tamaño en la testa y el endospermo que rodea el embrión con una aguja de inyección (27 G, 0,40 mm × 19 mm) (Figura 1 (3)).
NOTA: La ubicación óptima para hacer la cicatriz es en la unión de los cotiledones y la radícula. - Empuje el embrión pellizcando la semilla con pinzas (Figura 1 (4)). No triture la envoltura vacía de la semilla, que consta de la testa y el endospermo, y trate de mantener su forma redonda.
- Inserte la aguja de inyección en el sobre de semilla vacío en la cicatriz, perforándola de adentro hacia afuera (Figura 1 (5)).
- Mantenga la aguja en posición, rasque la superficie de la testa con pinzas con las puntas cerradas y corte un lado de la envoltura de semilla vacía para permitir que se abra (Figura 1 (6)).
- Abra el sobre de semilla vacío en una hoja con pinzas con puntas afiladas (Figura 1 (7)). La muestra ahora debe aislarse como una lámina bicapa que consta de las capas de endospermo y testa (Figura 1 (8)).
NOTA: Si la muestra tiende a enrollarse cuando se usa agua como medio de montaje en el paso 3 a continuación, divida la muestra en forma de hoja en dos partes. Las semillas cosechadas a partir de silicuas a unos 18 DAF (en esta etapa, la testa es marrón pero aún no completamente seca) también se pueden procesar utilizando este protocolo, aunque las semillas deben beberse durante varios minutos antes de la preparación.
2. Preparación de muestras de endospermo intactas a partir de semillas maduras
- Imbibición de semillas maduras
- Añadir 1 mL de agua bidestilada a un tubo de 1,5 mL que contenga semillas secas de Arabidopsis .
- Mantenga las semillas sumergidas durante al menos 40 minutos a temperatura ambiente (Figura 2 (1)).
NOTA: Las semillas secas y las semillas dentro de los 40 minutos posteriores a la imbibición son difíciles de cicatrizar en la testa y el endospermo y de extraer el embrión del interior de la semilla sin dañar la envoltura vacía de la semilla en los pasos 2.2.1 y 2.2.2, mientras que un tiempo de imbibición más largo facilita la manipulación. - Utilice una micropipeta de 1000 μL para transferir las semillas absorbidas a papel de filtro húmedo.
- Disección de semillas maduras
NOTA: Los siguientes pasos deben realizarse en papel de filtro húmedo para proteger las muestras de la desecación. Las manipulaciones deben realizarse bajo un microscopio estereoscópico.- Sosteniendo la semilla con pinzas sin estrellar la semilla, haga una cicatriz de aproximadamente 0,2 mm de tamaño en la testa y el endospermo que rodea el embrión con una aguja de inyección (Figura 2 (2)).
- Empuje el embrión pellizcando la semilla con pinzas (Figura 2 (3)). No triture la envoltura vacía de la semilla, que incluye la testa y el endospermo. Trata de mantener su forma redonda.
- Corte los lados superior e inferior del sobre de semilla vacío con una aguja de inyección para darle forma de cilindro (Figura 2 (4)).
- Corte el sobre de semilla vacío de forma cilíndrica a lo largo de su eje central para separarlo en dos piezas (Figura 2 (5)). Las muestras deben aislarse en láminas bicapa formadas por la capa de endospermo y la capa de testa (Figura 2 (6)).
3. Observación microscópica
- Coloque las muestras de endospermo en forma de lámina en un portaobjetos de vidrio y móntelas en agua o perfluorodecalina (PFD).
NOTA: Si quedan burbujas de aire entre la muestra y el cubreobjetos, sería útil la perfluorodecalina (PFD), que se ha reportado que es particularmente útil para obtener imágenes de muestras que contienen bolsas de aire, como las hojas18,19. Se sabe que PFD tiene la tensión superficial más baja, lo que le permite llenar fácilmente los espacios de aire en la superficie de la muestra. Sin embargo, para las imágenes de lapso de tiempo, se recomienda el uso de agua como medio de montaje, ya que el contenido de agua en las semillas maduras debe ser abundante para mantener la liquidez celular. - Coloque un cubreobjetos suavemente sobre la muestra. Asegúrese de que la capa del endospermo esté orientada hacia el cubreobjetos.
NOTA: Se puede usar esmalte de uñas o grasa para sellar los bordes del cubreobjetos para evitar la desecación de la muestra y el medio de montaje.
Resultados
Utilizando el protocolo que se muestra en la Figura 1, se prepararon muestras de endospermo a partir de semillas en desarrollo cosechadas de sílicas a 14 DAF (en esta etapa, la testa aún está verde). Se observaron numerosas células endospermas en una gran área y sus estructuras intracelulares (Figura 3A). En este experimento, se utilizaron semillas que expresan PHYB fusionadas con GFP en el extremo C-terminal (PHYB-GFP). Es bien sabido que PHYB se transloca al núcleo al ser activado por la luz roja y forma motas PHYB positivas, conocidas como fotocuerpos (PB), que están involucradas en la germinación de las semillas 4,20,21,22. Las muestras se recolectaron de plantas cultivadas bajo condiciones continuas de luz blanca a 22 °C. Como se muestra en la Figura 3B, se detectaron PBs dentro del núcleo en células endospermas. Este resultado corresponde a un estudio previo que demuestra que el PHYB en el endospermo regula la germinación óptima de las semillas15. Además, se realizaron imágenes de lapso de tiempo de células vivas para confirmar que las células de endospermo aisladas mantuvieron la actividad biológica incluso después de la preparación de la muestra mediante la observación de la fotorreversibilidad del fitocromo FR/R (Figura 3C). Las muestras de endospermo se prepararon a partir de semillas en desarrollo cosechadas de silicuas alrededor de 17-18 DAF. Los PB se detectaron dentro del núcleo tras la disección, mientras que desaparecieron por completo después de la irradiación con luz roja lejana. Posteriormente, la irradiación con luz roja volvió a inducir PBs. Esta fotorreversibilidad del fitocromo se detectó dos veces, lo que indica que las células de endospermo aisladas por este protocolo mantuvieron la actividad biológica durante al menos 4,5 h después de la disección (Figura 3C).
A continuación, se prepararon muestras de endospermo de semillas maduras (donde la testa es marrón), como se muestra en la Figura 2. En este experimento, se observó la motilidad de las mitocondrias utilizando semillas que expresaban GFP mitocondrial (mtGFP)23, que se habían almacenado en un desecador a temperatura ambiente en la oscuridad durante aproximadamente un año después de la cosecha. Se ha reportado que las mitocondrias en el embrión se mueven activamente y cambian dinámicamente de morfología después de la imbibición y la transferencia a las condiciones de germinación24. Se realizaron imágenes fluorescentes de lapso de tiempo de mitocondrias en células de endospermo intactas después de 3 h de imbibición de semillas, y se detectó el movimiento mitocondrial (Película suplementaria 1). Las mitocondrias en el endospermo se movieron inmediatamente dentro del citosol después de un corto período de imbibición a 22 °C. Después de 1 día de imbibición de la semilla a 22 °C, se observaron mitocondrias que se movían más dinámicamente (Figura 4 y Video Suplementario 2).
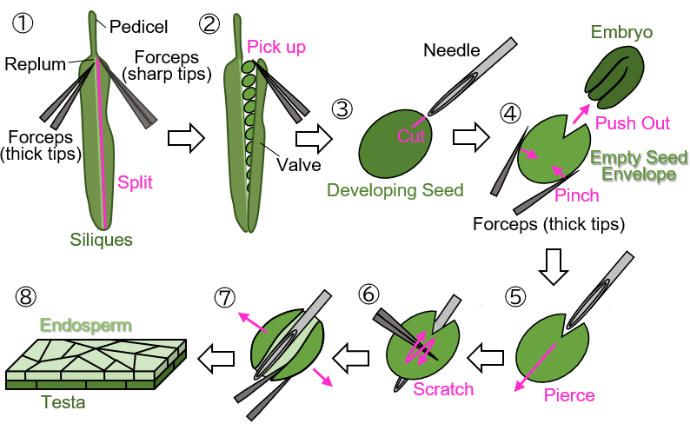
Figura 1: Preparación de la muestra de endospermo de semillas en desarrollo. Paso 1: Se separa una válvula del replume. Paso 2: Se recolectan las semillas en desarrollo. Paso 3: Se crea una cicatriz en la testa y el endospermo con una aguja de inyección. Paso 4: Se extrae el embrión pellizcando la semilla con pinzas. Paso 5: La aguja de inyección se inserta a través de la envoltura de semillas vacía desde el interior hacia el exterior. Paso 6: Se rasca la superficie de la testa con pinzas. Paso 7: El sobre de semilla vacío se abre en forma de hoja con pinzas. Paso 8: La muestra final de la lámina de endospermo se prepara para la observación microscópica. Todos los pasos se realizan en papel de filtro húmedo bajo un microscopio estereoscópico. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Preparación de muestras de endospermo a partir de semillas maduras. Paso 1: Las semillas secas se sumergen en agua durante más de 40 minutos en un tubo de 1,5 ml. Paso 2: Se crea una cicatriz en la testa y el endospermo con una aguja de inyección. Paso 3: Se extrae el embrión pellizcando la semilla con pinzas. Paso 4: Los lados superior e inferior del sobre de semilla vacío se cortan para darle forma de cilindro. Paso 5: La envoltura de semilla vacía de forma cilíndrica se corta a lo largo de su eje central. Paso 6: La muestra final de la lámina de endospermo se prepara para la observación microscópica. Todos los pasos se realizan en papel de filtro húmedo bajo un microscopio estereoscópico. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Imágenes fluorescentes de una capa de células endospermas intactas utilizando semillas en desarrollo. Se prepararon muestras de capas de células endospermas intactas a partir de semillas en desarrollo de silicuas (A,B) 14 días después de la floración (DAF) Y 17-18 silicuas DAF (C). Las imágenes microscópicas se realizaron utilizando un microscopio de barrido láser confocal equipado con una lente objetivo de inmersión en aceite Plan-Apochromat 63× y un láser de luz blanca. (A) Una imagen confocal del endospermo bajo contraste de interferencia diferencial (DIC) muestra grandes áreas con numerosas células de endospermo intactas. Barra de escala: 20 μm. (B) Se muestran imágenes confocales del endospermo que expresa PHYB-GFP, con PHYB-GFP en verde y autofluorescencia de clorofila en cian. Los fotocuerpos (PB) en un núcleo se indican con puntas de flecha blancas. Barras de escala: 10 μm; Barra de escala de imagen ampliada: 2,5 μm. La señal de GFP se separó de la autofluorescencia de las vacuolas de almacenamiento de proteínas (PSV) mediante microscopía de fluorescencia de por vida (FLIM). Los tiempos de vida de la fluorescencia se obtuvieron utilizando TauScan y se separaron utilizando la función TauSeparation. El tiempo de vida medio de la fluorescencia para la GFP fue de 2,2 ns. La fluorescencia GFP se excitó a 488 nm y se recogió entre 500-530 nm, mientras que la autofluorescencia de clorofila se excitó a 405 nm y se recogió entre 688-729 nm. (C) Se presentan imágenes confocales del endospermo que expresa PHYB-GFP bajo luz blanca continua (cWL), luz roja lejana continua (cFR) o luz roja continua (cR). PHYB-GFP se muestra en verde y la autofluorescencia de PSV se muestra en magenta. Barras de escala: 10 μm; Barra de escala de imagen ampliada: 2,5 μm. Intensidades de luz: WL, 46,5 μmol/m2/s; FR, 35,2 μmol/m2/s; R, 18,6 μmol/m2/s. La autofluorescencia del PSV se excitó a 561 nm y se recogió entre 565-621 nm. La señal GFP se separó utilizando el mismo método descrito anteriormente. Haga clic aquí para ver una versión más grande de esta figura.
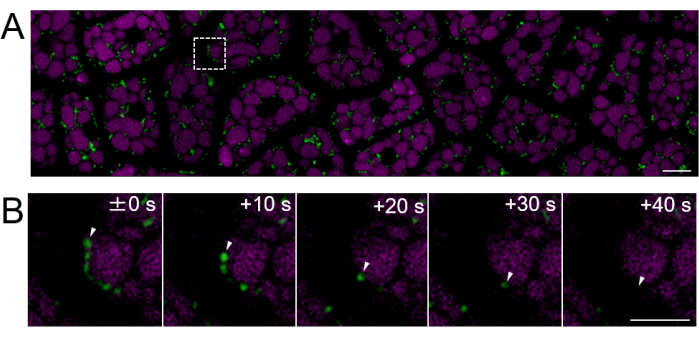
Figura 4: Imágenes fluorescentes de células vivas de una capa de células endospermas intactas utilizando semillas maduras. Las imágenes microscópicas se realizaron utilizando el mismo método descrito en la Figura 3. (A) Se muestra una imagen confocal de toda la capa intacta de células endospermas, obtenida de la Película Suplementaria 2. Las mitocondrias están marcadas en verde, y la autofluorescencia del PSV está marcada en magenta. Barra de escala: 10 μm. (B) Una serie de imágenes ampliadas en un lapso de tiempo del área cuadrada de la línea discontinua en el panel (A) muestra el movimiento de una mitocondria, indicado por puntas de flecha blancas. Barra de escala: 5 μm. Haga clic aquí para ver una versión más grande de esta figura.
Película complementaria 1: Se muestra un video de lapso de tiempo de mtGFP en la capa de células endospermas de una semilla madura 3 h después de la imbibición. Se tomó un fotograma cada 10 s y la velocidad de fotogramas del vídeo es de 10 fotogramas/s. Barra de escala: 10 μm. Haga clic aquí para descargar este archivo.
Película complementaria 2: Se muestra un video de lapso de tiempo de mtGFP en la capa de células endospermas de una semilla madura 1 día después de la imbibición. Se tomó un fotograma cada 10 s y la velocidad de fotogramas del vídeo es de 10 fotogramas/s. Barra de escala: 10 μm. Haga clic aquí para descargar este archivo.
Discusión
El papel del endospermo en la germinación de las semillas se ha revelado a través de análisis genéticos y bioquímicos utilizando tejidos de semillas separados, como el análisis de expresión génica y la cuantificación de lípidos y fitohormonas 9,14,25,26,27. Un ensayo in vitro de lecho de la cubierta de la semilla, combinando la envoltura vacía de la semilla (endospermo y testa) con un embrión aislado de diferentes mutantes de Arabidopsis, descubrió los mecanismos moleculares que subyacen a los procesos de germinación 14,15,16,28. Sin embargo, la preparación de la muestra para la observación microscópica ha sido un desafío debido al pequeño tamaño de las semillas de Arabidopsis y la ubicación de la capa de células del endospermo debajo de la testa. En particular, la observación de la capa de células endospermas durante el desarrollo de la semilla rara vez se ha llevado a cabo sin la fijación y el corte químicos.
Durante la preparación de la muestra, la envoltura vacía de las semillas en desarrollo es frágil porque la testa está viva y, por lo tanto, blanda. Aquí, se establecieron dos protocolos para la preparación rápida de muestras de capas de células endospermas intactas adecuadas para la observación microscópica y el análisis en semillas en desarrollo sin necesidad de fijación o sección. En el caso de la preparación de muestras a partir de semillas maduras, la testa está muerta y es resistente, lo que hace que la envoltura de semilla vacía conserve su curvatura cuando se monta en un vidrio deslizante. Esta curvatura dificulta la observación clara de la capa de células endospermas en una amplia gama de enfoques. Por lo tanto, el método de disección para el desarrollo de las semillas se modificó ligeramente para recortar adecuadamente la envoltura vacía de la semilla. Al separarlo en dos partes con este método, se logró una observación clara de numerosas células endospermas mientras se mantenía el enfoque.
Se han desarrollado varios reactivos de imagen (para tinción de ADN, especies reactivas de oxígeno, compartimentos ácidos, etc.) y algunos se han aplicado a plantas de Arabidopsis 29,30,31,32. Las muestras de capas de células endospermas preparadas con este protocolo ya se han utilizado para la observación microscópica con LysoTracker y la tinción con yoduro de propidio, lo que contribuye a la evaluación de la función del endospermo17. Desde el descubrimiento de la GFP en 196233, las proteínas marcadas con GFP se han convertido en herramientas esenciales para dilucidar la dinámica de las estructuras intracelulares 23,24,34,35,36,37,38. Mediante la preparación de muestras de endospermo de acuerdo con este protocolo y el empleo de los métodos antes mencionados, es posible realizar imágenes de células vivas del endospermo durante el desarrollo y la germinación de la semilla, como se muestra en la Figura 3 y la Figura 4, dilucidando así los eventos intracelulares y la localización de proteínas específicas. Además, se espera que la aplicación de inhibidores específicos (como los inhibidores de la proteasa, los inhibidores de la enzima modificadora de proteínas y los inhibidores de la dinámica celular)39,40,41,42 a las células endospermas vivas utilizando este protocolo proporcione una comprensión más profunda de los eventos intracelulares y los mecanismos moleculares que subyacen a la función del endospermo durante el desarrollo y la germinación de las semillas.
Una limitación de este protocolo es que no se pueden preparar capas de células endospermas de semillas completamente secas porque es difícil separar las semillas en el embrión y la envoltura de semilla vacía. Como se muestra en la Figura 2, es necesario un tiempo de imbibición de al menos 40 minutos para separar las semillas maduras. Es importante tener en cuenta que varios eventos celulares dentro de las células del endospermo pueden ser inducidos tras la imbibición. Otra limitación es que este protocolo no permite la observación del tejido del endospermo durante las primeras etapas del desarrollo de la semilla, particularmente antes de los 10 DAF, ya que está diseñado específicamente para observar la capa de endospermo unicelular. Durante estas primeras etapas, el tejido que precede a la formación de la capa de endospermo unicelular -un endospermo no estratificado- llena el interior de las semillas en desarrollo43, lo que dificulta la preparación de muestras de endospermo.
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Agradecemos a los Dres. Matsushita y Oka de la Universidad de Kyoto por proporcionar el mutante phyB que expresa PHYB-GFP impulsado por el promotor 35S. Este estudio fue financiado en parte por una Beca de Ayuda a la Investigación Científica en Áreas Innovadoras, Investigación en un Área de Investigación Propuesta (19H05713 a K.Y.).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
Referencias
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179 (2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202 (2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121 (2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394 (2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732 (2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650 (2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510 (2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -. C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -. H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados