Method Article
発育中および成熟 シロイヌナズ ナ種子中の胚乳細胞層の顕微鏡分析のための無傷組織の調製
要約
このプロトコルは、 シロイヌナズ ナの種子における胚乳細胞層の無傷のサンプルの調製について説明しています。この方法では、注射針や精密鉗子などの一般的な実験装置のみが必要で、発生中の種子と成熟した種子の両方の胚乳細胞の高分解能蛍光生細胞イメージングが可能になります。
要約
シロイヌナズナの種子では、胚と精巣の間に位置する生細胞の単層である胚乳が、種子の成熟、休眠、および発芽を調節する上で重要な役割を果たします。無傷の胚乳細胞の顕微鏡分析は、細胞および分子レベルでの胚乳の生理学的機能を理解するために不可欠です。しかし、シロイヌナズナの種子のサイズが小さく、精巣の下に胚乳細胞層が位置しているため、サンプル調製は困難でした。この記事では、発育中の種子と成熟した種子の両方で顕微鏡観察と分析に適した無傷の胚乳細胞層サンプルの調製について詳しく説明します。この方法により、固定や切片作製を必要とせずに、広い領域と多数の無傷の胚乳細胞を観察することができます。さらに、このプロトコルでは、注射針、精密鉗子、実体顕微鏡などの標準的な実験装置のみを使用します。このアプローチにより、無傷の胚乳細胞における緑色蛍光タンパク質(GFP)などの蛍光シグナルの高分解能生細胞イメージングに成功しました。この方法により、さまざまなシロイヌナズナ変異体の胚乳細胞におけるさまざまなタンパク質の細胞内局在と移動、およびオルガネラの形態を観察できます。このプロトコールは、新しい胚乳機能の解明に貢献し、この必須組織の細胞および分子研究の可能性を広げます。
概要
植物は固着生物であるため、種子の発芽はその運命を決定する重要なイベントです。発芽の決定は、一次種子の休眠レベル、温度、光強度と波長、窒素濃度1,2,3,4,5,6などの内部要因と環境要因の両方によって厳密に規制されます。種子は、複数の組織型からなる複雑な構造を有する7。シロイヌナズナの乾燥種子では、苗に成長する胚が単層の胚乳と最も外側の層である精巣に囲まれています。精巣は死んだ細胞の複数の層で構成されていますが、胚と胚乳は乾燥した種子でも生き続けています。胚乳は一般に、胚の成長に栄養を供給する貯蔵組織と見なされており、精巣とともに、根茎の突出8,9,10,11,12,13に対する機械的耐性を付与する。
最近のいくつかの研究は、胚乳が最適な種子発芽を調節する上で重要な役割を果たすことを実証している14,15,16,17。例えば、胚乳細胞の光受容体フィトクロムB(PHYB)は、赤色光(R)または遠赤色(FR)光を検出し、発芽応答を調節する15。胚乳は温度感知組織としても機能し、高温下での発芽応答を抑制します16。胚乳の品質管理は、特に長期保存種子17において、最適な種子の発芽にとって重要である。
胚乳の生理機能をさらに解明するためには、生細胞イメージングが必要とされています。蛍光タグ付きタンパク質を発現する無傷の胚乳細胞の顕微鏡分析により、胚乳が種子の発芽を制御する分子メカニズムを調べることができます。しかし、顕微鏡観察のために無傷の胚乳細胞を調製することは、特に シロイヌナズナ の種子では困難です。種子の直径は約0.4mmで、胚乳は胚と精巣の間に位置する単一細胞層であるため、精密な操作は困難です。その結果、その重要な生理学的役割にもかかわらず、胚乳は生細胞イメージングを使用して観察されることはほとんどありませんでした。
この記事では、発生中の種子と成熟した種子の両方で生細胞イメージングに適した無傷の胚乳細胞層サンプルを迅速に調製するためのプロトコールを紹介します。
プロトコル
この研究では、生きた胚乳細胞層サンプルの調製について、種子の開発用と成熟種子用の2つの異なる手順が確立されました。精巣の固さによって、若干異なるアプローチが必要です。使用した試薬や機器の詳細は 、資料表に記載されています。
1. 発育中の種子からの無傷の胚乳サンプルの調製
- シリックのコレクション
- シロイヌナズナの植物を土や岩羊の上で咲くまで育てます。
- 全開の花に色付きの糸で印を付けます(開花後0日、DAF0)。
注:緑、黄色、または茶色の糸を使用して花をマークすることは、これらの色が成長または成熟した植物やシリックと区別するのが難しいため、避けてください。 - 椎弓根でマークされた発育中のシリックを切り取り( 図1(1)を参照)、1.5mLチューブに集めます。
注:12-16 DAFからのシリクの現像は、このプロトコルを使用した調製に適しています。
- 発育中の種子の解剖
注意: 次の手順は、サンプルを乾燥から保護するために、濡れた濾紙で実行する必要があります。操作は実体顕微鏡下で行う必要があります。- 2つの鉗子を使用して、バルブ( 図1(2)を参照)をリプラム( 図1(1)に示)から分割します:1つは保持用の厚い先端があり、もう1つは引き裂くための鋭い先端があります)。
- 種子の損傷を避けるために、先端を閉じた鉗子を使用して、シリックから発育中の種子をそっと拾います(図1(2))。
- 種子を鉗子で墜落さず保持し、睾丸と胚の周囲に約0.2mmの大きさの傷跡を注射針(27G、0.40mm、19mm)で瘢痕×造成します(図1(3))。
注:傷跡を作るのに最適な場所は、子葉と根の接合部です。 - 鉗子で種子をつまんで胚を押し出します(図1(4))。精巣と胚乳からなる空の種子封筒をつぶさず、丸い形を維持しようとしてください。
- 傷跡の空のシードエンベロープに注射針を挿入し、内側から外側に突き刺します(図1(5))。
- 針を所定の位置に保持し、先端を閉じた状態で鉗子を使用して睾丸の表面を引っ掻き、空の種子封筒の片側を切って開きます(図1(6))。
- 先端が鋭い鉗子を使用して、空のシードエンベロープをシートに開きます(図1(7))。ここで、サンプルは胚乳層と精巣層からなる二重層シートとして分離する必要があります(図1(8))。
注:以下のステップ3で封入剤として水を使用するとサンプルが丸まりやすい場合は、シート状のサンプルを2つに分割します。約18DAFでシリクから収穫された種子(この段階では、精巣は茶色ですが、まだ完全には乾燥していません)もこのプロトコルを使用して処理できますが、種子は調製前に数分間吸収する必要があります。
2. 成熟種子からの無傷の胚乳サンプルの調製
- 成熟種子の吸収
- 乾燥シ ロイヌナズ ナの種子が入った1.5mLのチューブに1mLの再蒸留水を加えます。
- 種子を室温で少なくとも40分間吸収しておきます(図2(1))。
注:乾燥した種子と吸収から40分以内の種子は、精巣と胚乳に傷をつけること、およびステップ2.2.1および2.2.2で空の種子エンベロープを損傷することなく種子の内部から胚を除去することは困難ですが、吸収時間が長いほど操作が容易になります。 - 1000 μLのマイクロピペットを使用して、吸収した種子を湿った濾紙に移します。
- 成熟種子の解剖
注意: 次の手順は、サンプルを乾燥から保護するために、濡れた濾紙で実行する必要があります。操作は実体顕微鏡下で行う必要があります。- 種子を鉗子で挫折させずに保持し、注射針を用いて胚を囲む精巣と胚乳に約0.2mmの大きさの傷跡をあけます(図2(2))。
- 鉗子で種子をつまんで胚を押し出します(図2(3))。精巣と胚乳を含む空の種子封筒をつぶさないでください。丸い形を保つようにしてください。
- 空のシードエンベロープの上部と下部を注射針で切断して、円柱状に成形します(図2(4))。
- 円筒形の空の種子封筒を中心軸に沿って切り取り、2つに分けます(図2(5))。サンプルは、胚乳層と精巣層からなる二重層シートとして分離する必要があります(図2(6))。
3. 顕微鏡観察
- 胚乳サンプルをシート状にしてスライドガラスに置き、水またはパーフルオロデカリン(PFD)にマウントします。
注:サンプルとカバーガラスの間に気泡が残っている場合、葉18,19などのエアポケットを含むサンプルのイメージングに特に有用であると報告されているペルフルオロデカリン(PFD)が有用です。PFDは表面張力が最も低いことが知られているため、サンプル表面の空気空間を簡単に埋めることができます。ただし、タイムラプスイメージングでは、成熟した種子の水分含有量が細胞の流動性を維持するために豊富である必要があるため、封入剤として水を使用することをお勧めします。 - カバースリップをサンプルの上にそっと置きます。胚乳層がカバーガラスに面していることを確認します。
注:マニキュアまたはグリースを使用してカバースリップの端をシールし、サンプルと封入剤の乾燥を防ぐことができます。
結果
図1に示すプロトコルを使用して、胚乳サンプルは、14 DAFでシリックから収穫された発育中の種子から調製されました(この段階では、精巣はまだ緑色です)。広い領域にわたる多数の胚乳細胞とその細胞内構造が観察されました(図3A)。この実験では、C末端でGFPと融合したPHYBを発現するシーズ(PHYB-GFP)を使用しました。PHYBは赤色光による活性化により核に移動し、光体(PB)として知られるPHYB陽性のスペックルを形成し、これが種子の発芽に関与することはよく知られている4,20,21,22。サンプルは、22°Cの連続白色光条件下で栽培された植物から収穫されました。 図3Bに示すように、核内のPBは胚乳細胞で検出されました。この結果は、胚乳中のPHYBが最適な種子発芽を調節することを示す以前の研究と一致している15。また、フィトクロムFR/Rの光可逆性を観察することにより、単離された胚乳細胞が試料調製後も生体活性を保持していることを確認するため、生細胞タイムラプスイメージングを行いました(図3C)。胚乳サンプルは、約17-18 DAFのシリックから収穫された発育中の種子から調製されました。PBは解剖時に核内で検出されましたが、遠赤色光を照射すると完全に消失しました。続いて、赤色光照射により再びPBが誘導されました。このフィトクロム光可逆性は、このプロトコルによって単離された胚乳細胞が解剖後少なくとも4.5時間生物学的活性を保持したことを示し、2回検出されました(図3C)。
次に、 図2に示すように、成熟した種子(精巣が茶色)からの胚乳サンプルを調製しました。本実験では、収穫後約1年間、常温の暗所でデシケーターに保存したミトコンドリア標的GFP(mtGFP)23を発現する種子を用いて、ミトコンドリアの運動性を観察しました。胚中のミトコンドリアは、吸収後や発芽条件への移行後に活発に動き、形態を動的に変化させることが報告されている24。無傷の胚乳細胞におけるミトコンドリアの蛍光タイムラプスイメージングを3時間後のシードインビビビション後に行い、ミトコンドリアの動きを検出しました(補足動画1)。胚乳中のミトコンドリアは、22°Cで短期間の吸収後、すぐにサイトゾル内で移動しました。 22°Cで1日間のシード吸収後、よりダイナミックに動くミトコンドリアが観察されました(図4 および 補足動画2)。
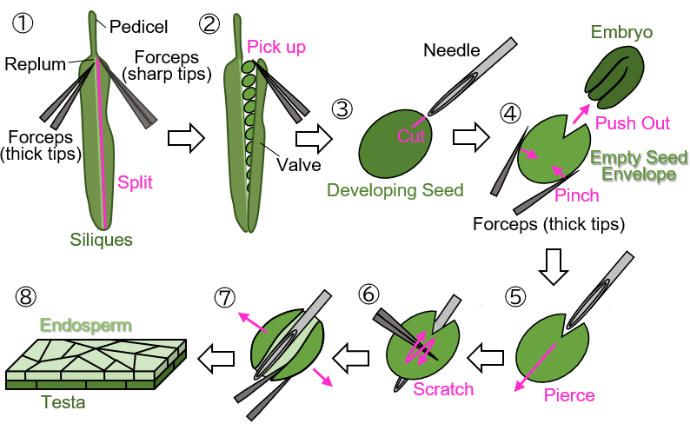
図1:発育中の種子からの胚乳サンプル調製。 ステップ1:バルブがリプラムから分割されます。ステップ2:発育中の種子が収集されます。ステップ3:注射針を使用して、精巣と胚乳に瘢痕を作成します。ステップ4:鉗子で種子をつまむことにより、胚が除去されます。ステップ5:注射針は、空のシードエンベロープを通して内側から外側に挿入されます。ステップ6:睾丸の表面を鉗子で引っ掻きます。ステップ7:空のシード封筒を鉗子を使用してシート状に開きます。ステップ8:最終的な胚乳シートサンプルは、顕微鏡観察のために準備されます。すべてのステップは、実体顕微鏡下で湿った濾紙で実行されます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:成熟種子からの胚乳サンプル調製。 ステップ1:乾燥した種子を1.5mLのチューブで40分以上水に吸収します。ステップ2:注射針を使用して、精巣と胚乳に瘢痕を作成します。ステップ3:鉗子で種子をつまむことにより、胚が除去されます。ステップ4:空のシードエンベロープの上側と下側をカットして円柱に成形します。ステップ5:円筒形の空の種子封筒をその中心軸に沿ってカットします。ステップ6:最終的な胚乳シートサンプルは、顕微鏡観察のために準備されます。すべてのステップは、実体顕微鏡下で湿った濾紙で実行されます。 この図の拡大版を表示するには、ここをクリックしてください。

図3:現像中の種子を用いた無傷の胚乳細胞層の蛍光イメージング。 無傷の胚乳細胞層サンプルは、開花後14日(DAF)シリック(A、B)および17-18 DAFシリック(C)の現像種子から調製されました。顕微鏡イメージングは、Plan-Apochromat 63×油浸対物レンズと白色光レーザーを備えた共焦点レーザー走査型顕微鏡を使用して行いました。(A)微分干渉コントラスト(DIC)下の胚乳の共焦点画像は、多数の無傷の胚乳細胞が存在する広い領域を示しています。スケールバー:20μm.(B)PHYB-GFPを発現する胚乳の共焦点画像を示し、PHYB-GFPは緑色、シアンはクロロフィル自家蛍光を示します。原子核内のフォトボディ(PB)は、白い矢印で示されます。スケールバー:10μm;拡大画像スケールバー:2.5μm。GFPシグナルは、蛍光寿命顕微鏡(FLIM)を使用して、タンパク質貯蔵液胞(PSV)の自家蛍光から分離されました。蛍光寿命はTauScanを使用して取得し、TauSeparation機能を使用して分離しました。GFPの平均蛍光寿命は2.2nsでした。GFP蛍光は488 nmで励起され、500〜530 nmで収集され、クロロフィル自家蛍光は405 nmで励起され、688〜729 nmで収集されました。(C)連続白色光(cWL)、連続遠赤光(cFR)、または連続赤色光(cR)の下でPHYB-GFPを発現する胚乳の共焦点画像を示します。PHYB-GFPは緑色、PSV自家蛍光はマゼンタで示しています。スケールバー:10μm;拡大画像スケールバー:2.5μm。光強度:WL、46.5μmol/m2/s;FR、35.2 μmol/m2/s;R, 18.6 μmol/m2/s. PSV自家蛍光は561 nmで励起され、565-621 nmで収集されました。GFPシグナルは、上記と同じ方法を用いて分離しました。 この図の拡大版を表示するには、ここをクリックしてください。
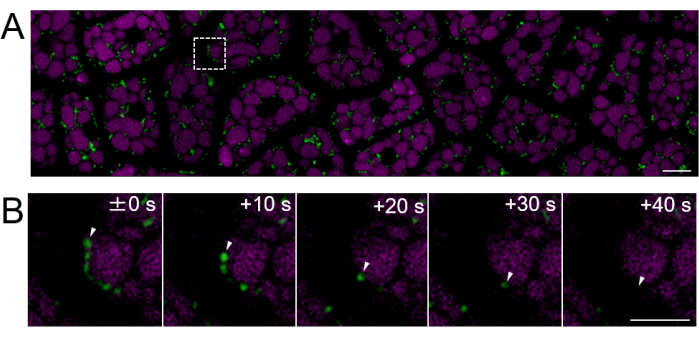
図4:成熟種子を用いた無傷の胚乳細胞層の蛍光生細胞イメージング。 顕微鏡イメージングは、 図3で説明したのと同じ方法を使用して行いました。(A) 補足動画2から得られた無傷の胚乳細胞層全体の共焦点画像を示す。ミトコンドリアは緑色で、PSV自家蛍光はマゼンタで標識されています。スケールバー:10μm. (B) パネル(A)の破線四角い部分から拡大した一連のタイムラプス画像は、白い矢印で示されたミトコンドリアの動きを示しています。スケールバー:5μmこの 図の拡大版を表示するには、ここをクリックしてください。
補足ムービー1: 吸収後3時間後の成熟種子の胚乳細胞層におけるmtGFPのタイムラプスビデオを示します。10秒ごとに1フレームが撮影され、ビデオのフレームレートは10フレーム/秒です。スケールバー:10μmこの ファイルをダウンロードするには、ここをクリックしてください。
補足ムービー2: 吸収の1日後の成熟種子の胚乳細胞層におけるmtGFPのタイムラプスビデオが示されています。10秒ごとに1フレームが撮影され、ビデオのフレームレートは10フレーム/秒です。スケールバー:10μmこの ファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
種子の発芽における胚乳の役割は、遺伝子発現解析や脂質および植物ホルモンの定量化など、分離種子組織を用いた遺伝学的および生化学的解析を通じて明らかにされている9,14,25,26,27。空の種子エンベロープ(胚乳および精巣)を異なるシロイヌナズナ変異体から単離された胚と組み合わせたin vitro種皮寝床アッセイにより、発芽過程の根底にある分子メカニズムが明らかになった14,15,16,28。しかし、シロイヌナズナの種子のサイズが小さく、精巣の下の胚乳細胞層の位置が悪いため、顕微鏡観察のためのサンプル調製は困難でした。特に、種子発生中の胚乳細胞層の観察は、化学的固定や切片化なしに行われることはほとんどありませんでした。
サンプル調製中、発育中の種子から出た空の種子エンベロープは、精巣が生きていて柔らかいため、壊れやすいです。ここでは、固定や切片化を必要とせずに、発育中の種子の顕微鏡観察および分析に適した無傷の胚乳細胞層サンプルを迅速に調製するための2つのプロトコルが確立されました。成熟した種子からのサンプル調製の場合、精巣は死んで頑丈であるため、スライドグラスに取り付けたときに空の種子エンベロープが湾曲を保持します。この湾曲により、広範囲の焦点で胚乳細胞層をはっきりと観察することが難しくなります。そこで、種子の現像方法に若干の改良を加え、空の種子エンベロープを適切にトリミングしました。この方法で2つに分離することで、多数の胚乳細胞をピントを合わせたまま鮮明に観察することができました。
種々のイメージング試薬(DNAの染色用、活性酸素種、酸性コンパートメントなど)が開発され、一部はシロイヌナズナ植物に適用されている29,30,31,32。このプロトコルを用いて調製した胚乳細胞層サンプルは、すでにLysoTrackerによる顕微鏡観察やヨウ化プロピジウム染色に利用されており、胚乳機能の評価に貢献しています17。1962年にGFPが発見されて以来、GFPタグ付きタンパク質は、細胞内構造の動態を解明するための不可欠なツールとなっている23,24,34,35,36,37,38。このプロトコルに従って胚乳サンプルを調製し、前述の方法を採用することにより、図3および図4に示すように、種子の発生および発芽中の胚乳の生細胞イメージングを行うことが可能になり、それにより細胞内イベントおよび特定のタンパク質の局在を解明することができる。さらに、このプロトコルを用いて、生きた胚乳細胞に対する特異的阻害剤(プロテアーゼ阻害剤、タンパク質修飾酵素阻害剤、および細胞動態阻害剤など)39,40,41,42の適用は、種子の発生および発芽中の胚乳機能の根底にある細胞内イベントおよび分子メカニズムへのより深い洞察を提供することが期待される。
このプロトコルの1つの制限は、完全に乾燥した種子からの胚乳細胞層を調製することができないことです。これは、種子を胚と空の種子エンベロープに分離することが困難であるためです。 図2に示すように、成熟した種子を分離するには、少なくとも40分の吸収時間が必要です。胚乳細胞内のいくつかの細胞イベントが吸収時に誘発される可能性があることに注意することが重要です。別の制限は、このプロトコルは、単一細胞胚乳層を観察するために特別に設計されているため、特に10 DAFより前の種子開発の初期段階で胚乳組織の観察を可能にしないことです。これらの初期段階では、単一細胞胚乳層の形成に先行する組織(非層状胚乳)が発育中の種子43の内部を埋め尽くし、胚乳サンプルの調製を困難にする。
開示事項
著者らは、競合する金銭的利益がないことを宣言します。
謝辞
35Sプロモーターが駆動するPHYB-GFPを発現する phyB 変異体を提供してくださった京都大学の松下博士と岡博士に感謝いたします。本研究の一部は、科学研究費補助金新学術領域研究「提案研究領域研究」の支援を受けて行われました(19H05713 to K.Y.)。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
参考文献
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179(2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Jr Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202(2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121(2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394(2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732(2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650(2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510(2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1(2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved