Method Article
Çeşitli Bakterilerin Migrasyonunun ve Biyofilm Oluşumunun Ölçülmesi
Bu Makalede
Özet
Burada, konak içindeki mikroorganizmaların izolasyonu ve tanımlanması için pratik bir yöntem sunuyoruz. Bu şekilde, mikroorganizmaların fizikokimyasal özellikleri ve konakta olası yaşam biçimleri açıkça tanımlanmaktadır.
Özet
Konakçı vücutta gelişen mikroplar öncelikle hayatta kalmalarını kolaylaştıran uyarlanabilir yeteneklere sahip olduklarından, doğalarını sınıflandırma ve tanımlama yöntemleri, karakterizasyonlarını kolaylaştırmada faydalı olacaktır. Şu anda, çoğu çalışma yalnızca belirli bir karakterizasyon yöntemine odaklanmaktadır; Bununla birlikte, mikroorganizmaların konakçıdan izolasyonu ve tanımlanması sürekli bir süreçtir ve genellikle birkaç kombinatoryal karakterizasyon yöntemi gerektirir. Burada, mikrobiyal biyofilm oluşturma yeteneğini, mikrobiyal solunum durumunu ve kemotaksis davranışlarını belirleme yöntemlerini açıklıyoruz. Yöntemler, üçü Sprague-Dawley (SD) sıçanlarının kemik dokusundan (Corynebacterium stationis, Staphylococcus cohnii subsp. urealyticus ve Enterococcus faecalis) ve ikisi Amerikan Tip Kültür Koleksiyonu'ndan (ATCC)-Staphylococcus aureus ATCC 25923 ve Enterococcus faecalis'ten izole edilen beş mikrobu tanımlamak için kullanılır V583 (İngilizce). SD sıçan kemik dokusundan izole edilen mikroplar, gram pozitif mikropları içerir. Bu mikroplar, kemik matrisi içindeki stresli ve besin sınırlayıcı ortamlarda gelişmeye adapte olmuşlardır. Bu makale, okuyuculara laboratuvar ortamında izole edilen mikropların doğasını ve davranışını belirleme konusunda özel bilgi birikimi sağlamayı amaçlamaktadır.
Giriş
İnsan vücudu tarafından temsil edilen memeli konakçı, çok sayıda mikroorganizma içerir. Bu mikroorganizmalar, konakçının ağzında, sindirim sisteminde, bağırsağında ve kanında yaygın olarak bulunur ve konakçının sağlığı üzerinde farklı etkilere sahiptir. Ağız boşluğu, konakçının enfeksiyonlara karşı duyarlılığını değiştirebilen çok sayıda mikroba ev sahipliği yapar. Streptokok (örneğin, S. mitis / oralis, S. pseudopneumoniae ve S. infantis) ve Prevotella spp. ağız boşluğunu kolonize ederek dil yüzeyinde çok türlü bir biyofilm oluşturur ve ağız kokusuna neden olur ve mikrobiyal enfeksiyon için mikrobiyal bir rezervuar olarak işlev görür. Bu patojenler, diş kökünü çene kemiğinde tutan periodontal ligamentlere sızarak çene kemiğini enfekte edebilir1. Konakçı vücuttan izole edilen bu mikropların karakterizasyonu, özellikle mikroplar özel tedavi ve büyüme koşulları gerektiren bireysel özellikler sergilediğinde, genellikle sıkıcı bir süreçtir. Patojenik Helicobacter pylori, Clostridium difficile ve Fusobacterium nucleatum gibi mikroplar, bağırsağın zorlu ortamında, spesifik oksijen, besin ve büyüme gereksinimleriyle gelişir ve karakterizasyon süreçlerinde, özellikle de bu mikropların patojenitesinin araştırılmasında bir zorluk teşkil eder. Bu nedenle, bilim adamlarının ve tıp pratisyenlerinin yeni tıbbi tedaviler geliştirmeleri için bu mikroorganizmaları izole etmek ve araştırmak için standart bir yönteme ihtiyaç vardır.
Bu protokol, sıçanların kemik matrisinde gelişen mikropları kullanır. Geleneksel olarak, dişlerin varlığının kemik matrisini diğer kemiklere göre enfeksiyona daha duyarlı hale getirdiği çene tarafından temsil edilen kemik sistemi hariç1, genellikle konakçının sağlıklı kemiğinin steril bir ortam olduğuna inanılmaktadır. Bununla birlikte, çalışmalar, mikroorganizmaların bağırsak duvarı yoluyla sistemik dolaşıma girdiğini ve sonuçta kemik mineralizasyonunu etkilediğini bulmuştur2. Bir kavram kanıtı olarak, sağlıklı SD sıçanların (Corynebacterium stationis, Staphylococcus cohnii subsp. ve Enterococcus faecalis) uyluk kemiği ve tibiasından mikrobiyal izolatların biyokimyasal özelliklerini karakterize etmek için açıklanan protokolü kullanıyoruz. Bu mikrobiyal izolatlar, kemiğin kapalı ve hipoksik bir ortam olması ve bu mikropları kemikten karakterize etmenin zorlu bir görev olabileceği için seçilmiştir. Çeşitli makaleler, bu mikropların incelenmesinde kullanılan süreçleri detaylandırmıştır; Bununla birlikte, konak tarafından izole edilen mikroorganizmaları tanımlamak için tam bir protokol sağlayan çok az şey vardır.
Uygun kültür koşullarının oluşturulmasında, mikrobun oksijen gereksinimlerinin Sıvı Tiyoglikolat Ortamı (FTM) kullanılarak anlaşılması gerekir. Farklı oksijen gereksinimlerine sahip mikroplar, berrak FTM sıvısındatabakalı katmanlar oluşturur 3. Tabakalaşma profiline dayanarak, mikrobun oksijen ihtiyacı daha sonra hücrelerin büyümesini araştırmak için kullanılır. FTM sıvısının yüzeyinde gelişen mikroplar zorunlu aeroblardır, oysa altta büyüyen mikroplar zorunlu anaeroblardır. FTM sıvısında süspansiyon olarak büyüyen mikroplar ya fakültatif ya da aerotolerant anaeroblardır. Mikrobiyal büyüme hızı, mikrobiyal hücrelerin üstel büyüme fazını gözlemleyerek belirlenir. Büyüme profili daha sonra mikrobun biyofilm oluşumu ile karşılaştırılır. Biyofilmler büyük ölçüde birbirlerinin sağlığını doğrudan ve dolaylı olarak etkileyen birden fazla türden oluşur. Bu süreç sırasında, mikrobiyal topluluklar arasındaki faydalı etkileşimler, aktif karşılıklı etkileşimlerin evrimini destekleyen mekansal bir yapı sağlayarak bağlanmayı seçer. Örneğin, Paenibacillus amylolyticus ve Xanthomonas retroflexus'un ko-kültürü, statik bir ortamda fakültatif simbiyotik etkileşimler sergileyerek hızlı biyofilm büyümesini teşvik eder13. Mikroplar, sürekli lokalizasyon için biyofilm oluşumu yoluyla konakçı dokulara adapte olurlar, kendilerini zorlu ortamlara karşı korurlar ve konakçının bağışıklık sisteminden kaçarlar 4,5,6,7. Biyofilmler genellikle mikroorganizmaların dış kritik altı uyaranlara direnmesine yardımcı olan yoğun ve çok katmanlı yapılardır; örneğin, diş pulpasındaki E. faecalis, tetrasiklin ve vankomisin8 alt konsantrasyonları ile karşı karşıya kaldığında biyofilm oluşumunu artırarak antibiyotiklere karşı direncini arttırır.
Kemotaksis, mikroorganizmaların kimyasal gradyanlara göre hareket etmesini sağlar ve sinyal yolları, çeşitli patojenik bakterilerde yaygın olarak dağıtılır. Bazı patojenik mikroorganizmalar, bulaşıcı hastalıklara neden olmak için kimyasal sinyallerin rehberliğinde belirli bölgelere göç eder14. Örneğin, Xanthomonas spp. konakta 19 kemoreseptör ve 11 flagellin proteinini eksprese eder, bakteriyel bağlanmayı ve nihayetinde ülserasyonutetikler 15. Bakterilerde ayrıca bakterilerin besinlere spesifik göçünü yönlendiren ve daha iyi büyümeye yol açabilen spesifik proteinler (pektin bağlayıcı proteinler) vardır16. Bu aynı zamanda besin açısından fakir ortamlarda bulunabilecek bakteriler için de kritik öneme sahiptir. Mikrobiyal hücreler, hücresel canlılığa zarar veren diğer yırtıcı hücrelerden ve toksinlerden kaçarken, kendilerini elverişli bir büyüme ortamına çekmek için genellikle kemotaktik motiliteye güvenirler. Kemotaksisi belirlemek için önceden belirlenmiş yumuşak agar yaklaşımlarına dayanarak, mikrobiyal kemotaksisi test etmek için bir kemoatraksant gradyanı oluşturmak için yayılabilir bir yöntem geliştiriyoruz.
Bu makale, örnek olarak Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ve Enterococcus faecalis V583 kullanılarak bakterilerin büyüme koşullarını, biyofilm oluşumunu ve kimyasal tropizmini belirleme yöntemlerini açıklamaktadır (bkz. Şekil 1). Mikrobiyal büyüme koşullarının optimizasyonu, mikrobun oksijen gereksinimlerini belirlemek için FTM'yi kullanırken, biyofilm oluşumu katı bir destek olarak cam yüzeyleri kullanır ve biyofilm kütlesi kristal viyole ile karşı boyanır. Mikrobun kimyasal tropizmi, 3D baskı yoluyla (Ek Şekil S1), yumuşak bir agar matrisinde kemoatraktan için kimyasal bir rezervuar oluşturmak için standartlaştırılmış bir yöntemin kullanıldığı kemotaktik davranışına dayanır (Ek Şekil S2).
Protokol
NOT: Bu protokolde kullanılan tüm malzeme ve ekipmanlarla ilgili ayrıntılar için Malzeme Tablosuna bakın. Kontaminasyonu önlemek için aseptik teknikler kullanın.
1. Tek bir koloni elde etmek için bakteri kazanımı
- Katı agar plakaları hazırlayın.
- Her litre sıvı 11.8 g tripton, 23.6 g maya özütü, 9.4 g K2HPO4, 2.2 g KH2PO4 ve 15 g agar, pH = 7 içeren agar içeren Müthiş Et Suyu (TB) ortamı hazırlayın.
- Çözeltiyi 121 °C'de 20 dakika boyunca hava geçirgen bir kapak veya havalandırma deliği olan şişe sızdırmazlık filmi kullanarak otoklavlayın.
- Sıvı soğumadan ve katılaşmadan önce, agar içeren TB suyunu plaka başına 25 mL hacminde 10 cm'lik plastik Petri kaplarına dökün.
NOT: Et suyu, 60 °C'den daha düşük sıcaklıklarda katılaşmadan önce tabağa dökülmelidir. Kontaminasyonu önlemek için aseptik teknikler kullanın.
- Plakaya bakteri aşılaması
- -80 °C'de saklanan hedef suşları çıkarın ve oda sıcaklığında biyolojik bir güvenlik kabininde çözdürün.
- 10 μL'lik bir pipet kullanarak 10 μL bakteri süspansiyonu alın ve çizerek TB plakasına yayın.
- Kirlenmeyi önlemek için plakayı kapatın. Plakayı 37 °C'de bir biyokimyasal inkübatöre yerleştirin. ~ 24 saat sonra koloni büyümesini görsel olarak kontrol edin. Tek kolonileri seçin ve yalnızca bir tür bakteri içerdiklerini doğrulamak için bunları PCR ile çoğaltın.
2. Logaritmik büyüme fazına bakteriyel sıvı kültür
- Sıvı kültür ortamı hazırlayın.
- Adım 1.1.1'deki katı agar plakalarının hazırlanmasına bakın. 1 L'si 11.8 g tripton, 23.6 g maya özütü, 9.4 gK2HPO4ve 2.2 g KH2PO4, pH ~ 7 içeren TB sıvı ortamı hazırlamak için.
NOT: Agar eklemeyin. Bakteriler sıvı besin ortamında daha hızlı büyür. - Çözeltiyi 121 °C'de 20 dakika boyunca hava geçirgen bir kapak veya havalandırma deliği olan şişe sızdırmazlık filmi kullanarak otoklavlayın.
- Sıvı kültür ortamını 4 °C'de saklayın.
- Adım 1.1.1'deki katı agar plakalarının hazırlanmasına bakın. 1 L'si 11.8 g tripton, 23.6 g maya özütü, 9.4 gK2HPO4ve 2.2 g KH2PO4, pH ~ 7 içeren TB sıvı ortamı hazırlamak için.
- Bakteri aşılama ve yetiştirme
- Biyolojik güvenlik kabininde, bir aşılama halkası veya 10 μL'lik bir pipet ile tek bir koloni seçin ve bakterileri bir Erlenmeyer şişesinde hazırlanan TB sıvı ortamında aşılayın.
- Erlenmeyer şişesini gazlı bezle kapatın ve bakterileri yetiştirmek için 37 °C'de bir çalkalayıcıya (200 rpm) yerleştirin.
NOT: Sıvı ortam 5 saat içinde kademeli olarak bulanıklaşır; Bulanık hale gelmek için geçen süre farklı bakterilere göre değişir.
3. FTM deneyi ve büyüme eğrisi belirleme
- Sıvı Tiyoglikolat Ortamı (FTM) hazırlama
- Her litresi 15 g tripton, 5 g maya özütü, 5 g glikoz, 0.5 g L-sistein, 0.5 g sodyum tiyoglikolat, 2.5 g sodyum klorür, 0.001 g resazurin ve 0.75 g agar içeren Tiyolglikolat Ortamı (TM) hazırlayın.
NOT: Ticari olarak temin edilebilen katı ortam, su ile kolayca sulandırılabilir ve sterilize edilebilir (Adım 3.1.2.). - 29.3 g katı Tiyoglikolat Ortamı tartın, 1 L damıtılmış su ekleyin, ısıtın ve tamamen eriyene kadar ve çözelti pembeye dönene kadar karıştırın.
- Sızdırmazlık tapalı bir test tüpüne TM (19 mL) ekleyin. Mühürlemeden sonra, hava geçirgen bir kapak veya hava deliği olan şişe sızdırmazlık filmi kullanarak çözeltiyi 121 °C'de 20 dakika otoklavlayın.
NOT: Isıtıldıktan sonra çözelti açık sarı olur.
- Her litresi 15 g tripton, 5 g maya özütü, 5 g glikoz, 0.5 g L-sistein, 0.5 g sodyum tiyoglikolat, 2.5 g sodyum klorür, 0.001 g resazurin ve 0.75 g agar içeren Tiyolglikolat Ortamı (TM) hazırlayın.
- Bakterilerin aşılanması, yetiştirilmesi ve gözlemlenmesi
- Bakteriyel süspansiyonu sıvı TB ortamında OD 0.6-0.8'e kadar büyüyecek şekilde hazırlayın (bkz. Adım 2.2.).
- Biyolojik güvenlik kabinindeki aseptik koşullar altında test tüpü sızdırmazlık tapasını açın, FTM içeren test tüpüne mümkün olan en kısa sürede 1 mL bakteri kültürü ekleyin ve test tüpünü hemen tekrar kapatın.
- Bakterilerin sıvı içinde homojen bir şekilde dağıldığından emin olmak için tüpü hafifçe çalkalayın ve statik kültür için test tüpünü 37 °C'ye yerleştirin.
- 48 saatlik inkübasyondan sonra, çeşitli test tüplerinde FTM'deki farklı bakterilerin büyümesini gözlemleyin ve fotoğraf çekin.
- Aerobik koşullar altında büyüme eğrisinin belirlenmesi
- İlk bakteri kültürünü uygun bir OD değeri ile hazırlayın (bkz. Adım 2.2.) ve bakterileri logaritmik büyüme aşamasına ulaşana kadar kültürleyin.
NOT: Bu protokolde kullanılan Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ve Enterococcus faecalis V583'ün log fazına ulaşması ~ 5 saat sürdü. - Üç nüsha halinde 96 oyuklu bir plakanın her bir oyuğuna TB sıvı ortamında 200 μL bakteri kültürü (Adım 3.3.1'den itibaren) ekleyin. 600 nm'de OD değerini belirlemek için bir mikroplaka okuyucu kullanın ve farklı bakteri kültürlerini, farklı bakteri içeren kuyucuklar ile TB sıvı ortamı (boş) arasındaki OD farkı 0.01 ile 0.02 arasında olacak şekilde seyreltin.
- 96 oyuklu yeni bir plaka alın, TB besiyeri ekleyin, Adım 3.3.2.'deki farklı seyreltilmiş bakteri kültürlerini üç nüsha halinde plakaya aktarın ve ultra temiz bir tezgah üzerine yerleştirin.
- 96 oyuklu plakayı sızdırmazlık bandı ile kapatın, mikroplaka okuyucuya yerleştirin ve programı aşağıdaki gibi ayarlayın:
- Sıcaklığı 37 °C'ye ± 0,5'e ayarlayın.
- Kinetik Döngüyü, her biri 60 dakika olan toplam 30 döngüye ayarlayın.
- Absorbansı 600 nm'ye ayarlayın.
- Sallamayı bir döngüde 1,600 s'ye ayarlayın.
- Programı çalıştırın ve büyüme eğrisi platoları olduğunda durdurun.
- İlk bakteri kültürünü uygun bir OD değeri ile hazırlayın (bkz. Adım 2.2.) ve bakterileri logaritmik büyüme aşamasına ulaşana kadar kültürleyin.
- Anaerobik koşullar altında büyüme eğrisinin belirlenmesi
- Adım 3.3'ü izleyin. ancak plakayı sızdırmazlık bandı ile kapatmadan önce 96 oyuklu plakayı TB ortamı ve bakteri süspansiyonları ile anaerobik bir inkübatörde tutun. Oksijen konsantrasyonunu %<3'e düşürmek için anaerobik kutuyu nitrojenle pompalayın ve doldurun. 96 oyuklu plakayı sızdırmazlık bandı ile kapatın ve anaerobik kutuda bırakın.
4. Biyofilm oluşturma yeteneği testi
- Bakterileri sıvı ortamda logaritmik büyüme fazına kültürleyin.
- Bakterileri TB sıvı ortamında aşılamak için Bölüm 2'ye bakın.
- Bakterileri gece boyunca 37 °C'de bir çalkalayıcıda büyütün ve bakteri kültürü ortamının OD600'ünün 0,6 ile 0,8 arasında olduğundan emin olun.
- Bakteri kültürünü bölün ve farklı koşullar altında yetiştirin.
- Bakteri kültürünün OD600'ü 0.6 ile 0.8 arasında olduğunda, bu bakteri süspansiyonunun 10 mL'sini bir cam test tüpüne ekleyin.
- Her bakteri kültürünü iki gruba ayırın: aerobik ve anaerobik koşullar ve tüm işlemleri üç nüsha halinde gerçekleştirin.
- Aerobik grup için, bakteri süspansiyonunu içeren test tüpünü kalay folyo ile sarın ve sabit bir sıcaklıkta 37 ° C'lik bir su banyosunda inkübe edin.
- Anaerobik grup için, bakteri süspansiyonunu içeren tüpü kalay folyo ile sarın ve anaerobik bir inkübatöre aktarın. Anaerobik inkübatördeki kalay folyoyu çıkarın ve inkübatördeki oksijen konsantrasyonunu pompalayıp nitrojenle doldurarak %<3'e düşürün. Test tüpünü buzlu bir cam tıpa ile kapatın, kapattıktan sonra çıkarın ve 37 °C'de bir su banyosunda inkübe edin.
- Her 6 saatte bir, alttaki biyofilmin büyümesini gözlemlemek için iki grubun her birinden (aerobik / anaerobik) üç test tüpü alın ve Adım 4.3'ü takip ederek boyayın.
- Bakteriyel süspansiyonu atın ve biyofilmi kurutun.
- Test tüplerini farklı zaman noktalarında çıkarın ve bakteri süspansiyonunun üst tabakasını dikkatlice aspire edin. Test tüpünün dibine yapışan beyaz biyofilmi gözlemleyin.
NOT: Bakteriyel süspansiyonu aspire ederken biyofilmi bozmamaya dikkat edin. - Test tüpünün duvarı boyunca dikkatlice 2 mL fosfat tamponlu salin (PBS) ekleyin, biyofilmde adsorbe edilen planktonik bakterileri yıkamak için hafifçe çalkalayın ve PBS tamponunu dikkatlice aspire edin.
- Altta biyofilm adsorbe edilmiş test tüpünü 30 dakika kuruması için fırına koyun.
- Test tüplerini farklı zaman noktalarında çıkarın ve bakteri süspansiyonunun üst tabakasını dikkatlice aspire edin. Test tüpünün dibine yapışan beyaz biyofilmi gözlemleyin.
- Boy -ama
- Test tüplerini çıkarın, her test tüpüne 2 mL% 0.1 kristal viyole boyama solüsyonu ekleyin ve biyofilmleri oda sıcaklığında 30 dakika boyunca boyayın.
- Kristal viyole boya çözeltisini dikkatlice aspire etmek için bir pipet kullanın. Kalan kristal viyole boya çözeltisini yıkamak için test tüpünün duvarı boyunca dikkatlice damıtılmış su ekleyin, eklenen damıtılmış su neredeyse renksiz hale gelene kadar 3x-5x tekrarlayın. Test tüpünün altındaki mor biyofilmi gözlemleyin.
- Test tüpünü tekrar kurutun.
- Biyofilmi %95 etanol ile çözün ve biyofilm çözeltisinin OD600'ünü ölçün.
- Kurutulmuş test tüpünü çıkarın, her test tüpüne 10 mL %95 etanol ekleyin ve kristal menekşenin etanol içinde tamamen çözündüğünden emin olmak için iyice çalkalayın.
- Oyuk başına 200 μL'lik bir hacimle, 96 oyuklu bir plakaya etanol içinde kristal viyole ekleyin ve emilimini 600 nm dalga boyunda ölçün.
NOT: Beer-Lambert yasasına göre, absorbans, çözeltinin konsantrasyonu ile doğrusal olarak ilişkilidir, bu nedenle OD600 değeri, farklı zamanlarda bakteri süspansiyonundaki biyofilm miktarını yansıtan kristal viyole konsantrasyonunu yansıtabilir.
5. Bakteriyel kemotaksis testi
- Diferansiyel ötrofik agar plakaları hazırlayın.
- Her litresi 11.8 g tripton, 23.6 g maya özütü, 9.4gK2HPO4, 2.2 g KH2PO4 ve 5 g agar, pH ~ 7 içeren% 0.5 agar içeren yarım doz bir MH ortamı hazırlamak için Adım 1'e bakın.
- Her litresi 59 g tripton, 118 g maya özütü, 47 g K2HPO4, 11 g KH2PO4 ve 5 g agar, pH ~ 7 içeren% 0,5 agar içeren 5x TB ortamı hazırlamak için Adım 1'e bakın.
- Çözeltiyi 121 °C'de 20 dakika boyunca hava geçirgen bir kapak veya havalandırma deliği olan şişe sızdırmazlık filmi kullanarak otoklavlayın.
- Sıvı soğutulmadan ve katılaşmadan önce, plaka başına 25 mL yarım doz MH suyu (% 0.5 agar içerir) dökün, plakayı 3D baskılı bir kapakla örtün ve biyolojik bir güvenlik kabinine yerleştirin. Soğuduktan sonra, yarı katı ortamdaki silindirik kuyuyu (1,4 cm çapında) gözlemlemek için kapağı çıkarın.
NOT: Reçine malzemeli 3D baskılı kapak, yüksek sıcaklıkta buhar kullanılarak sterilize edilemez. Yüzey bakterilerini öldürmek için% 95 etanol ile püskürtülebilir ve daha sonra biyolojik bir güvenlik kabininde 30 dakika boyunca bir UV lambası ile ışınlanabilir. Kapağı çıkarırken, dikey yönde kuvvet uygulayın ve yarı katı agarın zarar görmesini önlemek için dikkatlice kaldırın. - 5x TB suyu (% 0.5 Agar içeren) katılaşmadan önce, 5x TB suyunu yarı katı plakadaki kuyuya eklemek için bir pipet kullanın, et suyu ortamın yüzeyi ile aynı hizaya gelene kadar.
- Ötrofik cisimler içeren yarı katı bir agar plakası elde etmek için plakayı biyolojik bir güvenlik kabininde soğutun. Çevresel mikroorganizmalar tarafından plaka kontaminasyonunu önlemeye özen gösterin.
NOT: Yarı katı ortam hala biraz akışkandır ve bu nedenle baş aşağı depolanmadan önce tamamen soğutulmalıdır.
- Bakteri aşılaması, yetiştirme ve fotoğrafçılık
- Yarı katı kültür ortamının bulunduğu agar plakasını biyolojik bir güvenlik kabinine yerleştirin ve bakteriyel kontaminasyonu önlemek için UV ışınlaması altında ~ 30 dakika soğutun.
- ~ 0.6-0.8'lik bir OD'ye kültürlenmiş bakteri süspansiyonunun 4 μL'sini almak için 10 μL'lik bir pipet kullanın, pipet ucunu plastik Petri kaplarının ortasına yerleştirin ve bakteri süspansiyonunu pipetleyin.
- Bakteriyel süspansiyonun ortama emilmesi için 1 dakika bekleyin. Bakteriyel süspansiyon tamamen emildiğinde, plakayı üç nüsha halinde iki gruba (aerobik/anaerobik) bölün.
- Aerobik grubu sızdırmazlık bandı ile kapatın ve bu plakaları statik kültür için 37 ° C'lik bir biyokimyasal inkübatöre baş aşağı yerleştirin. Anaerobik grubu, Adım 4.2'de açıklandığı gibi anaerobik bir kutuya kapatın ve büyüme için plakaları 37 °C'de ters çevirin.
- Her 12 saatte bir (0 saat, 12 saat, 24 saat, 36 saat ve 48 saatte) bakterilerin yayılmasını ve göçünü kontrol edin ve plakanın görüntülerini almak için görüntüleme sistemini kullanın.
- Bakteri göç mesafelerini hesaplamak için ImageJ yazılımını kullanın.
- Görüntüleme sistemi kullanılarak elde edilen görüntü dosyasını içe aktarın.
- Ölçek çubuğunu ayarlayın ve tüm görüntülere uygulayın.
- Görüntü çekerken bir cetvel ekleyin, bir çizgi parçası oluşturun, bir düz çizgi parçası seçin (örneğin, 1 cm ve ardından bu çizgi parçasının uzunluğunu 1 cm olarak ayarlayın) ve tahtanın uzunluğunu işaretleyin.
- Ölçeği Ayarla penceresini açın; Analiz Et'e tıklayın | Ölçeği ayarlayın.
- Gerçek uzunluğu Bilinen uzaklık ve Uzunluk birimi alanına yazın.
- Global'i kontrol edin.
- Orijinal görüntünün klasör adresini ve çıktı dosyası adresini girin.
- Toplulukları tek tek seçmek için düz çizgi aracını kullanın ve düz takım çizgisi, her iki tarafa uzanan bakteri kolonisinin sınırına uyana kadar toleransı ayarlayın.
- Koloninin merkezden her iki uca olan göç mesafesini ayrı ayrı ölçün ve Analiz Et | Ölçün.
- Tüm topluluklar ölçülene kadar 5.3.3-5.3.4 Adımlarını tekrarlayın ve daha fazla analiz için sonuçları bir .csv dosyasına kaydedin.
Sonuçlar
Bu çalışma, konakçı mikrobiyomundan izole edilen mikropları karakterize etmek için alınan yaklaşımları açıklamaktadır (Şekil 1). Kavram kanıtı olarak, SD sıçan konakçısından (C. stationis, S. cohnii ve E. faecalis) üç mikrop izole edildi ve ticari olarak edinilmiş iki mikroorganizma (S. aureus ATCC 25923 ve E. faecalis V583) bu protokol kullanılarak test edildi. FTM kullanarak bireysel mikropların oksijen gereksinimlerini belirlemek için, zorunlu bir anaerob (Fusobacterium nucleatum ATCC 25586) ve bir fakültatif anaerob (Pseudomonas aeruginosa PAO1) olmak üzere iki kontrol organizması ekledik. Sonuçlar, test edilen beş mikrobun, bu mikropların daha önce bildirilen profilleriyle tutarlı olarak fakültatif anaeroblar olduğunu gösterdi (Şekil 2A)11. Oksijen gereksinimlerini açıklamak için, mikroplar hem aerobik hem de anaerobik koşullar altında kültürlendi. Test edilen tüm mikroplar hem aerobik hem de anaerobik koşullarda sigmoidal bir büyüme eğrisi sergiledi; bununla birlikte, OD600nm ile gösterildiği gibi mikrobiyal yoğunluk, beş mikrobun tümünün oksijen açısından zengin ortamlar için daha yüksek bir tercihe sahip olduğunu göstermiştir (Şekil 2B, C). Bu gözlemler, genellikle hipoksik olarak kabul edilen sıçan kemiklerine sızma ve enfekte etme mikrobiyal yetenekleriyle tutarlıdır.
Beş bakteri izolatının doğal olarak biyofilmler oluşturduğu bulundu, burada üretilen biyofilm kütlesi anaerobik koşullar altında daha yüksekti. Büyüme eğrisi karşılaştırması yoluyla, E. faecalis ve S. aureus ATCC 25923'ün biyofilmlerinin hem aerobik hem de anaerobik ortamlarda durağan büyüme fazı sırasında aktif olarak oluştuğu bulunmuştur (Şekil 3). Bu gözlem, biyofilm oluşumunun, muhtemelen biyofilm oluşumunu tetikleyen hücre içi sinyal molekülleri tarafından düzenlenen hücrelerin büyüme durumuna bağlı olduğunu göstermektedir11. Biyofilm oluşumunun büyüme koşullarına olan bu bağımlılığı, oksijen ve besin maddelerinden yoksun konakçı kemik matris ortamı tarafından sunulan besin ve büyüme koşulları ile tutarlıdır.
Mikropların patogenezi üzerine yapılan çalışmalar genellikle mikropun büyüme için elverişli olduğu düşünülen bölgelere göç etme yeteneği ile bağlantılıdır. Mikrobiyal kemotaksis ile ilgili birçok çalışma vardır, ancak bunu incelemek için standart bir yaklaşım yoktur. Ek olarak, yayılmayan kimyasalların kullanımı, bu fenomenin incelenmesinde sınırlayıcı bir faktör olarak kabul edilmiştir. Burada, kimyasal rezervuar ile aşılama noktası arasındaki mesafeyi standartlaştıran 3D baskı yoluyla üretilen bir reçine kapağı geliştirdik (Ek Şekil S1 ve Ek Şekil S2). Mikropların, kimyasal uyarıcı olarak 5x TB'nin kullanıldığı besin açısından zengin bir ortama göçünü inceledik. Mikroplar, aerobik ve anaerobik koşullar altında 48 saat boyunca izlendi, burada beş mikrobun tümü farklı derecelerde tropizm göçü gösterdi (Şekil 4A).
Bakterilerin göç mesafesini ölçmek için ImageJ kullanıldı (Şekil 4B); Rezervuara doğru göç, ters yöndeki göçten daha hızlı görünüyordu. Rezervuara doğru olan göç mesafesinin ters yöndeki mesafeye oranı, mikrobiyal kemotaksiye bağlı olarak mikrobiyal koloninin hızlı genişlemesini göstermektedir (Şekil 5B). Bu çalışmada, S. aureus ATCC 25923 gibi bakteriler, C. stationis gibi diğer mikroplardan daha hızlı göç etmiştir. İlginç bir şekilde, aerobik ve anaerobik koşullar altında kemotaktik kültürlerin göç profili, E. faecalis gibi bazı bakterilerin aerobik ve anaerobik koşullar altında göç modellerinde varyasyon gösterdiğini ve burada zaman içinde anaerobik koşullar altında hızlı bir genişlemenin gözlendiğini göstermiştir. Şaşırtıcı bir şekilde, laboratuvar suşu E. faecalis V583, kemotaksis için aerobik bir ortamı tercih etti. Bu nedenle, bu, farklı kaynaklardan izole edilen E. faecalis'in büyüme ortamına uyarlanmış farklı büyüme gereksinimlerine sahip olduğunu göstermektedir.

Şekil 1: İşlem sürecinin şematik diyagramı. (A) Bakteriler plakalara ve daha sonra sıvı ortama aşılanır ve logaritmik büyüme aşamasına kadar büyütülür. (B) Bakterilerin farklı koşullar altında (aerobik/anaerobik) biyofilm oluşturma yeteneğinin belirlenmesi. Her zaman noktası (6 saat) için üç numune seçildi ve paralel olarak tekrarlandı. (C) Farklı koşullar altında (aerobik/anaerobik) bakterilerin kimyasal tropizm deneyi için protokol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Mikrobiyal büyüme koşulları. (A) Sıvı Tiyoglikolat Ortamında kültürlenen bakterilerin büyüme profili (Soldan sağa I: Fusobacterium nucleatum ATCC 25586, II: Corynebacterium stationis, III: Staphylacoccus cohnii, IV: Enterococcus faecalis, V: Staphylacoccus aureus ATCC 25923, VI: Enterococcus faecalis V583 ve VII: Pseudomonas aeruginosa PAO1). (B) Aerobik koşullar altında konakçıdan izole edilen mikroorganizmaların büyüme eğrisi. (C) Anaerobik koşullar altında konakçıdan izole edilen mikroorganizmaların büyüme eğrisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
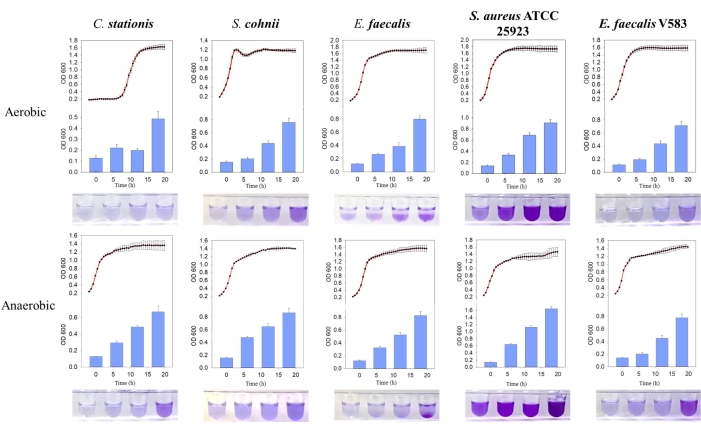
Şekil 3: Farklı koşullar altında farklı bakterilerin büyüme eğrilerinin ve biyofilm oluşumunun karşılaştırılması. Soldan sağa Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ve Enterococcus faecalis V583. Kırmızı eğri büyüme eğrisidir ve mavi histogram üretilen biyofilm miktarıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
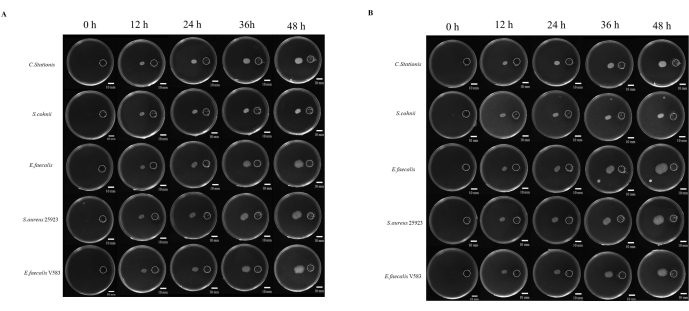
Şekil 4: Ötrofikasyona doğru mikrobiyal büyüme. (A) Aerobik koşullar, (B) anaerobik koşullar. Beş bakteri türü (yukarıdan aşağıya Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ve Enterococcus faecalis V583'tür) diferansiyel besin plakası üzerinde ötrofikasyona doğru büyüme eğilimindedir. Ölçek çubukları = 10 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Farklı koşullar altında mikropların kemotaksisi (aerobik/anaerobik). (A) Besin açısından zengin agar içeren bir plaka üzerinde beş bakterinin kimyasal tropizma göçünün sonuçları; Sol grup aerobik koşulları ve sağ grup anaerobik koşulları temsil eder. Her deney paralel olarak üç nüsha halinde tekrarlandı. (B) Kimyasal tropizmin veri analizi. Üst kısım aerobik koşulları ve alt kısım anaerobik koşulları temsil eder. Soldan sağa Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ve Enterococcus faecalis V583. Kırmızı ve mavi sütunlar, besin maddesine doğru ve besin maddesinden uzaklaşan bakterilerin besin gövdesinden göç mesafeleridir. Çizgi, iki değer arasındaki farktır (Kırmızı - Mavi). Ölçek çubukları = 10 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: Besin farkı yaratmak için 3D baskılı kapakların kullanılması agar plakaları. (A) 3D baskı kalıp işlemelerini hazırlamak için yazılım kullanın. (B) 8.000 reçine ile basılmış düz kapak kalıbı. (C) Besin farkı agar plakalarını elde etmek için yukarıdaki yöntemi kullanın. (D) Besin farkı agar plakalarının üretimi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S2: Besin farkı agar plakalarının yapımı ve ImageJ kullanılarak bakteri göç mesafesinin ölçümü. (A) Besin farkı agar plakalarının yapısı, plakayı örtmek için 3D baskılı bir kapak (silindirik bir çıkıntı içeren) kullanır. Agar soğutulduktan sonra, 5x TB agar ile doldurulmuş silindirik bir kuyu (kırmızı daire) oluşur. Bu daha sonra besin farkı agar plakaları elde etmek için soğutulur. (B) Bakterilerin farklı yönlerdeki göç mesafesini ölçmek için ImageJ'yi kullanın. Ölçek çubuğunu ayarlama (Analiz | Ölçeği Ayarla) ve Düz (Analiz | Ölçün). Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S3: M9 minimal orta-5x TB orta agar üzerinde beş bakterinin büyüme modelleri. Sol grup aerobik koşullar içindir ve sağ grup anaerobik koşullar içindir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S4: Fusobacterium nucleatum ATCC 25586 büyüme eğrileri ve anaerobik bakterilerin kemotaksisi üzerinde kontrol deneyleri. (A) Aerobik ve anaerobik koşullar altında F. nucleatum ATCC 25586'nın büyüme eğrilerinin belirlenmesi. (B) Farklı oksijen koşulları altında yarım doz MH-5x TB agar plakaları üzerinde F. nucleatum ATCC 25586'nın kemotaksisi deneyleri. Kısmi genişleme: F. nucleatum ATCC 25586'nın 48 saat sonra anaerobik koşullar altında plaka üzerinde büyümesi (kısmi büyütme). Bu dosyayı indirmek için lütfen buraya tıklayın.
| Bileşik | Konsantrasyon (g/L) |
| Na2HPO4 | 6.78 |
| KH2PO4 | 3 |
| NaCl (Doğal) | 0.5 |
| NH4Cl | 1 |
| MgSO4.7H 2O | 0.493 |
| CaCl2 | 0.011 |
| Glikoz | 4 |
Tablo 1: M9 Minimal ortamının bileşenleri ve içeriği.
Tartışmalar
Ardışık yöntemlerle beş bakteri türünü izole ettik ve tanımladık. Bakterilerin büyümesi minimum besin gereksinimlerine sahiptir: minimum ortam-yalnızca inorganik tuzlar, bir karbon kaynağı ve su içeren bir ortam. Deney grubundaki bakteriler MH solid plakalar üzerinde bulunmasına rağmen, bakterilerin kemotaksisini doğrulamak için yarım doz MH besiyeri kullandık ve iyi sonuçlar elde ettik. Bununla birlikte, minimum ortam kullanarak kontrol deneyleri de gerçekleştirdik. Deneyde M9 bazik besiyeri kullanıldı (bileşimi ve içeriği için Tablo 1'e bakınız) ve besin agar bloğu için hala 5x TB agar kullanıldı. Deneysel sonuçlar Ek Şekil S3'te gösterilmiştir. Her ne kadar bu bakteriler ( E. faecalis hariç) M9 ortamında yavaş büyür ve yavaş hareket eder, ancak bu deneylerde gözlemlendiği gibi genel olarak benzer bir eğilim (besin agarında büyümeye doğru) vardır. Bununla birlikte, E. faecalis V583, muhtemelen E. faecalis'in M9 ortamında büyümesi için gerekli bileşenlerin eksikliğinden dolayı M9 minimal ortamında büyümedi. Bu nedenle, besin eksikliği olan koşullar altında bakteri üremesini ve göçünü simüle etmek için besin eksikliği olan bir substrat olarak yarım doz MH ortamının kullanılmasını öneririz. Bu aynı zamanda bakterilerin göç etme eğiliminde olduğu mesafeyi ölçmek için ImageJ yazılımının kullanımını da kolaylaştırır.
Biyofilmler genellikle yüzeyle ilişkili mikrobiyal topluluklar olarak tanımlanır ve önemli bir mikrobiyal sağkalım stratejisidir. Pseudomonas aeruginosa, Haemophilus influenzae, Streptococcus pneumoniae ve Staphylococcus aureus gibi organizmalar asemptomatik konakçılarda bulunabilir ve in vivo yapışık mikroorganizmaların keşfi genellikle enfeksiyon değil kolonizasyon olarak adlandırılır. Çok önemli bir sorun, ideal bir hayvan kolonizasyon modelinin olmamasıdır12. Mikroplar, cam ve polivinil klorür (PVC) gibi malzemelerin biyofilm ile ilgili çalışmalar için uygun görüldüğü biyofilm oluşumundan önce yüklü yüzeylere ilk bağlanmaları gösterir. Mikrobiyal biyofilmleri9 incelemek için PVC 96 oyuklu plakalar kullanılarak yapılan çalışmalar, burada tek veya çok türlü biyofilmlerin gevşek veya yoğun şekilde paketlenmiş biyofilmlere10 neden olabileceği görülmüştür. Bu nedenle, biyofilm matrisi biyofilm boyama işlemi sırasında kolayca yıkanabildiğinden, PVC 96 oyuklu plakanın kullanılmasının gevşek bir şekilde paketlenmiş biyofilmler için uygun olmadığı düşünülmektedir. Bu nedenle, mikrobiyal biyofilm oluşumunu incelemek için cam test tüplerine güvendik (Şekil 3).
Bu yöntemin önemli bir sınırlaması, belirli koşullar altında büyüyen mikroorganizmalarla çalışmaması ve tüm bakterilerin göç edememesidir. Ayrıca, biyofilmler, mikroorganizmaların olumsuz dış ortamlara karşı savunmasına yardımcı olmanın etkili bir yolu olmasına rağmen, tüm konakçı mikroorganizmalar biyofilm üretme yeteneğine sahip değildir. Örneğin, daha önce bahsedilen ve kolon kanseri gelişimi17 ile ilişkili bir insan oral veya bağırsak simbiyozu ile ilişkili olan F. nucleatum ATCC 25586, yalnızca spesifik olarak anaerobik ortamlarda büyür, ancak biyofilm üretmez. FT ortamının etkinliğini doğrulamak için FTM deneylerinde kullandık. FT ortamının, bakterilere gradyan konsantrasyonlarında oksijen sağlamada etkili olduğu gösterilmiştir.
Karşılaştırma için, anaerobik bakteri F. nucleatum ATCC 25586'nın büyüme eğrisini ve kimyasal tropizmini test ettik (Ek Şekil S4). Büyüme eğrisi deneylerinde (Ek Şekil S4A), F. nucleatum ATCC 25586 aerobik koşullar altında büyüyemedi ve anaerobik koşullar altında kuyuların dibinde bakteri agregasyonu gösterdi. Kemotaksis deneylerinde (Ek Şekil S4B) ayrıca, F. nucleatum ATCC 25586 aerobik koşullar altında büyümedi ve 48 saat boyunca anaerobik koşullar altında yerinde aşılamadan sonra az sayıda bakteri bulundu. Benzer şekilde, bazı bakteriler göç ederek aktif olarak uygun büyüme koşullarını arayamadıkları için, uzun süreli uyku durumuna girerek uygun büyüme koşullarını beklerler18. Sıkı anaerobik bakterilerin yetiştirilmesinin, ET fermantasyon ortamı (yarı katı plakalar% 0.5 agar ile desteklenmelidir) gibi özel bir ortam gerektirdiğine dikkat edilmelidir, bu da geleneksel izolasyon ve tanımlamadan farklıdır. Önerilen bu yöntem, çoğu konakçı mikroorganizmayı karakterize etmek için uygulanabilir genel bir yöntemdir ve teknik, murin kemiklerinden izole edilen üç mikrop ve iki laboratuvar sınıfı mikrop dahil olmak üzere beş mikrop için gösterilmiştir. Bu protokol, gelecekteki çalışmalarda mikrobiyota izolatlarının doğru bir şekilde tanımlanmasına yardımcı olacaktır.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu tekniğin geliştirilmesi, Çin Ulusal Doğa Bilimleri Vakfı'nın Uluslararası Genç Bilim İnsanları Araştırma Fonu (22050410270), Shenzhen Denizaşırı Üst Düzey Yeteneklerin İnovasyon ve Girişimciliği Özel Fonu Peacock Ekibi (KQTD20170810111314625) ve Guangdong Yenilikçi ve Girişimci Araştırma Ekibi Programı (2019ZT08Y191). Bayan Chen Xinyi'ye belgenin düzeltilmesi ve laboratuvar yönetimi konusundaki yardımları için en içten şükranlarımızı sunarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chemical/Solution | |||
| 1% crystal violet dye solution | Solarbio | G1062 | 100 mL |
| Agar | Sigma-Aldrich | V900500 | Used to obtain semi-solid plates, 20 g |
| Centrifuge tube | Corning | 430790 | 15 mL |
| Fluid thioglycollate medium | Kinghunt | K0001 | 29.3 g |
| Mueller Hinton II Broth medium | Solarbio | NO.11865 | 100 g |
| Petri dishes | Bkman | B-SLPYM90-15 | Plastic Petri dishes, circular, 90 mm x 15 mm |
| Potassium Chloride | VETEC | WXBC4493V | 0.2 g |
| Potassium Dihydrogen Phosphate | aladdin | 04-11-7758 | 0.24 g |
| Sodium chloride | Macklin | S805275 | 8.0 g |
| Sodium phosphate dibasic | aladdin | 7558-79-4 | 1.44 g |
| Terrific Broth medium | Solarbio | LA2520 | 200 g |
| Kits/ Equipment | |||
| Anaerobic incubator | Longyue | ||
| Biochemical incubator | Blue pard | LRH-70 | |
| Microplate reader | Spark | ||
| Tanon 5200multi imaging system | Tanon | 5200CE | |
| Thermostatic water bath | Jinghong | DK-S28 |
Referanslar
- Bernardi, S., et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients' tongue biofilm. MicrobiologyOpen. 9 (2), 958 (2020).
- Tellez, G., Latorre, J. D., Kuttappan, V. A., et al. Rye affects bacterial translocation, intestinal viscosity, microbiota composition and bone mineralization in Turkey poults. PLOS One. 10, (2015).
- Brewer, J. H. Clear liquid mediums for the "aerobic" cultivation of anaerobes. Journal of the American Medical Association. 115 (8), 598 (1940).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Liu, C., et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review. Frontiers in Microbiology. 11, 802 (2020).
- Kumar, A., et al. Biofilms: survival and defense strategy for pathogens. International Journal of Medical Microbiology. , (2017).
- Penesyan, A., et al. Secondary effects of antibiotics on microbial biofilms. Frontiers in Microbiology. 11, 2109 (2020).
- Bernardi, S., et al. Subinhibitory antibiotic concentrations enhance biofilm formation of clinical Enterococcus faecalis isolates. Antibiotics. 10 (7), 874 (2021).
- Tsukatani, T., Fumihiko, S., Rieko, K. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids. World Journal of Microbiology and Biotechnology. 36 (12), 1-9 (2020).
- Hartmann, R., et al. Emergence of three-dimensional order and structure in growing biofilms. Nature Physics. 15, 251-256 (2019).
- Liu, Z., et al. Advances in bacterial biofilm management for maintaining microbiome homeostasis. Biotechnology Journal. 15 (10), 1900320 (2020).
- Hall-Stoodley, L., Stoodley, P. Evolving concepts in biofilm infections. Cellular Microbiology. 11 (7), 1034-1043 (2009).
- Røder, H. L., et al. Enhanced bacterial mutualism through an evolved biofilm phenotype. The ISME Journal. 12 (11), 2608-2618 (2018).
- Matilla, M. A., Tino, K. The effect of bacterial chemotaxis on host infection and pathogenicity. FEMS Microbiology Reviews. 42 (1), 052 (2018).
- Moreira, L. M., et al. Chemotactic signal transduction and phosphate metabolism as adaptive strategies during citrus canker induction by Xanthomonas citri. Functional & Integrative Genomics. 15 (2), 197-210 (2015).
- Konishi, H., et al. Bacterial chemotaxis towards polysaccharide pectin by pectin-binding protein. Scientific Reports. 10 (1), 1-12 (2020).
- Kostic, A. D., et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host & Microbe. 14 (2), 207-215 (2013).
- Kochan, T. J., et al. Updates to Clostridium difficile spore germination. Journal of Bacteriology. 200 (16), 00218 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır