Method Article
قياس الهجرة وتكوين الأغشية الحيوية للبكتيريا المختلفة
In This Article
Summary
هنا ، نقدم طريقة عملية لعزل وتحديد الكائنات الحية الدقيقة داخل المضيف. بهذه الطريقة ، يتم وصف الخصائص الفيزيائية والكيميائية للكائنات الحية الدقيقة والطرق الممكنة للعيش في المضيف بوضوح.
Abstract
نظرا لأن الميكروبات التي تزدهر في الجسم المضيف تتمتع في المقام الأول بقدرات تكيفية تسهل بقائها على قيد الحياة ، فإن طرق تصنيف طبيعتها وتحديدها ستكون مفيدة في تسهيل توصيفها. حاليا ، تركز معظم الدراسات فقط على طريقة توصيف واحدة محددة. ومع ذلك ، فإن عزل الكائنات الحية الدقيقة وتحديدها من المضيف هو عملية مستمرة وعادة ما يتطلب عدة طرق توصيف اندماجية. هنا ، نصف طرق تحديد قدرة تكوين الأغشية الحيوية الميكروبية ، وحالة التنفس الميكروبي ، وسلوكها الكيميائي. تستخدم الطرق لتحديد خمسة ميكروبات ، تم عزل ثلاثة منها من أنسجة عظام فئران Sprague-Dawley (SD) (Corynebacterium stationis و Staphylococcus cohnii subsp. urealyticus و Enterococcus faecalis) واثنان من مجموعة ثقافة النوع الأمريكي (ATCC) - المكورات العنقودية الذهبية ATCC 25923 و Enterococcus faecalis V583. تشمل الميكروبات المعزولة من أنسجة عظام الفئران SD الميكروبات موجبة الجرام. تكيفت هذه الميكروبات لتزدهر في ظل بيئات مرهقة ومحدودة للمغذيات داخل مصفوفة العظام. تهدف هذه المقالة إلى تزويد القراء بالمعرفة المحددة لتحديد طبيعة وسلوك الميكروبات المعزولة داخل بيئة معملية.
Introduction
يحتوي مضيف الثدييات الذي يمثله جسم الإنسان على عدد كبير من الكائنات الحية الدقيقة. تنتشر هذه الكائنات الحية الدقيقة على نطاق واسع في الفم والجهاز الهضمي والأمعاء ودم المضيف ولها تأثيرات مختلفة على صحة المضيف. يستضيف تجويف الفم عددا كبيرا من الميكروبات التي يمكن أن تعدل قابلية المضيف للعدوى. الميكروبات مثل المكورات العقدية (على سبيل المثال ، S. mitis / oralis و S. pseudopneumoniae و S. infantis) و Prevotella spp. تستعمر تجويف الفم ، وتشكل غشاء حيويا متعدد الأنواع على سطح اللسان يسبب رائحة الفم الكريهة ويعمل كخزان ميكروبي للعدوى الميكروبية. يمكن أن تصيب مسببات الأمراض هذه عظم الفك عن طريق التسلل إلى أربطة اللثة التي تثبت جذر السن في عظمالفك 1. غالبا ما يكون توصيف هذه الميكروبات المعزولة عن الجسم المضيف عملية شاقة ، خاصة عندما تظهر الميكروبات سمات فردية تتطلب علاجا وظروف نمو محددة. تزدهر الميكروبات ، مثل هيليكوباكتر بيلوري المسببة للأمراض ، والمطثية العسيرة ، ونواة الفوسوبكتيريا ، في بيئة الأمعاء القاسية ، مع متطلبات محددة من الأكسجين والمغذيات والنمو ، مما يمثل تحديا في عمليات التوصيف ، لا سيما في التحقيق في إمراضية هذه الميكروبات. لذلك ، هناك حاجة إلى طريقة موحدة لعزل هذه الكائنات الحية الدقيقة والتحقيق فيها للعلماء والممارسين الطبيين لتطوير علاجات طبية جديدة.
يستخدم هذا البروتوكول الميكروبات التي تزدهر في مصفوفة عظام الفئران. تقليديا ، باستثناء النظام العظمي الذي يمثله الفك ، حيث يجعل وجود الأسنان مصفوفة العظام أكثر عرضة للعدوى من العظامالأخرى 1 ، يعتقد عموما أن العظام السليمة للمضيف هي بيئة معقمة. ومع ذلك ، فقد وجدت الدراسات أن الكائنات الحية الدقيقة تدخل الدورة الدموية الجهازية عبر جدار الأمعاء ، مما يؤثر في النهاية على تمعدن العظام2. كدليل على المفهوم ، نستخدم البروتوكول الموصوف لتوصيف الخصائص الكيميائية الحيوية للعزلات الميكروبية من عظم الفخذ والساق للفئران SD السليمة (Corynebacterium stationis و Staphylococcus cohnii subsp. و Enterococcus faecalis). تم اختيار هذه العزلات الميكروبية لأن العظم عبارة عن بيئة مغلقة وناقص الأكسجين ، ويمكن أن يكون توصيف هذه الميكروبات من العظام مهمة صعبة. قامت مقالات مختلفة بتفصيل العمليات المستخدمة في دراسة هذه الميكروبات. ومع ذلك ، هناك القليل من الكائنات الحية التي توفر بروتوكولا كاملا لتحديد الكائنات الحية الدقيقة المعزولة عن المضيف.
عند تهيئة ظروف الاستزراع المناسبة ، يجب فهم متطلبات الأكسجين للميكروب من خلال استخدام وسط الثيوغليكولات السائل (FTM). تشكل الميكروبات ذات متطلبات الأكسجين المختلفة طبقات طبقية في سائل FTM الشفاف3. بناء على ملف تعريف التقسيم الطبقي ، يتم بعد ذلك استخدام متطلبات الأكسجين للميكروب للتحقيق في نمو الخلايا. الميكروبات التي تزدهر على سطح سائل FTM هي هوائية ملزمة ، في حين أن الميكروبات التي تنمو في القاع هي لاهوائية ملزمة. الميكروبات التي تنمو كتعليق في سائل FTM هي إما لاهوائية اختيارية أو متسامحة للهواء. يتم تحديد معدل النمو الميكروبي من خلال مراقبة مرحلة النمو الأسي للخلايا الميكروبية. ثم تتم مقارنة ملف النمو بتكوين الأغشية الحيوية للميكروب. تتكون الأغشية الحيوية إلى حد كبير من أنواع متعددة تؤثر بشكل مباشر وغير مباشر على صحة بعضها البعض. خلال هذه العملية ، تختار التفاعلات المفيدة بين المجتمعات الميكروبية الارتباط ، مما يوفر بنية مكانية تفضل تطور التفاعلات المتبادلة النشطة. على سبيل المثال ، تظهر الزراعة المشتركة ل Paenibacillus amylolyticus و Xanthomonas retroflexus تفاعلات تكافلية اختيارية في بيئة ثابتة ، مما يعزز نمو الأغشية الحيويةالسريع 13. تتكيف الميكروبات مع الأنسجة المضيفة عن طريق تكوين الأغشية الحيوية من أجل التوطين المستدام ، وحماية نفسها من البيئات القاسية والتهرب من جهاز المناعة للمضيف4،5،6،7. عادة ما تكون الأغشية الحيوية عبارة عن هياكل كثيفة ومتعددة الطبقات تساعد الكائنات الحية الدقيقة على مقاومة المحفزات الخارجية دون الحرجة. على سبيل المثال ، بكتريا البرازية في لب الأسنان يعزز مقاومته للمضادات الحيوية عن طريق زيادة تكوين الأغشية الحيوية عند مواجهة تركيزات فرعية من التتراسيكلين والفانكومايسين8.
يمكن الانجذاب الكيميائي الكائنات الحية الدقيقة من التحرك وفقا للتدرجات الكيميائية ، ويتم توزيع مسارات الإشارات على نطاق واسع في مجموعة متنوعة من البكتيريا المسببة للأمراض. تهاجر بعض الكائنات الحية الدقيقة المسببة للأمراض إلى مواقع محددة ، تحت إشراف الإشارات الكيميائية ، لتسبب الأمراض المعدية14. على سبيل المثال ، Xanthomonas spp. التعبير عن 19 مستقبلا كيميائيا و 11 بروتينا من السوط في المضيف ، مما يؤدي إلى الارتباط البكتيري ، وفي النهاية ، التقرح15. هناك أيضا بروتينات محددة في البكتيريا (بروتينات مرتبطة بالبكتين) توجه الهجرة المحددة للبكتيريا إلى العناصر الغذائية ، مما قد يؤدي إلى نمو أفضل16. هذا أمر بالغ الأهمية أيضا للبكتيريا التي قد توجد في البيئات الفقيرة بالمغذيات. غالبا ما تعتمد الخلايا الميكروبية على الحركة الكيميائية لجذب نفسها إلى بيئة نمو مواتية مع التهرب من الخلايا المفترسة والسموم الأخرى التي تضر بصلاحية الخلايا. بناء على مناهج الأجار الناعمة التي تم إنشاؤها مسبقا لتحديد الانجذاب الكيميائي ، قمنا بتطوير طريقة قابلة للانتشار لتوليد تدرج جاذب كيميائي لاختبار الانجذاب الكيميائي الميكروبي.
تصف هذه الورقة طرق تحديد ظروف النمو ، وتكوين الأغشية الحيوية ، والانتواء الكيميائي للبكتيريا ، باستخدام Corynebacterium stationis و Staphylacoccus cohnii و Enterococcus faecalis و Staphylacoccus aureus ATCC 25923 و Enterococcus faecalis V583 كأمثلة (انظر الشكل 1). يستخدم تحسين ظروف النمو الميكروبي FTM لتحديد متطلبات الأكسجين للميكروب ، بينما يستخدم تكوين الأغشية الحيوية الأسطح الزجاجية كدعم صلب ، ويتم تلطيخ كتلة الأغشية الحيوية بالبنفسج الكريستالي. تعتمد الانتوائية الكيميائية للميكروب على سلوكه الكيميائي ، حيث من خلال الطباعة ثلاثية الأبعاد (الشكل التكميلي S1) ، يتم استخدام طريقة موحدة لتوليد خزان كيميائي للجاذب الكيميائي في مصفوفة أجار ناعمة (الشكل التكميلي S2).
Protocol
ملاحظة: راجع جدول المواد للحصول على تفاصيل حول جميع المواد والمعدات المستخدمة في هذا البروتوكول. استخدم تقنيات معقمة لتجنب التلوث.
1. الانتعاش البكتيري للحصول على مستعمرة واحدة
- تحضير ألواح أجار صلبة.
- تحضير وسط مرق رائع (TB) يحتوي على أجار ، مع كل لتر من السائل يحتوي على 11.8 جم من التربتون ، و 23.6 جم من مستخلص الخميرة ، و 9.4 جم من K2HPO4 ، و 2.2 جم من KH2PO4 ، و 15 جم من أجار ، الرقم الهيدروجيني = 7.
- قم بتعقيم المحلول عند 121 درجة مئوية لمدة 20 دقيقة باستخدام غطاء منفذ للهواء أو فيلم مانع للتسرب من الزجاجة مع فتحة تهوية.
- قبل أن يبرد السائل ويتصلب ، اسكب مرق السل الذي يحتوي على أجار في أطباق بتري بلاستيكية مقاس 10 سم بحجم 25 مل لكل طبق.
ملاحظة: يجب سكب المرق في الطبق قبل أن يتجمد في درجات حرارة أقل من 60 درجة مئوية. استخدم تقنيات معقمة لمنع التلوث.
- التلقيح البكتيري للوحة
- أخرج السلالات المستهدفة المخزنة عند -80 درجة مئوية وقم بإذابة الثلج في درجة حرارة الغرفة في خزانة السلامة البيولوجية.
- استخدم ماصة سعة 10 ميكرولتر لامتصاص 10 ميكرولتر من المعلق البكتيري ونشرها على صفيحة السل عن طريق الخطوط.
- أغلق اللوحة لمنع التلوث. ضع الطبق في حاضنة كيميائية حيوية عند 37 درجة مئوية. تحقق من نمو المستعمرة بصريا بعد ~ 24 ساعة. اختر مستعمرات مفردة وقم بتضخيمها بواسطة تفاعل البوليميراز المتسلسل للتأكد من أنها تحتوي على نوع واحد فقط من البكتيريا.
2. ثقافة السائل البكتيري لمرحلة النمو اللوغاريتمي
- تحضير وسط الاستزراع السائل.
- راجع تحضير ألواح الأجار الصلبة في الخطوة 1.1.1. لتحضير وسط سائل السل ، يحتوي 1 لتر منه على 11.8 جم من التربتون ، و 23.6 جم من مستخلص الخميرة ، و 9.4 جم من K2HPO4 ، و 2.2 جم من KH2PO4 ، درجة الحموضة ~ 7.
ملاحظة: لا تضيف أجار. تنمو البكتيريا بشكل أسرع في بيئة المغذيات السائلة. - قم بتعقيم المحلول عند 121 درجة مئوية لمدة 20 دقيقة باستخدام غطاء منفذ للهواء أو فيلم مانع للتسرب من الزجاجة مع فتحة تهوية.
- قم بتخزين وسط الاستزراع السائل عند 4 درجات مئوية.
- راجع تحضير ألواح الأجار الصلبة في الخطوة 1.1.1. لتحضير وسط سائل السل ، يحتوي 1 لتر منه على 11.8 جم من التربتون ، و 23.6 جم من مستخلص الخميرة ، و 9.4 جم من K2HPO4 ، و 2.2 جم من KH2PO4 ، درجة الحموضة ~ 7.
- التلقيح البكتيري وزراعته
- في خزانة السلامة البيولوجية ، اختر مستعمرة واحدة بحلقة تلقيح أو ماصة سعة 10 ميكرولتر وتلقيح البكتيريا في وسط سائل السل المحضر في قارورة إرلينماير.
- أغلق قارورة Erlenmeyer بالشاش وضعها في شاكر (200 دورة في الدقيقة) عند 37 درجة مئوية لزراعة البكتيريا.
ملاحظة: يصبح الوسط السائل عكرا تدريجيا على مدى 5 ساعات. يختلف الوقت المستغرق لتصبح عكرة باختلاف البكتيريا.
3. تجربة FTM وتحديد منحنى النمو
- تحضير وسط الثيوغليكولات السائل (FTM)
- تحضير Thiolglycollate Medium (TM) ، يحتوي كل لتر منه على 15 جم من التربتون ، و 5 جم من مستخلص الخميرة ، و 5 جم من الجلوكوز ، و 0.5 جم من L-cysteine ، و 0.5 جم من ثيوغليكولات الصوديوم ، و 2.5 جم من كلوريد الصوديوم ، و 0.001 جم من ريزازورين ، و 0.75 جم من أجار.
ملاحظة: يمكن بسهولة إعادة تكوين الوسط الصلب المتاح تجاريا بالماء وتعقيمه (الخطوة 3.1.2). - يزن 29.3 جم من ثيوغليكولايت الصلب المتوسط ، يضاف 1 لتر من الماء المقطر ، ويسخن ويحرك حتى يذوب تماما وحتى يتحول المحلول إلى اللون الوردي.
- أضف TM (19 مل) إلى أنبوب اختبار بقابس مانع للتسرب. بعد الختم ، قم بتعقيم المحلول عند 121 درجة مئوية لمدة 20 دقيقة باستخدام غطاء منفذ للهواء أو فيلم مانع للتسرب مع فتحة تهوية.
ملاحظة: بعد التسخين ، يصبح المحلول أصفر فاتح.
- تحضير Thiolglycollate Medium (TM) ، يحتوي كل لتر منه على 15 جم من التربتون ، و 5 جم من مستخلص الخميرة ، و 5 جم من الجلوكوز ، و 0.5 جم من L-cysteine ، و 0.5 جم من ثيوغليكولات الصوديوم ، و 2.5 جم من كلوريد الصوديوم ، و 0.001 جم من ريزازورين ، و 0.75 جم من أجار.
- تلقيح البكتيريا وزراعتها ومراقبتها
- تحضير المعلق البكتيري لينمو إلى OD 0.6-0.8 في وسط السل السائل (انظر الخطوة 2.2.).
- افتح قابس ختم أنبوب الاختبار في ظل ظروف معقمة في خزانة السلامة البيولوجية ، وأضف 1 مل من الثقافة البكتيرية إلى أنبوب الاختبار الذي يحتوي على FTM في أسرع وقت ممكن ، وأغلق أنبوب الاختبار على الفور مرة أخرى.
- هز الأنبوب برفق للتأكد من توزيع البكتيريا بشكل متجانس في السائل وضع أنبوب الاختبار عند 37 درجة مئوية للثقافة الساكنة.
- بعد 48 ساعة من الحضانة ، لاحظ نمو البكتيريا المختلفة في FTM في أنابيب اختبار مختلفة والتقط صورا فوتوغرافية.
- تحديد منحنى النمو في ظل الظروف الهوائية
- قم بإعداد المزرعة البكتيرية الأولية بقيمة OD مناسبة (انظر الخطوة 2.2) ، وقم بزراعة البكتيريا حتى تصل إلى مرحلة النمو اللوغاريتمي.
ملاحظة: استغرق الأمر محطة Corynebacterium ، والمكورات العنقودية cohnii ، والمكورات المعوية البرازية ، والمكورات العنقودية الذهبية ATCC 25923 ، و Enterococcus faecalis V583 المستخدمة في هذا البروتوكول ~ 5 ساعات للوصول إلى مرحلة السجل. - أضف 200 ميكرولتر من المزرعة البكتيرية (من الخطوة 3.3.1) في وسط سائل السل إلى كل بئر من صفيحة 96 بئرا في ثلاث نسخ. استخدم قارئ صفيحة دقيقة لتحديد قيمة OD عند 600 نانومتر ، وقم بتخفيف الثقافات البكتيرية المختلفة بحيث يكون فرق OD بين الآبار المختلفة المحتوية على البكتيريا والوسط السائل السلي (فارغ) بين 0.01 و 0.02.
- خذ طبقا جديدا سعة 96 بئرا ، وأضف وسيط السل ، وانقل المزارع البكتيرية المخففة المختلفة من الخطوة 3.3.2 ، في ثلاث نسخ ، إلى اللوحة ، وضعها على طاولة عمل فائقة النظافة.
- أغلق اللوحة المكونة من 96 بئرا بشريط مانع للتسرب ، وضعها في قارئ الصفيحة الدقيقة ، واضبط البرنامج على النحو التالي:
- اضبط درجة الحرارة على 37 درجة مئوية ± 0.5.
- اضبط الحلقة الحركية على إجمالي 60 دورة ، كل منها لمدة 30 دقيقة.
- اضبط الامتصاص على 600 نانومتر.
- اضبط الاهتزاز على 1,600 ثانية في الدورة.
- قم بتشغيل البرنامج وأوقفه عندما يستقر منحنى النمو.
- قم بإعداد المزرعة البكتيرية الأولية بقيمة OD مناسبة (انظر الخطوة 2.2) ، وقم بزراعة البكتيريا حتى تصل إلى مرحلة النمو اللوغاريتمي.
- تحديد منحنى النمو في ظل الظروف اللاهوائية
- اتبع الخطوة 3.3. لكن احتفظ باللوحة المكونة من 96 بئرا مع تعليق السل المتوسط والبكتيري في حاضنة لاهوائية قبل إغلاق اللوحة بشريط مانع للتسرب. قم بضخ وملء الصندوق اللاهوائي بالنيتروجين لتقليل تركيز الأكسجين إلى <3٪. أغلق اللوحة المكونة من 96 بئرا بشريط مانع للتسرب واتركها في الصندوق اللاهوائي.
4. اختبار قدرة تكوين الأغشية الحيوية
- زراعة البكتيريا إلى مرحلة النمو اللوغاريتمي في وسط سائل.
- يرجى الرجوع إلى القسم 2 لتلقيح البكتيريا الموجودة في وسط السل السائل.
- قم بزراعة البكتيريا طوال الليل في شاكر عند 37 درجة مئوية ، مع التأكد من أن OD600 لوسط الثقافة البكتيرية يتراوح بين 0.6 و 0.8.
- قسم الثقافة البكتيرية وزراعتها في ظل ظروف مختلفة.
- عندما يكون OD600 للثقافة البكتيرية بين 0.6 و 0.8 ، أضف 10 مل من هذا المعلق البكتيري إلى أنبوب اختبار زجاجي.
- قسم كل مزرعة بكتيرية إلى مجموعتين: الظروف الهوائية واللاهوائية ، وقم بإجراء جميع العمليات ثلاث نسخ.
- بالنسبة للمجموعة الهوائية ، لف أنبوب الاختبار الذي يحتوي على المعلق البكتيري بورق قصدير واحتضنه في حمام مائي 37 درجة مئوية عند درجة حرارة ثابتة.
- بالنسبة للمجموعة اللاهوائية ، لف الأنبوب الذي يحتوي على المعلق البكتيري بورق قصدير وانقله إلى حاضنة لاهوائي. قم بإزالة ورق القصدير في الحاضنة اللاهوائية وتقليل تركيز الأكسجين في الحاضنة إلى <3٪ عن طريق ضخه وتعبئته بالنيتروجين. أغلق أنبوب الاختبار بسدادة زجاجية بلورية ، وأخرجه بعد الإغلاق ، واحتضنه في حمام مائي عند 37 درجة مئوية.
- كل 6 ساعات ، خذ ثلاثة أنابيب اختبار من كل من المجموعتين (الهوائية / اللاهوائية) لمراقبة نمو الأغشية الحيوية في الأسفل ، والبقعة بعد الخطوة 4.3.
- تخلص من المعلق البكتيري وجفف الأغشية الحيوية.
- أخرج أنابيب الاختبار في نقاط زمنية مختلفة واستنشق بعناية الطبقة العليا من التعليق البكتيري. لاحظ الأغشية الحيوية البيضاء الملتصقة بالجزء السفلي من أنبوب الاختبار.
ملاحظة: احرص على عدم إزعاج الأغشية الحيوية عند شفط المعلق البكتيري. - أضف بعناية 2 مل من المحلول الملحي المخزن بالفوسفات (PBS) على طول جدار أنبوب الاختبار ، ورجها برفق لغسل البكتيريا العوالق الممتصة في الأغشية الحيوية ، واستنشق بعناية المخزن المؤقت PBS.
- ضع أنبوب الاختبار مع الأغشية الحيوية الممتزة في الأسفل في الفرن حتى يجف لمدة 30 دقيقة.
- أخرج أنابيب الاختبار في نقاط زمنية مختلفة واستنشق بعناية الطبقة العليا من التعليق البكتيري. لاحظ الأغشية الحيوية البيضاء الملتصقة بالجزء السفلي من أنبوب الاختبار.
- تلطيخ
- أخرج أنابيب الاختبار ، وأضف 2 مل من محلول تلطيخ البنفسجي البلوري بنسبة 0.1٪ إلى كل أنبوب اختبار ، وقم بتلطيخ الأغشية الحيوية لمدة 30 دقيقة في درجة حرارة الغرفة.
- استخدم ماصة لشفط محلول صبغة البنفسج الكريستالي بعناية. أضف الماء المقطر بعناية على طول جدار أنبوب الاختبار لغسل محلول صبغة البنفسج الكريستالي المتبقي ، وكرر 3x-5x حتى يصبح الماء المقطر المضاف عديم اللون تقريبا. راقب الأغشية الحيوية الأرجواني في الجزء السفلي من أنبوب الاختبار.
- جفف أنبوب الاختبار مرة أخرى.
- قم بإذابة الأغشية الحيوية بنسبة 95٪ من الإيثانول وقياس OD600 من محلول الأغشية الحيوية.
- أخرج أنبوب الاختبار المجفف ، وأضف 10 مل من الإيثانول بنسبة 95٪ إلى كل أنبوب اختبار ، ورجه جيدا للتأكد من ذوبان البنفسج البلوري بالكامل في الإيثانول.
- بحجم 200 ميكرولتر لكل بئر ، أضف البنفسج البلوري في الإيثانول إلى صفيحة مكونة من 96 بئرا ، وقم بقياس امتصاصه بطول موجة 600 نانومتر.
ملاحظة: وفقا لقانون Beer-Lambرت ، يرتبط الامتصاص خطيا بتركيز المحلول ، وبالتالي فإن قيمة OD600 يمكن أن تعكس تركيز البنفسج البلوري ، مما يعكس كمية الأغشية الحيوية في المعلق البكتيري في أوقات مختلفة.
5. اختبار الانجذاب الكيميائي البكتيري
- تحضير لوحات أجار التغذية التفاضلية.
- ارجع إلى الخطوة 1 لتحضير نصف جرعة من وسط MH يحتوي على 0.5٪ أجار ، يحتوي كل لتر منه على 11.8 جم من التربتون ، و 23.6 جم من مستخلص الخميرة ، و 9.4 جم من K2HPO4 ، و 2.2 جم من KH2PO4 ، و 5 جم من أجار ، درجة الحموضة ~ 7.
- ارجع إلى الخطوة 1 لتحضير 5x TB medium يحتوي على 0.5٪ أجار ، يحتوي كل لتر منه على 59 جم من التربتون ، و 118 جم من مستخلص الخميرة ، و 47 جم من K2HPO4 ، و 11 جم من KH2PO4 ، و 5 جم من أجار ، درجة الحموضة ~ 7.
- قم بتعقيم المحلول عند 121 درجة مئوية لمدة 20 دقيقة باستخدام غطاء منفذ للهواء أو فيلم مانع للتسرب من الزجاجة مع فتحة تهوية.
- قبل أن يتم تبريد السائل وتصميده ، اسكب 25 مل من مرق MH نصف جرعة (يحتوي على 0.5٪ أجار) لكل طبق ، وقم بتغطية اللوحة بغطاء مطبوع ثلاثي الأبعاد ، وضعها في خزانة السلامة البيولوجية. بعد التبريد ، قم بإزالة الغطاء لمراقبة البئر الأسطواني (قطر 1.4 سم) في الوسط شبه الصلب.
ملاحظة: لا يمكن تعقيم الغطاء المطبوع ثلاثي الأبعاد بمادة الراتنج باستخدام بخار عالي الحرارة. لقتل البكتيريا السطحية ، يمكن رشها بنسبة 95٪ من الإيثانول ثم تشعيعها بمصباح للأشعة فوق البنفسجية لمدة 30 دقيقة في خزانة السلامة البيولوجية. عند إزالة الغطاء ، استخدم القوة في الاتجاه الرأسي وارفعه بعناية لمنع تلف الأجار شبه الصلب. - قبل أن يتجمد مرق 5x TB (الذي يحتوي على 0.5٪ أجار) ، استخدم ماصة لإضافة مرق 5x TB إلى البئر في اللوحة شبه الصلبة حتى يتدفق المرق مع سطح الوسط.
- قم بتبريد اللوحة في خزانة السلامة البيولوجية للحصول على صفيحة أجار شبه صلبة تحتوي على أجسام غذائية. احرص على تجنب تلوث الألواح بالكائنات الحية الدقيقة البيئية.
ملاحظة: لا يزال الوسط شبه الصلب سائلا إلى حد ما ، وبالتالي ، يجب تبريده بالكامل قبل تخزينه رأسا على عقب.
- التلقيح البكتيري وزراعته وتصويره
- ضع لوحة الأجار مع وسط الثقافة شبه الصلبة في خزانة أمان بيولوجية وقم بتبريدها لمدة ~ 30 دقيقة تحت الأشعة فوق البنفسجية لمنع التلوث البكتيري.
- استخدم ماصة سعة 10 ميكرولتر لاستيعاب ما يصل إلى 4 ميكرولتر من المعلق البكتيري المزروع إلى OD من ~0.6-0.8، وأدخل طرف الماصة في وسط أطباق بتري البلاستيكية، وقم بإخراج المعلق البكتيري.
- انتظر حتى يتم امتصاص المعلق البكتيري في الوسط لمدة 1 دقيقة. عندما يتم امتصاص المعلق البكتيري بالكامل ، قسم اللوحة إلى مجموعتين (هوائية / لاهوائية) في ثلاث نسخ.
- أغلق المجموعة الهوائية بشريط مانع للتسرب وضع تلك الألواح رأسا على عقب في حاضنة كيميائية حيوية بدرجة حرارة 37 درجة مئوية للثقافة الساكنة. أغلق المجموعة اللاهوائية في صندوق لاهوائي كما هو موضح في الخطوة 4.2 ، مع قلب الألواح عند 37 درجة مئوية للنمو.
- تحقق من انتشار البكتيريا وهجرتها كل 12 ساعة (عند 0 ساعة و 12 ساعة و 24 ساعة و 36 ساعة و 48 ساعة) ، واستخدم نظام التصوير لالتقاط صور للوحة.
- استخدم برنامج ImageJ لحساب مسافات ترحيل البكتيريا.
- استيراد ملف الصورة الذي تم الحصول عليه باستخدام نظام التصوير.
- اضبط شريط المقياس وقم بتطبيقه على جميع الصور.
- عند التقاط الصور ، أضف مسطرة ، وأنشئ مقطع خطي ، وحدد مقطعا مستقيما (على سبيل المثال ، 1 سم ، ثم اضبط طول هذا المقطع الخطي على 1 سم) ، وحدد طول اللوحة.
- افتح نافذة Set Scale . انقر فوق تحليل | تعيين المقياس.
- اكتب الطول الفعلي بالمسافة المعروفة ووحدة الطول.
- تحقق من العالمية.
- أدخل عنوان مجلد الصورة الأصلية وعنوان ملف الإخراج.
- استخدم أداة الخط المستقيم لتحديد المجتمعات واحدة تلو الأخرى وضبط التسامح حتى يتناسب خط الأداة المستقيم مع حدود المستعمرة البكتيرية الممتدة إلى كلا الجانبين.
- قم بقياس مسافة هجرة المستعمرة من المركز إلى كلا الطرفين بشكل منفصل واستخلاص طول الخط المستقيم بالنقر فوق تحليل | قياس.
- كرر الخطوات 5.3.3-5.3.4 حتى يتم قياس جميع المجتمعات واحفظ النتائج في ملف .csv لمزيد من التحليل.
النتائج
يصف هذا العمل الأساليب المتبعة لتوصيف الميكروبات المعزولة من الميكروبيوم المضيف (الشكل 1). كدليل على المفهوم ، تم عزل ثلاثة ميكروبات من مضيف الفئران SD (C. stationis و S. cohnii و E. faecalis) ، وتم اختبار كائنين دقيقين مكتسبين تجاريا (S. aureus ATCC 25923 و E. faecalis V583) باستخدام هذا البروتوكول. لتحديد متطلبات الأكسجين للميكروبات الفردية باستخدام FTM ، أضفنا كائنين سيطريين ، لاهوائي إلزامي (Fusobacterium nucleatum ATCC 25586) ولاهوائي اختياري (Pseudomonas aeruginosa PAO1). أظهرت النتائج أن الميكروبات الخمسة التي تم اختبارها كانت لاهوائية اختيارية (الشكل 2 أ) ، بما يتفق مع الملامح التي تم الإبلاغ عنها سابقا لهذه الميكروبات11. لتوضيح احتياجاتها من الأكسجين ، تمت زراعة الميكروبات في كل من الظروف الهوائية واللاهوائية. أظهرت جميع الميكروبات المختبرة منحنى نمو سيني في كل من الظروف الهوائية واللاهوائية. ومع ذلك ، أظهرت الكثافة الميكروبية ، كما هو موضح في OD600nm ، أن جميع الميكروبات الخمسة لديها تفضيل أعلى للبيئات الغنية بالأكسجين (الشكل 2 ب ، ج). تتوافق هذه الملاحظات مع القدرات الميكروبية على التسلل وإصابة عظام الفئران ، والتي تعتبر عموما ناقصة التأكسج.
تم العثور على العزلات البكتيرية الخمس لتشكل أغشية حيوية بشكل طبيعي ، حيث كانت كتلة الأغشية الحيوية المنتجة أعلى في ظل الظروف اللاهوائية. من خلال مقارنة منحنى النمو ، تم العثور على الأغشية الحيوية للإشريكية البرازية و S. aureus ATCC 25923 تشكلت بنشاط خلال مرحلة النمو الثابت في كل من البيئات الهوائية واللاهوائية (الشكل 3). تشير هذه الملاحظة إلى أن تكوين الأغشية الحيوية يعتمد على حالة نمو الخلايا ، وربما يتم تنظيمها بواسطة جزيئات الإشارات داخل الخلايا التي تؤدي إلى تكوين الأغشيةالحيوية 11. يتوافق هذا الاعتماد على تكوين الأغشية الحيوية على ظروف النمو مع ظروف المغذيات والنمو التي تقدمها بيئة مصفوفة العظام المضيفة التي تفتقر إلى الأكسجين والمواد المغذية.
غالبا ما ترتبط الدراسات التي أجريت على التسبب في الميكروبات بقدرة الميكروب على الهجرة إلى المواقع التي تعتبر مواتية للنمو. هناك العديد من الدراسات حول الانجذاب الكيميائي الميكروبي ، ولكن لا يوجد نهج واحد موحد لدراسته. بالإضافة إلى ذلك ، اعتبر استخدام المواد الكيميائية غير القابلة للانتشار عاملا مقيدا في دراسة هذه الظاهرة. هنا ، قمنا بتطوير غطاء راتينج يتم إنتاجه عبر الطباعة ثلاثية الأبعاد التي توحد المسافة بين الخزان الكيميائي ونقطة التلقيح (الشكل التكميلي S1 والشكل التكميلي S2). درسنا هجرة الميكروبات إلى بيئة غنية بالمغذيات ، حيث تم استخدام 5x TB كمنشط كيميائي. تمت مراقبة الميكروبات لمدة 48 ساعة في ظل الظروف الهوائية واللاهوائية ، حيث أظهرت الميكروبات الخمسة درجات مختلفة من هجرة الانتحاء (الشكل 4 أ).
تم استخدام ImageJ لقياس مسافة هجرة البكتيريا (الشكل 4 ب) ؛ يبدو أن الهجرة نحو الخزان كانت أسرع من الهجرة في الاتجاه المعاكس. تظهر نسبة مسافة الهجرة نحو الخزان إلى تلك الموجودة في الاتجاه المعاكس التوسع السريع للمستعمرة الميكروبية بسبب الانجذاب الكيميائي الميكروبي (الشكل 5 ب). في هذه الدراسة ، هاجرت بكتيريا مثل S. aureus ATCC 25923 أسرع من الميكروبات الأخرى مثل C. stationis. ومن المثير للاهتمام ، أن ملف تعريف الهجرة للثقافات الكيميائية في ظل الظروف الهوائية واللاهوائية أظهر أن بعض البكتيريا ، مثل E. faecalis ، أظهرت تباينا في أنماط الهجرة في ظل الظروف الهوائية واللاهوائية ، حيث لوحظ توسع سريع في ظل الظروف اللاهوائية بمرور الوقت. بشكل محير ، السلالة المختبرية E. faecalis V583 فضلت بيئة هوائية للانجذاب الكيميائي. وبالتالي ، يشير هذا إلى أن بكتريا البرازية المعزولة من مصادر مختلفة لها متطلبات نمو مختلفة تتكيف مع بيئة النمو.

الشكل 1: رسم تخطيطي لعملية التشغيل. (أ) يتم تلقيح البكتيريا على ألواح ثم في وسط سائل وتنمو إلى مرحلة النمو اللوغاريتمي. (ب) تحديد قدرة البكتيريا على تكوين الأغشية الحيوية في ظل ظروف مختلفة (الهوائية / اللاهوائية). تم اختيار ثلاث عينات لكل نقطة زمنية (6 ساعات) وتكررت بالتوازي. (ج) بروتوكول تجربة الانتحاء الكيميائي للبكتيريا في ظل ظروف مختلفة (الهوائية / اللاهوائية). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: ظروف النمو الميكروبي. (أ) ملف نمو البكتيريا المستزرعة في وسط الثيوغليكولات السائل (من اليسار إلى اليمين هي: Fusobacterium nucleatum ATCC 25586 ، II: Corynebacterium stationis ، III: المكورات العنقودية cohnii ، الرابع: المكورات المعوية البرازية ، V: المكورات العنقودية الذهبية ATCC 25923 ، VI: المكورات المعوية البرازية V583 ، والسابع: Pseudomonas aeruginosa PAO1). (ب) منحنى نمو الكائنات الحية الدقيقة المعزولة عن المضيف في ظل الظروف الهوائية. (ج) منحنى نمو الكائنات الحية الدقيقة المعزولة عن المضيف في ظل ظروف لاهوائية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
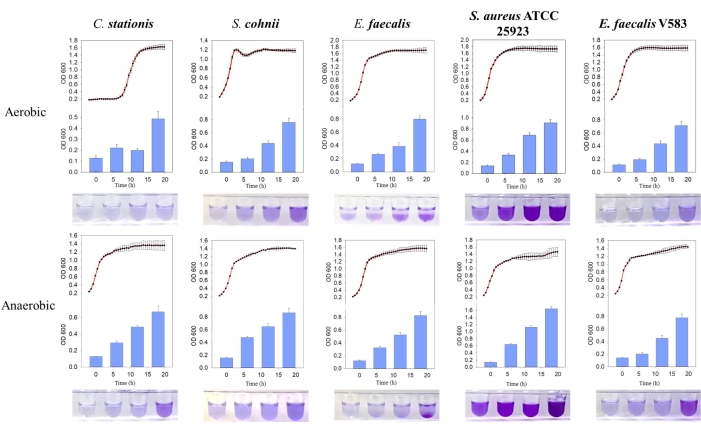
الشكل 3: مقارنة بين منحنيات النمو وتكوين الأغشية الحيوية للبكتيريا المختلفة في ظل ظروف مختلفة. من اليسار إلى اليمين محطات Corynebacterium ، المكورات العنقودية cohnii ، المكورات المعوية البرازية ، المكورات العنقودية الذهبية ATCC 25923 ، والمكورات المعوية البرازية V583. المنحنى الأحمر هو منحنى النمو ، والرسم البياني الأزرق هو كمية الأغشية الحيوية المنتجة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
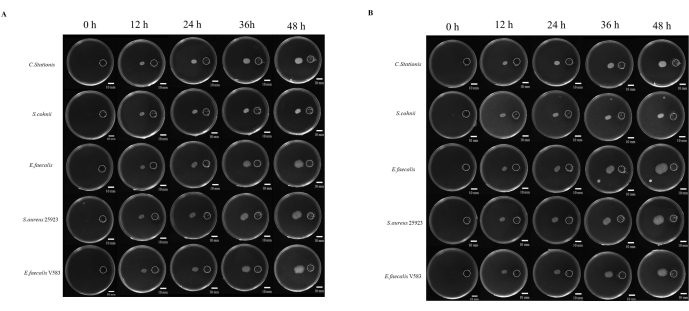
الشكل 4: النمو الميكروبي نحو التخثث. (أ) الظروف الهوائية ، (ب) الظروف اللاهوائية. خمسة أنواع من البكتيريا (من أعلى إلى أسفل هي Corynebacterium stationis و Staphylacoccus cohnii و Enterococcus faecalis و Staphylacoccus aureus ATCC 25923 و Enterococcus faecalis V583) تميل إلى النمو نحو التخثث على صفيحة المغذيات التفاضلية. أشرطة المقياس = 10 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: الانجذاب الكيميائي للميكروبات في ظل ظروف مختلفة (الهوائية / اللاهوائية). (أ) نتائج هجرة الانتحاء الكيميائي لخمس بكتيريا على صفيحة تحتوي على أجار غني بالمغذيات؛ تمثل المجموعة اليسرى الظروف الهوائية والمجموعة اليمنى الظروف اللاهوائية. تكررت كل تجربة ثلاث نسخ بالتوازي. (ب) تحليل بيانات الانتحاء الكيميائي. يمثل الجزء العلوي الظروف الهوائية والجزء السفلي الظروف اللاهوائية. من اليسار إلى اليمين محطات Corynebacterium ، المكورات العنقودية cohnii ، المكورات المعوية البرازية ، المكورات العنقودية الذهبية ATCC 25923 ، والمكورات المعوية البرازية V583. الأعمدة الحمراء والزرقاء هي مسافات الهجرة من الجسم الغذائي للبكتيريا التي تهاجر نحو الجسم المغذي وبعيدا عنه. الخط هو الفرق بين القيمتين (أحمر - أزرق). أشرطة المقياس = 10 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
الشكل التكميلي S1: استخدام أغطية مطبوعة ثلاثية الأبعاد لعمل ألواح أجار ذات اختلاف المغذيات. (أ) استخدم برنامجا لإعداد عروض قوالب الطباعة ثلاثية الأبعاد. (ب) قالب غطاء مسطح مطبوع ب 8,000 راتنج. (ج) استخدم الطريقة المذكورة أعلاه للحصول على ألواح أجار فرق المغذيات. (د) إنتاج ألواح أجار الفرق في المغذيات. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S2: بناء ألواح أجار فرق المغذيات وقياس مسافة الهجرة البكتيرية باستخدام ImageJ. (أ) يستخدم بناء ألواح أجار الفرق بين المغذيات غطاءا مطبوعا ثلاثي الأبعاد (يحتوي على نتوء أسطواني) لتغطية اللوحة. بعد تبريد الأجار ، يتم تشكيل بئر أسطواني (الدائرة الحمراء) ، مملوء ب 5x TB agar. ثم يتم تبريده للحصول على ألواح أجار باختلاف المغذيات. (ب) استخدم ImageJ لقياس مسافة هجرة البكتيريا في اتجاهات مختلفة. تعيين شريط المقياس (تحليل | تعيين المقياس) وتصدير مسافة الترحيل باستخدام Straight (تحليل | قياس). الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S3: أنماط نمو خمس بكتيريا على أجار متوسط متوسط M9 متوسط 5x. المجموعة اليسرى للظروف الهوائية ، والمجموعة اليمنى للظروف اللاهوائية. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S4: تجارب التحكم على منحنيات نمو Fusobacterium nucleatum ATCC 25586 والانجذاب الكيميائي للبكتيريا اللاهوائية. (أ) تحديد منحنيات نمو F. nucleatum ATCC 25586 في ظل الظروف الهوائية واللاهوائية. (ب) تجارب الانجذاب الكيميائي ل F. nucleatum ATCC 25586 على صفائح أجار MH-5x TB نصف جرعة في ظل ظروف أكسجين مختلفة. التوسيع الجزئي: نمو F. nucleatum ATCC 25586 على اللوحة في ظل ظروف لاهوائية بعد 48 ساعة (تكبير جزئي). الرجاء النقر هنا لتنزيل هذا الملف.
| مركب | التركيز (جم / لتر) |
| نا2HPO4 | 6.78 |
| KH2PO4 | 3 |
| كلوريد الصوديوم | 0.5 |
| NH4Cl | 1 |
| MgSO4.7H 2O | 0.493 |
| كلوريدالهواء 2 | 0.011 |
| الجلوكوز | 4 |
الجدول 1: مكونات ومحتوى الوسائط الدنيا M9.
Discussion
قمنا بعزل وتحديد خمسة أنواع من البكتيريا بطرق متسلسلة. يحتوي نمو البكتيريا على الحد الأدنى من متطلبات المغذيات: الحد الأدنى من الوسط - وهو وسط يحتوي فقط على أملاح غير عضوية ، ومصدر كربون ، ومياه. على الرغم من العثور على البكتيريا في المجموعة التجريبية على صفائح صلبة MH ، إلا أننا استخدمنا نصف جرعة من وسط MH للتحقق من الانجذاب الكيميائي للبكتيريا وحققنا نتائج جيدة. ومع ذلك ، أجرينا أيضا تجارب تحكم باستخدام الحد الأدنى من الوسط. تم استخدام الوسط الأساسي M9 في التجربة (انظر الجدول 1 لمعرفة تكوينه ومحتواه) ، ولا يزال أجار 5x TB يستخدم لكتلة أجار المغذيات. تظهر النتائج التجريبية في الشكل التكميلي S3. على الرغم من أن هذه البكتيريا (باستثناء E. faecalis) تنمو ببطء وتتحرك ببطء في وسط M9 ، إلا أن هناك اتجاها مشابها بشكل عام (نحو النمو على أجار المغذيات) ، كما لوحظ في هذه التجارب. ومع ذلك ، فإن E. faecalis V583 لم ينمو على متوسط M9 الحد الأدنى ، ربما بسبب نقص المكونات المطلوبة ل E. faecalis للنمو في وسط M9. لذلك ، نوصي باستخدام نصف جرعة وسيط MH كركيزة تعاني من نقص المغذيات لمحاكاة نمو البكتيريا وهجرتها في ظل ظروف نقص المغذيات. يسهل هذا أيضا استخدام برنامج ImageJ لقياس المسافة التي تميل البكتيريا إلى الهجرة.
تعرف الأغشية الحيوية عموما بأنها مجتمعات ميكروبية مرتبطة بالسطح وهي استراتيجية مهمة للبقاء الميكروبي. يمكن العثور على الكائنات الحية مثل Pseudomonas aeruginosa و Haemophilus influenzae و Streptococcus pneumoniae و Staphylococcus aureus في المضيفين الذين لا تظهر عليهم أعراض ، وغالبا ما يشار إلى اكتشاف الكائنات الحية الدقيقة الملتصقة في الجسم الحي باسم الاستعمار وليس العدوى. مشكلة مهمة للغاية هي عدم وجود نموذج مثالي لاستعمار12. تظهر الميكروبات ارتباطات أولية بالأسطح المشحونة قبل تكوين الأغشية الحيوية ، حيث تعتبر مواد مثل الزجاج والبولي فينيل كلوريد (PVC) مناسبة للدراسات المتعلقة بالأغشية الحيوية. تم استخدام الدراسات التي استخدمت ألواح PVC 96 جيدا لدراسة الأغشية الحيوية الميكروبية9 ، حيث قد تؤدي الأغشية الحيوية أحادية أو متعددة الأنواع إلى أغشية حيوية فضفاضة أو كثيفة10. على هذا النحو ، يعتبر استخدام لوحة PVC ذات 96 جيدا غير مناسب للأغشية الحيوية المعبأة بشكل فضفاض حيث يمكن بسهولة غسل مصفوفة الأغشية الحيوية أثناء عملية تلطيخ الأغشية الحيوية. لذلك ، اعتمدنا على أنابيب اختبار زجاجية لدراسة تكوين الأغشية الحيوية الميكروبية (الشكل 3).
أحد القيود الرئيسية لهذه الطريقة هو أنها لا تعمل مع الكائنات الحية الدقيقة التي تنمو في ظل ظروف معينة ، ولا يمكن لجميع البكتيريا أن تهاجر. علاوة على ذلك ، على الرغم من أن الأغشية الحيوية هي وسيلة فعالة لمساعدة الكائنات الحية الدقيقة على الدفاع ضد البيئات الخارجية المعاكسة ، إلا أن الكائنات الحية الدقيقة المضيفة ليست كلها قادرة على إنتاج الأغشية الحيوية. على سبيل المثال ، F. nucleatum ATCC 25586 ، المذكور سابقا ، والذي يرتبط بالتكافل الفموي أو الأمعاء البشري المرتبط بتطور سرطان القولون17 ، ينمو فقط على وجه التحديد في البيئات اللاهوائية ولكنه لا ينتج أغشية حيوية. استخدمناه في تجارب FTM للتحقق من فعالية وسيط FT. ثبت أن وسط FT فعال في تزويد البكتيريا بتركيزات متدرجة من الأكسجين.
للمقارنة ، اختبرنا منحنى النمو والانتحاء الكيميائي للبكتيريا اللاهوائية F. nucleatum ATCC 25586 (الشكل التكميلي S4). في تجارب منحنى النمو (الشكل التكميلي S4A) ، F. nucleatum ATCC 25586 لا يمكن أن ينمو في ظل الظروف الهوائية وأظهر تراقا بكتيريا في قاع الآبار في ظل الظروف اللاهوائية. في تجارب الانجذاب الكيميائي (الشكل التكميلي S4B) أيضا ، F. nucleatum ATCC 25586 لم ينمو في ظل الظروف الهوائية ، وتم العثور على عدد قليل من البكتيريا بعد التلقيح في الموقع في ظل ظروف لاهوائية لمدة 48 ساعة. وبالمثل ، نظرا لأن بعض البكتيريا لا تستطيع البحث بنشاط عن ظروف نمو مناسبة عن طريق الهجرة ، فإنها تنتظر ظروف نمو مناسبة من خلال الدخول في حالة نائمة طويلةالأمد 18. وتجدر الإشارة إلى أن زراعة البكتيريا اللاهوائية الصارمة تتطلب وسيطا خاصا ، مثل وسط تخمير ET (يجب استكمال الصفائح شبه الصلبة بنسبة 0.5٪ أجار) ، والتي تختلف أيضا عن العزل التقليدي وتحديد الهوية. هذه الطريقة المقترحة هي طريقة عامة قابلة للتطبيق لتوصيف معظم الكائنات الحية الدقيقة المضيفة ، مع عرض هذه التقنية لخمسة ميكروبات ، بما في ذلك ثلاثة ميكروبات معزولة من عظام الفئران وميكروبين من الدرجة المختبرية. سيساعد هذا البروتوكول في التعرف الصحيح على عزلات الجراثيم في الدراسات المستقبلية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم تطوير هذه التقنية من خلال الأموال من مؤسسة العلوم الطبيعية الوطنية الصينية لصندوق أبحاث العلماء الشباب الدوليين (22050410270) ، وصندوق شنتشن الخاص للابتكار وريادة الأعمال للمواهب عالية المستوى في الخارج (KQTD20170810111314625) ، وبرنامج فريق أبحاث قوانغدونغ المبتكر وريادة الأعمال (2019ZT08Y191). نود أن نعرب عن خالص امتناننا للآنسة تشين شيني لمساعدتها في تدقيق المستند وإدارة المختبر.
Materials
| Name | Company | Catalog Number | Comments |
| Chemical/Solution | |||
| 1% crystal violet dye solution | Solarbio | G1062 | 100 mL |
| Agar | Sigma-Aldrich | V900500 | Used to obtain semi-solid plates, 20 g |
| Centrifuge tube | Corning | 430790 | 15 mL |
| Fluid thioglycollate medium | Kinghunt | K0001 | 29.3 g |
| Mueller Hinton II Broth medium | Solarbio | NO.11865 | 100 g |
| Petri dishes | Bkman | B-SLPYM90-15 | Plastic Petri dishes, circular, 90 mm x 15 mm |
| Potassium Chloride | VETEC | WXBC4493V | 0.2 g |
| Potassium Dihydrogen Phosphate | aladdin | 04-11-7758 | 0.24 g |
| Sodium chloride | Macklin | S805275 | 8.0 g |
| Sodium phosphate dibasic | aladdin | 7558-79-4 | 1.44 g |
| Terrific Broth medium | Solarbio | LA2520 | 200 g |
| Kits/ Equipment | |||
| Anaerobic incubator | Longyue | ||
| Biochemical incubator | Blue pard | LRH-70 | |
| Microplate reader | Spark | ||
| Tanon 5200multi imaging system | Tanon | 5200CE | |
| Thermostatic water bath | Jinghong | DK-S28 |
References
- Bernardi, S., et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients' tongue biofilm. MicrobiologyOpen. 9 (2), 958 (2020).
- Tellez, G., Latorre, J. D., Kuttappan, V. A., et al. Rye affects bacterial translocation, intestinal viscosity, microbiota composition and bone mineralization in Turkey poults. PLOS One. 10, (2015).
- Brewer, J. H. Clear liquid mediums for the "aerobic" cultivation of anaerobes. Journal of the American Medical Association. 115 (8), 598 (1940).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Liu, C., et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review. Frontiers in Microbiology. 11, 802 (2020).
- Kumar, A., et al. Biofilms: survival and defense strategy for pathogens. International Journal of Medical Microbiology. , (2017).
- Penesyan, A., et al. Secondary effects of antibiotics on microbial biofilms. Frontiers in Microbiology. 11, 2109 (2020).
- Bernardi, S., et al. Subinhibitory antibiotic concentrations enhance biofilm formation of clinical Enterococcus faecalis isolates. Antibiotics. 10 (7), 874 (2021).
- Tsukatani, T., Fumihiko, S., Rieko, K. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids. World Journal of Microbiology and Biotechnology. 36 (12), 1-9 (2020).
- Hartmann, R., et al. Emergence of three-dimensional order and structure in growing biofilms. Nature Physics. 15, 251-256 (2019).
- Liu, Z., et al. Advances in bacterial biofilm management for maintaining microbiome homeostasis. Biotechnology Journal. 15 (10), 1900320 (2020).
- Hall-Stoodley, L., Stoodley, P. Evolving concepts in biofilm infections. Cellular Microbiology. 11 (7), 1034-1043 (2009).
- Røder, H. L., et al. Enhanced bacterial mutualism through an evolved biofilm phenotype. The ISME Journal. 12 (11), 2608-2618 (2018).
- Matilla, M. A., Tino, K. The effect of bacterial chemotaxis on host infection and pathogenicity. FEMS Microbiology Reviews. 42 (1), 052 (2018).
- Moreira, L. M., et al. Chemotactic signal transduction and phosphate metabolism as adaptive strategies during citrus canker induction by Xanthomonas citri. Functional & Integrative Genomics. 15 (2), 197-210 (2015).
- Konishi, H., et al. Bacterial chemotaxis towards polysaccharide pectin by pectin-binding protein. Scientific Reports. 10 (1), 1-12 (2020).
- Kostic, A. D., et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host & Microbe. 14 (2), 207-215 (2013).
- Kochan, T. J., et al. Updates to Clostridium difficile spore germination. Journal of Bacteriology. 200 (16), 00218 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved