Method Article
Измерение миграции и образования биопленки различных бактерий
В этой статье
Резюме
В этой статье мы представляем практический метод выделения и идентификации микроорганизмов в организме хозяина. Таким образом, четко описываются физико-химические свойства микроорганизмов и возможные способы жизни в организме хозяина.
Аннотация
Поскольку микробы, которые процветают в организме хозяина, в первую очередь обладают адаптационными способностями, облегчающими их выживание, методы классификации и идентификации их природы были бы полезны для облегчения их характеристики. В настоящее время большинство исследований сосредоточены только на одном конкретном методе характеристики; Тем не менее, выделение и идентификация микроорганизмов от хозяина является непрерывным процессом и обычно требует нескольких комбинаторных методов характеризации. В данной работе мы описываем методы определения способности микробных биопленкообразующих бактерий, состояния микробного дыхания и их хемотаксисного поведения. Методы используются для идентификации пяти микробов, три из которых были выделены из костной ткани крыс Sprague-Dawley (SD) (Corynebacterium stationis, Staphylococcus cohnii subsp. urealyticus и Enterococcus faecalis) и два из Американской коллекции типовых культур (ATCC) - Staphylococcus aureus ATCC 25923 и Enterococcus faecalis Версия V583. К микробам, выделенным из костной ткани крысы SD, относятся грамположительные микробы. Эти микробы приспособились к процветанию в стрессовых и ограничивающих питательные вещества средах внутри костного матрикса. Цель данной статьи – познакомить читателей со специфическими ноу-хау по определению природы и поведения выделенных микробов в лабораторных условиях.
Введение
Млекопитающий хозяин, представленный человеческим телом, содержит большое количество микроорганизмов. Эти микроорганизмы широко распространены во рту, пищеварительном тракте, кишечнике и крови хозяина и по-разному влияют на здоровье хозяина. В полости рта обитает множество микробов, которые могут модулировать восприимчивость хозяина к инфекциям. Микробы, такие как стрептококки (например, S. mitis/oralis, S. pseudopneumoniae и S. infantis) и Prevotella spp. , колонизируют ротовую полость, образуя многовидовую биопленку на поверхности языка, вызывающую неприятный запах изо рта и функционирующую как микробный резервуар для микробной инфекции. Эти патогены могут инфицировать челюстную кость, проникая в периодонтальные связки, которые удерживают корень зуба в челюстной кости1. Определение характеристик этих микробов, выделенных из организма хозяина, часто является утомительным процессом, особенно когда микробы проявляют индивидуальные черты, требующие особого лечения и условий роста. Микробы, такие как патогенные Helicobacter pylori, Clostridium difficile и Fusobacterium nucleatum, процветают в суровых условиях кишечника со специфическими потребностями в кислороде, питательных веществах и росте, что представляет собой проблему в процессах характеристики, особенно в исследовании патогенности этих микробов. Таким образом, ученым и практикующим врачам необходим стандартизированный метод выделения и исследования этих микроорганизмов для разработки новых методов лечения.
В этом протоколе используются микробы, которые процветают в костном матриксе крыс. Традиционно, за исключением костной системы, представленной челюстью, где наличие зубов делает костный матрикс более восприимчивым к инфекции, чем другиекости1, принято считать, что здоровая кость хозяина представляет собой стерильную среду. Однако исследования показали, что микроорганизмы попадают в системный кровоток через стенки кишечника, что в конечном итоге влияет на минерализацию костей2. В качестве доказательства концепции мы используем описанный протокол для характеристики биохимических свойств микробных изолятов бедренной и большеберцовой костей здоровых крыс SD (Corynebacterium stationis, Staphylococcus cohnii subsp. и Enterococcus faecalis). Эти микробные изоляты были выбраны, поскольку кость представляет собой закрытую и гипоксическую среду, и характеристика этих микробов из кости может быть сложной задачей. В различных статьях подробно описаны процессы, используемые при изучении этих микробов; Тем не менее, лишь немногие из них предоставляют полный протокол для идентификации микроорганизмов, изолированных от хозяина.
При определении надлежащих условий культивирования необходимо понимать потребности микроба в кислороде с помощью жидкой тиогликоллатной среды (FTM). Микробы с различной потребностью в кислороде образуют стратифицированные слои в прозрачной жидкости FTM3. На основе профиля стратификации потребность микроба в кислороде затем используется для исследования роста клеток. Микробы, которые процветают на поверхности жидкости FTM, являются облигатными аэробами, в то время как микробы, которые растут на дне, являются облигатными анаэробами. Микробы, которые растут в виде суспензии в жидкости FTM, являются либо факультативными, либо аэротолерантными анаэробами. Скорость роста микроорганизмов устанавливается путем наблюдения за экспоненциальной фазой роста микробных клеток. Затем профиль роста сравнивают с образованием биопленки микроба. Биопленки в основном состоят из нескольких видов, которые прямо и косвенно влияют на здоровье друг друга. Во время этого процесса полезные взаимодействия между микробными сообществами отбирают привязанность, обеспечивая пространственную структуру, которая способствует эволюции активных взаимных взаимодействий. Например, сокультуры Paenibacillus amylolyticus и Xanthomonas retroflexus демонстрируют факультативные симбиотические взаимодействия в статической среде, способствуя быстрому росту биопленки13. Микробы адаптируются к тканям хозяина посредством образования биопленки для устойчивой локализации, защищая себя от суровых условий окружающей среды и уклоняясь от иммунной системы хозяина 4,5,6,7. Биопленки обычно представляют собой плотные и многослойные структуры, которые помогают микроорганизмам противостоять внешним подкритическим раздражителям; Например, E. faecalis в пульпе зуба повышает свою устойчивость к антибиотикам за счет увеличения образования биопленки при столкновении с субконцентрациями тетрациклина и ванкомицина8.
Хемотаксис позволяет микроорганизмам двигаться в соответствии с химическими градиентами, а сигнальные пути широко распространены в различных патогенных бактериях. Некоторые патогенные микроорганизмы мигрируют в определенные участки, под руководством химических сигналов, вызывая инфекционные заболевания14. Например, Xanthomonas spp. экспрессируют 19 хеморецепторных и 11 жгутиковых белков в организме хозяина, вызывая бактериальное связывание и, в конечном счете, изъязвление15. В бактериях также есть специфические белки (пектин-связывающие белки), которые направляют специфическую миграцию бактерий к питательным веществам, что может привести к лучшему росту16. Это также имеет решающее значение для бактерий, которые могут существовать в среде, бедной питательными веществами. Микробные клетки часто полагаются на хемотаксическую подвижность, чтобы притягивать себя к благоприятной среде для роста, уклоняясь от других хищных клеток и токсинов, которые наносят вред жизнеспособности клеток. Основываясь на ранее разработанных подходах к определению хемотаксиса на основе мягкого агара, мы разрабатываем диффузный метод генерации градиента хемоаттрактанта для тестирования микробного хемотаксиса.
В данной статье описаны методы определения условий роста, биопленкообразования и химического тропизма бактерий на примере Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 и Enterococcus faecalis V583 (см. рис. 1). Оптимизация условий роста микробов использует FTM для определения потребности микроба в кислороде, в то время как для формирования биопленки в качестве твердой основы используются стеклянные поверхности, а масса биопленки уравновешивается кристаллическим фиолетовым цветом. Химический тропизм микроба основан на его хемотаксическом поведении, где с помощью 3D-печати (дополнительный рисунок S1) используется стандартизированный метод для создания химического резервуара для хемоаттрактанта в мягкой агаровой матрице (дополнительный рисунок S2).
протокол
ПРИМЕЧАНИЕ: Смотрите Таблицу материалов для получения подробной информации обо всех материалах и оборудовании, используемых в этом протоколе. Используйте асептические методы, чтобы избежать загрязнения.
1. Бактериальное восстановление для получения одной колонии
- Подготовьте твердые агаровые пластины.
- Приготовьте среду Terrific Broth (TB), содержащую агар, с каждым литром жидкости, содержащей 11,8 г триптона, 23,6 г дрожжевого экстракта, 9,4 г K2HPO4, 2,2 г KH2PO4 и 15 г агара, pH = 7.
- Раствор автоклавировать при температуре 121 °C в течение 20 мин с помощью воздухопроницаемой крышки или пленки для укупорки бутылок с вентиляционным отверстием.
- Прежде чем жидкость остынет и застынет, разлейте бульон, содержащий агар, в 10 см пластиковые чашки Петри объемом 25 мл на тарелку.
ПРИМЕЧАНИЕ: Бульон следует вылить в тарелку до того, как он застынет при температуре ниже 60 °C. Используйте асептические методы для предотвращения загрязнения.
- Бактериальный посев в тарелку
- Извлеките целевые штаммы, хранившиеся при температуре −80 °C, и разморозьте их при комнатной температуре в биологически безопасном шкафу.
- С помощью пипетки объемом 10 мкл наберите 10 мкл бактериальной суспензии и распределите ее по противотуберкулезной пластине полосами.
- Закройте пластину во избежание загрязнения. Поместите планшет в биохимический инкубатор при температуре 37 °C. Проверьте рост колонии визуально через ~24 ч. Выберите отдельные колонии и амплифицируйте их с помощью ПЦР, чтобы подтвердить, что они содержат только один тип бактерий.
2. Бактериальная жидкая культура до логарифмической фазы роста
- Приготовьте жидкую питательную среду.
- Обратитесь к разделу Приготовление твердых агаровых пластин в Шаге 1.1.1. для приготовления жидкой среды ТБ, в 1 л которой содержится 11,8 г триптона, 23,6 г дрожжевого экстракта, 9,4 г К2НПО4 и 2,2 г КН2ПО4, рН ~7.
ПРИМЕЧАНИЕ: Не добавляйте агар. Бактерии быстрее растут в жидкой питательной среде. - Раствор автоклавировать при температуре 121 °C в течение 20 мин с помощью воздухопроницаемой крышки или пленки для укупорки бутылок с вентиляционным отверстием.
- Храните жидкую питательную среду при температуре 4 °C.
- Обратитесь к разделу Приготовление твердых агаровых пластин в Шаге 1.1.1. для приготовления жидкой среды ТБ, в 1 л которой содержится 11,8 г триптона, 23,6 г дрожжевого экстракта, 9,4 г К2НПО4 и 2,2 г КН2ПО4, рН ~7.
- Бактериальный посев и культивирование
- В шкафу биологической безопасности выберите одну колонию с помощью инокуляционной петли или пипетки объемом 10 мкл и введите бактерии в подготовленную жидкую среду для борьбы с туберкулезом в колбе Эрленмейера.
- Закройте колбу Эрленмейера марлей и поместите ее в шейкер (200 об/мин) при температуре 37 °C, чтобы культивировать бактерии.
ПРИМЕЧАНИЕ: Жидкая среда постепенно мутнеет в течение 5 часов; Время, необходимое для помутнения, варьируется в зависимости от бактерии.
3. Эксперимент FTM и определение кривой роста
- Подготовка жидкой тиогликоллатной среды (FTM)
- Приготовьте тиолгликоллатную среду (ТМ), каждый литр которой содержит 15 г триптона, 5 г дрожжевого экстракта, 5 г глюкозы, 0,5 г L-цистеина, 0,5 г тиогликолата натрия, 2,5 г натрия хлорида, 0,001 г резазурина и 0,75 г агара.
ПРИМЕЧАНИЕ: Коммерчески доступная твердая среда может быть легко восстановлена водой и стерилизована (Шаг 3.1.2.). - Взвесьте 29,3 г твердой тиогликоллатной среды, добавьте 1 л дистиллированной воды, нагрейте и размешайте до полного растворения и до тех пор, пока раствор не станет розовым.
- Добавьте ТМ (19 мл) в пробирку с уплотнительной пробкой. После герметизации раствор должен быть автоклавирован при температуре 121 °C в течение 20 мин с помощью воздухопроницаемой крышки или пленки для запайки бутылок с вентиляционным отверстием.
ПРИМЕЧАНИЕ: После нагревания раствор становится светло-желтым.
- Приготовьте тиолгликоллатную среду (ТМ), каждый литр которой содержит 15 г триптона, 5 г дрожжевого экстракта, 5 г глюкозы, 0,5 г L-цистеина, 0,5 г тиогликолата натрия, 2,5 г натрия хлорида, 0,001 г резазурина и 0,75 г агара.
- Посев, культивирование и наблюдение за бактериями
- Приготовьте бактериальную суспензию для роста до ОД 0,6-0,8 в жидкой среде ТБ (см. Шаг 2.2.).
- Откройте уплотнительную пробку пробирки в асептических условиях в шкафу биологической безопасности, как можно скорее добавьте 1 мл бактериальной культуры в пробирку, содержащую FTM, и немедленно снова запечатайте пробирку.
- Осторожно встряхните пробирку, чтобы убедиться, что бактерии равномерно распределены в жидкости, и поместите пробирку при температуре 37 °C для статического посева.
- После 48 ч инкубации наблюдайте за ростом различных бактерий в FTM в различных пробирках и делайте фотографии.
- Определение кривой роста в аэробных условиях
- Приготовьте исходную бактериальную культуру с подходящим значением OD (см. Шаг 2.2.) и культивируйте бактерии до тех пор, пока они не достигнут логарифмической фазы роста.
ПРИМЕЧАНИЕ: Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 и Enterococcus faecalis V583, используемые в этом протоколе, достигли логарифмической фазы в течение ~5 часов. - Добавьте 200 мкл бактериальной культуры (начиная с шага 3.3.1) в жидкую среду TB в каждую лунку 96-луночного планшета в трех экземплярах. Используйте считыватель микропланшетов для определения значения OD при длине волны 600 нм и разбавьте различные бактериальные культуры так, чтобы разница OD между различными лунками, содержащими бактерии, и жидкой средой TB (пустой) составляла от 0,01 до 0,02.
- Возьмите новый планшет на 96 лунок, добавьте среду для туберкулеза, перенесите различные разбавленные бактериальные культуры из Шага 3.3.2., в трех экземплярах, на планшет и поместите его на ультрачистый рабочий стол.
- Заклейте 96-луночный планшет уплотнительной лентой, вставьте его в микропланшетный ридер и установите программу следующим образом:
- Установите температуру 37 °C ± 0,5.
- Установите Кинетическую петлю в общей сложности на 60 циклов, каждый по 30 минут.
- Установите поглощение на 600 нм.
- Установите встряхивание на 1 600 с в цикле.
- Запустите программу и остановите ее, когда кривая роста выйдет на плато.
- Приготовьте исходную бактериальную культуру с подходящим значением OD (см. Шаг 2.2.) и культивируйте бактерии до тех пор, пока они не достигнут логарифмической фазы роста.
- Определение кривой роста в анаэробных условиях
- Следуйте шагу 3.3. но храните 96-луночный планшет со средой TB и бактериальными суспензиями в анаэробном инкубаторе перед запечатыванием планшета герметизирующей лентой. Накачайте и заполните анаэробный бокс азотом, чтобы снизить концентрацию кислорода до <3%. Заклейте 96-луночный планшет герметизирующей лентой и оставьте его в анаэробной коробке.
4. Тест на способность к образованию биопленки
- Культивируйте бактерии до логарифмической фазы роста в жидкой среде.
- Обратитесь к разделу 2 для инокуляции бактерий в жидкую среду для лечения туберкулеза.
- Культивируйте бактерии в течение ночи в шейкере при температуре 37 °C, следя за тем, чтобы внешний диаметр600 бактериальной среды составлял от 0,6 до 0,8.
- Разделите бактериальную культуру и культивируйте в разных условиях.
- Когда наружный диаметр600 бактериальной культуры составляет от 0,6 до 0,8, добавьте 10 мл этой бактериальной суспензии в стеклянную пробирку.
- Разделите каждую бактериальную культуру на две группы: аэробные и анаэробные условия, и выполняйте все операции в трех экземплярах.
- Для аэробной группы оберните пробирку, содержащую бактериальную суспензию, оловянной фольгой и инкубируйте в водяной бане при температуре 37 °C при постоянной температуре.
- Для анаэробной группы оберните пробирку с бактериальной суспензией оловянной фольгой и перенесите в анаэробный инкубатор. Снимите жестяную фольгу в анаэробном инкубаторе и уменьшите концентрацию кислорода в инкубаторе до <3% путем откачки и наполнения его азотом. Закройте пробирку пробкой из матового стекла, выньте ее после запечатывания и выдержите на водяной бане при температуре 37 °C.
- Каждые 6 ч берите по три пробирки из каждой из двух групп (аэробной/анаэробной), чтобы наблюдать за ростом биопленки на дне, и окрашивайте в соответствии с Шагом 4.3.
- Выбросьте бактериальную суспензию и высушите биопленку.
- Вынимайте пробирки в разные моменты времени и осторожно отсасывайте верхний слой бактериальной суспензии. Наблюдайте за белой биопленкой, прилипшей к дну пробирки.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не повредить биопленку при аспирации бактериальной суспензии. - Осторожно добавьте 2 мл фосфатно-солевого буфера (PBS) вдоль стенки пробирки, осторожно встряхните его, чтобы смыть планктонные бактерии, адсорбированные в биопленке, и осторожно аспирируйте PBS-буфер.
- Поставьте пробирку с адсорбированной на дне биопленкой в духовку для просушки на 30 минут.
- Вынимайте пробирки в разные моменты времени и осторожно отсасывайте верхний слой бактериальной суспензии. Наблюдайте за белой биопленкой, прилипшей к дну пробирки.
- Окрашивание
- Выньте пробирки, добавьте в каждую пробирку по 2 мл 0,1% раствора для окрашивания кристаллическим фиолетовым цветом и окрашивайте биопленки в течение 30 минут при комнатной температуре.
- С помощью пипетки осторожно отсасывайте раствор кристаллического фиолетового красителя. Осторожно добавьте дистиллированную воду вдоль стенки пробирки, чтобы смыть остатки кристаллического раствора фиолетового красителя, повторяя 3х-5х до тех пор, пока добавленная дистиллированная вода не станет почти бесцветной. Обратите внимание на фиолетовую биопленку на дне пробирки.
- Снова высушите пробирку.
- Растворите биопленку с 95% этанолом и отмерьте наружный диаметр600 раствора биопленки.
- Достаньте высушенную пробирку, добавьте в каждую пробирку по 10 мл 95% этанола и тщательно встряхните, чтобы убедиться, что кристаллический фиалка полностью растворился в этаноле.
- При объеме 200 мкл на лунку добавьте кристаллический фиолетовый цвет в этаноле в 96-луночный планшет и измерьте его поглощение на длине волны 600 нм.
ПРИМЕЧАНИЕ: Согласно закону Бера-Ламберта, поглощение линейно связано с концентрацией раствора, поэтому значение OD600 может отражать концентрацию кристаллического фиолетового, которая отражает количество биопленки в бактериальной суспензии в разное время.
5. Бактериальный хемотаксис-тест
- Готовят дифференциальные эвтрофные агаровые пластины.
- Обратитесь к Шагу 1 для приготовления полудозы среды MH, содержащей 0,5% агара, каждый литр которой содержит 11,8 г триптона, 23,6 г дрожжевого экстракта, 9,4 г K2HPO4, 2,2 г KH2PO4 и 5 г агара, pH ~7.
- Обратитесь к Шагу 1 для приготовления 5x TB среды, содержащей 0,5% агара, каждый литр которого содержит 59 г триптона, 118 г дрожжевого экстракта, 47 г K2HPO4, 11 г KH2PO4 и 5 г агара, pH ~ 7.
- Раствор автоклавировать при температуре 121 °C в течение 20 мин с помощью воздухопроницаемой крышки или пленки для укупорки бутылок с вентиляционным отверстием.
- Прежде чем жидкость остынет и застынет, налейте 25 мл полудозы бульона MH (содержащего 0,5% агара) на тарелку, накройте пластину крышкой, напечатанной на 3D-принтере, и поместите ее в шкаф биологической безопасности. После остывания снимите крышку, чтобы наблюдать цилиндрическую лунку (диаметром 1,4 см) в полутвердой среде.
ПРИМЕЧАНИЕ: Напечатанная на 3D-принтере крышка из смоляного материала не может быть стерилизована с помощью высокотемпературного пара. Чтобы убить поверхностные бактерии, его можно распылить 95% этанола, а затем облучать ультрафиолетовой лампой в течение 30 минут в шкафу биологической безопасности. Снимая крышку, приложите усилие в вертикальном направлении и осторожно поднимите ее, чтобы не повредить полутвердый агар. - Прежде чем бульон 5x TB (содержащий 0,5% агара) застынет, используйте пипетку, чтобы добавить бульон 5x TB в лунку в полутвердой пластине, пока бульон не окажется на одном уровне с поверхностью среды.
- Охладите пластину в шкафу биологической безопасности для получения полутвердой агаровой пластины, содержащей эвтрофные тела. Следите за тем, чтобы пластины не были загрязнены микроорганизмами окружающей среды.
ПРИМЕЧАНИЕ: Полутвердая среда все еще остается в некоторой степени жидкой и, следовательно, должна быть полностью охлаждена перед хранением в перевернутом виде.
- Бактериальный посев, культивирование и фотосъемка
- Поместите агаровую пластину с полутвердой питательной средой в шкаф биологической безопасности и охладите ее в течение ~30 минут под ультрафиолетовым излучением для предотвращения бактериального загрязнения.
- С помощью пипетки объемом 10 мкл наберите 4 мкл бактериальной суспензии, культивированной с наружным диаметром ~0,6-0,8, вставьте наконечник пипетки в центр пластиковых чашек Петри и изведите бактериальную суспензию с помощью пипетки.
- Подождите, пока бактериальная суспензия впитается в среду в течение 1 минуты. Когда бактериальная суспензия полностью впитается, разделите планшет на две группы (аэробные/анаэробные) в трех экземплярах.
- Запечатайте аэробную группу герметизирующей лентой и поместите эти планшеты вверх дном в биохимический инкубатор при температуре 37 °C для статического культивирования. Запечатайте анаэробную группу в анаэробной коробке, как описано в шаге 4.2, инвертируя пластины при температуре 37 °C для роста.
- Проверяйте распространение и миграцию бактерий каждые 12 часов (через 0 часов, 12 часов, 24 часа, 36 часов и 48 часов) и используйте систему визуализации для получения изображений планшета.
- Используйте программное обеспечение ImageJ для расчета расстояний миграции бактерий.
- Импортируйте файл изображения, полученный с помощью системы обработки изображений.
- Установите масштабную линейку и примените ее ко всем изображениям.
- При съемке изображений добавьте линейку, создайте отрезок линии, выберите отрезок прямой линии (например, 1 см, а затем установите длину этого отрезка равной 1 см) и отметьте длину доски.
- Откройте окно "Установить масштаб "; нажмите на Анализ | Установите масштаб.
- Введите фактическую длину в полях Известное расстояние и Единица длины.
- Проверьте Глобальный.
- Введите адрес папки исходного изображения и адрес выходного файла.
- С помощью инструмента « Прямая линия » выберите сообщества одно за другим и настройте допуск до тех пор, пока прямая линия инструмента не войдет в границу колонии бактерий, простирающуюся с обеих сторон.
- Измерьте расстояние миграции колонии от центра до обоих концов отдельно и получите длину прямой, нажав на кнопку Анализ | Измерьте.
- Повторяйте шаги 5.3.3-5.3.4 до тех пор, пока не будут измерены все сообщества, и сохраните результаты в файл .csv для дальнейшего анализа.
Результаты
В данной работе описаны подходы, использованные для характеристики выделенных микробов из микробиома хозяина (рис. 1). В качестве доказательства концепции три микроба были выделены из крысы-хозяина SD (C. stationis, S. cohnii и E. faecalis), а два коммерчески приобретенных микроорганизма (S. aureus ATCC 25923 и E. faecalis V583) были протестированы с использованием этого протокола. Чтобы определить потребности отдельных микробов в кислороде с помощью FTM, мы добавили два контрольных организма: облигатный анаэроб (Fusobacterium nucleatum ATCC 25586) и факультативный анаэроб (Pseudomonas aeruginosa PAO1). Результаты показали, что пять протестированных микробов были факультативными анаэробами (рисунок 2А), что согласуется с ранее опубликованными профилями этих микробов11. Чтобы выяснить их потребности в кислороде, микробы культивировали как в аэробных, так и в анаэробных условиях. У всех испытуемых микробов наблюдалась сигмовидная кривая роста как в аэробных, так и в анаэробных условиях; тем не менее, плотность микроорганизмов, как показано наружным диаметром600 нм, показала, что все пять микробов имеют более высокое предпочтение к окружающей среде, богатой кислородом (рисунок 2B, C). Эти наблюдения согласуются со способностью микробов проникать и заражать кости крыс, которые обычно считаются гипоксическими.
Было обнаружено, что пять бактериальных изолятов естественным образом образуют биопленки, где масса производимой биопленки была выше в анаэробных условиях. При сравнении кривой роста было обнаружено, что биопленки E. faecalis и S. aureus ATCC 25923 активно формируются во время стационарной фазы роста как в аэробной, так и в анаэробной среде (рис. 3). Это наблюдение позволяет предположить, что образование биопленки зависит от состояния роста клеток, возможно, регулируется внутриклеточными сигнальными молекулами, которые запускаютобразование биопленки. Эта зависимость образования биопленки от условий роста согласуется с питательными веществами и условиями роста, представленными средой костного матрикса хозяина, которой не хватает кислорода и питательных веществ.
Исследования патогенеза микробов часто связывают со способностью микробов мигрировать в места, которые считаются благоприятными для роста. Существует множество исследований микробного хемотаксиса, но не существует единого стандартизированного подхода к его изучению. Кроме того, использование недиффузных химических веществ считается ограничивающим фактором в изучении этого явления. В этой статье мы разработали смоляное покрытие, изготовленное с помощью 3D-печати, которое стандартизирует расстояние между резервуаром с химическим веществом и точкой инокуляции (дополнительный рисунок S1 и дополнительный рисунок S2). Мы изучали миграцию микробов в богатую питательными веществами среду, где в качестве химического стимулятора использовался 5-кратный ТБ. Микробы контролировались в течение 48 ч в аэробных и анаэробных условиях, где все пять микробов показали разную степень миграции тропизма (рис. 4A).
ImageJ был использован для измерения расстояния миграции бактерий (рис. 4B); Миграция к водоему оказалась более быстрой, чем миграция в обратном направлении. Отношение расстояния миграции к водохранилищу к расстоянию в обратном направлении показывает быстрое расширение колонии микробов за счет микробного хемотаксиса (рис. 5B). В этом исследовании бактерии, такие как S. aureus ATCC 25923, мигрировали быстрее, чем другие микробы, такие как C. stationis. Интересно, что миграционный профиль хемотаксических культур в аэробных и анаэробных условиях показал, что некоторые бактерии, такие как E. faecalis, демонстрируют вариации в моделях миграции в аэробных и анаэробных условиях, при этом в анаэробных условиях с течением времени наблюдалась быстрая экспансия. Как ни странно, лабораторный штамм E. faecalis V583 благоприятствовал аэробной среде для хемотаксиса. Таким образом, это говорит о том, что выделенные из разных источников E. faecalis имеют разные требования к росту, адаптированные к среде произрастания.

Рисунок 1: Принципиальная схема процесса работы. (А) Бактерии инокулируются на планшетах, а затем в жидкую среду и выращиваются до логарифмической фазы роста. (В) Определение способности бактерий образовывать биопленки в различных условиях (аэробных/анаэробных). Для каждой временной точки (6 часов) были отобраны три выборки и повторены параллельно. (В) Протокол эксперимента по химическому тропизму бактерий в различных условиях (аэробных/анаэробных). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Условия роста микроорганизмов. (A) Профиль роста бактерий, культивируемых в жидкой среде тиогликоллата (слева направо: I: Fusobacterium nucleatum ATCC 25586, II: Corynebacterium stationis, III: Staphylacoccus cohnii, IV: Enterococcus faecalis, V: Staphylacoccus aureus ATCC 25923, VI: Enterococcus faecalis V583, и VII: Pseudomonas aeruginosa PAO1). (В) Кривая роста микроорганизмов, выделенных от хозяина в аэробных условиях. (В) Кривая роста микроорганизмов, выделенных от хозяина в анаэробных условиях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
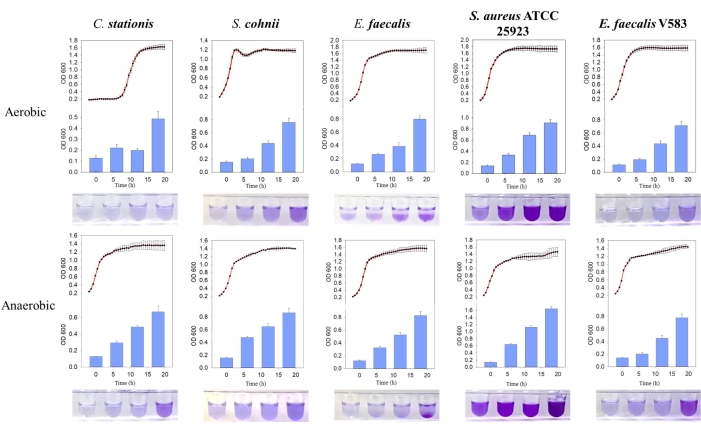
Рисунок 3: Сравнение кривых роста и образования биопленки у различных бактерий в различных условиях. Слева направо — Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 и Enterococcus faecalis V583. Красная кривая — это кривая роста, а синяя гистограмма — количество произведенной биопленки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
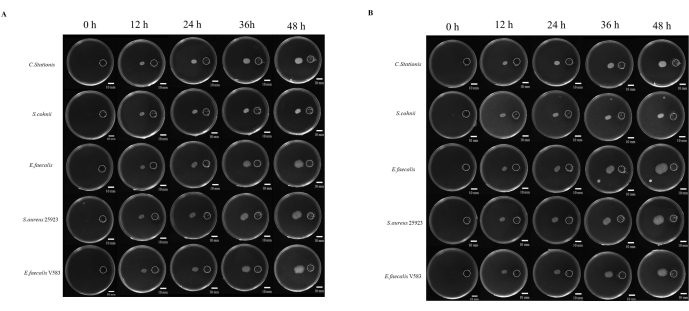
Рисунок 4: Рост микроорганизмов в направлении эвтрофикации. (А) Аэробные условия, (Б) анаэробные условия. Пять типов бактерий (сверху вниз Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 и Enterococcus faecalis V583) имеют тенденцию к эвтрофикации на дифференциальной питательной пластине. Масштабные линейки = 10 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Хемотаксис микробов в различных условиях (аэробных/анаэробных). (А) Результаты химической миграции пяти бактерий на пластине, содержащей богатый питательными веществами агар; Левая группа представляет аэробные условия, а правая — анаэробные условия. Каждый эксперимент повторялся в трех экземплярах параллельно. (B) Анализ данных по химическому тропизму. Верхняя часть представляет аэробные условия, а нижняя – анаэробные условия. Слева направо — Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 и Enterococcus faecalis V583. Красные и синие столбцы представляют собой расстояния миграции от питательного тела бактерий, мигрирующих к питательному телу и от него. Линия – это разница между двумя значениями (Красный – Синий). Масштабные линейки = 10 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок S1: Использование напечатанных на 3D-принтере крышек для изготовления агаровых пластин с разницей питательных веществ. (A) Используйте программное обеспечение для подготовки визуализации пресс-форм для 3D-печати. (B) Форма с плоской крышкой, напечатанная смолой 8 000. (В) Используйте вышеуказанный метод для получения разницы питательных веществ в агаровых пластинах. (D) Производство агаровых пластин с разницей питательных веществ. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2: Построение агаровых пластин для разностных питательных веществ и измерение расстояния миграции бактерий с помощью ImageJ. (A) При изготовлении пластин из агаровых пластин с разницей питательных веществ используется напечатанная на 3D-принтере крышка (с цилиндрическим выступом) для покрытия пластины. После того, как агар остынет, образуется цилиндрический колодец (красный круг), который заполняется 5x TB агаром. Затем его охлаждают для получения разницы питательных веществ в агаровых пластинах. (B) Используйте ImageJ для измерения расстояния миграции бактерий в разных направлениях. Установка масштабной линейки (Анализ | Set Scale) и экспортировать расстояние миграции с помощью функции Straight (Analyze | Измерить). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S3: Модели роста пяти бактерий на минимальном среднем агаре M9 в 5 раз меньше ТБ. Левая группа предназначена для аэробных условий, а правая группа — для анаэробных условий. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S4: Контрольные эксперименты по кривым роста Fusobacterium nucleatum ATCC 25586 и хемотаксису анаэробных бактерий. (A) Определение кривых роста F. nucleatum ATCC 25586 в аэробных и анаэробных условиях. (B) Эксперименты по хемотаксису F. nucleatum ATCC 25586 на агаровых планшетах MH-5x TB с половинной дозой в различных кислородных условиях. Частичное увеличение: Рост F. nucleatum ATCC 25586 на планшете в анаэробных условиях через 48 ч (частичное увеличение). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
| Соединение | Концентрация (г/л) |
| Na2HPO4 | 6.78 |
| КХ2ГО4 | 3 |
| NaCl | 0.5 |
| NH4Cl | 1 |
| MgSO4,7H 2O | 0.493 |
| CaCl2 | 0.011 |
| Глюкоза | 4 |
Таблица 1: Компоненты и состав среды M9 Minimal.
Обсуждение
Мы выделили и идентифицировали пять видов бактерий последовательными методами. Для роста бактерий потребность в питательных веществах минимальна: минимальная среда – среда, содержащая только неорганические соли, источник углерода и вода. Несмотря на то, что бактерии в опытной группе были обнаружены на твердых пластинах MH, мы использовали среду MH в половинной дозе для проверки хемотаксиса бактерий и добились хороших результатов. Тем не менее, мы также проводили контрольные эксперименты с использованием минимальной среды. В эксперименте использовалась основная среда М9 (состав и содержание см. в таблице 1 ), а для блока питательного агара по-прежнему использовалось 5 ТБ агара. Результаты эксперимента представлены на дополнительном рисунке S3. Хотя эти бактерии (за исключением E. faecalis) растут медленно и медленно передвигаются в среде M9, в целом наблюдается аналогичная тенденция (к росту на питательном агаре), как и в этих экспериментах. Тем не менее, E. faecalis V583 не рос на минимальной среде M9, возможно, из-за отсутствия компонентов, необходимых для роста E. faecalis в среде M9. Поэтому мы рекомендуем использовать среду MH в половинной дозе в качестве субстрата с дефицитом питательных веществ для моделирования роста и миграции бактерий в условиях дефицита питательных веществ. Это также облегчает использование программного обеспечения ImageJ для измерения расстояния, на которое бактерии обычно мигрируют.
Биопленки обычно определяются как поверхностно-ассоциированные микробные сообщества и являются важной стратегией выживания микроорганизмов. Такие организмы, как Pseudomonas aeruginosa, Haemophilus influenzae, Streptococcus pneumoniae и Staphylococcus aureus , могут быть обнаружены у бессимптомных хозяев, а обнаружение адгезивных микроорганизмов in vivo часто называют колонизацией, а не инфекцией. Очень важной проблемой является отсутствие идеальной модели колонизации животных12. Микробы демонстрируют первоначальное прикрепление к заряженным поверхностям до образования биопленки, где такие материалы, как стекло и поливинилхлорид (ПВХ), считаются подходящими для исследований, связанных с биопленкой. Исследования с использованием 96-луночных планшетов из ПВХ были использованы для изучения микробных биопленок9, в которых одно- или многовидовые биопленки могут приводить к образованию свободно или плотно упакованных биопленок10. Таким образом, использование 96-луночного планшета из ПВХ считается неподходящим для неплотно упакованных биопленок, поскольку матрица биопленки может быть легко смыта в процессе окрашивания биопленки. Поэтому мы полагались на стеклянные пробирки для изучения образования микробной биопленки (рис. 3).
Ключевым ограничением этого метода является то, что он не работает с микроорганизмами, которые растут в определенных условиях, и не все бактерии могут мигрировать. Более того, хотя биопленки являются эффективным средством, помогающим микроорганизмам защищаться от неблагоприятных внешних сред, не все микроорганизмы-хозяева способны производить биопленки. Например, F . nucleatum ATCC 25586, упомянутый ранее, который связан с симбиозом полости рта или кишечника человека, связанным с развитием рака толстой кишки17, растет только в анаэробных средах, но не образует биопленки. Мы использовали его в экспериментах FTM для проверки эффективности среды FT. Было показано, что среда FT эффективна в снабжении бактерий градиентными концентрациями кислорода.
Для сравнения мы протестировали кривую роста и химический тропизм анаэробной бактерии F. nucleatum ATCC 25586 (дополнительный рисунок S4). В экспериментах с кривой роста (дополнительный рисунок S4A) F. nucleatum ATCC 25586 не мог расти в аэробных условиях и демонстрировал бактериальную агрегацию на дне лунок в анаэробных условиях. В экспериментах с хемотаксисом (дополнительный рисунок S4B) F . nucleatum ATCC 25586 также не рос в аэробных условиях, и небольшое количество бактерий было обнаружено после инокуляции in situ в анаэробных условиях в течение 48 часов. Точно так же, поскольку некоторые бактерии не могут активно искать подходящие условия для роста путем миграции, они ждут подходящих условий для роста, входя вдолгосрочное состояние покоя. Следует отметить, что для культивирования строго анаэробных бактерий требуется специальная среда, такая как ферментационная среда ЭТ (полутвердые пластины должны быть дополнены 0,5% агаром), что также отличается от обычной изоляции и идентификации. Предлагаемый метод представляет собой общий метод, применимый для характеристики большинства микроорганизмов-хозяев, при этом он был продемонстрирован для пяти микробов, включая три микроба, выделенных из костей мышей, и два микроба лабораторного класса. Этот протокол поможет правильно идентифицировать изоляты микробиоты в будущих исследованиях.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Разработка этого метода была поддержана средствами Национального фонда естественных наук Китая Исследовательского фонда для международных молодых ученых (22050410270), Шэньчжэньского специального фонда инноваций и предпринимательства зарубежных талантов высокого уровня Peacock Team (KQTD20170810111314625) и Программы инновационных и предпринимательских исследований провинции Гуандун (2019ZT08Y191). Мы хотели бы выразить нашу искреннюю благодарность мисс Чэнь Синьи за ее помощь в корректуре документа и управлении лабораторией.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemical/Solution | |||
| 1% crystal violet dye solution | Solarbio | G1062 | 100 mL |
| Agar | Sigma-Aldrich | V900500 | Used to obtain semi-solid plates, 20 g |
| Centrifuge tube | Corning | 430790 | 15 mL |
| Fluid thioglycollate medium | Kinghunt | K0001 | 29.3 g |
| Mueller Hinton II Broth medium | Solarbio | NO.11865 | 100 g |
| Petri dishes | Bkman | B-SLPYM90-15 | Plastic Petri dishes, circular, 90 mm x 15 mm |
| Potassium Chloride | VETEC | WXBC4493V | 0.2 g |
| Potassium Dihydrogen Phosphate | aladdin | 04-11-7758 | 0.24 g |
| Sodium chloride | Macklin | S805275 | 8.0 g |
| Sodium phosphate dibasic | aladdin | 7558-79-4 | 1.44 g |
| Terrific Broth medium | Solarbio | LA2520 | 200 g |
| Kits/ Equipment | |||
| Anaerobic incubator | Longyue | ||
| Biochemical incubator | Blue pard | LRH-70 | |
| Microplate reader | Spark | ||
| Tanon 5200multi imaging system | Tanon | 5200CE | |
| Thermostatic water bath | Jinghong | DK-S28 |
Ссылки
- Bernardi, S., et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients' tongue biofilm. MicrobiologyOpen. 9 (2), 958 (2020).
- Tellez, G., Latorre, J. D., Kuttappan, V. A., et al. Rye affects bacterial translocation, intestinal viscosity, microbiota composition and bone mineralization in Turkey poults. PLOS One. 10, (2015).
- Brewer, J. H. Clear liquid mediums for the "aerobic" cultivation of anaerobes. Journal of the American Medical Association. 115 (8), 598 (1940).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Liu, C., et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review. Frontiers in Microbiology. 11, 802 (2020).
- Kumar, A., et al. Biofilms: survival and defense strategy for pathogens. International Journal of Medical Microbiology. , (2017).
- Penesyan, A., et al. Secondary effects of antibiotics on microbial biofilms. Frontiers in Microbiology. 11, 2109 (2020).
- Bernardi, S., et al. Subinhibitory antibiotic concentrations enhance biofilm formation of clinical Enterococcus faecalis isolates. Antibiotics. 10 (7), 874 (2021).
- Tsukatani, T., Fumihiko, S., Rieko, K. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids. World Journal of Microbiology and Biotechnology. 36 (12), 1-9 (2020).
- Hartmann, R., et al. Emergence of three-dimensional order and structure in growing biofilms. Nature Physics. 15, 251-256 (2019).
- Liu, Z., et al. Advances in bacterial biofilm management for maintaining microbiome homeostasis. Biotechnology Journal. 15 (10), 1900320 (2020).
- Hall-Stoodley, L., Stoodley, P. Evolving concepts in biofilm infections. Cellular Microbiology. 11 (7), 1034-1043 (2009).
- Røder, H. L., et al. Enhanced bacterial mutualism through an evolved biofilm phenotype. The ISME Journal. 12 (11), 2608-2618 (2018).
- Matilla, M. A., Tino, K. The effect of bacterial chemotaxis on host infection and pathogenicity. FEMS Microbiology Reviews. 42 (1), 052 (2018).
- Moreira, L. M., et al. Chemotactic signal transduction and phosphate metabolism as adaptive strategies during citrus canker induction by Xanthomonas citri. Functional & Integrative Genomics. 15 (2), 197-210 (2015).
- Konishi, H., et al. Bacterial chemotaxis towards polysaccharide pectin by pectin-binding protein. Scientific Reports. 10 (1), 1-12 (2020).
- Kostic, A. D., et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host & Microbe. 14 (2), 207-215 (2013).
- Kochan, T. J., et al. Updates to Clostridium difficile spore germination. Journal of Bacteriology. 200 (16), 00218 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены