Method Article
다양한 박테리아의 이동 및 생물막 형성 측정
요약
여기에서는 숙주 내에서 미생물을 격리하고 식별하기 위한 실용적인 방법을 제시합니다. 이러한 방식으로 미생물의 물리 화학적 특성과 숙주에서 가능한 생활 방식이 명확하게 설명됩니다.
초록
숙주체에서 번성하는 미생물은 주로 생존을 촉진하는 적응 능력을 가지고 있기 때문에 미생물의 본성을 분류하고 식별하는 방법은 미생물의 특성화를 용이하게 하는 데 도움이 될 것입니다. 현재 대부분의 연구는 하나의 특정 특성화 방법에만 초점을 맞추고 있습니다. 그러나 숙주에서 미생물을 분리하고 식별하는 것은 지속적인 과정이며 일반적으로 여러 가지 조합 특성화 방법이 필요합니다. 본 명세서에서는 미생물 생물막 형성 능력, 미생물 호흡 상태 및 화학주성 거동을 확인하는 방법을 설명합니다. 이 방법은 5개의 미생물을 식별하는 데 사용되며, 그 중 3개는 Sprague-Dawley(SD) 쥐의 뼈 조직(Corynebacterium stationis, Staphylococcus cohnii subsp. urealyticus 및 Enterococcus faecalis) 에서 분리되었고 2개는 American Type Culture Collection(ATCC)-Staphylococcus aureus ATCC 25923 및 Enterococcus faecalis 에서 분리되었습니다 V583입니다. SD 쥐 뼈 조직에서 분리된 미생물에는 그람 양성 미생물이 포함됩니다. 이 미생물은 뼈 기질 내에서 스트레스가 많고 영양이 제한적인 환경에서 번성하도록 적응했습니다. 이 기사는 실험실 환경에서 분리된 미생물의 특성과 행동을 결정하는 구체적인 노하우를 독자에게 제공하는 것을 목표로 합니다.
서문
인체로 대표되는 포유류 숙주에는 많은 수의 미생물이 포함되어 있습니다. 이 미생물은 숙주의 입, 소화관, 장 및 혈액에 널리 분포되어 있으며 숙주의 건강에 다양한 영향을 미칩니다. 구강은 감염에 대한 숙주의 감수성을 조절할 수 있는 과다한 미생물의 숙주입니다. 연쇄상구균 (예: S. mitis/oralis, S. pseudopneumoniae, S. infantis) 및 Prevotella spp. 와 같은 미생물은 구강에 군체를 형성하여 혀 표면에 다종 생물막을 형성하여 구취를 유발하고 미생물 감염을 위한 미생물 저장소로 기능합니다. 이러한 병원체는 턱뼈에서 치아 뿌리를 잡고 있는 치주 인대에 침투하여 턱뼈를 감염시킬 수 있습니다1. 숙주체에서 분리된 이러한 미생물의 특성화는 특히 미생물이 특정 처리 및 성장 조건을 필요로 하는 개별 형질을 나타내는 경우 지루한 과정인 경우가 많습니다. 병원성 헬리코박터 파일로리(Helicobacter pylori), 클로스트리듐 디피실리(Clostridium difficile) 및 푸소박테리움 뉴클레아툼(Fusobacterium nucleatum)과 같은 미생물은 특정 산소, 영양소 및 성장 요구 사항과 함께 장의 혹독한 환경에서 번성하기 때문에 특성 분석 과정, 특히 이러한 미생물의 병원성을 조사하는 데 어려움을 겪고 있습니다. 따라서 과학자와 의료 종사자가 새로운 치료법을 개발하기 위해서는 이러한 미생물을 분리하고 조사하는 표준화된 방법이 필요합니다.
이 프로토콜은 쥐의 뼈 매트릭스에서 번성하는 미생물을 사용합니다. 전통적으로, 치아가 있어 뼈 기질이 다른 뼈보다 감염에 더 취약한 턱으로 대표되는 골계를 제외하고1, 일반적으로 숙주의 건강한 뼈는 무균 환경이라고 믿어집니다. 그러나 연구에 따르면 미생물은 장벽을 통해 전신 순환계로 들어가 궁극적으로 뼈 무기질화에 영향을 미친다2. 개념 증명(proof-of-concept)으로, 당사는 설명된 프로토콜을 사용하여 건강한 SD 쥐(Corynebacterium stationis, Staphylococcus cohnii subsp. 및 Enterococcus faecalis)의 대퇴골 및 경골에서 분리된 미생물의 생화학적 특성을 특성화합니다. 이러한 미생물 분리물은 뼈가 폐쇄적이고 저산소성 환경이기 때문에 선택되었으며, 뼈에서 이러한 미생물을 특성화하는 것은 어려운 작업이 될 수 있습니다. 다양한 기사에서 이러한 미생물을 연구하는 데 사용되는 과정을 자세히 설명했습니다. 그러나 숙주 분리 미생물을 식별하기 위한 완전한 프로토콜을 제공하는 것은 거의 없습니다.
적절한 배양 조건을 확립하기 위해서는 FTM(Fluid Thioglycollate Medium)을 사용하여 미생물의 산소 요구량을 이해해야 합니다. 산소 요구량이 다른 미생물은 투명한 FTM 액체에서 성층을 형성합니다3. 성층화 프로파일을 기반으로 미생물의 산소 요구량을 사용하여 세포의 성장을 조사합니다. FTM 액체의 표면에서 번성하는 미생물은 절대 호기성(obligate aerobe)인 반면, 바닥에서 자라는 미생물은 절대 혐기성(obligate anaerobes)입니다. FTM 액체에서 현탁액으로 성장하는 미생물은 통성 또는 공기성 혐기성입니다. 미생물 성장률은 미생물 세포의 기하급수적 성장 단계를 관찰하여 설정됩니다. 그런 다음 성장 프로파일을 미생물의 생물막 형성과 비교합니다. 생물막은 주로 서로의 건강에 직간접적으로 영향을 미치는 여러 종으로 구성되어 있습니다. 이 과정에서 미생물 군집 간의 유익한 상호 작용은 애착을 선택하여 적극적인 상호 작용의 진화를 선호하는 공간 구조를 제공합니다. 예를 들어, Paenibacillus amylolyticus와 Xanthomonas retroflexus의 공동 배양은 정적 환경에서 통성 공생 상호 작용을 나타내어 빠른 생물막 성장을 촉진합니다13. 미생물은 지속적인 국소화를 위해 생물막 형성을 통해 숙주 조직에 적응하여 가혹한 환경으로부터 자신을 보호하고 숙주의 면역 체계를 회피합니다 4,5,6,7. 생물막은 일반적으로 미생물이 외부 저임계 자극에 저항하는 데 도움이 되는 조밀하고 다층적인 구조입니다. 예를 들어, 치과 치수의 E. faecalis는 테트라사이클린과 반코마이신의 하위 농도에 직면했을 때 생물막 형성을 증가시켜 항생제에 대한 내성을 향상시킵니다8.
화학주성은 미생물이 화학적 구배에 따라 이동할 수 있도록 하며, 신호 전달 경로는 다양한 병원성 박테리아에 널리 분포되어 있습니다. 일부 병원성 미생물은 화학적 신호의 유도에 따라 특정 부위로 이동하여 전염병을 일으킨다14. 예를 들어, Xanthomonas spp. 숙주에서 19개의 화학수용체(chemoreceptor)와 11개의 편모(flagellin) 단백질을 발현하여 박테리아 결합을 유발하고 궁극적으로 궤양을 유발합니다15. 또한 박테리아 내에는 박테리아가 영양소로 특이적으로 이동하는 것을 안내하는 특정 단백질(펙틴 결합 단백질)이 있으며, 이는 더 나은 성장으로 이어질 수 있습니다16. 이것은 영양이 부족한 환경에 존재할 수 있는 박테리아에도 중요합니다. 미생물 세포는 세포 생존력에 해를 끼치는 다른 포식성 세포와 독소를 회피하면서 유리한 성장 환경으로 자신을 끌어들이기 위해 종종 화학주성 운동성에 의존합니다. 화학주성을 측정하기 위해 이전에 확립된 소프트 한천 접근법을 기반으로 당사는 미생물 화학주성을 테스트하기 위한 화학유인 구배를 생성하는 확산성 방법을 개발합니다.
본 논문에서는 Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 및 Enterococcus faecalis V583을 예로 들어 박테리아의 성장 조건, 생물막 형성 및 화학적 tropism을 측정하는 방법을 설명합니다( 그림 1 참조). 미생물 성장 조건의 최적화는 FTM을 사용하여 미생물의 산소 요구량을 결정하는 반면, 생물막 형성은 유리 표면을 고체 지지대로 사용하고 생물막 덩어리는 결정 바이올렛으로 대조 염색됩니다. 미생물의 화학적 영양성은 3D 프린팅(보충 그림 S1)을 통해 표준화된 방법을 사용하여 부드러운 한천 매트릭스(보충 그림 S2)에서 화학유인물질에 대한 화학적 저장소를 생성하는 화학주성 거동에 의존합니다.
프로토콜
참고: 이 프로토콜에 사용된 모든 재료 및 장비에 대한 자세한 내용은 재료 표를 참조하십시오. 오염을 방지하기 위해 무균 기술을 사용하십시오.
1. 단일 식민지를 얻기 위한 박테리아 회수
- 단단한 한천 플레이트를 준비합니다.
- 트립톤 11.8g, 효모 추출물 23.6g, K2HPO4 9.4g, KH2PO4 2.2g 및 한천 15g을 포함하는 액체 1 리터, pH = 7을 포함하는 Terrific Broth (TB) 배지를 준비합니다.
- 121°C에서 20분 동안 공기 투과성 캡 또는 통풍구가 있는 병 밀봉 필름을 사용하여 용액을 고압증기멸마합니다.
- 액체가 식고 응고되기 전에 한천이 들어있는 TB 육수를 10cm 플라스틱 페트리 접시에 접시 당 25mL의 부피로 붓습니다.
알림: 육수는 60 °C 미만의 온도에서 응고되기 전에 접시에 부어야 합니다. 무균 기술을 사용하여 오염을 방지하십시오.
- 플레이트에 대한 박테리아 접종
- -80°C에 보관된 대상 균주를 꺼내 생물 안전 캐비닛에서 실온에서 해동합니다.
- 10μL 피펫을 사용하여 10μL의 박테리아 현탁액을 흡수하고 줄무늬를 만들어 TB 플레이트에 펴 바릅니다.
- 오염을 방지하기 위해 플레이트를 밀봉하십시오. 플레이트를 37°C의 생화학 인큐베이터에 넣습니다. ~24시간 후에 군체 성장을 육안으로 확인하십시오. 단일 콜로니를 선택하고 PCR로 증폭하여 한 가지 유형의 박테리아만 포함되어 있는지 확인합니다.
2. 대수 성장 단계에 세균성 액체 배양
- 액체 배양 배지를 준비합니다.
- 1.1.1 단계에서 단단한 한천 플레이트의 준비를 참조하십시오. TB를 제조하기 위해, 1L는 트립톤 11.8g, 효모 추출물 23.6g,K2HPO49.4g, KH2PO42.2g, pH~7을 포함한다.
참고: 한천을 추가하지 마십시오. 박테리아는 액체 영양소 환경에서 더 빨리 자랍니다. - 121°C에서 20분 동안 공기 투과성 캡 또는 통풍구가 있는 병 밀봉 필름을 사용하여 용액을 고압증기멸마합니다.
- 액체 배양 배지를 4 °C에서 보관하십시오.
- 1.1.1 단계에서 단단한 한천 플레이트의 준비를 참조하십시오. TB를 제조하기 위해, 1L는 트립톤 11.8g, 효모 추출물 23.6g,K2HPO49.4g, KH2PO42.2g, pH~7을 포함한다.
- 세균 접종 및 배양
- 생물 안전 캐비닛에서 접종 루프 또는 10μL 피펫이 있는 단일 콜로니를 선택하고 삼각 플라스크에서 준비된 TB 액체 배지의 박테리아를 접종합니다.
- 삼각 플라스크를 거즈로 밀봉하고 37°C의 셰이커(200rpm)에 넣어 박테리아를 배양합니다.
참고: 액체 매체는 5시간에 걸쳐 점차적으로 혼탁해집니다. 탁해지기까지 걸리는 시간은 박테리아에 따라 다릅니다.
3. FTM 실험 및 성장 곡선 측정
- 유체 티오글리콜레이트 배지(FTM) 준비
- 트립톤 15g, 효모 추출물 5g, 포도당 5g, L-시스테인 0.5g, 티오글리콜산나트륨 0.5g, 염화나트륨 2.5g, 레사주린 0.001g, 한천 0.75g을 포함하는 티올글리콜레이트 배지(TM)를 준비합니다.
참고: 시판되는 고체 배지는 물로 쉽게 재구성하고 멸균할 수 있습니다(단계 3.1.2). - 고체 Thioglycollate Medium 29.3g의 무게를 달고 증류수 1L를 넣고 가열하고 완전히 용해될 때까지 용액이 분홍색으로 변할 때까지 저어줍니다.
- 밀봉 플러그가 있는 시험관에 TM(19mL)을 추가합니다. 밀봉 후 121°C에서 20분 동안 공기 투과성 캡 또는 통풍구가 있는 병 밀봉 필름을 사용하여 용액을 고압증기멸마합니다.
알림: 가열 후 용액은 연한 노란색이 됩니다.
- 트립톤 15g, 효모 추출물 5g, 포도당 5g, L-시스테인 0.5g, 티오글리콜산나트륨 0.5g, 염화나트륨 2.5g, 레사주린 0.001g, 한천 0.75g을 포함하는 티올글리콜레이트 배지(TM)를 준비합니다.
- 세균의 접종, 배양 및 관찰
- 액체 TB 배지에서 OD 0.6-0.8로 성장하도록 박테리아 현탁액을 준비합니다(단계 2.2 참조).
- 생물 안전 캐비닛의 무균 상태에서 시험관 밀봉 플러그를 열고 가능한 한 빨리 FTM이 포함된 시험관에 박테리아 배양액 1mL를 첨가한 다음 즉시 시험관을 다시 밀봉합니다.
- 튜브를 부드럽게 흔들어 박테리아가 액체에 균일하게 분포되어 있는지 확인하고 정적 배양을 위해 테스트 튜브를 37°C에 놓습니다.
- 48시간의 배양 후 다양한 시험관에서 FTM의 다양한 박테리아가 성장하는 것을 관찰하고 사진을 찍습니다.
- 호기성 조건에서의 성장 곡선 결정
- 적절한 OD 값으로 초기 박테리아 배양을 준비하고(2.2단계 참조) 박테리아가 로그 성장 단계에 도달할 때까지 박테리아를 배양합니다.
참고: 이 프로토콜에 사용된 Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 및 Enterococcus faecalis V583은 로그 단계에 도달하는 데 ~5시간이 걸렸습니다. - TB 액체 배지에 있는 박테리아 배양액 200μL(단계 3.3.1)를 96웰 플레이트의 각 웰에 3회씩 추가합니다. 마이크로플레이트 리더를 사용하여 600nm에서 OD 값을 측정하고 서로 다른 박테리아 함유 웰과 TB 액체 매체(블랭크) 간의 OD 차이가 0.01에서 0.02 사이가 되도록 서로 다른 박테리아 배양액을 희석합니다.
- 새로운 96웰 플레이트를 가져와서 TB 배지를 추가하고 3.3.2.단계에서 희석된 다양한 박테리아 배양액을 플레이트로 3회 이동시킨 다음 매우 깨끗한 작업대에 놓습니다.
- 96웰 플레이트를 밀봉 테이프로 밀봉하고 마이크로플레이트 리더에 넣은 후 프로그램을 다음과 같이 설정합니다.
- 온도를 37°C ± 0.5로 설정합니다.
- Kinetic Loop를 각각 60분 동안 총 30사이클로 설정합니다.
- 흡광도를 600nm로 설정합니다.
- 한 주기에서 흔들기를 1,600초로 설정합니다.
- 프로그램을 실행하고 성장 곡선이 안정되면 중지하십시오.
- 적절한 OD 값으로 초기 박테리아 배양을 준비하고(2.2단계 참조) 박테리아가 로그 성장 단계에 도달할 때까지 박테리아를 배양합니다.
- 혐기성 조건에서의 성장 곡선 결정
- 3.3단계를 수행합니다. 그러나 밀봉 테이프로 플레이트를 밀봉하기 전에 TB 배지 및 박테리아 현탁액이 있는 96웰 플레이트를 혐기성 인큐베이터에 보관하십시오. 펌프를 통해 혐기성 상자에 질소를 채워 산소 농도를 <3%로 낮춥니다. 96웰 플레이트를 밀봉 테이프로 밀봉하고 혐기성 상자에 그대로 둡니다.
4. 생물막 형성 능력 시험
- 액체 매체에서 박테리아를 대수 성장 단계로 배양합니다.
- 섹션 2를 참조하여 TB 액체 배지에 있는 박테리아를 접종합니다.
- 37°C의 셰이커에서 하룻밤 동안 박테리아를 배양하여 박테리아 배양 배지의 OD600 이 0.6에서 0.8 사이가 되도록 합니다.
- 박테리아 배양을 나누고 다른 조건에서 배양합니다.
- 박테리아 배양의 OD600 이 0.6에서 0.8 사이인 경우 이 박테리아 현탁액 10mL를 유리 시험관에 첨가합니다.
- 각 박테리아 배양을 호기성 및 혐기성 조건의 두 그룹으로 나누고 모든 작업을 세 번 수행합니다.
- 유산소 그룹의 경우, 박테리아 현탁액이 포함된 시험관을 은박지로 감싸고 일정한 온도의 37°C 수조에서 배양합니다.
- 혐기성 그룹의 경우, 박테리아 현탁액이 들어있는 튜브를 주석 호지로 감싸고 혐기성 인큐베이터로 옮깁니다. 혐기성 인큐베이터에서 은박지를 제거하고 펌핑하고 질소를 채워 인큐베이터의 산소 농도를 <3%로 줄입니다. 시험관을 젖빛 유리 마개로 닫고 밀봉 후 꺼내 37°C의 수조에서 배양합니다.
- 매 6 시간마다, 2개 그룹 (호기성/혐기성)의 각각에서 3개의 시험관을 가지고 바닥에 biofilm의 성장을 관찰하고, 단계 4.3에 따라 염색하십시오.
- 박테리아 현탁액을 버리고 생물막을 건조시킵니다.
- 다른 시점에서 시험관을 꺼내고 박테리아 현탁액의 상층을 조심스럽게 흡인합니다. 시험관 바닥에 부착된 흰색 생물막을 관찰하십시오.
알림: 박테리아 현탁액을 흡인할 때 생물막을 방해하지 않도록 주의하십시오. - 시험관 벽을 따라 인산염 완충 식염수(PBS) 2mL를 조심스럽게 넣고 부드럽게 흔들어 생물막에 흡착된 플랑크톤 박테리아를 씻어낸 다음 PBS 완충액을 조심스럽게 흡인합니다.
- 바닥에 바이오필름이 흡착된 시험관을 오븐에 넣고 30분 동안 건조시킵니다.
- 다른 시점에서 시험관을 꺼내고 박테리아 현탁액의 상층을 조심스럽게 흡인합니다. 시험관 바닥에 부착된 흰색 생물막을 관찰하십시오.
- 얼룩
- 시험관을 꺼내 각 시험관에 0.1% 크리스탈 바이올렛 염색액 2mL를 첨가하고 실온에서 30분 동안 바이오필름을 염색합니다.
- 피펫을 사용하여 크리스탈 바이올렛 염료 용액을 조심스럽게 흡인합니다. 시험관 벽을 따라 증류수를 조심스럽게 첨가하여 남아 있는 크리스탈 바이올렛 염료 용액을 씻어내고 첨가된 증류수가 거의 무색이 될 때까지 3x-5x를 반복합니다. 시험관 바닥에 있는 보라색 생물막을 관찰합니다.
- 시험관을 다시 말리십시오.
- 바이오필름을 95% 에탄올로 용해시키고 바이오필름 용액의 OD600 을 측정합니다.
- 건조된 시험관을 꺼내 각 시험관에 10% 에탄올 95mL를 넣고 철저히 흔들어 크리스탈 바이올이 에탄올에 완전히 용해되었는지 확인합니다.
- 웰당 200μL의 부피로 에탄올 중 크리스털릿을 96웰 플레이트에 첨가하고 600nm의 파장에서 흡광도를 측정합니다.
참고: Beer-Lambert의 법칙에 따르면 흡광도는 용액의 농도와 선형적으로 관련되어 있으므로 OD600 의 값은 결정 바이올렛의 농도를 반영할 수 있으며, 이는 서로 다른 시간에 박테리아 현탁액의 생물막의 양을 반영합니다.
5. 세균성 화학주성 검사
- 차동 부영양화 한천 플레이트를 준비합니다.
- 1단계를 참조하여 0.5% 한천을 함유하는 반용량 MH 배지를 제조하고, 각 리터에는 트립톤 11.8g, 효모 추출물 23.6g, K2HPO4 9.4g, KH2PO4 2.2g 및 pH ~7 한천 5g이 포함되어 있습니다.
- 1단계를 참조하여 0.5% 한천을 포함하는 5x TB 배지를 제조하며, 각 리터에는 트립톤 59g, 효모 추출물 118g, K2HPO4 47g, KH2PO4 11g 및 pH ~7 한천 5g이 포함되어 있습니다.
- 121°C에서 20분 동안 공기 투과성 캡 또는 통풍구가 있는 병 밀봉 필름을 사용하여 용액을 고압증기멸마합니다.
- 액체를 냉각하고 응고시키기 전에 플레이트당 25mL의 절반 용량 MH 육수(0.5% 한천 포함)를 붓고 플레이트를 3D 프린팅 뚜껑으로 덮은 다음 생물 안전 캐비닛에 넣습니다. 냉각 후 덮개를 제거하여 반고체 매체에서 원통형 웰(직경 1.4cm)을 관찰합니다.
참고: 수지 재질의 3D 프린팅 뚜껑은 고온 증기를 사용하여 멸균할 수 없습니다. 표면 박테리아를 죽이기 위해 95% 에탄올을 분사한 다음 생물 안전 캐비닛에서 30분 동안 UV 램프를 조사할 수 있습니다. 뚜껑을 제거할 때는 수직 방향으로 힘을 가하고 조심스럽게 들어 올려 반고체 한천의 손상을 방지하십시오. - 5x TB 육수(0.5% 한천 함유)가 응고되기 전에 피펫을 사용하여 국물이 배지 표면과 같은 높이가 될 때까지 반고체 플레이트의 웰에 5x TB 육수를 추가합니다.
- 생물 안전 캐비닛에서 플레이트를 냉각하여 부영양체를 포함하는 반고체 한천 플레이트를 얻습니다. 환경 미생물에 의한 플레이트 오염을 피하도록 주의하십시오.
참고: 반고체 매체는 여전히 다소 유동적이므로 거꾸로 보관하기 전에 완전히 냉각해야 합니다.
- 세균 접종, 배양 및 사진 촬영
- 반고체 배양 배지가 있는 한천 플레이트를 생물 안전 캐비닛에 놓고 박테리아 오염을 방지하기 위해 UV 조사 하에서 ~30분 동안 냉각합니다.
- 10 μL 피펫을 사용하여 ~0.6-0.8의 OD로 배양된 박테리아 현탁액 4 μL를 흡수하고, 피펫 팁을 플라스틱 페트리 접시 중앙에 삽입하고, 박테리아 현탁액을 피펫으로 제거합니다.
- 박테리아 현탁액이 배지에 흡수될 때까지 1분 동안 기다립니다. 박테리아 현탁액이 완전히 흡수되면 플레이트를 세 부분으로 두 그룹(호기성/무산소성)으로 나눕니다.
- 밀봉 테이프로 유산소 그룹을 밀봉하고 정적 배양을 위해 37°C 생화학 인큐베이터에 플레이트를 거꾸로 놓습니다. 단계 4.2에서 기술된 것과 같이 혐기성 상자에 있는 혐기성 그룹을 밀봉하고, 성장을 위한 37 °C에 판을 반전시키.
- 12시간마다(0시간, 12시간, 24시간, 36시간, 48시간) 박테리아의 확산 및 이동을 확인하고 이미징 시스템을 사용하여 플레이트의 이미지를 촬영합니다.
- ImageJ 소프트웨어를 사용하여 박테리아 이동 거리를 계산합니다.
- 이미징 시스템을 사용하여 획득한 이미지 파일을 가져옵니다.
- 축척 막대를 설정하고 모든 이미지에 적용합니다.
- 이미지를 촬영할 때 눈금자를 추가하고, 선분을 만들고, 직선 선분(예: 1cm)을 선택한 다음 이 선분의 길이를 1cm로 설정하고, 보드의 길이를 표시합니다.
- Set Scale 창을 엽니다. Analyze(분석) | 배율을 설정합니다.
- Known distance(알려진 거리)와 Unit of length(길이 단위)에 실제 길이를 입력합니다.
- 전역을 선택합니다.
- 원본 이미지의 폴더 주소와 출력 파일 주소를 입력합니다.
- 직선 도구를 사용하여 군집을 하나씩 선택하고 직선 도구 선이 양쪽으로 확장되는 박테리아 군집의 경계에 맞을 때까지 허용 오차를 조정합니다.
- 중심에서 양쪽 끝까지 군체의 이동 거리를 개별적으로 측정하고 Analyze(분석) | 측정.
- 모든 커뮤니티가 측정될 때까지 5.3.3-5.3.4 단계를 반복하고 추가 분석을 위해 결과를 .csv 파일에 저장합니다.
결과
이 연구는 숙주 마이크로바이옴에서 분리된 미생물을 특성화하기 위해 취한 접근 방식을 설명합니다(그림 1). 개념 증명으로 SD 쥐 숙주에서 3개의 미생물(C. stationis, S. cohnii 및 E. faecalis)을 분리하고 상업적으로 획득한 2개의 미생물(S. aureus ATCC 25923 및 E. faecalis V583) 을 이 프로토콜을 사용하여 테스트했습니다. FTM을 사용하여 개별 미생물의 산소 요구량을 확인하기 위해 obligate anaerobe(Fusobacterium nucleatum ATCC 25586)와 facultative anaerobe(Pseudomonas aeruginosa PAO1)의 두 가지 대조 유기체를 추가했습니다. 그 결과, 테스트된 5개의 미생물이 통성 혐기성(facultative anaerobes)인 것으로 나타났으며(그림 2A), 이는 이전에 보고된 이러한 미생물의 프로파일과 일치한다11. 산소 요구량을 밝히기 위해 미생물은 호기성 및 혐기성 조건 모두에서 배양되었습니다. 테스트된 모든 미생물은 호기성 및 혐기성 조건 모두에서 시그모이드 성장 곡선을 나타냈습니다. 그러나 OD600nm에서 알 수 있듯이 미생물 밀도는 5가지 미생물 모두 산소가 풍부한 환경에서 더 높은 선호도를 갖는 것으로 나타났습니다(그림 2B, C). 이러한 관찰은 일반적으로 저산소성으로 간주되는 쥐 뼈에 침투하여 감염시키는 미생물 능력과 일치합니다.
5개의 세균 분리물은 자연적으로 생물막을 형성하는 것으로 밝혀졌으며, 여기서 대량 생산된 생물막은 혐기성 조건에서 더 높았습니다. 성장 곡선 비교를 통해 E. faecalis 및 S. aureus ATCC 25923의 생물막은 호기성 및 혐기성 환경 모두에서 고정 성장 단계 동안 활발하게 형성되는 것으로 밝혀졌습니다(그림 3). 이 관찰은 생물막 형성이 세포의 성장 상태에 따라 달라지며, 생물막 형성을 유발하는 세포 내 신호 분자에 의해 조절될 수 있음을 시사합니다 11. 성장 조건에 대한 생물막 형성의 이러한 의존성은 산소와 영양소가 부족한 숙주 뼈 기질 환경이 제시하는 영양소 및 성장 조건과 일치합니다.
미생물의 발병기전에 대한 연구는 종종 미생물이 성장에 도움이 되는 것으로 간주되는 부위로 이동하는 능력과 관련이 있습니다. 미생물 화학주성에 대한 많은 연구가 있지만, 이를 연구하기 위한 표준화된 접근법은 없습니다. 또한 비확산성 화학 물질의 사용은 이 현상을 연구하는 데 제한 요인으로 간주되었습니다. 여기에서 우리는 화학 물질 저장소와 접종 지점 사이의 거리를 표준화하는 3D 프린팅을 통해 생산된 수지 덮개를 개발했습니다(보충 그림 S1 및 보충 그림 S2). 우리는 영양이 풍부한 환경으로 미생물이 이동하는 과정을 연구했는데, 그곳에서 5배 결핵이 화학적 자극제로 사용되었습니다. 미생물은 호기성 및 혐기성 조건에서 48시간 동안 모니터링되었으며, 5가지 미생물 모두 서로 다른 tropism 이동 정도를 보였습니다(그림 4A).
ImageJ는 박테리아의 이동 거리를 측정하는 데 사용되었습니다(그림 4B). 저수지를 향한 이주는 반대 방향으로의 이주보다 더 빠른 것으로 나타났다. 반대 방향의 이동 거리와 저류층을 향한 이동 거리의 비율은 미생물 화학주성으로 인한 미생물 군집의 급속한 확장을 보여줍니다(그림 5B). 이 연구에서 S. aureus ATCC 25923과 같은 박테리아는 C. stationis와 같은 다른 미생물보다 빠르게 이동했습니다. 흥미롭게도, 호기성 및 혐기성 조건에서 화학주성 배양의 이동 프로파일은 E. faecalis 와 같은 일부 박테리아가 호기성 및 혐기성 조건에서 이동 패턴의 변화를 보였으며, 시간이 지남에 따라 혐기성 조건에서 급격한 확장이 관찰되었음을 보여주었습니다. 당혹스럽게도, 실험실 균주 E. faecalis V583은 화학주성을 위한 호기성 환경을 선호했습니다. 따라서 이는 서로 다른 공급원에서 분리된 E. faecalis 가 성장 환경에 적응된 성장 요구 사항이 다르다는 것을 시사합니다.

그림 1: 작동 프로세스의 개략도. (A) 박테리아를 플레이트에 접종한 다음 액체 배지에 접종하고 로그 성장 단계로 성장시킵니다. (B) 다양한 조건(호기성/혐기성)에서 박테리아가 생물막을 형성하는 능력의 결정. 각 시점(6시간)에 대해 3개의 샘플을 선택하고 병렬로 반복했습니다. (C) 다양한 조건(호기성/혐기성)에서 박테리아의 화학적 친화성 실험을 위한 프로토콜. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 미생물 성장 조건. (A) 플루이드 티오글리콜레이트 배지(Fluid Thioglycollate Medium)에서 배양된 박테리아의 성장 프로파일(왼쪽에서 오른쪽으로: Fusobacterium nucleatum ATCC 25586, II: Corynebacterium stationis, III: Staphylacoccus cohnii, IV: Enterococcus faecalis, V: Staphylacoccus aureus ATCC 25923, VI: Enterococcus faecalis V583, 및 VII: Pseudomonas aeruginosa PAO1). (B) 호기성 조건에서 숙주로부터 분리된 미생물의 성장 곡선. (C) 혐기성 조건에서 숙주로부터 분리된 미생물의 성장 곡선. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
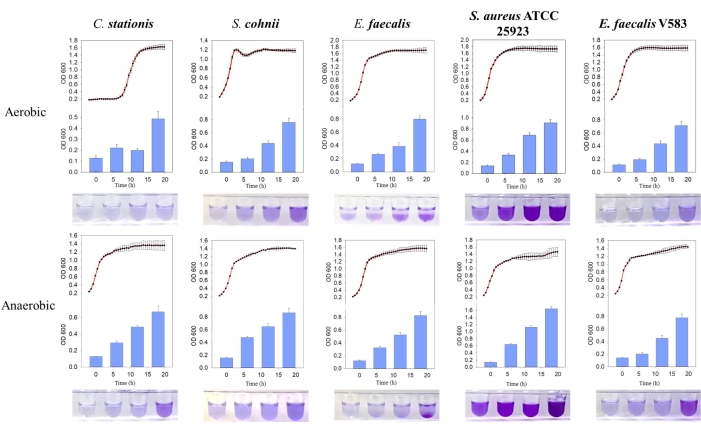
그림 3: 서로 다른 조건에서 서로 다른 박테리아의 성장 곡선과 생물막 형성 비교. 왼쪽에서 오른쪽으로 Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 및 Enterococcus faecalis V583이 있습니다. 빨간색 곡선은 성장 곡선이고 파란색 히스토그램은 생성된 생물막의 양입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
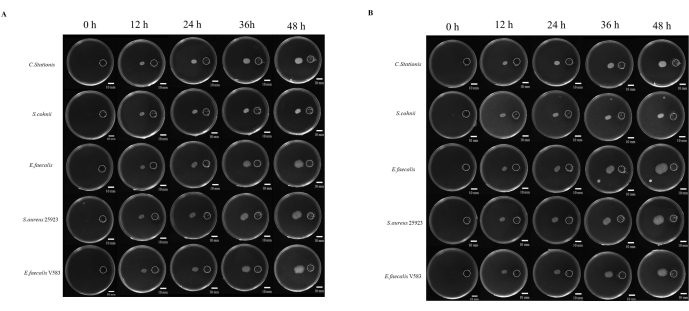
그림 4: 부영양화를 향한 미생물 성장. (A) 호기성 조건, (B) 혐기성 조건. 5가지 유형의 박테리아(위에서 아래로, Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 및 Enterococcus faecalis V583)는 차등 영양판에서 부영양화를 향해 성장하는 경향이 있습니다. 스케일 바 = 10mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 다양한 조건(호기성/무산소성)에서 미생물의 화학주성. (A) 영양이 풍부한 한천이 들어있는 접시에 있는 5개의 박테리아의 화학적 tropism 이동의 결과; 왼쪽 그룹은 유산소 조건을 나타내고 오른쪽 그룹은 무산소 조건을 나타냅니다. 각 실험은 병렬로 세 번 반복되었습니다. (B) 화학적 tropism의 데이터 분석. 윗부분은 호기성 조건을 나타내고 아랫부분은 혐기성 조건을 나타냅니다. 왼쪽에서 오른쪽으로 Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 및 Enterococcus faecalis V583이 있습니다. 빨간색과 파란색 열은 박테리아의 영양체에서 영양체로 이동하거나 영양체에서 멀어지는 이동 거리입니다. 선은 두 값(빨강 - 파랑)의 차이입니다. 스케일 바 = 10mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 S1: 3D 프린팅 뚜껑을 사용하여 영양소 차이 한천 플레이트를 만듭니다. (A) 소프트웨어를 사용하여 3D 프린팅 금형 렌더링을 준비합니다. (B) 8,000 레진으로 프린팅된 플랫 커버 몰드. (C) 위의 방법을 사용하여 영양소 차이 한천 플레이트를 얻습니다. (D) 영양 차이 한천 플레이트의 생산. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S2: 영양소 차이 한천 플레이트의 구성 및 ImageJ를 사용한 박테리아 이동 거리 측정. (A) 영양소 차이 한천 플레이트의 구성은 플레이트를 덮기 위해 3D 프린팅 된 뚜껑 (원통형 돌출부 포함)을 사용합니다. 한천이 냉각 된 후, 5x TB 한천으로 채워진 원통형 우물 (빨간색 원)이 형성됩니다. 그런 다음 이를 냉각시켜 영양 차이 한천 플레이트를 얻습니다. (B) ImageJ를 사용하여 다른 방향에서 박테리아의 이동 거리를 측정합니다. 축척 막대 설정(Analyze(분석) | Set Scale)을 선택하고 Straight (Analyze(분석 ) | 측정). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S3: M9 최소 매체-5x TB 중간 한천에서 5개 박테리아의 성장 패턴. 왼쪽 그룹은 유산소 조건이고 오른쪽 그룹은 무산소 조건입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S4: 혐기성 박테리아의 Fusobacterium nucleatum ATCC 25586 성장 곡선 및 화학주성에 대한 제어 실험. (A) 호기성 및 혐기성 조건에서 F. nucleatum ATCC 25586의 성장 곡선 측정. (B) 다양한 산소 조건에서 절반 선량 MH-5x TB 한천 플레이트에 대한 F. nucleatum ATCC 25586의 화학주성 실험. 부분 확대: 48시간 후 혐기성 조건에서 플레이트에서 F. nucleatum ATCC 25586의 성장(부분 확대). 이 파일을 다운로드하려면 여기를 클릭하십시오.
| 화합물 | 농도 (g/L) |
| 나2HPO4 | 6.78 |
| KH2사서함4 | 3 |
| 염화나트륨 | 0.5 |
| 뉴햄프셔4CL | 1 |
| MgSO4.7H 2O | 0.493 |
| 염화칼슘2 | 0.011 |
| 포도당 | 4 |
표 1: M9 Minimal 미디어의 구성 요소 및 내용.
토론
우리는 순차적인 방법으로 5종의 박테리아를 분리하고 식별했습니다. 박테리아의 성장은 최소한의 영양 요구 사항을 가지고 있습니다 : 최소 매체 - 무기염, 탄소원 및 물 만 포함하는 매체. 실험군의 박테리아는 MH 고체 플레이트에서 발견되었지만, 박테리아의 화학주성을 확인하기 위해 절반 용량의 MH 배지를 사용했고 좋은 결과를 얻었습니다. 그러나 최소한의 매체를 사용하여 대조군 실험도 수행했습니다. M9 염기성 배지가 실험에 사용되었으며(조성 및 함량은 표 1 참조), 영양 한천 블록에는 여전히 5x TB 한천이 사용되었습니다. 실험 결과는 보충 그림 S3에 나와 있습니다. 이러한 박테리아( E. faecalis 제외)는 M9 배지에서 천천히 성장하고 느리게 이동하지만, 이러한 실험에서 관찰된 바와 같이 일반적으로 유사한 경향(영양 한천에서 성장하는 경향)이 있습니다. 그러나 E. faecalis V583은 M9 최소 배지에서 성장하지 않았는데, 이는 E. faecalis가 M9 배지에서 성장하는 데 필요한 성분이 부족했기 때문일 수 있습니다. 따라서 영양소 결핍 조건에서 박테리아 성장 및 이동을 시뮬레이션하기 위해 영양 결핍 기질로 절반 용량 MH 배지를 사용하는 것이 좋습니다. 이것은 또한 ImageJ 소프트웨어를 사용하여 박테리아가 이동하는 경향이 있는 거리를 측정하는 것을 용이하게 합니다.
생물막은 일반적으로 표면 관련 미생물 군집으로 정의되며 중요한 미생물 생존 전략입니다. 녹농균(Pseudomonas aeruginosa), 헤모필루스 인플루엔자(Haemophilus influenzae), 폐렴구균(Streptococcus pneumoniae), 황색포도상구균(Staphylococcus aureus )과 같은 유기체는 무증상 숙주에서 발견될 수 있으며, 생체 내에서 부착 미생물의 발견은 종종 감염이 아닌 집락화(colonization)라고 합니다. 매우 중요한 문제는 이상적인 동물 군집화 모델이 없다는 것이다12. 미생물은 생물막이 형성되기 전에 하전된 표면에 대한 초기 부착을 보여주며, 유리 및 폴리염화비닐(PVC)과 같은 물질은 생물막 관련 연구에 적합한 것으로 간주됩니다. PVC 96-웰 플레이트를 사용하는 연구는 미생물 생물막9을 연구하는 데 사용되었으며, 여기서 단일 또는 다종 생물막은 느슨하게 또는 조밀하게 채워진 생물막(10)을 초래할 수 있습니다. 따라서 PVC 96웰 플레이트의 사용은 바이오필름 염색 공정 중에 바이오필름 매트릭스가 쉽게 씻겨 나갈 수 있기 때문에 느슨하게 충전된 바이오필름에 적합하지 않은 것으로 간주됩니다. 따라서 우리는 미생물 생물막 형성을 연구하기 위해 유리 시험관에 의존했습니다(그림 3).
이 방법의 주요 한계는 특정 조건에서 자라는 미생물에는 작동하지 않으며 모든 박테리아가 이동할 수 있는 것은 아니라는 것입니다. 또한, 생물막은 미생물이 불리한 외부 환경으로부터 방어하는 데 도움이 되는 효과적인 수단이지만 모든 숙주 미생물이 생물막을 생산할 수 있는 것은 아닙니다. 예를 들어, 앞서 언급한 F. nucleatum ATCC 25586은 대장암 발병과 관련된 인간의 구강 또는 장 공생과 관련이 있으며17 혐기성 환경에서만 특이적으로 성장하지만 생물막을 생성하지는 않습니다. FT 매체의 효과를 검증하기 위해 FTM 실험에 사용했습니다. FT 배지는 박테리아에 구배 농도의 산소를 공급하는 데 효과적인 것으로 나타났습니다.
비교를 위해 혐기성 박테리아 F. nucleatum ATCC 25586(보충 그림 S4)의 성장 곡선과 화학적 영양성을 테스트했습니다. 성장 곡선 실험(보충 그림 S4A)에서 F. nucleatum ATCC 25586은 호기성 조건에서 성장할 수 없었고 혐기성 조건에서 웰 바닥에서 박테리아 응집을 보여주었습니다. 화학주성 실험(보충 그림 S4B)에서도 F. nucleatum ATCC 25586은 호기성 조건에서 성장하지 않았으며, 48시간 동안 혐기성 조건에서 현장 접종 후 적은 수의 박테리아가 발견되었습니다. 마찬가지로, 일부 박테리아는 이동을 통해 적절한 성장 조건을 적극적으로 찾을 수 없기 때문에 장기 휴면 상태에 진입하여 적절한 성장 조건을 기다립니다18. 엄격한 혐기성 박테리아의 배양에는 ET 발효 매체(반고체 플레이트에는 0.5% 한천을 보충해야 함)와 같은 특수 배지가 필요하며, 이는 기존의 분리 및 식별과도 다르다는 점에 유의해야 합니다. 이 제안된 방법은 대부분의 숙주 미생물을 특성화하는 데 적용할 수 있는 일반적인 방법이며, 이 기술은 쥐 뼈에서 분리된 3개의 미생물과 2개의 실험실 등급 미생물을 포함하여 5개의 미생물에 대해 시연되고 있습니다. 이 프로토콜은 향후 연구에서 분리된 미생물총(microbiota)을 적절하게 식별하는 데 도움이 될 것입니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 기술의 개발은 중국 국제 젊은 과학자 연구 기금(22050410270)의 국립 자연과학 재단, 해외 고위급 인재 혁신 및 기업가 정신을 위한 선전 특별 기금(KQTD20170810111314625) 및 광둥성 혁신 및 기업가 연구팀 프로그램(2019ZT08Y191)의 자금으로 지원되었습니다. 문서 교정과 실험실 관리에 도움을 주신 Chen Xinyi 양에게 진심으로 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Chemical/Solution | |||
| 1% crystal violet dye solution | Solarbio | G1062 | 100 mL |
| Agar | Sigma-Aldrich | V900500 | Used to obtain semi-solid plates, 20 g |
| Centrifuge tube | Corning | 430790 | 15 mL |
| Fluid thioglycollate medium | Kinghunt | K0001 | 29.3 g |
| Mueller Hinton II Broth medium | Solarbio | NO.11865 | 100 g |
| Petri dishes | Bkman | B-SLPYM90-15 | Plastic Petri dishes, circular, 90 mm x 15 mm |
| Potassium Chloride | VETEC | WXBC4493V | 0.2 g |
| Potassium Dihydrogen Phosphate | aladdin | 04-11-7758 | 0.24 g |
| Sodium chloride | Macklin | S805275 | 8.0 g |
| Sodium phosphate dibasic | aladdin | 7558-79-4 | 1.44 g |
| Terrific Broth medium | Solarbio | LA2520 | 200 g |
| Kits/ Equipment | |||
| Anaerobic incubator | Longyue | ||
| Biochemical incubator | Blue pard | LRH-70 | |
| Microplate reader | Spark | ||
| Tanon 5200multi imaging system | Tanon | 5200CE | |
| Thermostatic water bath | Jinghong | DK-S28 |
참고문헌
- Bernardi, S., et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients' tongue biofilm. MicrobiologyOpen. 9 (2), 958 (2020).
- Tellez, G., Latorre, J. D., Kuttappan, V. A., et al. Rye affects bacterial translocation, intestinal viscosity, microbiota composition and bone mineralization in Turkey poults. PLOS One. 10, (2015).
- Brewer, J. H. Clear liquid mediums for the "aerobic" cultivation of anaerobes. Journal of the American Medical Association. 115 (8), 598 (1940).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Liu, C., et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review. Frontiers in Microbiology. 11, 802 (2020).
- Kumar, A., et al. Biofilms: survival and defense strategy for pathogens. International Journal of Medical Microbiology. , (2017).
- Penesyan, A., et al. Secondary effects of antibiotics on microbial biofilms. Frontiers in Microbiology. 11, 2109 (2020).
- Bernardi, S., et al. Subinhibitory antibiotic concentrations enhance biofilm formation of clinical Enterococcus faecalis isolates. Antibiotics. 10 (7), 874 (2021).
- Tsukatani, T., Fumihiko, S., Rieko, K. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids. World Journal of Microbiology and Biotechnology. 36 (12), 1-9 (2020).
- Hartmann, R., et al. Emergence of three-dimensional order and structure in growing biofilms. Nature Physics. 15, 251-256 (2019).
- Liu, Z., et al. Advances in bacterial biofilm management for maintaining microbiome homeostasis. Biotechnology Journal. 15 (10), 1900320 (2020).
- Hall-Stoodley, L., Stoodley, P. Evolving concepts in biofilm infections. Cellular Microbiology. 11 (7), 1034-1043 (2009).
- Røder, H. L., et al. Enhanced bacterial mutualism through an evolved biofilm phenotype. The ISME Journal. 12 (11), 2608-2618 (2018).
- Matilla, M. A., Tino, K. The effect of bacterial chemotaxis on host infection and pathogenicity. FEMS Microbiology Reviews. 42 (1), 052 (2018).
- Moreira, L. M., et al. Chemotactic signal transduction and phosphate metabolism as adaptive strategies during citrus canker induction by Xanthomonas citri. Functional & Integrative Genomics. 15 (2), 197-210 (2015).
- Konishi, H., et al. Bacterial chemotaxis towards polysaccharide pectin by pectin-binding protein. Scientific Reports. 10 (1), 1-12 (2020).
- Kostic, A. D., et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host & Microbe. 14 (2), 207-215 (2013).
- Kochan, T. J., et al. Updates to Clostridium difficile spore germination. Journal of Bacteriology. 200 (16), 00218 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유