Method Article
测量各种细菌的迁移和生物膜形成
摘要
在这里,我们提出了一种分离和鉴定宿主内微生物的实用方法。通过这种方式,清楚地描述了微生物的物理化学性质和在宿主中可能的生活方式。
摘要
由于在宿主体内茁壮成长的微生物主要具有促进其生存的适应能力,因此分类和鉴定其性质的方法将有助于促进其表征。目前,大多数研究只关注一种特定的表征方法;然而,从宿主中分离和鉴定微生物是一个连续的过程,通常需要几种组合表征方法。在本文中,我们描述了鉴定微生物生物膜形成能力、微生物呼吸状态及其趋化行为的方法。这些方法用于鉴定五种微生物,其中三种是从 Sprague-Dawley (SD) 大鼠(Stationis棒状杆菌、 科氏葡萄球菌溶脲亚种和 粪肠球 菌)的骨组织中分离出来的,另外两种来自美国典型培养物保藏中心 (ATCC)-金黄色葡萄球菌 ATCC 25923 和 粪肠球 菌V583.从 SD 大鼠骨组织中分离的微生物包括革兰氏阳性微生物。这些微生物已经适应了在骨基质内的压力和营养限制环境中茁壮成长。本文旨在为读者提供在实验室环境中确定分离微生物的性质和行为的具体知识。
引言
以人体为代表的哺乳动物宿主含有大量的微生物。这些微生物广泛分布在宿主的口腔、消化道、肠道和血液中,对宿主的健康有不同的影响。口腔是大量微生物的宿主,这些微生物可以调节宿主对感染的易感性。 链球菌 (例如,螨状链球菌 /口腔链球菌、 假肺炎链球菌和 婴儿链球菌)和 普雷沃菌 属等微生物在口腔中定植,在舌头表面形成多物种生物膜,导致口臭,并充当微生物感染的微生物储存库。这些病原体可以通过浸润将牙根固定在颌骨中的牙周韧带来感染颚骨1。从宿主体内分离的这些微生物的表征通常是一个乏味的过程,特别是当微生物表现出需要特定治疗和生长条件的个体特征时。致病性幽 门螺杆菌、艰难梭 菌和 核梭杆菌等微生物在肠道的恶劣环境中茁壮成长,具有特定的氧气、营养和生长要求,对表征过程提出了挑战,尤其是在研究这些微生物的致病性方面。因此,科学家和医生需要一种标准化的方法来分离和研究这些微生物,以开发新的医学治疗方法。
该协议使用在大鼠骨基质中茁壮成长的微生物。传统上,除了以颌骨为代表的骨系统外,牙齿的存在使骨基质比其他骨骼更容易受到感染1,通常认为宿主的健康骨骼是一个无菌环境。然而,研究发现,微生物通过肠壁进入体循环,最终影响骨矿化2。作为概念验证,我们使用所描述的方案来表征来自健康 SD 大鼠(Stationicyukium stationis、 Staphylococcus cohnii subsp. 和 Enterococcus faecalis)股骨和胫骨微生物分离物的生化特性。之所以选择这些微生物分离物,是因为骨骼是一个封闭和缺氧的环境,从骨骼中表征这些微生物可能是一项具有挑战性的任务。各种文章详细介绍了研究这些微生物的过程;然而,很少有研究提供完整的方案来识别宿主分离的微生物。
在建立适当的培养条件时,需要通过使用液态巯基乙酸盐培养基 (FTM) 来了解微生物的氧气需求。具有不同氧气需求的微生物在透明的 FTM 液体中形成分层层3.根据分层曲线,然后使用微生物的需氧量来研究细胞的生长。在 FTM 液体表面茁壮成长的微生物是专性需氧菌,而生长在底部的微生物是专性厌氧菌。在 FTM 液体中以悬浮液形式生长的微生物是兼性厌氧菌或耐气厌氧菌。微生物生长速率是通过观察微生物细胞的指数生长期来确定的。然后将生长曲线与微生物的生物膜形成进行比较。生物膜主要由多个物种组成,它们直接或间接地影响彼此的健康。在此过程中,微生物群落之间的有益相互作用选择附着,提供有利于主动互惠相互作用进化的空间结构。例如,解淀粉芽孢杆菌和反枝黄单胞菌的共培养在静态环境中表现出兼性共生相互作用,促进生物膜的快速生长13。微生物通过生物膜的形成适应宿主组织以进行持续定位,保护自己免受恶劣环境的影响并逃避宿主的免疫系统 4,5,6,7。生物膜通常是致密的多层结构,可帮助微生物抵抗外部亚临界刺激;例如,牙髓中的粪肠球菌在面对亚浓度的四环素和万古霉素时,通过增加生物膜的形成来增强其对抗生素的耐药性8。
趋化性使微生物能够根据化学梯度移动,信号通路广泛分布在多种病原菌中。一些病原微生物在化学信号的引导下迁移到特定部位,引起传染病14。例如, 黄单胞菌属 在宿主中表达 19 个化学感受器和 11 个鞭毛蛋白,触发细菌结合,最终导致溃疡15。细菌中还有特异性蛋白质(果胶结合蛋白),它们指导细菌向营养物质的特异性迁移,这可以导致更好的生长16。这对于可能存在于营养贫乏环境中的细菌也至关重要。微生物细胞通常依靠趋化运动将自己吸引到有利的生长环境中,同时逃避其他损害细胞活力的捕食性细胞和毒素。在先前建立的确定趋化性的软琼脂方法的基础上,我们开发了一种可扩散方法来产生用于测试微生物趋化性的趋化因子梯度。
本文以 Corynebacterium stationis、Staphylacoccus cohnii、Enterococcus faecalis、Staphylacoccus aureus ATCC 25923 和 Enterococcus faecalis V583 为例,描述了确定细菌生长条件、生物膜形成和化学嗜性的方法(见 图 1)。微生物生长条件的优化使用 FTM 来确定微生物的氧气需求,而生物膜的形成使用玻璃表面作为固体背衬,生物膜块用结晶紫复染。微生物的化学趋向性取决于其趋化行为,其中通过 3D 打印(补充图 S1),使用标准化方法在软琼脂基质中生成化学引诱剂的化学储存库(补充图 S2)。
研究方案
注意:有关本协议中使用的所有材料和设备的详细信息,请参阅 材料表 。使用无菌技术以避免污染。
1. 细菌回收以获得单个菌落
- 准备固体琼脂平板。
- 制备含有琼脂的 Terrific Broth (TB) 培养基,每升液体含有 11.8 g 胰蛋白胨、23.6 g 酵母提取物、9.4 g K2HPO4、2.2 g KH2PO4 和 15 g 琼脂,pH = 7。
- 使用透气盖或带通风口的瓶封膜在 121 °C 下高压灭菌溶液 20 分钟。
- 在液体冷却和凝固之前,将含有琼脂的 TB 肉汤以每板 25 mL 的体积倒入 10 cm 塑料培养皿中。
注意:肉汤应在低于 60 °C 的温度下凝固之前倒入板中。 使用无菌技术防止污染。
- 细菌接种到板中
- 取出储存在 -80 °C 的目标菌株,并在生物安全柜中在室温下解冻。
- 使用 10 μL 移液器吸取 10 μL 细菌悬浮液,并通过划线将其涂抹在 TB 板上。
- 密封板以防止污染。将板置于 37 °C 的生化培养箱中。 ~24 小时后目视检查菌落生长。挑选单个菌落并通过 PCR 扩增它们,以确认它们仅包含一种类型的细菌。
2. 细菌液体培养至对数生长期
- 制备液体培养基。
- 请参阅步骤 1.1.1 中固体琼脂平板的制备。制备 TB 液体培养基,其中 1 L 含有 11.8 g 胰蛋白胨、23.6 g 酵母提取物、9.4 g K2HPO4 和 2.2 g KH2PO4,pH ~7。
注意:不要添加琼脂。细菌在液体营养环境中生长得更快。 - 使用透气盖或带通风口的瓶封膜在 121 °C 下高压灭菌溶液 20 分钟。
- 将液体培养基储存在 4 °C。
- 请参阅步骤 1.1.1 中固体琼脂平板的制备。制备 TB 液体培养基,其中 1 L 含有 11.8 g 胰蛋白胨、23.6 g 酵母提取物、9.4 g K2HPO4 和 2.2 g KH2PO4,pH ~7。
- 细菌接种和培养
- 在生物安全柜中,用接种环或 10 μL 移液器挑选一个菌落,并在锥形瓶中将细菌接种在制备好的 TB 液体培养基中。
- 用纱布密封锥形瓶,并将其置于37°C的振荡器(200rpm)中以培养细菌。
注意:液体培养基在 5 小时内逐渐变浑浊;变浑浊所需的时间因细菌而异。
3. FTM 实验和生长曲线测定
- 液体巯基乙酸盐培养基 (FTM) 制备
- 制备巯基乙酸盐培养基 (TM),每升含有 15 克胰蛋白胨、5 克酵母提取物、5 克葡萄糖、0.5 克 L-半胱氨酸、0.5 克巯基乙酸钠、2.5 克氯化钠、0.001 克刃天青和 0.75 克琼脂。
注意:市售固体培养基可以很容易地用水复溶并消毒(步骤 3.1.2.)。 - 称取 29.3 g 巯基乙酸盐固体培养基,加入 1 L 蒸馏水,加热搅拌直至完全溶解,直至溶液变为粉红色。
- 将 TM (19 mL) 添加到带有密封塞的试管中。密封后,使用透气盖或带通风口的瓶子密封膜在 121 °C 下高压灭菌溶液 20 分钟。
注意:加热后,溶液变为浅黄色。
- 制备巯基乙酸盐培养基 (TM),每升含有 15 克胰蛋白胨、5 克酵母提取物、5 克葡萄糖、0.5 克 L-半胱氨酸、0.5 克巯基乙酸钠、2.5 克氯化钠、0.001 克刃天青和 0.75 克琼脂。
- 细菌的接种、培养和观察
- 准备细菌悬浮液,使其在液体 TB 培养基中生长至 OD 0.6-0.8(参见步骤 2.2)。
- 在生物安全柜中无菌条件下打开试管密封塞,尽快向含有 FTM 的试管中加入 1 mL 细菌培养物,并立即再次密封试管。
- 轻轻摇动试管以确保细菌在液体中均匀分布,并将试管置于 37 °C 进行静态培养。
- 孵育 48 小时后,观察各种试管中 FTM 中不同细菌的生长情况并拍照。
- 在有氧条件下测定生长曲线
- 准备具有合适 OD 值的初始细菌培养物(参见步骤 2.2.),并培养细菌直到它们达到对数生长期。
注:该方案中使用的 Corynebacterium stationis、Staphylacoccus cohnii、Enterococcus faecalis、Staphylacoccus aureus ATCC 25923 和 Enterococcus faecalis V583 需要 ~5 小时才能达到对数期。 - 将 200 μL TB 液体培养基中的细菌培养物(来自步骤 3.3.1)加入到 96 孔板的每个孔中,一式三份。使用酶标仪测定 600 nm 处的 OD 值,并稀释不同的细菌培养物,使不同含细菌的孔与 TB 液体培养基(空白)之间的 OD 差异在 0.01 和 0.02 之间。
- 取一个新的 96 孔板,加入 TB 培养基,将步骤 3.3.2. 中不同的稀释细菌培养物一式三份转移到板上,并将其放在超净工作台上。
- 用密封胶带密封 96 孔板,放入酶标仪中,并按如下方式设置程序:
- 将 温度 设置为 37 °C ± 0.5。
- 将 Kinetic Loop 设置为总共 60 个循环,每个循环 30 分钟。
- 将 吸光度 设置为 600 nm。
- 将 Shaking 设置为一个周期的 1,600 秒 。
- 运行程序并在增长曲线趋于平稳时停止它。
- 准备具有合适 OD 值的初始细菌培养物(参见步骤 2.2.),并培养细菌直到它们达到对数生长期。
- 厌氧条件下生长曲线的测定
- 按照步骤 3.3 进行作。但在用密封胶带密封板之前,将带有 TB 培养基和细菌悬浮液的 96 孔板保存在厌氧培养箱中。泵送并用氮气填充厌氧箱,以将氧气浓度降低到 <3%。用密封胶带密封 96 孔板,并将其留在厌氧盒中。
4. 生物膜形成能力测试
- 在液体培养基中培养细菌至对数生长期。
- 请参阅第 2 节以接种 TB 液体培养基中的细菌。
- 在 37 °C 的摇床中培养细菌过夜,确保细菌培养基的 OD600 在 0.6 和 0.8 之间。
- 分细菌培养物,在不同条件下培养。
- 当细菌培养物的 OD600 在 0.6 和 0.8 之间时,将 10 mL 这种细菌悬浮液添加到玻璃试管中。
- 将每种细菌培养物分为两组:需氧和厌氧条件,并一式三份执行所有作。
- 对于好氧组,用锡箔包裹含有细菌悬浮液的试管,并在 37 °C 水浴中恒温孵育。
- 对于厌氧组,用锡箔包裹含有细菌悬浮液的试管,并将其转移到厌氧培养箱中。去除厌氧培养箱中的锡箔纸,通过泵送并充满氮气,将培养箱中的氧气浓度降低至 <3%。用磨砂玻璃塞封闭试管,密封后取出,在37°C水浴中孵育。
- 每 6 小时,从两组(需氧/厌氧)中各取三个试管,以观察底部生物膜的生长,并按照步骤 4.3 染色。
- 丢弃细菌悬浮液并干燥生物膜。
- 在不同时间点取出试管,小心吸出细菌悬浮液的上层。观察粘附在试管底部的白色生物膜。
注意:吸出细菌悬浮液时注意不要干扰生物膜。 - 沿试管壁小心加入 2 mL 磷酸盐缓冲盐水 (PBS),轻轻摇晃以洗去吸附在生物膜中的浮游细菌,然后小心吸出 PBS 缓冲液。
- 将底部吸附有生物膜的试管放入烤箱中干燥 30 分钟。
- 在不同时间点取出试管,小心吸出细菌悬浮液的上层。观察粘附在试管底部的白色生物膜。
- 染色
- 取出试管,向每个试管中加入 2 mL 0.1% 结晶紫染色液,并在室温下对生物膜染色 30 分钟。
- 使用移液管小心吸出结晶紫染料溶液。沿试管壁小心加入蒸馏水,洗去残留的结晶紫染料溶液,重复 3 次至 5 次,直到加入的蒸馏水几乎变为无色。观察试管底部的紫色生物膜。
- 再次擦干试管。
- 用 95% 乙醇溶解生物膜并测量生物膜溶液的 OD600 。
- 取出干燥的试管,向每支试管中加入 10 mL 95% 乙醇,并充分摇匀,确保结晶紫完全溶解在乙醇中。
- 将结晶紫的乙醇溶液加入 96 孔板中,以每孔 200 μL 的体积,并在 600 nm 波长下测量其吸光度。
注:根据比尔-朗伯定律,吸光度与溶液浓度呈线性关系,因此OD600 的值可以反映结晶紫的浓度,结晶紫的浓度反映了不同时间细菌悬浮液中生物膜的量。
5. 细菌趋化性试验
- 准备差异富营养琼脂平板。
- 参考步骤 1 制备含有 0.5% 琼脂的半剂量 MH 培养基,每升含有 11.8 g 胰蛋白胨、23.6 g 酵母提取物、9.4 g K2HPO4、2.2 g KH2PO4 和 5 g 琼脂,pH ~7。
- 参考步骤 1 制备含有 0.5% 琼脂的 5x TB 培养基,每升含有 59 g 胰蛋白胨、118 g 酵母提取物、47 g K2HPO4、11 g KH2PO4 和 5 g 琼脂,pH ~7。
- 使用透气盖或带通风口的瓶封膜在 121 °C 下高压灭菌溶液 20 分钟。
- 在液体冷却和凝固之前,每板倒入 25 mL 半剂量 MH 肉汤(含有 0.5% 琼脂),用 3D 打印的盖子盖住板,并将其放入生物安全柜中。冷却后,取下盖子,观察半固体介质中的圆柱形孔(直径 1.4 cm)。
注意:使用树脂材料的 3D 打印盖子不能使用高温蒸汽进行消毒。为了杀死表面细菌,可以用 95% 乙醇喷洒,然后在生物安全柜中用紫外灯照射 30 分钟。取下盖子时,沿垂直方向用力并小心提起,以防止损坏半固体琼脂。 - 在 5x TB 肉汤(含有 0.5% 琼脂)凝固之前,使用移液器将 5x TB 肉汤加入半固体板的孔中,直到肉汤与培养基表面齐平。
- 在生物安全柜中冷却板,以获得含有富营养体的半固体琼脂平板。注意避免板被环境微生物污染。
注意:半固体培养基仍然具有一定的流动性,因此在倒置储存之前必须完全冷却。
- 细菌接种、培养和摄影
- 将琼脂板和半固体培养基放入生物安全柜中,并在紫外线照射下冷却 ~30 分钟,以防止细菌污染。
- 使用 10 μL 移液器吸取 4 μL 培养至 OD 为 ~0.6-0.8 的细菌悬浮液,将移液器吸头插入塑料培养皿的中心,然后吸出细菌悬浮液。
- 等待细菌悬浮液被吸收到培养基中 1 分钟。当细菌悬浮液被完全吸收后,将板分成两组(需氧/厌氧),一式三份。
- 用密封胶带密封好氧基团,并将这些板倒置在 37 °C 生化培养箱中进行静态培养。如步骤 4.2 所述,将厌氧基团密封在厌氧盒中,在 37 °C 下倒置板以进行生长。
- 每 12 小时(0 h、12 h、24 h、36 h 和 48 h)检查细菌的传播和迁移,并使用成像系统拍摄板的图像。
- 使用 ImageJ 软件计算细菌迁移距离。
- 导入使用成像系统获取的图像文件。
- 设置比例尺并将其应用于所有图像。
- 拍照时,添加标尺,创建线段,选择直线段(例如 1 cm,然后将该线段的长度设置为 1 cm),并标记板的长度。
- 打开 Set Scale 窗口;单击 Analyze |设置 Scale。
- 在 Known distance (已知距离 ) 和 Unit of length (长度单位) 中键入实际长度。
- 选中 Global。
- 输入原始图像的文件夹地址和输出文件地址。
- 使用 直线 工具逐个选择群落并调整容差,直到直线工具线适合向两侧延伸的细菌菌落的边界。
- 分别测量菌落从中心到两端的迁移距离,并通过单击 分析 |测量。
- 重复步骤 5.3.3-5.3.4,直到测量完所有社区,并将结果保存到 .csv 文件中以供进一步分析。
结果
这项工作描述了从宿主微生物组中表征分离微生物的方法(图 1)。作为概念验证,从 SD 大鼠宿主中分离出三种微生物(C. stationis、S. cohnii 和 E. faecalis),并使用该方案测试了两种商业获得的微生物(金黄色 葡萄球菌 ATCC 25923 和 粪肠球 菌 V583)。 为了使用 FTM 确定单个微生物的氧需求,我们添加了两种对照生物,一种专性厌氧菌 (Fusobacterium nucleatum ATCC 25586) 和一种兼性厌氧菌 (铜绿假单胞 菌 PAO1)。结果表明,测试的五种微生物是兼性厌氧菌(图 2A),与先前报道的这些微生物的概况一致11。为了阐明它们的氧气需求,微生物在好氧和厌氧条件下培养。所有测试的微生物在需氧和厌氧条件下均表现出 S 形生长曲线;然而,OD600nm 所示的微生物密度表明,所有五种微生物都对富氧环境具有更高的偏好(图 2B、C)。这些观察结果与微生物渗透和感染大鼠骨骼的能力一致,大鼠骨骼通常被认为是缺氧的。
发现这 5 种细菌分离物自然形成生物膜,其中在厌氧条件下产生的生物膜质量较高。通过生长曲线比较,发现 粪肠球 菌和 金黄色 葡萄球菌 ATCC 25923 的生物膜在好氧和厌氧环境中的静止生长期都是主动形成的(图 3)。这一观察结果表明,生物膜的形成取决于细胞的生长状态,可能受触发生物膜形成的细胞内信号分子的调节11。生物膜形成对生长条件的这种依赖性与缺乏氧气和营养物质的宿主骨基质环境所呈现的营养和生长条件一致。
对微生物发病机制的研究通常与微生物迁移到被认为有利于生长的部位的能力有关。关于微生物趋化性的研究很多,但没有一种标准化的研究方法。此外,使用不可扩散的化学品被认为是研究这种现象的限制因素。在这里,我们开发了一种通过 3D 打印生产的树脂盖,它标准化了化学储液罐和接种点之间的距离(补充图 S1 和 补充图 S2)。我们研究了微生物向营养丰富的环境的迁移,其中 5x TB 被用作化学兴奋剂。在好氧和厌氧条件下监测微生物 48 小时,其中所有五种微生物都显示出不同程度的趋向性迁移(图 4A)。
ImageJ 用于测量细菌的迁移距离(图 4B);向储层迁移似乎比向相反方向迁移要快。朝向储层的迁移距离与朝向相反方向的迁移距离之比表明由于微生物趋化性,微生物菌落迅速扩张(图 5B)。在这项研究中, 金黄色葡萄球菌 ATCC 25923 等细菌的迁移速度比 C. stationis 等其他微生物更快。有趣的是,在需氧和厌氧条件下趋化培养物的迁移曲线表明,一些细菌,如 粪肠球菌, 在好氧和厌氧条件下表现出迁移模式的变化,其中在厌氧条件下观察到随着时间的推移而快速扩增。令人困惑的是,实验室菌株 E. faecalis V583 倾向于在有氧环境中进行趋化性。因此,这表明从不同来源分离的 粪肠球菌 具有不同的生长要求,以适应生长环境。

图 1:作过程示意图。 (A) 将细菌接种在平板上,然后接种到液体培养基中并生长至对数生长期。(B) 测定细菌在不同条件(好氧/厌氧)下形成生物膜的能力。每个时间点 (6 h) 选择 3 个样品并平行重复。(C) 不同条件下(好氧/厌氧)细菌的化学趋向实验方案。 请单击此处查看此图的较大版本。

图 2:微生物生长条件。 (A) 在巯基乙酸盐液培养基中培养的细菌的生长曲线(从左到右分别为 I: 核梭杆菌 ATCC 25586、II: 站状棒状杆菌、III: 科氏葡萄球菌、IV: 粪肠球菌、 V: 金黄色葡萄球菌 ATCC 25923、VI: 粪肠球菌 V583 和 VII: 铜绿假单胞 菌 PAO1)。(B) 在有氧条件下从宿主分离的微生物的生长曲线。(C) 厌氧条件下从宿主分离的微生物的生长曲线。 请单击此处查看此图的较大版本。
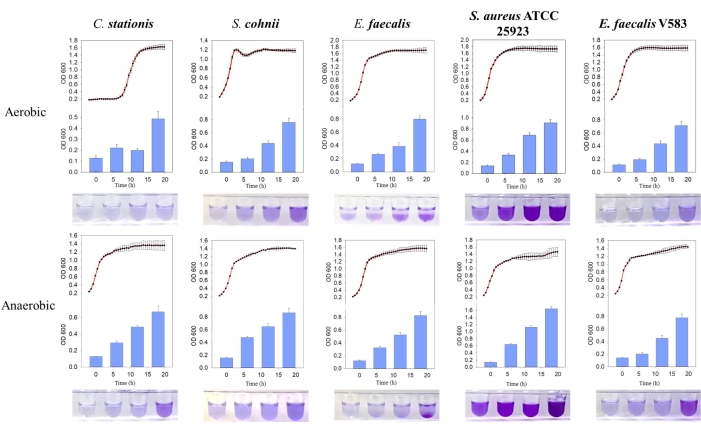
图 3:不同细菌在不同条件下的生长曲线和生物膜形成的比较。 从左到右依次为 固定棒状杆菌、科氏葡萄球菌、粪肠球菌、金黄色 葡萄球菌 ATCC 25923 和 粪肠球 菌 V583。红色曲线是生长曲线,蓝色直方图是产生的生物膜量。 请单击此处查看此图的较大版本。
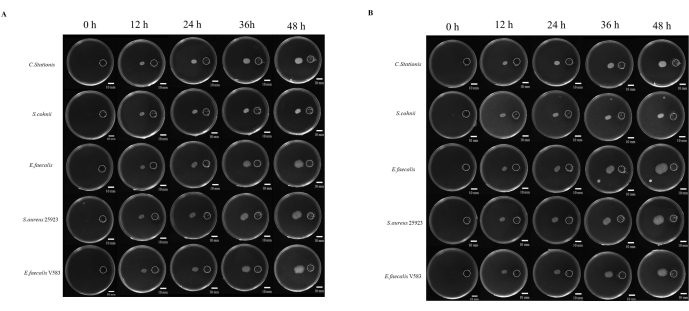
图 4:微生物向富营养化生长。 (A) 好氧条件,(B) 厌氧条件。五种类型的细菌(从上到下分别是 Corynebacterium stationis、Staphylacoccus cohnii、Enterococcus faecalis、Staphylacoccus aureus ATCC 25923 和 Enterococcus faecalis V583)倾向于在差异营养板上向富营养化生长。比例尺 = 10 毫米。 请点击此处查看此图的较大版本。

图 5:不同条件下(需氧/厌氧)下微生物的趋化性。 (A) 5 个细菌在含有营养丰富的琼脂平板上的化学嗜性迁移结果;左组表示好氧条件,右组表示厌氧条件。每个实验一式三份平行重复。(B) 化学嗜性数据分析。上半部分代表好氧条件,下半部分代表厌氧条件。从左到右依次为 固定棒状杆菌、科氏葡萄球菌、粪肠球菌、金黄色 葡萄球菌 ATCC 25923 和 粪肠球 菌 V583。红色和蓝色柱是细菌从营养体迁移到营养体和远离营养体的迁移距离。该线是两个值之间的差值 (红色 - 蓝色)。比例尺 = 10 毫米。 请点击此处查看此图的较大版本。
补充图 S1:使用 3D 打印盖子制作营养差异琼脂板。 (A) 使用软件准备 3D 打印模具效果图。(B) 用 8,000 树脂打印的平盖模具。(C) 使用上述方法获得营养差异琼脂平板。(D) 营养差异琼脂平板的生产。 请点击此处下载此文件。
补充图 S2:营养差异琼脂平板的构建和使用 ImageJ 测量细菌迁移距离。 (A) 营养差异琼脂板的结构使用 3D 打印的盖子(包含一个圆柱形突起)来覆盖板。琼脂冷却后,形成一个圆柱形孔(红色圆圈),其中填充有 5x TB 琼脂。然后将其冷却以获得营养差异琼脂平板。(B) 使用 ImageJ 测量细菌在不同方向上的迁移距离。设置 比例尺 (分析 | Set Scale) 并使用 Straight (分析 ) | Measure) 的 Measure 中)。 请点击此处下载此文件。
补充图 S3:M9 最小培养基-5x TB 培养基琼脂上五种细菌的生长模式。 左组用于有氧条件,右组用于厌氧条件。 请点击此处下载此文件。
补充图 S4: 核梭杆菌 ATCC 25586 生长曲线和厌氧菌趋化性的对照实验。 (A) 在好氧和厌氧条件下 F. nucleatum ATCC 25586 生长曲线的测定。(B) 不同氧气条件下, F. nucleatum ATCC 25586 在半剂量 MH-5x TB 琼脂平板上的趋化性实验。 部分增大: 厌氧条件下 F. nucleatum ATCC 25586 在 48 小时后在平板上的生长(部分放大)。 请点击此处下载此文件。
| 复合 | 浓度 (g/L) |
| Na2HPO4 | 6.78 |
| KH2PO4 | 3 |
| 氯化钠 | 0.5 |
| NH4Cl 盐 | 1 |
| 硫酸镁4.7H 2O | 0.493 |
| 氯化钙2 | 0.011 |
| 葡萄糖 | 4 |
表 1:M9 Minimal 培养基的成分和内容。
讨论
我们通过顺序方法分离和鉴定了 5 种细菌。细菌的生长对营养的需求最小:最低培养基 - 仅包含无机盐、碳源和水的培养基。虽然实验组的细菌是在 MH 固体平板上发现的,但我们使用半剂量 MH 培养基验证细菌的趋化性,取得了良好的效果。然而,我们也使用最少的培养基进行了对照实验。实验中使用 M9 碱性培养基(其组成和含量见 表 1 ),营养琼脂块仍使用 5x TB 琼脂。实验结果显示在 补充图 S3 中。尽管这些细菌(粪 肠球菌除外)在 M9 培养基中生长缓慢且移动缓慢,但正如在这些实验中观察到的那样,存在大致相似的趋势(在营养琼脂上生长)。然而, 粪肠球 菌 V583 没有在 M9 基本培养基上生长,可能是由于缺乏粪 肠球 菌在 M9 培养基中生长所需的成分。因此,我们建议使用半剂量 MH 培养基作为营养缺乏的底物,以模拟营养缺乏条件下的细菌生长和迁移。这也有助于使用 ImageJ 软件来测量细菌倾向于迁移的距离。
生物膜通常被定义为表面相关的微生物群落,是一种重要的微生物生存策略。铜 绿假单胞菌、流感 嗜血杆菌、 肺炎链球菌和 金黄色 葡萄球菌等生物体可以在无症状宿主中发现, 在体内 发现贴壁微生物通常被称为定植,而不是感染。一个非常重要的问题是缺乏理想的动物定植模型12.微生物在生物膜形成之前表现出对带电表面的初始附着,其中玻璃和聚氯乙烯 (PVC) 等材料被认为适合生物膜相关研究。使用 PVC 96 孔板的研究已被用于研究微生物生物膜9,其中单物种或多物种生物膜可能导致松散或密集的生物膜10。因此,使用 PVC 96 孔板被认为不适合松散填充的生物膜,因为生物膜基质在生物膜染色过程中很容易被洗掉。因此,我们依靠玻璃试管来研究微生物生物膜的形成(图 3)。
这种方法的一个关键限制是它不适用于在特定条件下生长的微生物,并且并非所有细菌都可以迁移。此外,尽管生物膜是帮助微生物抵御不利外部环境的有效手段,但并非所有宿主微生物都能够产生生物膜。例如,前面提到的 F. nucleatum ATCC 25586 与结肠癌发展相关的人类口腔或肠道共生有关17,仅在厌氧环境中特异性生长,但不产生生物膜。我们在 FTM 实验中使用它来验证 FT 培养基的有效性。FT 培养基已被证明可有效为细菌提供梯度浓度的氧气。
为了进行比较,我们测试了厌氧菌 F. nucleatum ATCC 25586 的生长曲线和化学嗜性(补充图 S4)。在生长曲线实验(补充图 S4A)中, 有核镰刀菌 ATCC 25586 在好氧条件下无法生长,并且在厌氧条件下显示细菌聚集在井底。同样在趋化性实验 (补充图 S4B) 中, 有核镰刀菌 ATCC 25586 在有氧条件下不生长,并且在厌氧条件下原 位接种 48 小时后发现少量细菌。同样,由于一些细菌无法通过迁移积极寻找合适的生长条件,因此它们通过进入长期休眠状态来等待合适的生长条件18。需要注意的是,严格厌氧菌的培养需要特殊的培养基,如ET发酵培养基(半固体平板必须补充0.5%琼脂),这也不同于常规的分离鉴定。本提议的方法是适用于表征大多数宿主微生物的通用方法,该技术已针对五种微生物进行了演示,包括从小鼠骨骼中分离的三种微生物和两种实验室级微生物。该协议将有助于在未来研究中正确鉴定微生物群分离株。
披露声明
作者没有需要披露的利益冲突。
致谢
该技术的开发得到了国家自然科学基金国际青年科学研究基金 (22050410270)、深圳市海外高层次人才创新创业专项资金 (KQTD20170810111314625) 和广东省创新创业研究团队计划 (2019ZT08Y191) 的资助。我们衷心感谢陈欣怡小姐在校对文件和实验室管理方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Chemical/Solution | |||
| 1% crystal violet dye solution | Solarbio | G1062 | 100 mL |
| Agar | Sigma-Aldrich | V900500 | Used to obtain semi-solid plates, 20 g |
| Centrifuge tube | Corning | 430790 | 15 mL |
| Fluid thioglycollate medium | Kinghunt | K0001 | 29.3 g |
| Mueller Hinton II Broth medium | Solarbio | NO.11865 | 100 g |
| Petri dishes | Bkman | B-SLPYM90-15 | Plastic Petri dishes, circular, 90 mm x 15 mm |
| Potassium Chloride | VETEC | WXBC4493V | 0.2 g |
| Potassium Dihydrogen Phosphate | aladdin | 04-11-7758 | 0.24 g |
| Sodium chloride | Macklin | S805275 | 8.0 g |
| Sodium phosphate dibasic | aladdin | 7558-79-4 | 1.44 g |
| Terrific Broth medium | Solarbio | LA2520 | 200 g |
| Kits/ Equipment | |||
| Anaerobic incubator | Longyue | ||
| Biochemical incubator | Blue pard | LRH-70 | |
| Microplate reader | Spark | ||
| Tanon 5200multi imaging system | Tanon | 5200CE | |
| Thermostatic water bath | Jinghong | DK-S28 |
参考文献
- Bernardi, S., et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients' tongue biofilm. MicrobiologyOpen. 9 (2), 958 (2020).
- Tellez, G., Latorre, J. D., Kuttappan, V. A., et al. Rye affects bacterial translocation, intestinal viscosity, microbiota composition and bone mineralization in Turkey poults. PLOS One. 10, (2015).
- Brewer, J. H. Clear liquid mediums for the "aerobic" cultivation of anaerobes. Journal of the American Medical Association. 115 (8), 598 (1940).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Liu, C., et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review. Frontiers in Microbiology. 11, 802 (2020).
- Kumar, A., et al. Biofilms: survival and defense strategy for pathogens. International Journal of Medical Microbiology. , (2017).
- Penesyan, A., et al. Secondary effects of antibiotics on microbial biofilms. Frontiers in Microbiology. 11, 2109 (2020).
- Bernardi, S., et al. Subinhibitory antibiotic concentrations enhance biofilm formation of clinical Enterococcus faecalis isolates. Antibiotics. 10 (7), 874 (2021).
- Tsukatani, T., Fumihiko, S., Rieko, K. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids. World Journal of Microbiology and Biotechnology. 36 (12), 1-9 (2020).
- Hartmann, R., et al. Emergence of three-dimensional order and structure in growing biofilms. Nature Physics. 15, 251-256 (2019).
- Liu, Z., et al. Advances in bacterial biofilm management for maintaining microbiome homeostasis. Biotechnology Journal. 15 (10), 1900320 (2020).
- Hall-Stoodley, L., Stoodley, P. Evolving concepts in biofilm infections. Cellular Microbiology. 11 (7), 1034-1043 (2009).
- Røder, H. L., et al. Enhanced bacterial mutualism through an evolved biofilm phenotype. The ISME Journal. 12 (11), 2608-2618 (2018).
- Matilla, M. A., Tino, K. The effect of bacterial chemotaxis on host infection and pathogenicity. FEMS Microbiology Reviews. 42 (1), 052 (2018).
- Moreira, L. M., et al. Chemotactic signal transduction and phosphate metabolism as adaptive strategies during citrus canker induction by Xanthomonas citri. Functional & Integrative Genomics. 15 (2), 197-210 (2015).
- Konishi, H., et al. Bacterial chemotaxis towards polysaccharide pectin by pectin-binding protein. Scientific Reports. 10 (1), 1-12 (2020).
- Kostic, A. D., et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host & Microbe. 14 (2), 207-215 (2013).
- Kochan, T. J., et al. Updates to Clostridium difficile spore germination. Journal of Bacteriology. 200 (16), 00218 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。