Method Article
さまざまな細菌の移動とバイオフィルム形成の測定
要約
ここでは、宿主内の微生物を単離および同定するための実用的な方法を紹介します。このようにして、微生物の物理化学的性質と宿主での生活の可能な方法が明確に説明されています。
要約
宿主体内で繁殖する微生物は、主に生存を促進する適応能力を持っているため、その性質を分類および特定する方法は、その特性評価を容易にするのに有益です。現在、ほとんどの研究は、1つの特定の特性評価方法のみに焦点を当てています。ただし、宿主からの微生物の単離と同定は継続的なプロセスであり、通常、いくつかの組み合わせ特性評価方法が必要です。ここでは、微生物のバイオフィルム形成能力、微生物の呼吸状態、およびそれらの走化性挙動を特定する方法について説明します。この方法を用いて5つの微生物を同定し、そのうち3つはSprague-Dawley(SD)ラット(Corynebacterium stationis、 Staphylococcus cohnii subsp. urealyticus、 Enterococcus faecalis) の骨組織から単離され、2つはAmerican Type Culture Collection(ATCC)-Staphylococcus aureus ATCC 25923および Enterococcus faecalis から単離されましたV583です。SDラットの骨組織から単離された微生物には、グラム陽性菌が含まれます。これらの微生物は、骨基質内のストレスの多い栄養制限環境下で繁殖するように適応しています。この記事は、実験室環境内で単離された微生物の性質と挙動を決定するための特定のノウハウを読者に提供することを目的としています。
概要
人体に代表される哺乳類宿主には、多数の微生物が含まれています。これらの微生物は、宿主の口、消化管、腸、血液に広く分布しており、宿主の健康にさまざまな影響を及ぼします。口腔には、宿主の感染に対する感受性を調節できる多数の微生物が生息しています。連鎖球菌(S. mitis/oralis、S. pseudopneumoniae、S. infantisなど)やPrevotella spp.などの微生物が口腔内にコロニーを形成し、舌の表面に多種のバイオフィルムを形成して口臭を引き起こし、微生物感染の微生物貯蔵庫として機能します。これらの病原体は、顎骨の歯根を保持する歯周靭帯に浸潤することにより、顎骨に感染する可能性があります1。宿主体から単離されたこれらの微生物の特性評価は、特に微生物が特定の治療や成長条件を必要とする個々の形質を示す場合、しばしば面倒なプロセスです。病原性ヘリコバクター・ピロリ菌、クロストリジウム・ディフィシル菌、フソバクテリウム・ヌクレアタムなどの微生物は、腸内の過酷な環境で増殖し、特定の酸素、栄養素、および成長要件があるため、特性評価プロセス、特にこれらの微生物の病原性を調査する上での課題となっています。したがって、科学者や医療従事者が新しい治療法を開発するためには、これらの微生物を分離して調査する標準化された方法が必要です。
このプロトコルは、ラットの骨基質で繁殖する微生物を使用します。伝統的に、歯の存在が骨基質を他の骨1よりも感染しやすくする顎に代表される骨系を除いて、宿主の健康な骨は無菌環境であると一般に考えられています。しかし、研究によると、微生物は腸壁を通じて体循環に入り込み、最終的に骨の石灰化に影響を与えることがわかっています2。概念実証として、記載されているプロトコルを使用して、健康なSDラット(Corynebacterium stationis、 Staphylococcus cohnii subsp.、および Enterococcus faecalis)の大腿骨および脛骨からの微生物分離株の生化学的特性を特徴付けます。これらの微生物分離株は、骨が閉鎖的で低酸素環境であり、骨からこれらの微生物を特徴付けることは困難な作業になる可能性があるため、選択されました。さまざまな記事で、これらの微生物の研究に使用されるプロセスについて詳しく説明しています。しかし、宿主単離された微生物を同定するための完全なプロトコルを提供するものはほとんどありません。
適切な培養条件を確立するには、液体チオグリコール酸培地(FTM)を使用して微生物の酸素必要量を理解する必要があります。異なる酸素要件を持つ微生物は、透明なFTM液体中に層状層を形成します3.次に、層別化プロファイルに基づいて、微生物の酸素必要量を使用して細胞の増殖を調査します。FTM液体の表面で繁殖する微生物は偏性好気性菌であり、底部で増殖する微生物は偏性嫌気性菌です。FTM液中で懸濁液として増殖する微生物は、通性嫌気性菌または気性嫌気性菌のいずれかです。微生物の増殖速度は、微生物細胞の指数関数的な増殖期を観察することによって確立されます。次に、成長プロファイルを微生物のバイオフィルム形成と比較します。バイオフィルムは、主に複数の種で構成されており、直接的および間接的に互いの健康に影響を与えます。この過程で、微生物群集間の有益な相互作用が付着を選択し、活発な相互相互作用の進化を促進する空間構造を提供します。例えば、Paenibacillus amylolyticusとXanthomonas retroflexusの共培養は、静的な環境下で通性共生相互作用を示し、バイオフィルムの急速な成長を促進する13。微生物は、持続的な局在化のためにバイオフィルム形成を介して宿主組織に適応し、過酷な環境から身を守り、宿主の免疫系を回避します4,5,6,7。バイオフィルムは通常、微生物が外部の亜臨界刺激に抵抗するのを助ける緻密で多層構造です。例えば、歯髄中のE. faecalisは、テトラサイクリンとバンコマイシンのサブ濃度に直面したときにバイオフィルム形成を増加させることにより、抗生物質に対する耐性を高めます8。
走化性は、微生物が化学的勾配に従って移動することを可能にし、シグナル伝達経路はさまざまな病原菌に広く分布しています。一部の病原性微生物は、化学信号の誘導の下で特定の場所に移動し、感染症を引き起こします14。例えば、 Xanthomonas spp. 宿主で19の化学受容器と11のフラジェリンタンパク質を発現させ、細菌の結合を引き起こし、最終的には潰瘍形成を引き起こします15。また、細菌には特定のタンパク質(ペクチン結合タンパク質)があり、それが細菌の栄養素への特異的な移動を導き、それがより良い成長につながる可能性がある16。これは、栄養価の低い環境に存在する可能性のある細菌にとっても重要です。微生物細胞は、細胞の生存能力を害する他の捕食細胞や毒素を回避しながら、成長を助長する環境に自分自身を引き寄せるために、走化性の運動性に依存することがよくあります。走化性を決定するために以前に確立された軟寒天アプローチに基づいて、微生物の走化性をテストするための走化性勾配を生成する拡散可能な方法を開発します。
この論文では、 Corynebacterium stationis、Staphylacoccus cohnii、Enterococcus faecalis、Staphylacoccus aureus ATCC 25923、 およびEnterococcus faecalis V583を例に、細菌の増殖条件、バイオフィルム形成、および化学的親和性を決定する方法について説明します( 図1を参照)。微生物の増殖条件の最適化では、FTMを使用して微生物の酸素必要量を決定し、バイオフィルム形成はガラス表面を固体の裏地として使用し、バイオフィルムの塊はクリスタルバイオレットで対比染色されます。微生物の化学的指向性は、その走化性挙動に依存しており、3Dプリンティング(補足図S1)を通じて、標準化された方法を使用して、軟寒天マトリックス中に化学誘引物質の化学リザーバーを生成します(補足図S2)。
プロトコル
注意: このプロトコルで使用されるすべての材料と機器の詳細については、 資料の表 を参照してください。無菌技術を使用して、汚染を回避します。
1.単一のコロニーを得るための細菌の回復
- 固形の寒天プレートを準備します。
- 寒天を含むTerrific Broth(TB)培地を調製し、各リットルの液体には11.8 gのトリプトン、23.6 gの酵母抽出物、9.4 gのK2HPO4、2.2 gのKH2PO4、および15 gの寒天が含まれ、pH = 7です。
- 溶液を121°Cで20分間オートクレーブ処理し、通気性のあるキャップまたは通気孔付きのボトルシールフィルムを使用します。
- 液体が冷えて固まる前に、寒天を含むTBブロスを10cmのプラスチックシャーレにプレートあたり25mLの容量で注ぎます。
注:ブロスは、60°C未満の温度で固化する前にプレートに注ぐ必要があります。 無菌技術を使用して汚染を防ぎます。
- プレートへの細菌接種
- -80°Cで保存した対象菌株を取り出し、生物学的安全キャビネット内で室温で解凍します。
- 10 μLのピペットを使用して10 μLの細菌懸濁液を取り込み、ストリーキングでTBプレート上に広げます。
- 汚染を防ぐためにプレートを密封します。プレートを37°Cの生化学的インキュベーターに入れます。 ~24時間後にコロニーの成長を視覚的に確認します。単一のコロニーを選択し、PCRで増幅して、1種類の細菌のみが含まれていることを確認します。
2.対数成長期までの細菌液体培養
- 液体培地を準備します。
- ステップ1.1.1の固体寒天プレートの調製を参照してください。1 Lに11.8 gのトリプトン、23.6 gの酵母抽出物、9.4 gのK2HPO4、および2.2 gのKH2PO4、pH ~7を含有するTB液体培地を調製する。
注意: 寒天は加えないでください。バクテリアは、液体の栄養環境ではより速く成長します。 - 溶液を121°Cで20分間オートクレーブ処理し、通気性のあるキャップまたは通気孔付きのボトルシールフィルムを使用します。
- 液体培地は4°Cで保存してください。
- ステップ1.1.1の固体寒天プレートの調製を参照してください。1 Lに11.8 gのトリプトン、23.6 gの酵母抽出物、9.4 gのK2HPO4、および2.2 gのKH2PO4、pH ~7を含有するTB液体培地を調製する。
- 細菌の接種と培養
- 生物学的安全キャビネットで、接種ループまたは10μLピペットを備えた単一のコロニーを選択し、調製したTB液体培地中の細菌を三角フラスコで接種します。
- 三角フラスコをガーゼで密封し、37°Cのシェーカー(200rpm)に入れて細菌を培養します。
注:液体媒体は5時間かけて徐々に濁ります。濁るまでにかかる時間は、細菌によって異なります。
3. FTM実験と成長曲線の決定
- 液体チオグリコール酸培地(FTM)調製
- 各リットルに15gのトリプトン、5gの酵母抽出物、5gのグルコース、0.5gのL-システイン、0.5gのチオグリコール酸ナトリウム、2.5gの塩化ナトリウム、0.001gのレサズリン、および0.75gの寒天を含むチオールグリコール酸培地(TM)を調製します。
注:市販の固体培地は、水で容易に再構成して滅菌することができます(ステップ3.1.2)。 - 29.3 gの固体チオグリコール酸培地を秤量し、蒸留水1 Lを加え、完全に溶解するまで加熱し、溶液がピンク色になるまで攪拌します。
- TM(19mL)をシールプラグ付きの試験管に加えます。密封後、通気性キャップまたは通気孔付きのボトルシールフィルムを使用して、溶液を121°Cで20分間オートクレーブします。
注:加熱後、溶液は淡黄色になります。
- 各リットルに15gのトリプトン、5gの酵母抽出物、5gのグルコース、0.5gのL-システイン、0.5gのチオグリコール酸ナトリウム、2.5gの塩化ナトリウム、0.001gのレサズリン、および0.75gの寒天を含むチオールグリコール酸培地(TM)を調製します。
- 細菌の接種・培養・観察
- 細菌懸濁液を液体TB培地でOD0.6-0.8まで増殖させる準備をします(ステップ2.2を参照)。
- 生物学的安全キャビネット内の無菌条件下で試験管シールプラグを開き、FTMを含む試験管にできるだけ早く細菌培養物1mLを追加し、すぐに試験管を再度シールします。
- チューブを静かに振って、細菌が液体中に均一に分布していることを確認し、試験管を37°Cに置いて静的培養します。
- インキュベーションの48時間後、さまざまな試験管内のFTMでさまざまな細菌の増殖を観察し、写真を撮ります。
- 好気性条件下での成長曲線の決定
- 適切なOD値(ステップ2.2を参照)で最初の細菌培養物を準備し、対数成長段階に達するまで細菌を培養します。
注:このプロトコルで使用された Corynebacterium stationis、Staphylacoccus cohnii、Enterococcus faecalis、Staphylacoccus aureus ATCC 25923、および Enterococcus faecalis V583は、対数相に達するまでに~5時間かかりました。 - 200 μLの細菌培養物(ステップ3.3.1から)をTB液体培地に96ウェルプレートの各ウェルに三回追加します。マイクロプレートリーダーを使用して 600 nm での OD 値を決定し、異なる細菌含有ウェルと TB 液体培地 (ブランク) の OD 差が 0.01 から 0.02 になるように、さまざまな細菌培養物を希釈します。
- 新しい96ウェルプレートを手に取り、結核培地を添加し、ステップ3.3.2で希釈したさまざまな細菌培養物をプレートに3回ずつ移し、超清潔なワークベンチに置きます。
- 96ウェルプレートをシーリングテープで密封し、マイクロプレートリーダーに入れて、プログラムを次のように設定します。
- 温度を37°C±0.5に設定します。
- キネティックループを合計60サイクルに設定し、それぞれ30分間行います。
- 吸光度を 600 nm に設定します。
- サイクルで Shaking を 1,600 秒に設定します。
- プログラムを実行し、成長曲線が横ばいになったら停止します。
- 適切なOD値(ステップ2.2を参照)で最初の細菌培養物を準備し、対数成長段階に達するまで細菌を培養します。
- 嫌気性条件下での成長曲線の決定
- ステップ3.3に従います。ただし、96ウェルプレートを結核培地および細菌懸濁液と一緒に嫌気性インキュベーターに保管してから、プレートをシーリングテープでシールしてください。嫌気性ボックスにポンプで送り込み、窒素を充填して、酸素濃度を<3%に下げます。96ウェルプレートをシーリングテープで密封し、嫌気性ボックスに入れておきます。
4.バイオフィルム形成能力試験
- 液体培地で細菌を対数成長段階まで培養します。
- セクション2を参照して、結核液中の細菌を接種します。
- 37°Cのシェーカーで一晩バクテリアを培養し、バクテリア培地のOD600 が0.6〜0.8であることを確認します。
- 細菌培養物を分割し、異なる条件下で培養します。
- 細菌培養物のOD600 が0.6〜0.8の場合、この細菌懸濁液を10mLガラス試験管に加えます。
- 各細菌培養物を好気性条件と嫌気性条件の2つのグループに分け、すべての操作を3回で実行します。
- 好気性グループの場合は、細菌懸濁液を含む試験管をスズ箔で包み、一定温度の37°C水浴でインキュベートします。
- 嫌気性グループの場合は、細菌懸濁液を含むチューブをスズ箔で包み、嫌気性インキュベーターに移します。.嫌気性インキュベーター内の錫箔を取り外し、インキュベーターをポンピングして窒素を充填することにより、インキュベーター内の酸素濃度を<3%に下げます。試験管をすりガラス栓で閉じ、密封後に取り出し、37°Cの水浴でインキュベートします。
- 6時間ごとに、2つのグループ(好気性/嫌気性)のそれぞれから3本の試験管を取り、下部のバイオフィルムの成長を観察し、ステップ4.3に従って染色します。
- 細菌懸濁液を廃棄し、バイオフィルムを乾燥させます。
- さまざまな時点で試験管を取り出し、細菌懸濁液の上層を慎重に吸引します。試験管の底に付着した白いバイオフィルムを観察します。
注:細菌懸濁液を吸引する際にバイオフィルムを乱さないように注意してください。 - 試験管の壁に沿って2mLのリン酸緩衝生理食塩水(PBS)を慎重に加え、バイオフィルムに吸着したプランクトン性細菌を洗い流すために穏やかに振って、PBS緩衝液を慎重に吸引します。
- 底にバイオフィルムを吸着した試験管をオーブンに入れて30分間乾燥させます。
- さまざまな時点で試験管を取り出し、細菌懸濁液の上層を慎重に吸引します。試験管の底に付着した白いバイオフィルムを観察します。
- 染色
- 試験管を取り出し、各試験管に0.1%クリスタルバイオレット染色液2mLを加え、バイオフィルムを室温で30分間染色します。
- ピペットを使用して、クリスタルバイオレット染料溶液を慎重に吸引します。試験管の壁に沿って蒸留水を慎重に加えて、残りのクリスタルバイオレット染料溶液を洗い流し、加えた蒸留水がほぼ無色になるまで3〜5回繰り返します。試験管の底にある紫色のバイオフィルムを観察します。
- 試験管を再度乾かします。
- バイオフィルムを95%エタノールで溶解し、バイオフィルム溶液のOD600 を測定します。
- 乾燥した試験管を取り出し、各試験管に10mLの95%エタノールを加え、よく振ってクリスタルバイオレットがエタノールに完全に溶解したことを確認します。
- ウェルあたり200 μLの容量で、エタノール中のクリスタルバイオレットを96ウェルプレートに加え、600 nmの波長でその吸光度を測定します。
注:ランベルトベールの法則によれば、吸光度は溶液の濃度に直線的に関連しているため、OD600 の値はクリスタルバイオレットの濃度を反映することができ、これは異なる時間における細菌懸濁液中のバイオフィルムの量を反映しています。
5.細菌走化性試験
- 示差富栄養寒天プレートを準備します。
- ステップ1を参照して、0.5%の寒天を含有する半用量MH培地を調製し、その各リットルには11.8gのトリプトン、23.6gの酵母抽出物、9.4gのK2HPO4、2.2gのKH2PO4、および5gの寒天、pH~7が含まれています。
- ステップ1を参照して、0.5%の寒天を含む5x TB培地を調製し、各リットルには59 gのトリプトン、118 gの酵母抽出物、47 gのK2HPO4、11 gのKH2PO4、および5 gの寒天が含まれています(pH ~7)。
- 溶液を121°Cで20分間オートクレーブ処理し、通気性のあるキャップまたは通気孔付きのボトルシールフィルムを使用します。
- 液体を冷却して固める前に、プレートあたり25 mLの半用量MHブロス(0.5%寒天を含む)を注ぎ、プレートを3Dプリントした蓋で覆い、生物学的安全キャビネットに置きます。冷却後、カバーを取り外して、半固体培地中の円筒形のウェル(直径1.4cm)を観察します。
注:樹脂材料を使用した3Dプリントされた蓋は、高温蒸気を使用して滅菌することはできません。表面のバクテリアを殺すために、95%エタノールを噴霧し、生物学的安全キャビネットでUVランプを30分間照射することができます。フタを外すときは、半固体寒天に損傷を与えないように、垂直方向に力を入れて慎重に持ち上げてください。 - 5x TBブロス(0.5%の寒天を含む)が固化する前に、ピペットを使用して、ブロスが培地の表面と同じ高さになるまで、半固体プレートのウェルに5x TBブロスを追加します。
- 生物学的安全キャビネットでプレートを冷却して、富栄養体を含む半固体寒天プレートを取得します。環境微生物によるプレート汚染にご注意ください。
注:半固体媒体はまだやや流動性があるため、逆さまに保管する前に完全に冷却する必要があります。
- 細菌の接種・培養・撮影
- 半固体培地を入れた寒天プレートを生物学的安全キャビネットに置き、細菌汚染を防ぐためにUV照射下で~30分間冷却します。
- 10 μL のピペットを使用して、OD が ~0.6-0.8 になるまで培養した細菌懸濁液 4 μL を取り込み、ピペットの先端をプラスチック ペトリ皿の中央に挿入し、細菌懸濁液をピペで取り出します。
- 細菌懸濁液が培地に吸収されるのを1分間待ちます。細菌懸濁液が完全に吸収されたら、プレートを2つのグループ(好気性/嫌気性)に三重に分けます。
- 好気性基をシーリングテープで密封し、それらのプレートを逆さまにして37°Cの生化学インキュベーターに置き、静止培養します。ステップ4.2で説明したように、嫌気性基を嫌気性ボックスに密封し、プレートを37°Cで反転させて成長させます。
- 12時間ごと(0時間、12時間、24時間、36時間、48時間)に細菌の広がりと移動を確認し、イメージングシステムを使用してプレートの画像を撮影します。
- ImageJソフトウェアを使用して、細菌の移動距離を計算します。
- イメージングシステムを使用して取得した画像ファイルをインポートします。
- スケールバーを設定し、すべての画像に適用します。
- 撮影の際は、定規をつけて線分を作成し、直線分(例:1cm)を選択し、この線分の長さを1cmにして、ボードの長さを印をつけてください。
- 「スケールの設定」ウィンドウを開きます。「分析」をクリックします。スケールを設定します。
- 実際の長さを [既知の距離 ] と [長さの単位] に入力します。
- [グローバル] をオンにします。
- 元画像のフォルダアドレスと出力ファイルのアドレスを入力します。
- 直線ツールを使用してコミュニティを1つずつ選択し、直線ツールラインが両側に伸びる細菌コロニーの境界に合うまで許容誤差を調整します。
- コロニーの中心から両端までの移動距離を別々に測定し、 Analyze |測定します。
- すべてのコミュニティが測定されるまで手順5.3.3〜5.3.4を繰り返し、結果を.csvファイルに保存してさらに分析します。
結果
この研究では、宿主のマイクロバイオームから単離された微生物を特徴付けるために採用されたアプローチについて説明します(図1)。概念実証として、SDラット宿主から3つの微生物(C.stationis、S.cohnii、 および E.faecalis)を単離し、2つの市販微生物(S.aureus ATCC 25923および E.faecalis V583) をこのプロトコルを使用して試験しました。FTMを用いて個々の微生物の酸素必要量を確立するために、偏性嫌気性菌(Fusobacterium nucleatum ATCC 25586)と通性嫌気性菌(Pseudomonas aeruginosa PAO1)の2つの対照生物を追加しました。その結果、試験された5つの微生物は通性嫌気性菌であり(図2A)、これらの微生物の以前に報告されたプロファイルと一致することが示されました11。それらの酸素必要量を解明するために、微生物を好気性および嫌気性の両方の条件下で培養しました。試験したすべての微生物は、好気性条件と嫌気性条件の両方でS状結腸成長曲線を示しました。しかし、外径600nmで示される微生物密度は、5つの微生物すべてが酸素が豊富な環境に対してより高い選好性を持っていることを示しました(図2B、C)。これらの観察結果は、一般的に低酸素と考えられているラットの骨に浸透して感染する微生物の能力と一致しています。
5つの細菌分離株は、自然にバイオフィルムを形成することがわかりましたが、嫌気性条件下で生成されるバイオフィルムの質量が高かった。成長曲線の比較を通じて、E. faecalisおよび黄色ブドウ球菌ATCC 25923のバイオフィルムは、好気性環境と嫌気性環境の両方で静止成長期に活発に形成されることがわかりました(図3)。この観察結果は、バイオフィルム形成が細胞の成長状態に依存し、おそらくバイオフィルム形成を誘発する細胞内シグナル伝達分子によって制御されていることを示唆している11。バイオフィルム形成が成長条件に依存することは、酸素と栄養素が不足している宿主の骨基質環境が示す栄養および成長条件と一致しています。
微生物の病因に関する研究は、多くの場合、微生物が成長を助長すると考えられる場所に移動する能力に関連しています。微生物の走化性に関する研究は数多くありますが、それを研究するための標準化されたアプローチは1つではありません。さらに、非拡散性化学物質の使用は、この現象を研究する際の制限要因と見なされてきました。そこで、薬液リザーバーと接種ポイントの距離を標準化した3Dプリントによる樹脂カバーを開発しました(補足図S1 、 補足図S2)。私たちは、微生物が栄養豊富な環境に移動する様子を研究し、化学刺激剤として5倍のTBを使用しました。微生物を好気性および嫌気性の条件下で48時間監視したところ、5つの微生物すべてが異なる程度の指向性移動を示しました(図4A)。
ImageJは、細菌の移動距離を測定するために使用されました(図4B)。貯水池への移動は、反対方向への移動よりも速いように見えました。リザーバーへの移動距離と反対方向の移動距離の比率は、微生物の走化性による微生物コロニーの急速な拡大を示しています(図5B)。この研究では、 黄色ブドウ球菌 ATCC 25923などの細菌は、 C. stationisなどの他の微生物よりも速く移動しました。興味深いことに、好気性および嫌気性条件下での走化性培養物の移動プロファイルは、 E. faecalis などの一部の細菌が好気性および嫌気性条件下での移動パターンに変動を示し、嫌気性条件下で経時的に急速な拡大が観察されたことを示しました。困惑したことに、実験室株 E.faecalis V583は走化性のための好気性環境を支持しました。したがって、これは、異なる供給源から分離された E.faecalis が、成長環境に適応した異なる成長要件を持っていることを示唆しています。

図1:操作プロセスの概略図。 (A)細菌をプレート上で接種し、次に液体培地に接種し、対数成長段階まで増殖させます。(B)さまざまな条件(好気性/嫌気性)で細菌がバイオフィルムを形成する能力の測定。各時点(6時間)ごとに3つのサンプルを選択し、並行して繰り返しました。(C)異なる条件(好気性/嫌気性)下での細菌の化学的親和性実験のためのプロトコル。 この図の拡大版を表示するには、ここをクリックしてください。

図2:微生物の増殖条件 (A)液体チオグリコール酸培地で培養した細菌の増殖プロファイル(左からI: Fusobacterium nucleatum ATCC 25586、II: Corynebacterium stationis、III: Staphylacoccus cohnii、IV: Enterococcus faecalis、 V: Staphylacoccus aureus ATCC 25923、VI: Enterococcus faecalis V583、VII: Pseudomonas aeruginosa PAO1)。(B)好気性条件下で宿主から単離された微生物の成長曲線。(C)嫌気性条件下で宿主から単離された微生物の成長曲線。 この図の拡大版を表示するには、ここをクリックしてください。
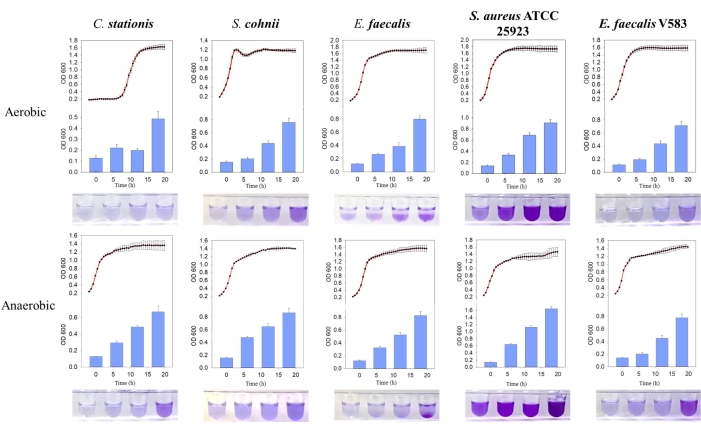
図3:異なる条件下での異なる細菌の成長曲線とバイオフィルム形成の比較。 左から右に 、Corynebacterium stationis、Staphylacoccus cohnii、Enterococcus faecalis、Staphylacoccus aureus ATCC 25923、 Enterococcus faecalis V583です。赤い曲線は成長曲線、青いヒストグラムはバイオフィルムの生産量です。 この図の拡大版を表示するには、ここをクリックしてください。
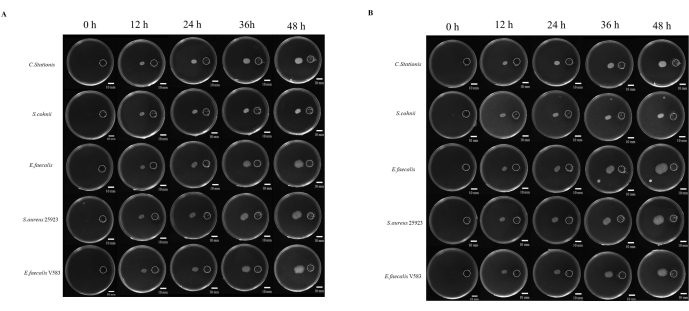
図4:富栄養化に向けた微生物の増殖((A)好気性条件、(B)嫌気性条件。5種類の細菌(上から順にCorynebacterium stationis、Staphylacoccus cohnii、Enterococcus faecalis、Staphylacoccus aureus ATCC 25923、Enterococcus faecalis V583)は、分差栄養プレート上で富栄養化に向かって成長する傾向があります。スケールバー = 10 mm。この図の拡大版を表示するには、ここをクリックしてください。

図5:さまざまな条件(好気性/嫌気性)下での微生物の走化性。 (A)栄養豊富な寒天を含むプレート上の5つの細菌の化学的指向性移動の結果。左のグループは好気性の状態を表し、右のグループは嫌気性の状態を表します。各実験は、並行して三重に繰り返されました。(B)化学親和性のデータ解析。上部は好気性状態を表し、下部は嫌気性状態を表しています。左から右に 、Corynebacterium stationis、Staphylacoccus cohnii、Enterococcus faecalis、Staphylacoccus aureus ATCC 25923、 Enterococcus faecalis V583です。赤と青の列は、細菌の栄養体から栄養体に向かって移動し、栄養体から離れて移動する移動距離です。線は 2 つの値 (赤 - 青) の差です。スケールバー = 10 mm。 この図の拡大版を表示するには、ここをクリックしてください。
補足図S1:3Dプリントされた蓋を使用して、栄養差寒天プレートを作成します。 (A)ソフトウェアを使用して、3Dプリントの金型レンダリングを準備します。(B)フラットカバーモールドを8,000樹脂でプリント。(C)上記の方法を使用して、栄養素の違い寒天プレートを取得します。(D)栄養差寒天プレートの製造。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S2:ImageJを用いた栄養差分寒天プレートの構築と細菌の移動距離の測定。 (A)栄養差分寒天プレートの構造は、プレートを覆うために3Dプリントされた蓋(円筒形の突起を含む)を使用します。寒天が冷却された後、円筒形のウェル(赤い丸)が形成され、5x TB寒天で満たされます。次に、これを冷却して栄養差寒天プレートを取得します。(B)ImageJを使用して、細菌のさまざまな方向への移動距離を測定します。 スケールバー の設定 ([分析] | Set Scale)を選択し、 Straight (Analyze | メジャー)。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S3:M9最小中程度から5倍TB中寒天培地での5つの細菌の成長パターン。 左のグループは有酸素性の状態用で、右のグループは嫌気性の状態用です。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S4:嫌気性細菌の Fusobacterium nucleatum ATCC 25586成長曲線と走化性に関する対照実験。 (A)好気性および嫌気性条件下での F.nucleatum ATCC 25586の成長曲線の決定。(B)異なる酸素条件下でのMH-5x TB寒天プレートの半用量に対する F. nucleatum ATCC 25586の走化性実験。 部分的な拡大: 48時間後の嫌気性条件下でのプレート上での F. nucleatum ATCC 25586の成長(部分倍率)。 このファイルをダウンロードするには、ここをクリックしてください。
| 化合物 | 濃度(g / L) |
| Na2HPO4 | 6.78 |
| KH2PO4 | 3 |
| NaClの | 0.5 |
| NH4CLの | 1 |
| MgSO4.7H 2O | 0.493 |
| CaCl2 | 0.011 |
| グルコース | 4 |
表1:M9 Minimalメディアのコンポーネントと内容。
ディスカッション
我々は、5種類の細菌を順次分離し、同定した。バクテリアの増殖には最小限の栄養素が必要です:最小限の培地-無機塩、炭素源、および水のみを含む培地。実験群の細菌はMH固体板上に発見されましたが、半用量MH培地を用いて細菌の走化性を検証し、良好な結果が得られました。しかし、最小限の媒質を用いた対照実験も行いました。実験ではM9塩基性培地を使用し(その組成と含有量については 表1 を参照)、栄養寒天ブロックには5x TB寒天を使用しました。実験結果を 補足図S3に示します。これらの細菌( E. faecalisを除く)はゆっくりと成長し、M9培地内でゆっくりと移動しますが、これらの実験で観察されたように、一般的に同様の傾向(栄養寒天培地での成長)があります。しかし、 E. faecalis V583はM9最小培地では生育しなかったが、これはおそらく E. faecalis がM9培地で生育するために必要な成分が不足していたためである。したがって、栄養不足条件下での細菌の増殖と移動をシミュレートするために、栄養不足基質として半用量のMH培地を使用することをお勧めします。これにより、ImageJソフトウェアを使用して、細菌が移動する傾向がある距離を測定することも容易になります。
バイオフィルムは一般に、表面関連微生物群集として定義され、重要な微生物生存戦略です。 緑膿菌、インフルエンザ 菌、肺炎 連鎖球菌、 黄色ブドウ球 菌などの生物は無症候性の宿主に見られ、 生体内で の付着微生物の発見は感染ではなくコロニー形成と呼ばれることがよくあります。非常に重要な問題は、理想的な動物コロニー形成モデルの欠如である12。微生物は、ガラスやポリ塩化ビニル(PVC)などの材料がバイオフィルム関連の研究に適していると考えられるバイオフィルム形成前に、荷電表面への初期付着を示します。PVC96ウェルプレートを用いた研究は、微生物バイオフィルム9の研究に使用されており、そこでは、単一または多種のバイオフィルムは、緩くまたは密に充填されたバイオフィルム10をもたらし得る。そのため、PVC 96ウェルプレートの使用は、バイオフィルムの染色プロセス中にバイオフィルムマトリックスが簡単に洗い流される可能性があるため、緩く詰められたバイオフィルムには適していないと考えられています。そのため、ガラス製の試験管に頼って微生物のバイオフィルム形成を研究しました(図3)。
この方法の主な制限は、特定の条件下で増殖する微生物には機能せず、すべての細菌が移動できるわけではないことです。また、バイオフィルムは微生物が不利な外部環境から身を守るための有効な手段ですが、すべての宿主微生物がバイオフィルムを作製できるわけではありません。例えば、先に述べた F. nucleatum ATCC 25586は、結腸癌の発症に関連するヒトの口腔または腸の共生17と関連しており、嫌気性環境でのみ特異的に増殖し、バイオフィルムを産生しない。FTM実験でFT媒体の有効性を検証するために使用しました。FT培地は、酸素の勾配濃度を細菌に供給するのに効果的であることが示されています。
比較のために、嫌気性細菌 F.nucleatum ATCC 25586の成長曲線と化学的親和性をテストしました(補足図S4)。成長曲線実験(補足図S4A)では、 F. nucleatum ATCC 25586は好気性条件下では増殖できず、嫌気性条件下でウェルの底に細菌の凝集を示しました。走化性実験(補足図S4B)でも、 F. nucleatum ATCC 25586は好気性条件下では増殖せず、嫌気性条件下で48時間の in situ 接種後には低数の細菌が見られた。同様に、一部の細菌は、移動によって適切な生育条件を積極的に探すことができないため、長期休眠状態に入ることで適切な生育条件を待つ18。厳密な嫌気性細菌の培養には、ET発酵培地(半固体プレートに0.5%寒天を補充する必要があります)などの特別な培地が必要であり、これも従来の分離および同定とは異なることに注意する必要があります。この提案方法は、ほとんどの宿主微生物の特性評価に適用できる一般的な方法であり、この手法は、マウスの骨から単離された3つの微生物と2つの実験室グレードの微生物を含む5つの微生物で実証されています。このプロトコルは、将来の研究で微生物叢分離株を適切に特定するのに役立ちます。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この技術の開発は、中国国家自然科学基金会の国際若手科学者研究基金(22050410270)、深セン海外高官人材孔雀チームのイノベーションと起業家精神のための深セン特別基金(KQTD20170810111314625)、および広東省革新起業家研究チームプログラム(2019ZT08Y191)からの資金によって支援されました。Chen Xinyi氏には、文書の校正と研究所の管理にご協力いただき、心から感謝申し上げます。
資料
| Name | Company | Catalog Number | Comments |
| Chemical/Solution | |||
| 1% crystal violet dye solution | Solarbio | G1062 | 100 mL |
| Agar | Sigma-Aldrich | V900500 | Used to obtain semi-solid plates, 20 g |
| Centrifuge tube | Corning | 430790 | 15 mL |
| Fluid thioglycollate medium | Kinghunt | K0001 | 29.3 g |
| Mueller Hinton II Broth medium | Solarbio | NO.11865 | 100 g |
| Petri dishes | Bkman | B-SLPYM90-15 | Plastic Petri dishes, circular, 90 mm x 15 mm |
| Potassium Chloride | VETEC | WXBC4493V | 0.2 g |
| Potassium Dihydrogen Phosphate | aladdin | 04-11-7758 | 0.24 g |
| Sodium chloride | Macklin | S805275 | 8.0 g |
| Sodium phosphate dibasic | aladdin | 7558-79-4 | 1.44 g |
| Terrific Broth medium | Solarbio | LA2520 | 200 g |
| Kits/ Equipment | |||
| Anaerobic incubator | Longyue | ||
| Biochemical incubator | Blue pard | LRH-70 | |
| Microplate reader | Spark | ||
| Tanon 5200multi imaging system | Tanon | 5200CE | |
| Thermostatic water bath | Jinghong | DK-S28 |
参考文献
- Bernardi, S., et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients' tongue biofilm. MicrobiologyOpen. 9 (2), 958 (2020).
- Tellez, G., Latorre, J. D., Kuttappan, V. A., et al. Rye affects bacterial translocation, intestinal viscosity, microbiota composition and bone mineralization in Turkey poults. PLOS One. 10, (2015).
- Brewer, J. H. Clear liquid mediums for the "aerobic" cultivation of anaerobes. Journal of the American Medical Association. 115 (8), 598 (1940).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Liu, C., et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review. Frontiers in Microbiology. 11, 802 (2020).
- Kumar, A., et al. Biofilms: survival and defense strategy for pathogens. International Journal of Medical Microbiology. , (2017).
- Penesyan, A., et al. Secondary effects of antibiotics on microbial biofilms. Frontiers in Microbiology. 11, 2109 (2020).
- Bernardi, S., et al. Subinhibitory antibiotic concentrations enhance biofilm formation of clinical Enterococcus faecalis isolates. Antibiotics. 10 (7), 874 (2021).
- Tsukatani, T., Fumihiko, S., Rieko, K. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids. World Journal of Microbiology and Biotechnology. 36 (12), 1-9 (2020).
- Hartmann, R., et al. Emergence of three-dimensional order and structure in growing biofilms. Nature Physics. 15, 251-256 (2019).
- Liu, Z., et al. Advances in bacterial biofilm management for maintaining microbiome homeostasis. Biotechnology Journal. 15 (10), 1900320 (2020).
- Hall-Stoodley, L., Stoodley, P. Evolving concepts in biofilm infections. Cellular Microbiology. 11 (7), 1034-1043 (2009).
- Røder, H. L., et al. Enhanced bacterial mutualism through an evolved biofilm phenotype. The ISME Journal. 12 (11), 2608-2618 (2018).
- Matilla, M. A., Tino, K. The effect of bacterial chemotaxis on host infection and pathogenicity. FEMS Microbiology Reviews. 42 (1), 052 (2018).
- Moreira, L. M., et al. Chemotactic signal transduction and phosphate metabolism as adaptive strategies during citrus canker induction by Xanthomonas citri. Functional & Integrative Genomics. 15 (2), 197-210 (2015).
- Konishi, H., et al. Bacterial chemotaxis towards polysaccharide pectin by pectin-binding protein. Scientific Reports. 10 (1), 1-12 (2020).
- Kostic, A. D., et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host & Microbe. 14 (2), 207-215 (2013).
- Kochan, T. J., et al. Updates to Clostridium difficile spore germination. Journal of Bacteriology. 200 (16), 00218 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved