Method Article
Misurazione della migrazione e della formazione di biofilm di vari batteri
In questo articolo
Riepilogo
Qui presentiamo un metodo pratico per l'isolamento e l'identificazione di microrganismi all'interno dell'ospite. In questo modo, vengono chiaramente descritte le proprietà fisico-chimiche dei microrganismi e i possibili modi di vivere nell'ospite.
Abstract
Poiché i microbi che prosperano nel corpo ospite hanno principalmente capacità adattative che facilitano la loro sopravvivenza, i metodi per classificare e identificare la loro natura sarebbero utili per facilitare la loro caratterizzazione. Attualmente, la maggior parte degli studi si concentra solo su un metodo di caratterizzazione specifico; Tuttavia, l'isolamento e l'identificazione di microrganismi dall'ospite è un processo continuo e di solito richiede diversi metodi di caratterizzazione combinatoria. In questo articolo, descriviamo i metodi per identificare la capacità microbica di formare biofilm, lo stato di respirazione microbica e il loro comportamento chemiotassico. I metodi sono stati utilizzati per identificare cinque microbi, tre dei quali sono stati isolati dal tessuto osseo di ratti Sprague-Dawley (SD) (Corynebacterium stationis, Staphylococcus cohnii subsp. urealyticus ed Enterococcus faecalis) e due dall'American Type Culture Collection (ATCC)-Staphylococcus aureus ATCC 25923 ed Enterococcus faecalis V583. I microbi isolati dal tessuto osseo di ratto SD includono i microbi gram-positivi. Questi microbi si sono adattati a prosperare in ambienti stressanti e limitanti i nutrienti all'interno della matrice ossea. Questo articolo ha lo scopo di fornire ai lettori il know-how specifico per determinare la natura e il comportamento dei microbi isolati all'interno di un ambiente di laboratorio.
Introduzione
L'ospite mammifero rappresentato dal corpo umano contiene un gran numero di microrganismi. Questi microrganismi sono ampiamente distribuiti nella bocca, nel tratto digestivo, nell'intestino e nel sangue dell'ospite e hanno effetti diversi sulla salute dell'ospite. La cavità orale ospita una pletora di microbi in grado di modulare la suscettibilità dell'ospite alle infezioni. Microbi come gli streptococchi (ad esempio, S. mitis/oralis, S. pseudopneumoniae e S. infantis) e Prevotella spp. colonizzano la cavità orale, formando un biofilm multispecie sulla superficie della lingua causando l'alitosi e funzionando come serbatoio microbico per l'infezione microbica. Questi agenti patogeni possono infettare l'osso mascellare infiltrandosi nei legamenti parodontali che trattengono la radice del dente nell'osso mascellare1. La caratterizzazione di questi microbi isolati dal corpo ospite è spesso un processo noioso, in particolare quando i microbi mostrano tratti individuali che richiedono un trattamento specifico e condizioni di crescita. I microbi, come il patogeno Helicobacter pylori, il Clostridium difficile e il Fusobacterium nucleatum, prosperano nell'ambiente ostile dell'intestino, con specifici requisiti di ossigeno, nutrienti e crescita, presentando una sfida nei processi di caratterizzazione, in particolare nello studio della patogenicità di questi microbi. Pertanto, è necessario un metodo standardizzato per isolare e studiare questi microrganismi affinché gli scienziati e i medici sviluppino nuovi trattamenti medici.
Questo protocollo utilizza microbi che prosperano nella matrice ossea dei ratti. Tradizionalmente, ad eccezione del sistema osseo rappresentato dalla mandibola, dove la presenza di denti rende la matrice ossea più suscettibile alle infezioni rispetto ad altre ossa1, si ritiene generalmente che l'osso sano dell'ospite sia un ambiente sterile. Tuttavia, gli studi hanno scoperto che i microrganismi entrano nella circolazione sistemica attraverso la parete intestinale, influenzando in ultima analisi la mineralizzazione ossea2. Come prova di concetto, utilizziamo il protocollo descritto per caratterizzare le proprietà biochimiche degli isolati microbici dal femore e dalla tibia di ratti SD sani (Corynebacterium stationis, Staphylococcus cohnii subsp. ed Enterococcus faecalis). Questi isolati microbici sono stati selezionati poiché l'osso è un ambiente chiuso e ipossico e caratterizzare questi microbi dall'osso può essere un compito impegnativo. Vari articoli hanno dettagliato i processi utilizzati nello studio di questi microbi; Tuttavia, sono pochi quelli che forniscono un protocollo completo per identificare i microrganismi isolati dall'ospite.
Nello stabilire le condizioni di coltura adeguate, i requisiti di ossigeno del microbo devono essere compresi attraverso l'uso del terreno di tioglicolato fluido (FTM). I microbi con diversi requisiti di ossigeno formano strati stratificati nel liquido FTM trasparente3. Sulla base del profilo di stratificazione, il fabbisogno di ossigeno del microbo viene quindi utilizzato per studiare la crescita delle cellule. I microbi che prosperano sulla superficie del liquido FTM sono aerobi obbligati, mentre i microbi che crescono sul fondo sono anaerobi obbligati. I microbi che crescono come sospensione nel liquido FTM sono anaerobi facoltativi o aerotolleranti. Il tasso di crescita microbica viene stabilito osservando la fase di crescita esponenziale delle cellule microbiche. Il profilo di crescita viene quindi confrontato con la formazione del biofilm del microbo. I biofilm sono in gran parte composti da più specie che influenzano direttamente e indirettamente la salute l'una dell'altra. Durante questo processo, le interazioni benefiche tra le comunità microbiche selezionano per l'attaccamento, fornendo una struttura spaziale che favorisce l'evoluzione delle interazioni reciproche attive. Ad esempio, la co-coltura di Paenibacillus amylolyticus e Xanthomonas retroflexus mostra interazioni simbiotiche facoltative in un ambiente statico, promuovendo una rapida crescita del biofilm13. I microbi si adattano ai tessuti dell'ospite attraverso la formazione di biofilm per una localizzazione sostenuta, proteggendosi dagli ambienti difficili ed eludendo il sistema immunitario dell'ospite 4,5,6,7. I biofilm sono solitamente strutture dense e multistrato che aiutano i microrganismi a resistere agli stimoli subcritici esterni; ad esempio, E. faecalis nella polpa dentale migliora la sua resistenza agli antibiotici aumentando la formazione di biofilm di fronte a sottoconcentrazioni di tetraciclina e vancomicina8.
La chemiotassi consente ai microrganismi di muoversi in base a gradienti chimici e le vie di segnalazione sono ampiamente distribuite in una varietà di batteri patogeni. Alcuni microrganismi patogeni migrano in siti specifici, sotto la guida di segnali chimici, per causare malattie infettive14. Ad esempio, Xanthomonas spp. esprimono 19 proteine chemocettrici e 11 flagelline nell'ospite, innescando il legame batterico e, infine, l'ulcerazione15. Ci sono anche proteine specifiche nei batteri (proteine leganti la pectina) che guidano la migrazione specifica dei batteri verso i nutrienti, che può portare a una migliore crescita16. Questo è fondamentale anche per i batteri che possono esistere in ambienti poveri di nutrienti. Le cellule microbiche spesso si affidano alla motilità chemiotattica per attirare se stesse in un ambiente di crescita favorevole, eludendo altre cellule predatorie e tossine che danneggiano la vitalità cellulare. Sulla base di approcci di agar morbido precedentemente stabiliti per determinare la chemiotassi, sviluppiamo un metodo diffusibile per generare un gradiente chemioattrattivo per testare la chemiotassi microbica.
Questo articolo descrive i metodi per determinare le condizioni di crescita, la formazione del biofilm e il tropismo chimico dei batteri, utilizzando come esempi Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ed Enterococcus faecalis V583 (vedi Figura 1). L'ottimizzazione delle condizioni di crescita microbica utilizza l'FTM per determinare il fabbisogno di ossigeno del microbo, mentre la formazione del biofilm utilizza superfici di vetro come supporto solido e la massa del biofilm è controcolorata con cristallovioletto. Il tropismo chimico del microbo si basa sul suo comportamento chemiotattico, dove attraverso la stampa 3D (Figura supplementare S1), viene utilizzato un metodo standardizzato per generare un serbatoio chimico per il chemioattrattivo in una matrice di agar morbido (Figura supplementare S2).
Protocollo
NOTA: Consultare la Tabella dei materiali per i dettagli su tutti i materiali e le attrezzature utilizzate in questo protocollo. Utilizzare tecniche asettiche per evitare la contaminazione.
1. Recupero batterico per ottenere una singola colonia
- Preparare piastre di agar solide.
- Preparare un terreno Terrific Broth (TB) contenente agar, con ogni litro di liquido contenente 11,8 g di triptone, 23,6 g di estratto di lievito, 9,4 g di K2HPO4, 2,2 g di KH2PO4 e 15 g di agar, pH = 7.
- Autoclavare la soluzione a 121 °C per 20 minuti utilizzando un tappo permeabile all'aria o una pellicola sigillante per flaconi con sfiato d'aria.
- Prima che il liquido si raffreddi e si solidifichi, versare il brodo TB contenente agar in piastre di Petri di plastica da 10 cm a un volume di 25 ml per piastra.
NOTA: Il brodo deve essere versato nella piastra prima che si solidifichi a temperature inferiori a 60 °C. Utilizzare tecniche asettiche per prevenire la contaminazione.
- Inoculazione batterica alla piastra
- Estrarre i ceppi bersaglio conservati a -80 °C e scongelarli a temperatura ambiente in una cabina di sicurezza biologica.
- Utilizzare una pipetta da 10 μl per prelevare 10 μl di sospensione batterica e distribuirla sulla piastra TB mediante strisciature.
- Sigillare la piastra per evitare contaminazioni. Porre la piastra in un incubatore biochimico a 37 °C. Controlla visivamente la crescita della colonia dopo ~24 ore. Scegli singole colonie e amplificale mediante PCR per confermare che contengono un solo tipo di batterio.
2. Da coltura batterica liquida a fase di crescita logaritmica
- Preparare il terreno di coltura liquido.
- Fare riferimento alla preparazione di piastre di agar solide al punto 1.1.1. per preparare il terreno liquido TB, 1 L del quale contiene 11,8 g di triptone, 23,6 g di estratto di lievito, 9,4 g di K2HPO4 e 2,2 g di KH2PO4, pH ~7.
NOTA: Non aggiungere agar. I batteri crescono più velocemente in un ambiente nutriente liquido. - Autoclavare la soluzione a 121 °C per 20 minuti utilizzando un tappo permeabile all'aria o una pellicola sigillante per flaconi con sfiato d'aria.
- Conservare il terreno di coltura liquido a 4 °C.
- Fare riferimento alla preparazione di piastre di agar solide al punto 1.1.1. per preparare il terreno liquido TB, 1 L del quale contiene 11,8 g di triptone, 23,6 g di estratto di lievito, 9,4 g di K2HPO4 e 2,2 g di KH2PO4, pH ~7.
- Inoculazione e coltivazione batterica
- Nella cabina di sicurezza biologica, prelevare una singola colonia con un'ansa di inoculazione o una pipetta da 10 μl e inoculare i batteri nel terreno liquido preparato per la tubercolosi in un pallone di Erlenmeyer.
- Sigillare il pallone di Erlenmeyer con una garza e metterlo in uno shaker (200 giri/min) a 37 °C per coltivare i batteri.
NOTA: Il mezzo liquido diventa gradualmente torbido nell'arco di 5 ore; Il tempo impiegato per diventare torbido varia a seconda dei diversi batteri.
3. Esperimento FTM e determinazione della curva di crescita
- Preparazione del terreno fluido di tioglicolato (FTM)
- Preparare il Terreno di Tiolglicolato (TM), ogni litro del quale contiene 15 g di triptone, 5 g di estratto di lievito, 5 g di glucosio, 0,5 g di L-cisteina, 0,5 g di tioglicolato di sodio, 2,5 g di cloruro di sodio, 0,001 g di resazurina e 0,75 g di agar.
NOTA: Il terreno solido disponibile in commercio può essere facilmente ricostituito con acqua e sterilizzato (Passaggio 3.1.2.). - Pesare 29,3 g di Tioglicolato Solido Medium, aggiungere 1 L di acqua distillata, scaldare e mescolare fino a completa dissoluzione e fino a quando la soluzione diventa rosa.
- Aggiungere TM (19 mL) a una provetta con un tappo di chiusura. Dopo la sigillatura, sterilizzare in autoclave la soluzione a 121 °C per 20 minuti utilizzando un tappo permeabile all'aria o una pellicola sigillante per flaconi con sfiato d'aria.
NOTA: Dopo il riscaldamento, la soluzione diventa giallo chiaro.
- Preparare il Terreno di Tiolglicolato (TM), ogni litro del quale contiene 15 g di triptone, 5 g di estratto di lievito, 5 g di glucosio, 0,5 g di L-cisteina, 0,5 g di tioglicolato di sodio, 2,5 g di cloruro di sodio, 0,001 g di resazurina e 0,75 g di agar.
- Inoculazione, coltivazione e osservazione dei batteri
- Preparare la sospensione batterica in modo che cresca fino a OD 0,6-0,8 in terreno liquido per la TB (vedere il passaggio 2.2.).
- Aprire il tappo di chiusura della provetta in condizioni asettiche nella camera di sicurezza biologica, aggiungere 1 mL di coltura batterica alla provetta contenente FTM il prima possibile e sigillare immediatamente la provetta.
- Agitare delicatamente la provetta per assicurarsi che i batteri siano distribuiti in modo omogeneo nel liquido e posizionare la provetta a 37 °C per la coltura statica.
- Dopo 48 ore di incubazione, osservare la crescita di diversi batteri in FTM in varie provette e scattare fotografie.
- Determinazione della curva di crescita in condizioni aerobiche
- Preparare la coltura batterica iniziale con un valore OD adeguato (vedere il passaggio 2.2.) e coltivare i batteri fino a raggiungere la fase di crescita logaritmica.
NOTA: Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ed Enterococcus faecalis V583 utilizzati in questo protocollo hanno impiegato ~5 ore per raggiungere la fase logaritmica. - Aggiungere 200 μl di coltura batterica (dalla fase 3.3.1) in terreno liquido TB a ciascun pozzetto di una piastra da 96 pozzetti in triplicato. Utilizzare un lettore di micropiastre per determinare il valore OD a 600 nm e diluire le diverse colture batteriche in modo che la differenza OD tra i diversi pozzetti contenenti batteri e il mezzo liquido TB (bianco) sia compresa tra 0,01 e 0,02.
- Prendere una nuova piastra da 96 pozzetti, aggiungere il terreno per la tubercolosi, trasferire le diverse colture batteriche diluite dal passaggio 3.3.2., in triplice copiato, alla piastra e posizionarla su un banco di lavoro ultra-pulito.
- Sigillare la piastra a 96 pozzetti con del nastro sigillante, inserirla nel lettore di micropiastre e impostare il programma come segue:
- Impostare la temperatura a 37 °C ± 0,5.
- Imposta il Kinetic Loop su un totale di 60 cicli, ciascuno per 30 minuti.
- Impostare l'assorbanza a 600 nm.
- Impostare Agitazione a 1.600 s in un ciclo.
- Esegui il programma e interrompilo quando la curva di crescita si stabilizza.
- Preparare la coltura batterica iniziale con un valore OD adeguato (vedere il passaggio 2.2.) e coltivare i batteri fino a raggiungere la fase di crescita logaritmica.
- Determinazione della curva di crescita in condizioni anaerobiche
- Seguire il passaggio 3.3. ma conservare la piastra a 96 pozzetti con il mezzo TB e le sospensioni batteriche in un incubatore anaerobico prima di sigillare la piastra con nastro sigillante. Pompare e riempire la scatola anaerobica con azoto per ridurre la concentrazione di ossigeno al <3%. Sigillare la piastra a 96 pozzetti con nastro sigillante e lasciarla nella scatola anaerobica.
4. Test di capacità di formazione del biofilm
- Coltivare i batteri fino alla fase di crescita logaritmica in mezzo liquido.
- Fare riferimento alla Sezione 2 per inoculare i batteri nel mezzo liquido della TBC.
- Coltivare i batteri per una notte in uno shaker a 37 °C, assicurandosi che il diametro esterno600 del terreno di coltura batterica sia compreso tra 0,6 e 0,8.
- Dividi la coltura batterica e coltiva in condizioni diverse.
- Quando l'OD600 della coltura batterica è compreso tra 0,6 e 0,8, aggiungere 10 ml di questa sospensione batterica in una provetta di vetro.
- Dividi ogni coltura batterica in due gruppi: condizioni aerobiche e anaerobiche ed esegui tutte le operazioni in triplice copia.
- Per il gruppo aerobico, avvolgere la provetta contenente la sospensione batterica con carta stagnola e incubarla in un bagno d'acqua a 37 °C a temperatura costante.
- Per il gruppo anaerobico, avvolgere la provetta contenente la sospensione batterica con carta stagnola e trasferirla in un incubatore anaerobico. Rimuovere la carta stagnola nell'incubatrice anaerobica e ridurre la concentrazione di ossigeno nell'incubatrice al <3% pompandola e riempiendola di azoto. Chiudere la provetta con un tappo di vetro smerigliato, estrarla dopo averla sigillata e incubarla a bagnomaria a 37 °C.
- Ogni 6 ore, prelevare tre provette da ciascuno dei due gruppi (aerobico/anaerobico) per osservare la crescita del biofilm sul fondo e colorare seguendo il passaggio 4.3.
- Scartare la sospensione batterica e asciugare il biofilm.
- Estrarre le provette in momenti diversi e aspirare con cura lo strato superiore della sospensione batterica. Osservare il biofilm bianco che aderisce al fondo della provetta.
NOTA: Fare attenzione a non disturbare il biofilm durante l'aspirazione della sospensione batterica. - Aggiungere con cautela 2 mL di soluzione salina tamponata con fosfato (PBS) lungo la parete della provetta, agitarla delicatamente per lavare via i batteri planctonici adsorbiti nel biofilm e aspirare con cura il tampone PBS.
- Mettere la provetta con il biofilm adsorbito sul fondo nel forno ad asciugare per 30 minuti.
- Estrarre le provette in momenti diversi e aspirare con cura lo strato superiore della sospensione batterica. Osservare il biofilm bianco che aderisce al fondo della provetta.
- Macchiatura
- Estrarre le provette, aggiungere 2 ml di soluzione colorante cristallovioletto allo 0,1% a ciascuna provetta e colorare i biofilm per 30 minuti a temperatura ambiente.
- Utilizzare una pipetta per aspirare con cura la soluzione di colorante cristallovioletto. Aggiungere con cura acqua distillata lungo la parete della provetta per lavare via la soluzione di colorante cristallovioletto rimanente, ripetendo 3x-5x fino a quando l'acqua distillata aggiunta non è diventata quasi incolore. Osservare il biofilm viola sul fondo della provetta.
- Asciugare nuovamente la provetta.
- Sciogliere il biofilm con etanolo al 95% e misurare l'OD600 della soluzione di biofilm.
- Estrarre la provetta essiccata, aggiungere 10 ml di etanolo al 95% a ciascuna provetta e agitare accuratamente per assicurarsi che il cristallovioletto sia completamente disciolto nell'etanolo.
- Con un volume di 200 μl per pozzetto, aggiungere il cristallovioletto in etanolo a una piastra a 96 pozzetti e misurarne l'assorbanza a una lunghezza d'onda di 600 nm.
NOTA: Secondo la legge di Beer-Lambert, l'assorbanza è linearmente correlata alla concentrazione della soluzione, quindi il valore di OD600 può riflettere la concentrazione di cristallovioletto, che riflette la quantità di biofilm nella sospensione batterica in momenti diversi.
5. Test di chemiotassi batterica
- Preparare piastre di agar eutrofiche differenziali.
- Fare riferimento al passaggio 1 per preparare un mezzo MH a mezza dose contenente lo 0,5% di agar, ogni litro del quale contiene 11,8 g di triptone, 23,6 g di estratto di lievito, 9,4 g di K2HPO4, 2,2 g di KH2PO4 e 5 g di agar, pH ~7.
- Fare riferimento al passaggio 1 per preparare 5 TB di terreno contenente lo 0,5% di agar, ogni litro dei quali contiene 59 g di triptone, 118 g di estratto di lievito, 47 g di K2HPO4, 11 g di KH2PO4 e 5 g di agar, pH ~7.
- Autoclavare la soluzione a 121 °C per 20 minuti utilizzando un tappo permeabile all'aria o una pellicola sigillante per flaconi con sfiato d'aria.
- Prima che il liquido si raffreddi e si solidifichi, versare 25 ml di brodo MH a metà dose (contenente lo 0,5% di agar) per piastra, coprire la piastra con un coperchio stampato in 3D e metterla in una cabina di sicurezza biologica. Dopo il raffreddamento, rimuovere il coperchio per osservare il pozzetto cilindrico (1,4 cm di diametro) nel mezzo semisolido.
NOTA: Il coperchio stampato in 3D con materiale in resina non può essere sterilizzato utilizzando vapore ad alta temperatura. Per uccidere i batteri superficiali, può essere spruzzato con etanolo al 95% e poi irradiato con una lampada UV per 30 minuti in una cappa di sicurezza biologica. Quando si rimuove il coperchio, applicare forza in direzione verticale e sollevarlo con cautela per evitare danni all'agar semisolido. - Prima che il brodo 5x TB (contenente lo 0,5% di Agar) si solidifichi, utilizzare una pipetta per aggiungere il brodo 5x TB al pozzetto della piastra semisolida fino a quando il brodo non è a filo con la superficie del terreno.
- Raffreddare la piastra in una cabina di sicurezza biologica per ottenere una piastra di agar semisolida contenente corpi eutrofici. Fare attenzione a evitare la contaminazione delle piastre da parte di microrganismi ambientali.
NOTA: Il mezzo semisolido è ancora un po' fluido e, quindi, deve essere completamente raffreddato prima di essere conservato capovolto.
- Inoculazione, coltivazione e fotografia batterica
- Posizionare la piastra di agar con il terreno di coltura semisolido in una cappa di sicurezza biologica e raffreddarla per ~30 minuti sotto irradiazione UV per prevenire la contaminazione batterica.
- Utilizzare una pipetta da 10 μl per prelevare 4 μl di sospensione batterica coltivata a un diametro esterno di ~0,6-0,8, inserire la punta della pipetta al centro delle piastre di Petri in plastica e pipettare la sospensione batterica.
- Attendere che la sospensione batterica venga assorbita nel terreno per 1 minuto. Quando la sospensione batterica è stata completamente assorbita, dividere la piastra in due gruppi (aerobico/anaerobico) in triplicato.
- Sigillare il gruppo aerobico con del nastro sigillante e posizionare le piastre capovolte in un incubatore biochimico a 37 °C per coltura statica. Sigillare il gruppo anaerobico in una scatola anaerobica come descritto al punto 4.2, capovolgendo le piastre a 37 °C per la crescita.
- Controllare la diffusione e la migrazione dei batteri ogni 12 ore (a 0 ore, 12 ore, 24 ore, 36 ore e 48 ore) e utilizzare il sistema di imaging per acquisire immagini della piastra.
- Utilizza il software ImageJ per calcolare le distanze di migrazione batterica.
- Importare il file immagine acquisito utilizzando il sistema di imaging.
- Imposta la barra della scala e applicala a tutte le immagini.
- Quando si scattano immagini, aggiungere un righello, creare un segmento di linea, selezionare un segmento di linea retta (ad esempio, 1 cm, quindi impostare la lunghezza di questo segmento di linea su 1 cm) e contrassegnare la lunghezza della tavola.
- Aprire la finestra Imposta scala ; clicca su Analizza | Imposta scala.
- Digitare la lunghezza effettiva in Distanza nota e Unità di lunghezza.
- Controlla Globale.
- Immettere l'indirizzo della cartella dell'immagine originale e l'indirizzo del file di output.
- Utilizzare lo strumento linea retta per selezionare le comunità una per una e regolare la tolleranza fino a quando la linea retta dell'utensile non si adatta al confine della colonia batterica che si estende su entrambi i lati.
- Misura la distanza di migrazione della colonia dal centro a entrambe le estremità separatamente e ricava la lunghezza della linea retta facendo clic su Analizza | Misurare.
- Ripetere i passaggi 5.3.3-5.3.4 fino a quando tutte le comunità non sono state misurate e salvare i risultati in un file .csv per ulteriori analisi.
Risultati
Questo lavoro descrive gli approcci adottati per caratterizzare i microbi isolati dal microbioma ospite (Figura 1). Come prova di concetto, tre microbi sono stati isolati dall'ospite del ratto SD (C. stationis, S. cohnii ed E. faecalis) e due microrganismi acquisiti commercialmente (S. aureus ATCC 25923 ed E. faecalis V583) sono stati testati utilizzando questo protocollo. Per stabilire il fabbisogno di ossigeno dei singoli microbi utilizzando FTM, abbiamo aggiunto due organismi di controllo, un anaerobo obbligato (Fusobacterium nucleatum ATCC 25586) e un anaerobo facoltativo (Pseudomonas aeruginosa PAO1). I risultati hanno mostrato che i cinque microbi testati erano anaerobi facoltativi (Figura 2A), in linea con i profili precedentemente riportati di questi microbi11. Per chiarire il loro fabbisogno di ossigeno, i microbi sono stati coltivati sia in condizioni aerobiche che anaerobiche. Tutti i microbi testati hanno mostrato una curva di crescita sigmoidale sia in condizioni aerobiche che anaerobiche; tuttavia, la densità microbica, come indicato dall'OD600nm, ha mostrato che tutti e cinque i microbi hanno una maggiore preferenza per gli ambienti ricchi di ossigeno (Figura 2B, C). Queste osservazioni sono coerenti con le capacità microbiche di infiltrarsi e infettare le ossa di ratto, che sono generalmente considerate ipossiche.
Si è scoperto che i cinque isolati batterici formano naturalmente biofilm, dove la massa di biofilm prodotta era più alta in condizioni anaerobiche. Attraverso il confronto della curva di crescita, si è scoperto che i biofilm di E. faeclis e S. aureus ATCC 25923 si formano attivamente durante la fase di crescita stazionaria sia in ambienti aerobici che anaerobici (Figura 3). Questa osservazione suggerisce che la formazione del biofilm dipende dallo stato di crescita delle cellule, eventualmente regolato da molecole di segnalazione intracellulare che innescano la formazione del biofilm11. Questa dipendenza della formazione del biofilm dalle condizioni di crescita è coerente con le condizioni di nutrienti e di crescita presentate dall'ambiente della matrice ossea ospite che manca di ossigeno e sostanze nutritive.
Gli studi sulla patogenesi dei microbi sono spesso legati alla capacità del microbo di migrare verso siti considerati favorevoli alla crescita. Ci sono molti studi sulla chemiotassi microbica, ma non esiste un approccio standardizzato per studiarla. Inoltre, l'uso di sostanze chimiche non diffusibili è stato considerato un fattore limitante nello studio di questo fenomeno. Qui, abbiamo sviluppato una copertura in resina prodotta tramite stampa 3D che standardizza la distanza tra il serbatoio chimico e il punto di inoculazione (Figura supplementare S1 e Figura supplementare S2). Abbiamo studiato la migrazione dei microbi in un ambiente ricco di sostanze nutritive, dove 5x TB è stato utilizzato come stimolante chimico. I microbi sono stati monitorati per 48 ore in condizioni aerobiche e anaerobiche, dove tutti e cinque i microbi hanno mostrato diversi gradi di migrazione del tropismo (Figura 4A).
ImageJ è stato utilizzato per misurare la distanza di migrazione dei batteri (Figura 4B); La migrazione verso il bacino sembra essere più veloce della migrazione nella direzione opposta. Il rapporto tra la distanza di migrazione verso il serbatoio e quella nella direzione opposta mostra la rapida espansione della colonia microbica dovuta alla chemiotassi microbica (Figura 5B). In questo studio, batteri come S. aureus ATCC 25923 sono migrati più velocemente di altri microbi come C. stationis. È interessante notare che il profilo di migrazione delle colture chemiotattiche in condizioni aerobiche e anaerobiche ha mostrato che alcuni batteri, come E. faecalis, hanno mostrato variazioni nei modelli di migrazione in condizioni aerobiche e anaerobiche, in cui è stata osservata una rapida espansione in condizioni anaerobiche nel tempo. Confondendo, il ceppo di laboratorio E. faecalis V583 ha favorito un ambiente aerobico per la chemiotassi. Pertanto, ciò suggerisce che E. faecalis isolato da fonti diverse ha esigenze di crescita diverse adattate all'ambiente di crescita.

Figura 1: Diagramma schematico del processo operativo. (A) I batteri vengono inoculati su piastre e poi in mezzo liquido e cresciuti fino alla fase di crescita logaritmica. (B) Determinazione della capacità dei batteri di formare biofilm in diverse condizioni (aerobica/anaerobica). Sono stati selezionati tre campioni per ogni punto temporale (6 ore) e ripetuti in parallelo. (C) Il protocollo per l'esperimento del tropismo chimico dei batteri in diverse condizioni (aerobico/anaerobico). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Condizioni di crescita microbica. (A) Il profilo di crescita dei batteri coltivati in terreno fluido di tioglicolato (da sinistra a destra I: Fusobacterium nucleatum ATCC 25586, II: Corynebacterium stationis, III: Staphylacoccus cohnii, IV: Enterococcus faecalis, V: Staphylacoccus aureus ATCC 25923, VI: Enterococcus faecalis V583 e VII: Pseudomonas aeruginosa PAO1). (B) Curva di crescita di microrganismi isolati dall'ospite in condizioni aerobiche. (C) Curva di crescita di microrganismi isolati dall'ospite in condizioni anaerobiche. Clicca qui per visualizzare una versione più grande di questa figura.
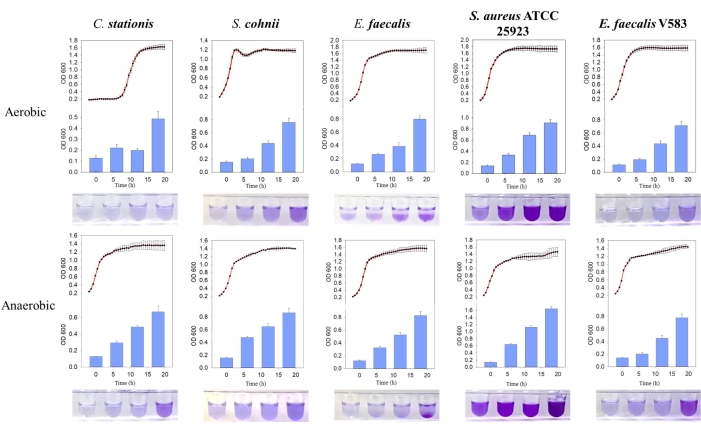
Figura 3: Confronto delle curve di crescita e della formazione di biofilm di diversi batteri in diverse condizioni. Da sinistra a destra ci sono Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ed Enterococcus faecalis V583. La curva rossa è la curva di crescita e l'istogramma blu è la quantità di biofilm prodotta. Clicca qui per visualizzare una versione più grande di questa figura.
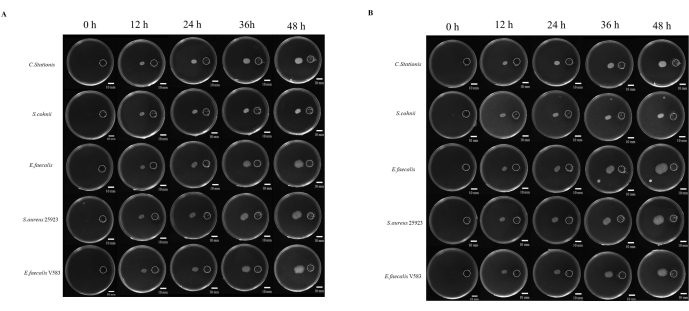
Figura 4: Crescita microbica verso l'eutrofizzazione. (A) Condizioni aerobiche, (B) condizioni anaerobiche. Cinque tipi di batteri (dall'alto verso il basso sono Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ed Enterococcus faecalis V583) tendono a crescere verso l'eutrofizzazione sulla piastra nutritiva differenziale. Barre della scala = 10 mm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Chemiotassi di microbi in diverse condizioni (aerobica/anaerobica). (A) I risultati della migrazione del tropismo chimico di cinque batteri su una piastra contenente agar ricco di sostanze nutritive; Il gruppo di sinistra rappresenta le condizioni aerobiche e il gruppo di destra le condizioni anaerobiche. Ogni esperimento è stato ripetuto in triplice copia in parallelo. (B) Analisi dei dati del tropismo chimico. La parte superiore rappresenta le condizioni aerobiche e la parte inferiore le condizioni anaerobiche. Da sinistra a destra ci sono Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ed Enterococcus faecalis V583. Le colonne rosse e blu sono le distanze di migrazione dal corpo nutritivo dei batteri che migrano verso e lontano dal corpo nutriente. La linea è la differenza tra i due valori (Rosso - Blu). Barre della scala = 10 mm. Clicca qui per visualizzare una versione più grande di questa figura.
Figura S1 supplementare: Utilizzo di coperchi stampati in 3D per realizzare piastre di agar per la differenza dei nutrienti. (A) Utilizzare il software per preparare i rendering degli stampi per la stampa 3D. (B) Stampo a copertura piatta stampato con resina 8.000. (C) Utilizzare il metodo sopra per ottenere le piastre di agar con differenza di nutrienti. (D) Produzione delle piastre di agar con differenza di nutrienti. Clicca qui per scaricare questo file.
Figura supplementare S2: Costruzione di piastre di agar per differenza di nutrienti e misurazione della distanza di migrazione batterica utilizzando ImageJ. (A) La costruzione delle piastre di agar con differenza di nutrienti utilizza un coperchio stampato in 3D (contenente una sporgenza cilindrica) per coprire la piastra. Dopo che l'agar si è raffreddato, si forma un pozzetto cilindrico (il cerchio rosso), che viene riempito con 5 TB di agar. Questo viene poi raffreddato per ottenere piastre di agar per differenza di nutrienti. (B) Utilizzare ImageJ per misurare la distanza di migrazione dei batteri in diverse direzioni. Impostare la barra di scala (Analizza | Imposta scala) ed esportare la distanza di migrazione utilizzando Dritto (Analizza | Misura). Clicca qui per scaricare questo file.
Figura supplementare S3: Modelli di crescita di cinque batteri su agar medio M9 minimo-5x TB medio. Il gruppo di sinistra è per le condizioni aerobiche e il gruppo di destra è per le condizioni anaerobiche. Clicca qui per scaricare questo file.
Figura S4 supplementare: Esperimenti di controllo sulle curve di crescita di Fusobacterium nucleatum ATCC 25586 e sulla chemiotassi di batteri anaerobi. (A) Determinazione delle curve di crescita di F. nucleatum ATCC 25586 in condizioni aerobiche e anaerobiche. (B) Esperimenti di chemiotassi di F. nucleatum ATCC 25586 su piastre di agar MH-5x TB a mezza dose in diverse condizioni di ossigeno. Allargamento parziale: Crescita di F. nucleatum ATCC 25586 sulla lastra in condizioni anaerobiche dopo 48 ore (ingrandimento parziale). Clicca qui per scaricare questo file.
| Composto | Concentrazione (g/L) |
| Na2HPO4 | 6.78 |
| KH2PO4 | 3 |
| NaCl | 0.5 |
| NH4Cl | 1 |
| MgSO4.7H 2O | 0.493 |
| CaCl2 | 0.011 |
| Glucosio | 4 |
Tabella 1: Componenti e contenuto del supporto M9 Minimal.
Discussione
Abbiamo isolato e identificato cinque specie di batteri con metodi sequenziali. La crescita dei batteri ha un fabbisogno minimo di nutrienti: il mezzo minimo è un terreno contenente solo sali inorganici, una fonte di carbonio e acqua. Sebbene i batteri nel gruppo sperimentale siano stati trovati su piastre solide MH, abbiamo utilizzato un mezzo MH a metà dose per verificare la chemiotassi dei batteri e abbiamo ottenuto buoni risultati. Tuttavia, abbiamo anche eseguito esperimenti di controllo utilizzando un terreno minimo. Nell'esperimento è stato utilizzato il terreno di base M9 (vedi Tabella 1 per la sua composizione e contenuto) e 5x TB agar è stato ancora utilizzato per il blocco di agar nutriente. I risultati sperimentali sono mostrati nella Figura S3 supplementare. Sebbene questi batteri (ad eccezione di E. faecalis) crescano lentamente e si muovano lentamente nel terreno M9, c'è una tendenza generalmente simile (verso la crescita su agar nutriente), come osservato in questi esperimenti. Tuttavia, E. faecalis V583 non è cresciuto su terreno minimo M9, probabilmente a causa della mancanza di componenti necessari per E . faecalis per crescere in terreno M9. Pertanto, si consiglia di utilizzare una mezza dose di terreno MH come substrato carente di nutrienti per simulare la crescita e la migrazione batterica in condizioni di carenza di nutrienti. Ciò facilita anche l'uso del software ImageJ per misurare la distanza su cui i batteri tendono a migrare.
I biofilm sono generalmente definiti come comunità microbiche associate alla superficie e rappresentano un'importante strategia di sopravvivenza microbica. Organismi come Pseudomonas aeruginosa, Haemophilus influenzae, Streptococcus pneumoniae e Staphylococcus aureus possono essere trovati in ospiti asintomatici e la scoperta di microrganismi aderenti in vivo è spesso indicata come colonizzazione, non infezione. Un problema molto importante è la mancanza di un modello ideale di colonizzazione animale12. I microbi dimostrano attacchi iniziali alle superfici cariche prima della formazione del biofilm, dove materiali come il vetro e il cloruro di polivinile (PVC) sono ritenuti adatti per gli studi relativi al biofilm. Per studiare i biofilm microbici 9 sono stati utilizzati studi che utilizzano piastre in PVCa 96 pozzetti, in cui i biofilm di una o più specie possono portare a biofilm debolmente o densamente impacchettati10. Pertanto, l'uso della piastra in PVC a 96 pozzetti è considerato inadatto per i biofilm impacchettati in modo lasco, poiché la matrice del biofilm può essere facilmente lavata via durante il processo di colorazione del biofilm. Pertanto, ci siamo affidati a provette di vetro per studiare la formazione di biofilm microbici (Figura 3).
Una limitazione chiave di questo metodo è che non funziona con microrganismi che crescono in condizioni specifiche e non tutti i batteri possono migrare. Inoltre, sebbene i biofilm siano un mezzo efficace per aiutare i microrganismi a difendersi dagli ambienti esterni avversi, non tutti i microrganismi ospiti sono in grado di produrre biofilm. Ad esempio, F. nucleatum ATCC 25586, menzionato in precedenza, che è associato a una simbiosi orale o intestinale umana associata allo sviluppo del cancro del colon17, cresce solo in ambienti anaerobici ma non produce biofilm. Lo abbiamo utilizzato negli esperimenti FTM per verificare l'efficacia del mezzo FT. Il terreno FT ha dimostrato di essere efficace nel fornire ai batteri concentrazioni di ossigeno in gradiente.
Per confronto, abbiamo testato la curva di crescita e il tropismo chimico del batterio anaerobico F. nucleatum ATCC 25586 (Figura supplementare S4). Negli esperimenti sulla curva di crescita (Figura supplementare S4A), F. nucleatum ATCC 25586 non poteva crescere in condizioni aerobiche e mostrava aggregazione batterica sul fondo dei pozzetti in condizioni anaerobiche. Anche negli esperimenti di chemiotassi (Figura supplementare S4B), F. nucleatum ATCC 25586 non è cresciuto in condizioni aerobiche e un basso numero di batteri è stato trovato dopo l'inoculazione in situ in condizioni anaerobiche per 48 ore. Allo stesso modo, poiché alcuni batteri non possono cercare attivamente condizioni di crescita adeguate migrando, attendono condizioni di crescita adeguate entrando in uno stato dormiente a lungo termine18. Va notato che la coltivazione di batteri anaerobi rigorosi richiede un mezzo speciale, come il mezzo di fermentazione ET (le piastre semisolide devono essere integrate con lo 0,5% di agar), che è anche diverso dall'isolamento e dall'identificazione convenzionali. Questo metodo proposto è un metodo generale applicabile per caratterizzare la maggior parte dei microrganismi ospiti, con la tecnica dimostrata per cinque microbi, inclusi tre microbi isolati da ossa murine e due microbi di laboratorio. Questo protocollo aiuterebbe la corretta identificazione degli isolati del microbiota negli studi futuri.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Lo sviluppo di questa tecnica è stato sostenuto dai fondi del Fondo nazionale per le scienze naturali della Cina per la ricerca per giovani scienziati internazionali (22050410270), del Fondo speciale di Shenzhen per l'innovazione e l'imprenditorialità dei talenti di alto livello d'oltremare Peacock Team (KQTD20170810111314625) e del Guangdong Innovative and Entrepreneurial Research Team Program (2019ZT08Y191). Vorremmo offrire la nostra sincera gratitudine alla signorina Chen Xinyi per la sua assistenza nella correzione delle bozze del documento e nella gestione del laboratorio.
Materiali
| Name | Company | Catalog Number | Comments |
| Chemical/Solution | |||
| 1% crystal violet dye solution | Solarbio | G1062 | 100 mL |
| Agar | Sigma-Aldrich | V900500 | Used to obtain semi-solid plates, 20 g |
| Centrifuge tube | Corning | 430790 | 15 mL |
| Fluid thioglycollate medium | Kinghunt | K0001 | 29.3 g |
| Mueller Hinton II Broth medium | Solarbio | NO.11865 | 100 g |
| Petri dishes | Bkman | B-SLPYM90-15 | Plastic Petri dishes, circular, 90 mm x 15 mm |
| Potassium Chloride | VETEC | WXBC4493V | 0.2 g |
| Potassium Dihydrogen Phosphate | aladdin | 04-11-7758 | 0.24 g |
| Sodium chloride | Macklin | S805275 | 8.0 g |
| Sodium phosphate dibasic | aladdin | 7558-79-4 | 1.44 g |
| Terrific Broth medium | Solarbio | LA2520 | 200 g |
| Kits/ Equipment | |||
| Anaerobic incubator | Longyue | ||
| Biochemical incubator | Blue pard | LRH-70 | |
| Microplate reader | Spark | ||
| Tanon 5200multi imaging system | Tanon | 5200CE | |
| Thermostatic water bath | Jinghong | DK-S28 |
Riferimenti
- Bernardi, S., et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients' tongue biofilm. MicrobiologyOpen. 9 (2), 958 (2020).
- Tellez, G., Latorre, J. D., Kuttappan, V. A., et al. Rye affects bacterial translocation, intestinal viscosity, microbiota composition and bone mineralization in Turkey poults. PLOS One. 10, (2015).
- Brewer, J. H. Clear liquid mediums for the "aerobic" cultivation of anaerobes. Journal of the American Medical Association. 115 (8), 598 (1940).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Liu, C., et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review. Frontiers in Microbiology. 11, 802 (2020).
- Kumar, A., et al. Biofilms: survival and defense strategy for pathogens. International Journal of Medical Microbiology. , (2017).
- Penesyan, A., et al. Secondary effects of antibiotics on microbial biofilms. Frontiers in Microbiology. 11, 2109 (2020).
- Bernardi, S., et al. Subinhibitory antibiotic concentrations enhance biofilm formation of clinical Enterococcus faecalis isolates. Antibiotics. 10 (7), 874 (2021).
- Tsukatani, T., Fumihiko, S., Rieko, K. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids. World Journal of Microbiology and Biotechnology. 36 (12), 1-9 (2020).
- Hartmann, R., et al. Emergence of three-dimensional order and structure in growing biofilms. Nature Physics. 15, 251-256 (2019).
- Liu, Z., et al. Advances in bacterial biofilm management for maintaining microbiome homeostasis. Biotechnology Journal. 15 (10), 1900320 (2020).
- Hall-Stoodley, L., Stoodley, P. Evolving concepts in biofilm infections. Cellular Microbiology. 11 (7), 1034-1043 (2009).
- Røder, H. L., et al. Enhanced bacterial mutualism through an evolved biofilm phenotype. The ISME Journal. 12 (11), 2608-2618 (2018).
- Matilla, M. A., Tino, K. The effect of bacterial chemotaxis on host infection and pathogenicity. FEMS Microbiology Reviews. 42 (1), 052 (2018).
- Moreira, L. M., et al. Chemotactic signal transduction and phosphate metabolism as adaptive strategies during citrus canker induction by Xanthomonas citri. Functional & Integrative Genomics. 15 (2), 197-210 (2015).
- Konishi, H., et al. Bacterial chemotaxis towards polysaccharide pectin by pectin-binding protein. Scientific Reports. 10 (1), 1-12 (2020).
- Kostic, A. D., et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host & Microbe. 14 (2), 207-215 (2013).
- Kochan, T. J., et al. Updates to Clostridium difficile spore germination. Journal of Bacteriology. 200 (16), 00218 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon