Method Article
מדידת הנדידה והיווצרות הביופילם של חיידקים שונים
In This Article
Summary
כאן אנו מציגים שיטה מעשית לבידוד וזיהוי של מיקרואורגניזמים בתוך המארח. באופן זה מתוארות בבירור התכונות הפיזיקוכימיות של מיקרואורגניזמים ודרכי החיים האפשריות במארח.
Abstract
מכיוון שלחיידקים המשגשגים בגוף המארח יש בעיקר יכולות הסתגלות המאפשרות את הישרדותם, שיטות לסיווג וזיהוי טבעם יועילו להקל על אפיונם. נכון לעכשיו, רוב המחקרים מתמקדים רק בשיטת אפיון ספציפית אחת; עם זאת, בידוד וזיהוי של מיקרואורגניזמים מהמארח הוא תהליך מתמשך ובדרך כלל דורש מספר שיטות אפיון קומבינטוריות. כאן, אנו מתארים שיטות לזיהוי יכולת יצירת הביופילם המיקרוביאלי, מצב הנשימה המיקרוביאלית והתנהגות הכימוטקסיס שלהם. השיטות משמשות לזיהוי חמישה חיידקים, שלושה מהם בודדו מרקמת העצם של חולדות Sprague-Dawley (SD) (Corynebacterium stationis, Staphylococcus cohnii subsp. urealyticus ו-Enterococcus faecalis) ושניים מאוסף תרביות הסוג האמריקאי (ATCC)-Staphylococcus aureus ATCC 25923 ו-Enterococcus faecalis V583. המיקרובים שבודדו מרקמת העצם של חולדת SD כוללים את המיקרובים הגראם חיוביים. חיידקים אלה הסתגלו לשגשג בסביבות מלחיצות ומגבילות חומרים מזינים בתוך מטריצת העצם. מאמר זה נועד לספק לקוראים את הידע הספציפי של קביעת האופי וההתנהגות של המיקרובים המבודדים בתוך סביבת מעבדה.
Introduction
מארח היונקים המיוצג על ידי גוף האדם מכיל מספר רב של מיקרואורגניזמים. מיקרואורגניזמים אלה מופצים באופן נרחב בפה, בדרכי העיכול, במעי ובדם של המארח ויש להם השפעות שונות על בריאות המארח. חלל הפה מארח שפע של חיידקים שיכולים לווסת את הרגישות של המארח לזיהומים. חיידקים כגון סטרפטוקוקוס (למשל, S. mitis/oralis, S. pseudopneumoniae ו-S. infantis) ו-Prevotella spp. מתיישבים בחלל הפה, יוצרים ביופילם רב-מינים על פני הלשון הגורם לריח רע מהפה ומתפקד כמאגר מיקרוביאלי לזיהום מיקרוביאלי. פתוגנים אלה יכולים להדביק את עצם הלסת על ידי חדירה לרצועות החניכיים המחזיקות את שורש השן בעצם הלסת1. האפיון של המיקרובים האלה שבודדו מגוף המארח הוא לעתים קרובות תהליך מייגע, במיוחד כאשר המיקרובים מציגים תכונות אינדיבידואליות הדורשות טיפול ספציפי ותנאי גדילה. חיידקים, כגון הליקובקטר פילורי הפתוגני, קלוסטרידיום דיפיצילה ופוסובקטריום נוקלאטום, משגשגים בסביבה הקשה של המעי, עם דרישות ספציפיות של חמצן, חומרים מזינים וגדילה, מה שמהווים אתגר בתהליכי האפיון, במיוחד בחקירת הפתוגניות של חיידקים אלה. לכן, דרושה שיטה סטנדרטית לבידוד וחקירה של המיקרואורגניזמים האלה עבור מדענים ורופאים כדי לפתח טיפולים רפואיים חדשים.
פרוטוקול זה משתמש בחיידקים המשגשגים במטריצת העצמות של חולדות. באופן מסורתי, למעט מערכת העצמות המיוצגת על ידי הלסת, שבה נוכחות השיניים הופכת את מטריצת העצם לרגישה יותר לזיהום מאשר עצמות אחרות1, בדרך כלל מאמינים כי העצם הבריאה של המארח היא סביבה סטרילית. עם זאת, מחקרים מצאו כי מיקרואורגניזמים נכנסים למחזור הדם המערכתי דרך דופן המעי, ובסופו של דבר משפיעים על מינרליזציה של העצם2. כהוכחת רעיון, אנו משתמשים בפרוטוקול המתואר כדי לאפיין את התכונות הביוכימיות של מבודדים מיקרוביאליים מעצם הירך והשוק של חולדות SD בריאות (Corynebacterium stationis, Staphylococcus cohnii subsp. ו-Enterococcus faecalis). מבודדים מיקרוביאליים אלה נבחרו מכיוון שהעצם היא סביבה סגורה והיפוקסית, ואפיון החיידקים האלה מהעצם יכול להיות משימה מאתגרת. מאמרים שונים פירטו את התהליכים המשמשים לחקר המיקרובים האלה; עם זאת, ישנם מעטים המספקים פרוטוקול שלם לזיהוי מיקרואורגניזמים מבודדים על ידי מארח.
בקביעת תנאי התרבית המתאימים, יש להבין את דרישות החמצן של המיקרוב באמצעות שימוש במדיום תיוגליקולט נוזלי (FTM). חיידקים עם דרישות חמצן שונות יוצרים שכבות מרובדות בנוזל ה-FTM השקוף3. בהתבסס על פרופיל הריבוד, דרישת החמצן של המיקרוב משמשת לאחר מכן לחקירת צמיחת התאים. חיידקים המשגשגים על פני השטח של נוזל ה-FTM הם אירובים מחייבים, ואילו מיקרובים שגדלים בתחתית הם אנאירובים מחויבים. חיידקים הגדלים כמתלה בנוזל ה-FTM הם אנאירובים פקולטטיביים או סובלניים לאוויר. קצב הגידול המיקרוביאלי נקבע על ידי התבוננות בשלב הגידול האקספוננציאלי של התאים המיקרוביאליים. לאחר מכן משווים את פרופיל הגידול להיווצרות הביופילם של המיקרוב. ביופילמים מורכבים ברובם ממספר מינים המשפיעים באופן ישיר ועקיף זה על בריאותו של זה. במהלך תהליך זה, אינטראקציות מועילות בין קהילות מיקרוביאליות בוחרות התקשרות, ומספקות מבנה מרחבי המעדיף את האבולוציה של אינטראקציות הדדיות פעילות. לדוגמה, התרבות המשותפת של Paenibacillus amylolyticus ו-Xanthomonas retroflexus מציגה אינטראקציות סימביוטיות פקולטטיביות בסביבה סטטית, ומקדמת צמיחה מהירה של ביופילם13. חיידקים מסתגלים לרקמות המארח באמצעות היווצרות ביופילם ללוקליזציה מתמשכת, מגנים על עצמם מפני סביבות קשות ומתחמקים ממערכת החיסון של המארח 4,5,6,7. ביופילמים הם בדרך כלל מבנים צפופים ורב-שכבתיים המסייעים למיקרואורגניזמים להתנגד לגירויים תת-קריטיים חיצוניים; לדוגמה, E. faecalis במוך השן משפר את עמידותו לאנטיביוטיקה על ידי הגברת היווצרות הביופילם כאשר הוא מתמודד עם תת-ריכוזים של טטרציקלין וונקומיצין8.
כימוטקסיס מאפשר למיקרואורגניזמים לנוע בהתאם לשיפועים כימיים, ומסלולי איתות מפוזרים באופן נרחב במגוון חיידקים פתוגניים. חלק מהמיקרואורגניזמים הפתוגניים נודדים לאתרים ספציפיים, בהנחיית אותות כימיים, כדי לגרום למחלות זיהומיות14. לדוגמה, Xanthomonas spp. מבטאים 19 קולטנים כימיים ו -11 חלבוני פלאגלין במארח, מה שמפעיל קשירת חיידקים ובסופו של דבר כיב15. ישנם גם חלבונים ספציפיים בחיידקים (חלבונים קושרי פקטין) המנחים את הנדידה הספציפית של חיידקים לחומרים מזינים, מה שיכול להוביל לצמיחה טובה יותר16. זה קריטי גם עבור חיידקים שעלולים להתקיים בסביבות דלות בחומרים מזינים. תאים מיקרוביאליים מסתמכים לעתים קרובות על תנועתיות כימוטקטית כדי למשוך את עצמם לסביבת גידול תומכת תוך התחמקות מתאים טורפים ורעלנים אחרים הפוגעים בכדאיות התאים. בהתבסס על גישות אגר רכות שנקבעו בעבר לקביעת הכימוטקסיס, אנו מפתחים שיטה ניתנת לדיפוזיה ליצירת שיפוע כימואטרקטיבי לבדיקת הכימוטקסיס המיקרוביאלי.
מאמר זה מתאר את השיטות לקביעת תנאי הגידול, היווצרות הביופילם והטרופיזם הכימי של חיידקים, תוך שימוש ב-Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ו-Enterococcus faecalis V583 כדוגמאות (ראו איור 1). האופטימיזציה של תנאי הגידול המיקרוביאלי משתמשת ב-FTM כדי לקבוע את דרישות החמצן של החיידק, בעוד שהיווצרות ביופילם משתמשת במשטחי זכוכית כגיבוי מוצק, ומסת הביופילם מוכתמת בסגול קריסטל. הטרופיזם הכימי של החיידק מסתמך על ההתנהגות הכימוטקטית שלו, כאשר באמצעות הדפסת תלת מימד (איור משלים S1), נעשה שימוש בשיטה סטנדרטית ליצירת מאגר כימי עבור החומר הכימי במטריצת אגר רכה (איור משלים S2).
Protocol
הערה: עיין בטבלת החומרים לקבלת פרטים על כל החומרים והציוד המשמשים בפרוטוקול זה. השתמש בטכניקות אספטיות כדי למנוע זיהום.
1. התאוששות חיידקים לקבלת מושבה אחת
- הכן צלחות אגר מוצקות.
- הכינו מדיום מרק נהדר (TB) המכיל אגר, כאשר כל ליטר נוזל מכיל 11.8 גרם טריפטון, 23.6 גרם תמצית שמרים, 9.4 גרם K2HPO4, 2.2 גרם KH2PO4 ו-15 גרם אגר, pH = 7.
- חיטוי התמיסה ב-121 מעלות צלזיוס למשך 20 דקות באמצעות מכסה חדיר אוויר או סרט איטום בקבוקים עם פתח אוורור.
- לפני שהנוזל מתקרר ומתמצק, שפכו את מרק השחפת המכיל אגר לצלחות פטרי מפלסטיק בגודל 10 ס"מ בנפח 25 מ"ל לצלחת.
הערה: יש לשפוך את המרק לצלחת לפני שהוא מתמצק בטמפרטורות נמוכות מ-60 מעלות צלזיוס. השתמש בטכניקות אספטיות למניעת זיהום.
- חיסון חיידקים לצלחת
- הוציאו את זני המטרה המאוחסנים בטמפרטורה של -80 מעלות צלזיוס והפשירו אותם בטמפרטורת החדר בארון בטיחות ביולוגי.
- השתמש בפיפטה של 10 מיקרוליטר כדי לקחת 10 מיקרוליטר של תרחיף חיידקים ולפזר אותו על צלחת השחפת על ידי פסים.
- אטום את הצלחת כדי למנוע זיהום. מניחים את הצלחת בחממה ביוכימית בטמפרטורה של 37 מעלות צלזיוס. בדוק את צמיחת המושבה באופן ויזואלי לאחר ~ 24 שעות. בחר מושבות בודדות והגביר אותן באמצעות PCR כדי לאשר שהן מכילות רק סוג אחד של חיידקים.
2. תרבית נוזל חיידקים לשלב גידול לוגריתמי
- הכן מדיום תרבות נוזלי.
- עיין בהכנת לוחות אגר מוצקים בשלב 1.1.1. להכנת מדיום נוזלי לשחפת, ש-1 ליטר ממנו מכיל 11.8 גרם טריפטון, 23.6 גרם תמצית שמרים, 9.4 גרם K2HPO4 ו-2.2 גרם KH2PO4, pH ~ 7.
הערה: אין להוסיף אגר. חיידקים גדלים מהר יותר בסביבה מזינה נוזלית. - חיטוי התמיסה ב-121 מעלות צלזיוס למשך 20 דקות באמצעות מכסה חדיר אוויר או סרט איטום בקבוקים עם פתח אוורור.
- אחסן את מדיום התרבות הנוזלית בטמפרטורה של 4 מעלות צלזיוס.
- עיין בהכנת לוחות אגר מוצקים בשלב 1.1.1. להכנת מדיום נוזלי לשחפת, ש-1 ליטר ממנו מכיל 11.8 גרם טריפטון, 23.6 גרם תמצית שמרים, 9.4 גרם K2HPO4 ו-2.2 גרם KH2PO4, pH ~ 7.
- חיסון וטיפוח חיידקים
- בארון הבטיחות הביולוגי, בחר מושבה בודדת עם לולאת חיסון או פיפטה של 10 מיקרוליטר וחסן את החיידקים במדיום הנוזלי המוכן לשחפת בבקבוק ארלנמאייר.
- אוטמים את בקבוק ארלנמאייר בגזה ומניחים אותו בשייקר (200 סל"ד) בטמפרטורה של 37 מעלות צלזיוס כדי לטפח את החיידקים.
הערה: המדיום הנוזלי הופך עכור בהדרגה במשך 5 שעות; הזמן שלוקח להיות עכור משתנה עם חיידקים שונים.
3. ניסוי FTM וקביעת עקומת צמיחה
- הכנת נוזל תיוגליקולט בינוני (FTM)
- הכינו תיולגליקולט מדיום (TM), שכל ליטר ממנו מכיל 15 גרם טריפטון, 5 גרם תמצית שמרים, 5 גרם גלוקוז, 0.5 גרם L-ציסטאין, 0.5 גרם נתרן תיוגליקולאט, 2.5 גרם נתרן כלורי, 0.001 גרם רזזורין ו-0.75 גרם אגר.
הערה: ניתן לשחזר בקלות מדיום מוצק זמין מסחרית עם מים ולעקר אותו (שלב 3.1.2.). - שוקלים 29.3 גרם תיוגליקולט בינוני מוצק, מוסיפים 1 ליטר מים מזוקקים, מחממים ומערבבים עד להמסה מלאה ועד שהתמיסה הופכת לוורודה.
- הוסף TM (19 מ"ל) למבחנה עם פקק איטום. לאחר האיטום, חיטוי התמיסה ב-121 מעלות צלזיוס למשך 20 דקות באמצעות מכסה חדיר אוויר או סרט איטום בקבוקים עם פתח אוורור.
הערה: לאחר החימום, התמיסה הופכת לצהובה בהירה.
- הכינו תיולגליקולט מדיום (TM), שכל ליטר ממנו מכיל 15 גרם טריפטון, 5 גרם תמצית שמרים, 5 גרם גלוקוז, 0.5 גרם L-ציסטאין, 0.5 גרם נתרן תיוגליקולאט, 2.5 גרם נתרן כלורי, 0.001 גרם רזזורין ו-0.75 גרם אגר.
- חיסון, טיפוח ותצפית על חיידקים
- הכן את תרחיף החיידקים לגדול ל-OD 0.6-0.8 במדיום שחפת נוזלי (ראה שלב 2.2.).
- פתח את פקק האיטום של המבחנה בתנאים אספטיים בארון הבטיחות הביולוגי, הוסף 1 מ"ל מתרבית החיידקים למבחנה המכילה FTM בהקדם האפשרי, ואטום מיד את המבחנה שוב.
- נער את הצינור בעדינות כדי לוודא שהחיידקים מפוזרים בצורה הומוגנית בנוזל והנח את המבחנה בטמפרטורה של 37 מעלות צלזיוס לתרבית סטטית.
- לאחר 48 שעות של דגירה, התבונן בצמיחה של חיידקים שונים ב-FTM במבחנות שונות וצלם תמונות.
- קביעת עקומת גדילה בתנאים אירוביים
- הכינו את תרבית החיידקים הראשונית עם ערך OD מתאים (ראה שלב 2.2.), ותרבו את החיידקים עד שהם מגיעים לשלב הגידול הלוגריתמי.
הערה: Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ו-Enterococcus faecalis V583 המשמשים בפרוטוקול זה לקח ~5 שעות להגיע לשלב היומן. - הוסף 200 מיקרוליטר מתרבית החיידקים (משלב 3.3.1) במדיום נוזלי שחפת לכל באר של צלחת של 96 בארות בשלוש עותקים. השתמש בקורא מיקרו-פלטות כדי לקבוע את ערך ה-OD ב-600 ננומטר, ודלל את תרביות החיידקים השונות כך שהפרש ה-OD בין הבארות השונות המכילות חיידקים לבין המדיום הנוזלי של שחפת (ריק) יהיה בין 0.01 ל-0.02.
- קח צלחת חדשה של 96 בארות, הוסף מדיום שחפת, העביר את תרביות החיידקים המדוללות השונות משלב 3.3.2., במשולש, לצלחת, והניח אותה על שולחן עבודה נקי במיוחד.
- אטום את צלחת 96 הבארות עם סרט איטום, הכנס אותה לקורא המיקרו-פלטות והגדר את התוכנית באופן הבא:
- הגדר את הטמפרטורה ל-37 מעלות צלזיוס ±-0.5.
- הגדר את הלולאה הקינטית לסך של 60 מחזורים, כל אחד למשך 30 דקות.
- הגדר את הספיגה ל-600 ננומטר.
- הגדר את הרעידות ל-1,600 שניות במחזור.
- הפעל את התוכנית ועצור אותה כאשר עקומת הצמיחה מתייצבת.
- הכינו את תרבית החיידקים הראשונית עם ערך OD מתאים (ראה שלב 2.2.), ותרבו את החיידקים עד שהם מגיעים לשלב הגידול הלוגריתמי.
- קביעת עקומת גדילה בתנאים אנאירוביים
- בצע את שלב 3.3. אך שמור את צלחת 96 הבארות עם מדיום השחפת ומתלי החיידקים בחממה אנאירובית לפני איטום הצלחת בסרט איטום. שאבו ומלאו את הקופסה האנאירובית בחנקן כדי להפחית את ריכוז החמצן ל-<3%. אטום את צלחת 96 הבארות עם סרט איטום והשאיר אותה בקופסה האנאירובית.
4. בדיקת יכולת היווצרות ביופילם
- תרבית החיידקים לשלב גידול לוגריתמי במדיום נוזלי.
- עיין בסעיף 2 כדי לחסן את החיידקים במדיום הנוזלי של השחפת.
- טפחו את החיידקים למשך הלילה בשייקר בטמפרטורה של 37 מעלות צלזיוס, וודא שה-OD600 של מדיום תרבית החיידקים הוא בין 0.6 ל-0.8.
- מחלקים את תרבית החיידקים ומטפחים בתנאים שונים.
- כאשר ה-OD600 של תרבית החיידקים הוא בין 0.6 ל-0.8, הוסף 10 מ"ל של תרחיף חיידקי זה למבחנה מזכוכית.
- חלקו כל תרבית חיידקים לשתי קבוצות: תנאים אירוביים ואנאירוביים, ובצעו את כל הפעולות בשלוש פעמים.
- עבור הקבוצה האירובית, עטפו את המבחנה המכילה את תרחיף החיידקים בנייר כסף ודגרו אותה באמבט מים של 37 מעלות צלזיוס בטמפרטורה קבועה.
- עבור הקבוצה האנאירובית, עטפו את הצינור המכיל את תרחיף החיידקים בנייר כסף והעבירו אותו לחממה אנאירובית. הסר את נייר הכסף בחממה האנאירובית והפחית את ריכוז החמצן בחממה ל-<3% על ידי שאיבה ומילויו בחנקן. סגור את המבחנה עם פקק זכוכית חלבית, הוצא אותה לאחר האיטום ודגר אותה באמבט מים בטמפרטורה של 37 מעלות צלזיוס.
- כל 6 שעות, קח שלוש מבחנות מכל אחת משתי הקבוצות (אירובי/אנאירובי) כדי לצפות בצמיחת הביופילם בתחתית, והכתים לאחר שלב 4.3.
- השליכו את תרחיף החיידקים וייבשו את הביופילם.
- הוצא את המבחנות בנקודות זמן שונות ושאף בזהירות את השכבה העליונה של תרחיף החיידקים. שימו לב לביופילם הלבן שנדבק לתחתית המבחנה.
הערה: הקפד לא להפריע לביופילם בעת שאיבת תרחיף החיידקים. - הוסף בזהירות 2 מ"ל של מי מלח עם חוצץ פוספט (PBS) לאורך דופן המבחנה, נער אותה בעדינות כדי לשטוף את החיידקים הפלנקטוניים הנספגים בביופילם, ושאף בזהירות את מאגר ה-PBS.
- הכניסו את המבחנה עם הביופילם הנספג בתחתית לתנור לייבוש למשך 30 דקות.
- הוצא את המבחנות בנקודות זמן שונות ושאף בזהירות את השכבה העליונה של תרחיף החיידקים. שימו לב לביופילם הלבן שנדבק לתחתית המבחנה.
- מכתים
- הוציאו את המבחנות, הוסיפו 2 מ"ל של תמיסת צביעה סגולה קריסטלית 0.1% לכל מבחנה, וצבעו את הביופילמים למשך 30 דקות בטמפרטורת החדר.
- השתמש בפיפטה כדי לשאוב בזהירות את תמיסת הצבע הסגול הקריסטלי. הוסף בזהירות מים מזוקקים לאורך דופן המבחנה כדי לשטוף את תמיסת הצבע הסגול הקריסטלי שנותרה, וחזור על הפעולה פי 3x-5x עד שהמים המזוקקים שנוספו הפכו כמעט חסרי צבע. התבונן בביופילם הסגול בתחתית המבחנה.
- יבש שוב את המבחנה.
- ממיסים את הביופילם עם 95% אתנול ומודדים את ה-OD600 של תמיסת הביופילם.
- הוציאו את המבחנה המיובשת, הוסיפו 10 מ"ל של 95% אתנול לכל מבחנה, ונערו היטב כדי לוודא שהסגול הקריסטלי מומס לחלוטין באתנול.
- בנפח של 200 מיקרוליטר לבאר, הוסף סגול קריסטל באתנול לצלחת של 96 בארות, ומדוד את ספיגתו באורך גל של 600 ננומטר.
הערה: על פי חוק באר-למברט, הספיגה קשורה באופן ליניארי לריכוז התמיסה, כך שהערך של OD600 יכול לשקף את ריכוז הסגול הגביש, המשקף את כמות הביופילם בתרחיף החיידקים בזמנים שונים.
5. בדיקת כימוטקסיס חיידקי
- הכן צלחות אגר אוטרופיות דיפרנציאליות.
- עיין בשלב 1 להכנת מדיום MH בחצי מנה המכיל 0.5% אגר, שכל ליטר ממנו מכיל 11.8 גרם טריפטון, 23.6 גרם תמצית שמרים, 9.4 גרם K2HPO4, 2.2 גרם KH2PO4 ו-5 גרם אגר, pH ~7.
- עיין בשלב 1 להכנת מדיום 5x TB המכיל 0.5% אגר, שכל ליטר ממנו מכיל 59 גרם טריפטון, 118 גרם תמצית שמרים, 47 גרם K2HPO4, 11 גרם KH2PO4 ו-5 גרם אגר, pH ~7.
- חיטוי התמיסה ב-121 מעלות צלזיוס למשך 20 דקות באמצעות מכסה חדיר אוויר או סרט איטום בקבוקים עם פתח אוורור.
- לפני שהנוזל מתקרר ומתמצק, יוצקים 25 מ"ל מרק MH בחצי מנה (המכיל 0.5% אגר) לצלחת, מכסים את הצלחת במכסה מודפס בתלת מימד ומניחים אותה בארון בטיחות ביולוגי. לאחר הקירור, הסר את הכיסוי כדי להתבונן בבאר הגלילית (קוטר 1.4 ס"מ) במדיום המוצק למחצה.
הערה: לא ניתן לעקר את המכסה המודפס בתלת מימד עם חומר שרף באמצעות קיטור בטמפרטורה גבוהה. כדי להרוג את חיידקי פני השטח, ניתן לרסס אותו באתנול 95% ולאחר מכן להקרין אותו במנורת UV למשך 30 דקות בארון בטיחות ביולוגי. בעת הסרת המכסה, הפעל כוח בכיוון האנכי והרם אותו בזהירות כדי למנוע נזק לאגר המוצק למחצה. - לפני שמרק 5x TB (המכיל 0.5% אגר) מתמצק, השתמש בפיפטה כדי להוסיף את מרק 5x TB לבאר בצלחת חצי מוצקה עד שהמרק סומק עם פני המדיום.
- מצננים את הצלחת בארון בטיחות ביולוגי כדי לקבל צלחת אגר חצי מוצקה המכילה גופים אוטרופיים. הקפד להימנע מזיהום צלחת על ידי מיקרואורגניזמים סביבתיים.
הערה: המדיום המוצק למחצה עדיין נוזלי במקצת, ולכן יש לקרר אותו במלואו לפני שהוא מאוחסן הפוך.
- חיסון, טיפוח וצילום חיידקים
- הנח את צלחת האגר עם מדיום התרבות המוצק למחצה בארון בטיחות ביולוגי וקרר אותה למשך ~30 דקות תחת קרינת UV כדי למנוע זיהום חיידקי.
- השתמש בפיפטה של 10 מיקרוליטר כדי לתפוס 4 מיקרוליטר מהתרחיף החיידקי שתורבת ל-OD של ~0.6-0.8, הכנס את קצה הפיפטה למרכז צלחות הפטרי מפלסטיק והוציא את תרחיף החיידקים.
- המתן עד שתרחיף החיידקים ייספג במדיום למשך דקה. כאשר התרחיף החיידקי נספג במלואו, חלקו את הצלחת לשתי קבוצות (אירובית/אנאירובית) בשלוש עותקים.
- אטמו את הקבוצה האירובית עם סרט איטום והניחו את הלוחות הללו הפוכים באינקובטור ביוכימי של 37 מעלות צלזיוס לתרבית סטטית. אטמו את הקבוצה האנאירובית בקופסה אנאירובית כמתואר בשלב 4.2, והפכו את הלוחות ב-37 מעלות צלזיוס לצמיחה.
- בדקו את ההתפשטות והנדידה של חיידקים כל 12 שעות (ב-0 שעות, 12 שעות, 24 שעות, 36 שעות ו-48 שעות), והשתמשו במערכת ההדמיה כדי לצלם תמונות של הצלחת.
- השתמש בתוכנת ImageJ כדי לחשב מרחקי נדידת חיידקים.
- ייבא את קובץ התמונה שנרכש באמצעות מערכת ההדמיה.
- הגדר את סרגל קנה המידה והחל אותו על כל התמונות.
- בעת צילום תמונות, הוסף סרגל, צור קטע קו, בחר קטע קו ישר (למשל, 1 ס"מ, ולאחר מכן הגדר את אורך קטע הקו הזה ל-1 ס"מ), וסמן את אורך הלוח.
- פתיחת החלון הגדרת קנה מידה ; לחץ על נתח | הגדר קנה מידה.
- הקלד את האורך בפועל תחת מרחק ידוע ויחידת אורך.
- בדוק גלובלי.
- הזן את כתובת התיקיה של התמונה המקורית ואת כתובת קובץ הפלט.
- השתמש בכלי הקו הישר כדי לבחור את הקהילות בזו אחר זו ולהתאים את הסובלנות עד שקו הכלים הישר יתאים לגבול מושבת החיידקים המשתרעת לשני הצדדים.
- מדוד את מרחק הנדידה של המושבה מהמרכז לשני הקצוות בנפרד וגזור את אורך הקו הישר על ידי לחיצה על ניתוח | למדוד.
- חזור על שלבים 5.3.3-5.3.4 עד שכל הקהילות יימדדו ושמור את התוצאות בקובץ .csv להמשך ניתוח.
תוצאות
עבודה זו מתארת את הגישות שננקטו כדי לאפיין את המיקרובים המבודדים מהמיקרוביום המארח (איור 1). כהוכחת רעיון, שלושה חיידקים בודדו ממארח החולדה SD (C. stationis, S. cohnii ו-E. faecalis), ושני מיקרואורגניזמים שנרכשו באופן מסחרי (S. aureus ATCC 25923 ו-E. faecalis V583) נבדקו באמצעות פרוטוקול זה. כדי לקבוע את דרישות החמצן של חיידקים בודדים באמצעות FTM, הוספנו שני אורגניזמי בקרה, אנאירוב מחייב (Fusobacterium nucleatum ATCC 25586) ואנאירוב פקולטטיבי (Pseudomonas aeruginosa PAO1). התוצאות הראו כי חמשת המיקרובים שנבדקו היו אנאירובים פקולטטיביים (איור 2A), בהתאם לפרופילים שדווחו בעבר של מיקרובים אלה11. כדי להבהיר את דרישות החמצן שלהם, החיידקים גודלו בתנאים אירוביים ואנאירוביים כאחד. כל החיידקים שנבדקו הראו עקומת גדילה סיגמואידית בתנאים אירוביים ואנאירוביים כאחד; אולם צפיפות המיקרואורגניזמים, כפי שמצוין על ידי OD600nm, הראתה שלכל חמשת המיקרובים יש העדפה גבוהה יותר לסביבות עשירות בחמצן (איור 2B,C). תצפיות אלה עולות בקנה אחד עם היכולות המיקרוביאליות לחדור ולהדביק את עצמות החולדות, הנחשבות בדרך כלל היפוקסיות.
נמצא כי חמשת החיידקים המבודדים יוצרים באופן טבעי ביופילמים, כאשר מסת הביופילם המיוצרת הייתה גבוהה יותר בתנאים אנאירוביים. באמצעות השוואת עקומת הגדילה, נמצא כי הביופילמים של E. faecalis, ו-S. aureus ATCC 25923 נוצרו באופן פעיל במהלך שלב הגדילה הנייח הן בסביבות אירוביות והן בסביבות אנאירוביות (איור 3). תצפית זו מצביעה על כך שהיווצרות ביופילם תלויה במצב הצמיחה של התאים, אולי מווסת על ידי מולקולות איתות תוך-תאיות המעוררות את היווצרות הביופילם11. תלות זו של היווצרות ביופילם בתנאי הגידול עולה בקנה אחד עם תנאי התזונה והצמיחה שמציגה סביבת מטריצת העצם המארחת שחסרה חמצן וחומרים מזינים.
מחקרים על פתוגנזה של חיידקים קשורים לעתים קרובות ליכולתו של המיקרוב לנדוד לאתרים הנחשבים תורמים לגדילה. ישנם מחקרים רבים על כימוטקסיס מיקרוביאלית, אך אין גישה סטנדרטית אחת לחקור אותה. בנוסף, השימוש בכימיקלים שאינם ניתנים לפיזור נחשב לגורם מגביל בחקר תופעה זו. כאן, פיתחנו כיסוי שרף המיוצר באמצעות הדפסת תלת מימד המתקנן את המרחק בין המאגר הכימי לנקודת החיסון (איור משלים S1 ואיור משלים S2). חקרנו את הנדידה של המיקרובים לסביבה עשירה בחומרי מזון, שבה פי 5 שחפת שימשה כממריץ כימי. המיקרובים נוטרו במשך 48 שעות בתנאים אירוביים ואנאירוביים, שבהם כל חמשת המיקרובים הראו דרגות שונות של נדידת טרופיזם (איור 4A).
ImageJ שימש למדידת מרחק הנדידה של חיידקים (איור 4B); הנדידה לכיוון המאגר נראתה מהירה יותר מהנדידה בכיוון ההפוך. היחס בין מרחק הנדידה לכיוון המאגר לזה שבכיוון ההפוך מראה את ההתרחבות המהירה של מושבת המיקרואורגניזמים כתוצאה מכימוטקסיס מיקרוביאלי (איור 5B). במחקר זה, חיידקים כמו S. aureus ATCC 25923 נדדו מהר יותר ממיקרובים אחרים כמו C. stationis. מעניין לציין שפרופיל הנדידה של תרביות כימוטקטיות בתנאים אירוביים ואנאירוביים הראה כי חיידקים מסוימים, כגון E. faecalis, הראו שונות בדפוסי הנדידה בתנאים אירוביים ואנאירוביים, שבהם נצפתה התפשטות מהירה בתנאים אנאירוביים לאורך זמן. באופן מבלבל, זן המעבדה E. faecalis V583 העדיף סביבה אירובית לכימוטקסיס. לפיכך, זה מצביע על כך של-E. faecalis המבודד ממקורות שונים יש דרישות גידול שונות המותאמות לסביבת הגידול.

איור 1: תרשים סכמטי של תהליך הפעולה. (A) חיידקים מחוסנים על צלחות ואז למדיום נוזלי, וגדלים לשלב הגדילה הלוגריתמי. (B) קביעת היכולת של חיידקים ליצור ביופילמים בתנאים שונים (אירובי/אנאירובי). שלוש דגימות נבחרו עבור כל נקודת זמן (6 שעות) וחזרו על עצמן במקביל. (C) הפרוטוקול לניסוי הטרופיזם הכימי של חיידקים בתנאים שונים (אירובי/אנאירובי). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: תנאי גידול מיקרוביאליים. (A) פרופיל הגדילה של חיידקים שגודלו במדיום תיוגליקולט נוזלי (משמאל לימין הם I: Fusobacterium nucleatum ATCC 25586, II: Corynebacterium stationis, III: Staphylacoccus cohnii, IV: Enterococcus faecalis, V: Staphylacoccus aureus ATCC 25923, VI: Enterococcus faecalis V583, ו-VII: Pseudomonas aeruginosa PAO1). (B) עקומת גדילה של מיקרואורגניזמים שבודדו מהמארח בתנאים אירוביים. (C) עקומת גדילה של מיקרואורגניזמים שבודדו מהמארח בתנאים אנאירוביים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
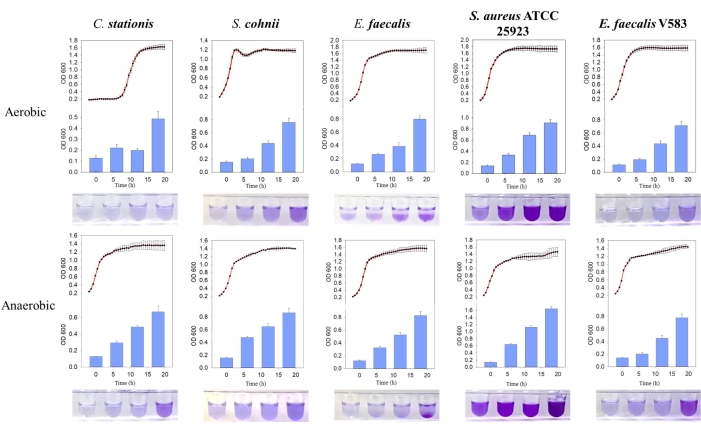
איור 3: השוואה בין עקומות גדילה והיווצרות ביופילם של חיידקים שונים בתנאים שונים. משמאל לימין נמצאים Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ו-Enterococcus faecalis V583. העקומה האדומה היא עקומת הצמיחה, וההיסטוגרמה הכחולה היא כמות הביופילם המיוצרת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
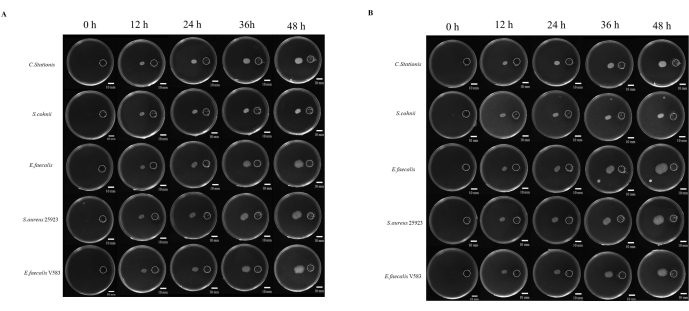
איור 4: גדילה מיקרוביאלית לקראת אטרופיקציה. (A) תנאים אירוביים, (B) תנאים אנאירוביים. חמישה סוגים של חיידקים (מלמעלה למטה הם Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ו-Enterococcus faecalis V583) נוטים לגדול לקראת אטרופיקציה על צלחת התזונה הדיפרנציאלית. פסי קנה מידה = 10 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: כימוטקסיס של מיקרובים בתנאים שונים (אירובי/אנאירובי). (A) התוצאות של נדידת טרופיזם כימי של חמישה חיידקים על צלחת שמכילה אגר עשיר בחומרי מזון; הקבוצה השמאלית מייצגת תנאים אירוביים והקבוצה הימנית תנאים אנאירוביים. כל ניסוי חזר על עצמו בשלוש פעמים במקביל. (B) ניתוח נתונים של טרופיזם כימי. החלק העליון מייצג תנאים אירוביים והחלק התחתון תנאים אנאירוביים. משמאל לימין נמצאים Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 ו-Enterococcus faecalis V583. העמודות האדומות והכחולות הן מרחקי הנדידה מגוף המזון של חיידקים הנודדים לכיוון גוף המזון והרחק ממנו. הקו הוא ההפרש בין שני הערכים (אדום - כחול). פסי קנה מידה = 10 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים S1: שימוש במכסים מודפסים בתלת מימד ליצירת לוחות אגר הבדלי חומרים מזינים. (א) השתמש בתוכנה להכנת עיבודי תבניות להדפסת תלת מימד. (ב) תבנית כריכה שטוחה מודפסת עם 8,000 שרף. (ג) השתמש בשיטה לעיל כדי לקבל את לוחות אגר הפרשי החומרים המזינים. (ד) ייצור לוחות אגר הפרשי הנוטריינטים. אנא לחץ כאן להורדת קובץ זה.
איור משלים S2: בניית לוחות אגר הפרשי חומרים מזינים ומדידת מרחק נדידת חיידקים באמצעות ImageJ. (A) הבנייה של לוחות אגר הפרשי חומרים מזינים משתמשת במכסה מודפס בתלת-ממד (המכיל בליטה גלילית) כדי לכסות את הצלחת. לאחר קירור האגר נוצרת באר גלילית (העיגול האדום), שממולאת באגר 5x TB. לאחר מכן זה מקורר כדי לקבל צלחות אגר הפרש תזונתי. (B) השתמשו ב-ImageJ כדי למדוד את מרחק הנדידה של חיידקים בכיוונים שונים. הגדרת סרגל קנה מידה (ניתוח | הגדר קנה מידה) וייצא את מרחק ההעברה באמצעות ישר (ניתוח | למדוד). אנא לחץ כאן להורדת קובץ זה.
איור משלים S3: דפוסי גדילה של חמישה חיידקים על אגר בינוני בינוני M9 בינוני פי 5. הקבוצה השמאלית מיועדת לתנאים אירוביים, והקבוצה הימנית מיועדת לתנאים אנאירוביים. אנא לחץ כאן להורדת קובץ זה.
איור משלים S4: ניסויי בקרה על עקומות גדילה של Fusobacterium nucleatum ATCC 25586 וכימוטקסיס של חיידקים אנאירוביים. (A) קביעת עקומות גדילה של F. nucleatum ATCC 25586 בתנאים אירוביים ואנאירוביים. (B) ניסויים כימוטקסיסיים של F. nucleatum ATCC 25586 על צלחות אגר MH-5x TB בחצי מינון בתנאי חמצן שונים. הגדלה חלקית: גידול של F. nucleatum ATCC 25586 על הצלחת בתנאים אנאירוביים לאחר 48 שעות (הגדלה חלקית). אנא לחץ כאן להורדת קובץ זה.
| תרכובת | ריכוז (גרם/ליטר) |
| עד2HPO4 | 6.78 |
| ק"ח2פ"ד4 | 3 |
| NaCl | 0.5 |
| NH4Cl | 1 |
| MgSO4.7 שעות2O | 0.493 |
| CaCl2 | 0.011 |
| גלוקוז | 4 |
טבלה 1: רכיבים ותכולה של מדיה מינימלית M9.
Discussion
בודדנו וזיהינו חמישה מינים של חיידקים בשיטות עוקבות. לגידול חיידקים יש דרישות תזונה מינימליות: המדיום המינימלי - מדיום המכיל רק מלחים אנאורגניים, מקור פחמן ומים. למרות שהחיידקים בקבוצת הניסוי נמצאו על צלחות מוצקות MH, השתמשנו במדיום MH בחצי מינון כדי לאמת את הכימוטקסיס של החיידקים והשגנו תוצאות טובות. אולם ביצענו גם ניסויי ביקורת באמצעות מדיום מינימלי. מדיום בסיסי M9 שימש בניסוי (ראה טבלה 1 להרכבו ותוכנו), ואגר 5x TB עדיין שימש עבור בלוק אגר התזונה. תוצאות הניסוי מוצגות באיור משלים S3. למרות שהחיידקים האלה (מלבד E. faecalis) גדלים לאט ונעים לאט בתווך M9, יש מגמה דומה בדרך כלל (לכיוון גדילה על אגר מזין), כפי שנצפה בניסויים אלה. עם זאת, E. faecalis V583 לא גדל על תווך מינימלי M9, אולי בשל מחסור ברכיבים הדרושים ל-E. faecalis כדי לגדול בתווך M9. לכן, אנו ממליצים להשתמש במדיום MH בחצי מנה כמצע חסר חומרים מזינים כדי לדמות צמיחה ונדידה של חיידקים בתנאים של מחסור בחומרים מזינים. זה גם מקל על השימוש בתוכנת ImageJ כדי למדוד את המרחק שבו חיידקים נוטים לנדוד.
ביופילמים מוגדרים בדרך כלל כקהילות מיקרוביאליות הקשורות לפני השטח ומהווים אסטרטגיית הישרדות מיקרוביאלית חשובה. אורגניזמים כמו Pseudomonas aeruginosa, Haemophilus influenzae, Streptococcus pneumoniae ו-Staphylococcus aureus יכולים להימצא במארחים אסימפטומטיים, וגילוי מיקרואורגניזמים דבקים in vivo מכונה לעתים קרובות קולוניזציה, לא זיהום. בעיה חשובה מאוד היא היעדר מודל אידיאלי להתיישבות בעלי חיים12. חיידקים מדגימים היצמדות ראשוניות למשטחים טעונים לפני היווצרות ביופילם, כאשר חומרים כגון זכוכית ופוליוויניל כלוריד (PVC) נחשבים מתאימים למחקרים הקשורים לביופילם. מחקרים המשתמשים בלוחות PVC 96 בארות שימשו לחקר הביופילמים המיקרוביאליים9, שבהם ביופילמים חד-מינים או מרובי מינים עשויים לגרום לביופילם ארוז באופן רופף או צפוף10. ככזה, השימוש בצלחת PVC 96 בארות נחשב לא מתאים לביופילם ארוז באופן רופף מכיוון שניתן לשטוף בקלות את מטריצת הביופילם במהלך תהליך צביעת הביופילם. לכן, הסתמכנו על מבחנות זכוכית כדי לחקור היווצרות ביופילם מיקרוביאלי (איור 3).
מגבלה מרכזית של שיטה זו היא שהיא אינה עובדת עם מיקרואורגניזמים הגדלים בתנאים מסוימים, ולא כל החיידקים יכולים לנדוד. יתר על כן, אף על פי שביופילמים הם אמצעי יעיל לסייע למיקרואורגניזמים להתגונן מפני סביבות חיצוניות שליליות, לא כל המיקרואורגניזמים המארחים מסוגלים לייצר ביופילמים. לדוגמה, F. nucleatum ATCC 25586, שהוזכר קודם לכן, הקשור לסימביוזה של הפה או המעי האנושי הקשורה להתפתחות סרטן המעיהגס 17, גדל במיוחד בסביבות אנאירוביות אך אינו מייצר ביופילמים. השתמשנו בו בניסויי FTM כדי לאמת את היעילות של מדיום ה-FT. מדיום ה-FT הוכח כיעיל באספקת חיידקים עם ריכוזי חמצן בשיפוע.
לשם השוואה, בדקנו את עקומת הגדילה ואת הטרופיזם הכימי של החיידק האנאירובי F. nucleatum ATCC 25586 (איור משלים S4). בניסויי עקומת הגדילה (איור משלים S4A), F. nucleatum ATCC 25586 לא יכול היה לגדול בתנאים אירוביים והראה הצטברות חיידקים בתחתית הבארות בתנאים אנאירוביים. גם בניסויי הכימוטקסיס (איור משלים S4B), F. nucleatum ATCC 25586 לא גדל בתנאים אירוביים, ומספר נמוך של חיידקים נמצא לאחר חיסון באתרו בתנאים אנאירוביים במשך 48 שעות. באופן דומה, מכיוון שחלק מהחיידקים אינם יכולים לחפש באופן פעיל תנאי גידול מתאימים על ידי נדידה, הם ממתינים לתנאי גידול מתאימים על ידי כניסה למצב רדום ארוך טווח18. יש לציין כי גידול חיידקים אנאירוביים קפדניים דורש מדיום מיוחד, כגון מדיום תסיסה ET (יש להשלים צלחות חצי מוצקות עם 0.5% אגר), השונה גם מבידוד וזיהוי קונבנציונליים. שיטה מוצעת זו היא שיטה כללית הניתנת לאפיון רוב המיקרואורגניזמים המארחים, כאשר הטכניקה מודגמת עבור חמישה חיידקים, כולל שלושה חיידקים שבודדו מעצמות עכברים ושני חיידקים בדרגת מעבדה. פרוטוקול זה יסייע בזיהוי נכון של מיקרוביוטה מבודדת במחקרים עתידיים.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
פיתוח טכניקה זו נתמך על ידי כספים מהקרן הלאומית למדעי הטבע של קרן המחקר של סין למדענים צעירים בינלאומיים (22050410270), הקרן המיוחדת של שנזן לחדשנות ויזמות של צוות טווס כישרונות ברמה גבוהה בחו"ל (KQTD20170810111314625), ותוכנית צוות המחקר החדשני והיזמי של גואנגדונג (2019ZT08Y191). ברצוננו להביע את תודתנו הכנה לגברת צ'ן שיניי על עזרתה בהגהה של המסמך ובניהול המעבדה.
Materials
| Name | Company | Catalog Number | Comments |
| Chemical/Solution | |||
| 1% crystal violet dye solution | Solarbio | G1062 | 100 mL |
| Agar | Sigma-Aldrich | V900500 | Used to obtain semi-solid plates, 20 g |
| Centrifuge tube | Corning | 430790 | 15 mL |
| Fluid thioglycollate medium | Kinghunt | K0001 | 29.3 g |
| Mueller Hinton II Broth medium | Solarbio | NO.11865 | 100 g |
| Petri dishes | Bkman | B-SLPYM90-15 | Plastic Petri dishes, circular, 90 mm x 15 mm |
| Potassium Chloride | VETEC | WXBC4493V | 0.2 g |
| Potassium Dihydrogen Phosphate | aladdin | 04-11-7758 | 0.24 g |
| Sodium chloride | Macklin | S805275 | 8.0 g |
| Sodium phosphate dibasic | aladdin | 7558-79-4 | 1.44 g |
| Terrific Broth medium | Solarbio | LA2520 | 200 g |
| Kits/ Equipment | |||
| Anaerobic incubator | Longyue | ||
| Biochemical incubator | Blue pard | LRH-70 | |
| Microplate reader | Spark | ||
| Tanon 5200multi imaging system | Tanon | 5200CE | |
| Thermostatic water bath | Jinghong | DK-S28 |
References
- Bernardi, S., et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients' tongue biofilm. MicrobiologyOpen. 9 (2), 958 (2020).
- Tellez, G., Latorre, J. D., Kuttappan, V. A., et al. Rye affects bacterial translocation, intestinal viscosity, microbiota composition and bone mineralization in Turkey poults. PLOS One. 10, (2015).
- Brewer, J. H. Clear liquid mediums for the "aerobic" cultivation of anaerobes. Journal of the American Medical Association. 115 (8), 598 (1940).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Liu, C., et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review. Frontiers in Microbiology. 11, 802 (2020).
- Kumar, A., et al. Biofilms: survival and defense strategy for pathogens. International Journal of Medical Microbiology. , (2017).
- Penesyan, A., et al. Secondary effects of antibiotics on microbial biofilms. Frontiers in Microbiology. 11, 2109 (2020).
- Bernardi, S., et al. Subinhibitory antibiotic concentrations enhance biofilm formation of clinical Enterococcus faecalis isolates. Antibiotics. 10 (7), 874 (2021).
- Tsukatani, T., Fumihiko, S., Rieko, K. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids. World Journal of Microbiology and Biotechnology. 36 (12), 1-9 (2020).
- Hartmann, R., et al. Emergence of three-dimensional order and structure in growing biofilms. Nature Physics. 15, 251-256 (2019).
- Liu, Z., et al. Advances in bacterial biofilm management for maintaining microbiome homeostasis. Biotechnology Journal. 15 (10), 1900320 (2020).
- Hall-Stoodley, L., Stoodley, P. Evolving concepts in biofilm infections. Cellular Microbiology. 11 (7), 1034-1043 (2009).
- Røder, H. L., et al. Enhanced bacterial mutualism through an evolved biofilm phenotype. The ISME Journal. 12 (11), 2608-2618 (2018).
- Matilla, M. A., Tino, K. The effect of bacterial chemotaxis on host infection and pathogenicity. FEMS Microbiology Reviews. 42 (1), 052 (2018).
- Moreira, L. M., et al. Chemotactic signal transduction and phosphate metabolism as adaptive strategies during citrus canker induction by Xanthomonas citri. Functional & Integrative Genomics. 15 (2), 197-210 (2015).
- Konishi, H., et al. Bacterial chemotaxis towards polysaccharide pectin by pectin-binding protein. Scientific Reports. 10 (1), 1-12 (2020).
- Kostic, A. D., et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host & Microbe. 14 (2), 207-215 (2013).
- Kochan, T. J., et al. Updates to Clostridium difficile spore germination. Journal of Bacteriology. 200 (16), 00218 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved