Method Article
Medindo a migração e a formação de biofilme de várias bactérias
Neste Artigo
Resumo
Aqui, apresentamos um método prático para o isolamento e identificação de microrganismos dentro do hospedeiro. Desta forma, as propriedades físico-químicas dos microrganismos e possíveis formas de viver no hospedeiro são claramente descritas.
Resumo
Como os micróbios que prosperam no corpo hospedeiro têm principalmente habilidades adaptativas que facilitam sua sobrevivência, métodos para classificar e identificar sua natureza seriam benéficos para facilitar sua caracterização. Atualmente, a maioria dos estudos se concentra apenas em um método de caracterização específico; No entanto, o isolamento e identificação de microrganismos do hospedeiro é um processo contínuo e geralmente requer vários métodos de caracterização combinatória. Aqui, descrevemos métodos para identificar a capacidade de formação de biofilme microbiano, o estado de respiração microbiana e seu comportamento de quimiotaxia. Os métodos são usados para identificar cinco micróbios, três dos quais foram isolados do tecido ósseo de ratos Sprague-Dawley (SD) (Corynebacterium stationis, Staphylococcus cohnii subsp. urealyticus e Enterococcus faecalis) e dois da American Type Culture Collection (ATCC)-Staphylococcus aureus ATCC 25923 e Enterococcus faecalis V583. Os micróbios isolados do tecido ósseo do rato SD incluem os micróbios gram-positivos. Esses micróbios se adaptaram para prosperar em ambientes estressantes e limitantes de nutrientes dentro da matriz óssea. Este artigo tem como objetivo fornecer aos leitores o know-how específico para determinar a natureza e o comportamento dos micróbios isolados em um ambiente de laboratório.
Introdução
O hospedeiro mamífero representado pelo corpo humano contém um grande número de microrganismos. Esses microrganismos são amplamente distribuídos na boca, trato digestivo, intestino e sangue do hospedeiro e têm diferentes efeitos na saúde do hospedeiro. A cavidade oral hospeda uma infinidade de micróbios que podem modular a suscetibilidade do hospedeiro a infecções. Micróbios como Streptococcus (por exemplo, S. mitis/oralis, S. pseudopneumoniae e S. infantis) e Prevotella spp. colonizam a cavidade oral, formando um biofilme multiespécie na superfície da língua, causando mau hálito e funcionando como um reservatório microbiano para infecção microbiana. Esses patógenos podem infectar o maxilar infiltrando-se nos ligamentos periodontais que sustentam a raiz do dente no maxilar1. A caracterização desses micróbios isolados do corpo hospedeiro costuma ser um processo tedioso, principalmente quando os micróbios exibem características individuais que requerem tratamento específico e condições de crescimento. Micróbios, como os patogênicos Helicobacter pylori, Clostridium difficile e Fusobacterium nucleatum, prosperam no ambiente hostil do intestino, com requisitos específicos de oxigênio, nutrientes e crescimento, apresentando um desafio nos processos de caracterização, particularmente na investigação da patogenicidade desses micróbios. Portanto, um método padronizado de isolamento e investigação desses microrganismos é necessário para que cientistas e médicos desenvolvam novos tratamentos médicos.
Este protocolo usa micróbios que prosperam na matriz óssea de ratos. Tradicionalmente, com exceção do sistema ósseo representado pela mandíbula, onde a presença de dentes torna a matriz óssea mais suscetível à infecção do que outros ossos1, geralmente acredita-se que o osso saudável do hospedeiro seja um ambiente estéril. No entanto, estudos descobriram que os microrganismos entram na circulação sistêmica através da parede intestinal, afetando a mineralização óssea2. Como prova de conceito, usamos o protocolo descrito para caracterizar as propriedades bioquímicas de isolados microbianos do fêmur e tíbia de ratos SD saudáveis (Corynebacterium stationis, Staphylococcus cohnii subsp. e Enterococcus faecalis). Esses isolados microbianos foram selecionados porque o osso é um ambiente fechado e hipóxico, e caracterizar esses micróbios do osso pode ser uma tarefa desafiadora. Vários artigos detalharam os processos usados no estudo desses micróbios; no entanto, são poucos os que fornecem um protocolo completo para identificar microrganismos isolados do hospedeiro.
Ao estabelecer as condições de cultura adequadas, as necessidades de oxigênio do micróbio precisam ser compreendidas por meio do uso de meio de tioglicolato fluido (FTM). Micróbios com diferentes necessidades de oxigênio formam camadas estratificadas no líquido FTM claro3. Com base no perfil de estratificação, a necessidade de oxigênio do micróbio é então usada para investigar o crescimento das células. Os micróbios que prosperam na superfície do líquido FTM são aeróbios obrigatórios, enquanto os micróbios que crescem na parte inferior são anaeróbios obrigatórios. Os micróbios que crescem como uma suspensão no líquido FTM são anaeróbios facultativos ou aerotolerantes. A taxa de crescimento microbiano é estabelecida pela observação da fase de crescimento exponencial das células microbianas. O perfil de crescimento é então comparado à formação de biofilme do micróbio. Os biofilmes são em grande parte compostos por várias espécies que afetam direta e indiretamente a saúde umas das outras. Durante esse processo, as interações benéficas entre as comunidades microbianas selecionam a fixação, fornecendo uma estrutura espacial que favorece a evolução das interações recíprocas ativas. Por exemplo, a co-cultura de Paenibacillus amylolyticus e Xanthomonas retroflexus exibe interações simbióticas facultativas em um ambiente estático, promovendo o rápido crescimento do biofilme13. Os micróbios se adaptam aos tecidos do hospedeiro por meio da formação de biofilme para localização sustentada, protegendo-se contra ambientes hostis e evitando o sistema imunológico do hospedeiro 4,5,6,7. Os biofilmes são geralmente estruturas densas e multicamadas que ajudam os microrganismos a resistir a estímulos subcríticos externos; por exemplo, E. faecalis na polpa dentária aumenta sua resistência a antibióticos, aumentando a formação de biofilme quando confrontado com subconcentrações de tetraciclina e vancomicina8.
A quimiotaxia permite que os microrganismos se movam de acordo com gradientes químicos, e as vias de sinalização são amplamente distribuídas em uma variedade de bactérias patogênicas. Alguns microrganismos patogênicos migram para locais específicos, sob a orientação de sinais químicos, para causar doenças infecciosas14. Por exemplo, Xanthomonas spp. expressam 19 proteínas quimiorreceptoras e 11 proteínas flagelinas no hospedeiro, desencadeando a ligação bacteriana e, por fim, a ulceração15. Existem também proteínas específicas nas bactérias (proteínas de ligação à pectina) que orientam a migração específica das bactérias para os nutrientes, o que pode levar a um melhor crescimento16. Isso também é crítico para bactérias que podem existir em ambientes pobres em nutrientes. As células microbianas geralmente dependem da motilidade quimiotática para se atrair para um ambiente propício ao crescimento, evitando outras células predadoras e toxinas que prejudicam a viabilidade celular. Com base em abordagens de ágar macio previamente estabelecidas para determinar a quimiotaxia, desenvolvemos um método difusível para gerar um gradiente de quimioatraente para testar a quimiotaxia microbiana.
Este artigo descreve os métodos para determinar as condições de crescimento, formação de biofilme e tropismo químico de bactérias, usando Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 e Enterococcus faecalis V583 como exemplos (ver Figura 1). A otimização das condições de crescimento microbiano usa FTM para determinar as necessidades de oxigênio do micróbio, enquanto a formação de biofilme usa superfícies de vidro como suporte sólido e a massa de biofilme é contracorada com cristal violeta. O tropismo químico do micróbio depende de seu comportamento quimiotático, onde através da impressão 3D (Figura Suplementar S1), um método padronizado é usado para gerar um reservatório químico para o quimioatraente em uma matriz de ágar macio (Figura Suplementar S2).
Protocolo
NOTA: Consulte a Tabela de Materiais para obter detalhes sobre todos os materiais e equipamentos usados neste protocolo. Use técnicas assépticas para evitar contaminação.
1. Recuperação bacteriana para obter uma única colônia
- Prepare placas de ágar sólidas.
- Prepare o meio Terrific Broth (TB) contendo ágar, com cada litro de líquido contendo 11,8 g de triptona, 23,6 g de extrato de levedura, 9,4 g de K2HPO4, 2,2 g de KH2PO4 e 15 g de ágar, pH = 7.
- Autoclave a solução a 121 °C durante 20 min utilizando uma cápsula permeável ao ar ou uma película de vedação do frasco com um respiradouro de ventilação.
- Antes que o líquido esfrie e solidifique, despeje o caldo TB contendo ágar em placas de Petri plásticas de 10 cm a um volume de 25 mL por placa.
NOTA: O caldo deve ser despejado no prato antes de solidificar em temperaturas inferiores a 60 °C. Use técnicas assépticas para evitar contaminação.
- Inoculação bacteriana na placa
- Retire as cepas alvo armazenadas a -80 °C e descongele-as à temperatura ambiente em uma cabine de segurança biológica.
- Use uma pipeta de 10 μL para absorver 10 μL de suspensão bacteriana e espalhe-a na placa de TB por estrias.
- Sele a placa para evitar contaminação. Colocar a placa numa incubadora bioquímica a 37 °C. Verifique o crescimento da colônia visualmente após ~ 24 h. Escolha colônias únicas e amplifique-as por PCR para confirmar que contêm apenas um tipo de bactéria.
2. Cultura líquida bacteriana até a fase de crescimento logarítmico
- Prepare o meio de cultura líquido.
- Consulte a preparação de placas de ágar sólido na Etapa 1.1.1. para preparar o meio líquido TB, 1 L do qual contém 11,8 g de triptona, 23,6 g de extrato de levedura, 9,4 g de K2HPO4 e 2,2 g de KH2PO4, pH ~ 7.
NOTA: Não adicione ágar. As bactérias crescem mais rápido em um ambiente de nutrientes líquidos. - Autoclave a solução a 121 °C durante 20 min utilizando uma cápsula permeável ao ar ou uma película de vedação do frasco com um respiradouro de ventilação.
- Armazenar o meio de cultura líquido a 4 °C.
- Consulte a preparação de placas de ágar sólido na Etapa 1.1.1. para preparar o meio líquido TB, 1 L do qual contém 11,8 g de triptona, 23,6 g de extrato de levedura, 9,4 g de K2HPO4 e 2,2 g de KH2PO4, pH ~ 7.
- Inoculação e cultivo bacteriano
- Na cabine de segurança biológica, pegar uma única colônia com uma alça de inoculação ou uma pipeta de 10 μL e inocular as bactérias no meio líquido de TB preparado em um Erlenmeyer.
- Fechar o erlenmeyer com gaze e colocá-lo num agitador (200 rpm) a 37 °C para cultivar as bactérias.
NOTA: O meio líquido torna-se gradualmente turvo ao longo de 5 h; O tempo necessário para se tornar turvo varia de acordo com as diferentes bactérias.
3. Experimento FTM e determinação da curva de crescimento
- Preparação de meio de tioglicolato fluido (FTM)
- Prepare o meio de tiolglicolato (TM), cada litro contendo 15 g de triptona, 5 g de extrato de levedura, 5 g de glicose, 0,5 g de L-cisteína, 0,5 g de tioglicolato de sódio, 2,5 g de cloreto de sódio, 0,001 g de resazurina e 0,75 g de ágar.
NOTA: O meio sólido disponível comercialmente pode ser facilmente reconstituído com água e esterilizado (Etapa 3.1.2.). - Pesar 29,3 g de meio sólido de tioglicolato, adicionar 1 L de água destilada, aquecer e mexer até dissolver completamente e até que a solução fique rosa.
- Adicione TM (19 mL) a um tubo de ensaio com um tampão de vedação. Após a selagem, autoclave a solução a 121 °C durante 20 minutos utilizando uma cápsula permeável ao ar ou uma película de vedação de frascos com uma saída de ar.
NOTA: Após o aquecimento, a solução torna-se amarelo claro.
- Prepare o meio de tiolglicolato (TM), cada litro contendo 15 g de triptona, 5 g de extrato de levedura, 5 g de glicose, 0,5 g de L-cisteína, 0,5 g de tioglicolato de sódio, 2,5 g de cloreto de sódio, 0,001 g de resazurina e 0,75 g de ágar.
- Inoculação, cultivo e observação de bactérias
- Prepare a suspensão bacteriana para crescer até OD 0,6-0,8 em meio líquido TB (consulte a Etapa 2.2.).
- Abra o bujão de vedação do tubo de ensaio em condições assépticas no gabinete de segurança biológica, adicione 1 mL da cultura bacteriana ao tubo de ensaio contendo FTM o mais rápido possível e feche imediatamente o tubo de ensaio novamente.
- Agitar suavemente o tubo para se certificar de que as bactérias estão homogeneamente distribuídas no líquido e colocar o tubo de ensaio a 37 °C para cultura estática.
- Após 48 h de incubação, observe o crescimento de diferentes bactérias no FTM em vários tubos de ensaio e tire fotografias.
- Determinação da curva de crescimento em condições aeróbias
- Preparar a cultura bacteriana inicial com um valor de DO adequado (ver Passo 2.2) e cultivar as bactérias até atingirem a fase de crescimento logarítmico.
NOTA: Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 e Enterococcus faecalis V583 usados neste protocolo levaram ~ 5 h para atingir a fase logarítmica. - Adicione 200 μL da cultura bacteriana (da Etapa 3.3.1) em meio líquido TB a cada poço de uma placa de 96 poços em triplicata. Use um leitor de microplacas para determinar o valor de DO a 600 nm e dilua as diferentes culturas bacterianas de modo que a diferença de DO entre os diferentes poços contendo bactérias e o meio líquido TB (em branco) esteja entre 0,01 e 0,02.
- Pegue uma nova placa de 96 poços, adicione meio TB, transfira as diferentes culturas bacterianas diluídas da Etapa 3.3.2., em triplicata, para a placa e coloque-a em uma bancada ultralimpa.
- Sele a placa de 96 poços com fita de vedação, coloque-a no leitor de microplacas e defina o programa da seguinte forma:
- Defina a temperatura para 37 °C ± 0.5.
- Defina o Loop Cinético para um total de 60 ciclos, cada um por 30 min.
- Definir a absorvância para 600 nm.
- Defina Agitação para 1.600 s em um ciclo.
- Execute o programa e interrompa-o quando a curva de crescimento se estabilizar.
- Preparar a cultura bacteriana inicial com um valor de DO adequado (ver Passo 2.2) e cultivar as bactérias até atingirem a fase de crescimento logarítmico.
- Determinação da curva de crescimento em condições anaeróbias
- Siga o Passo 3.3. mas mantenha a placa de 96 poços com o meio TB e as suspensões bacterianas em uma incubadora anaeróbica antes de selar a placa com fita adesiva. Bombeie e encha a caixa anaeróbica com nitrogênio para reduzir a concentração de oxigênio para <3%. Sele a placa de 96 poços com fita de vedação e deixe-a na caixa anaeróbica.
4. Teste de capacidade de formação de biofilme
- Cultive a bactéria até a fase de crescimento logarítmico em meio líquido.
- Consulte a Seção 2 para inocular as bactérias no meio líquido TB.
- Cultive as bactérias durante a noite em um agitador a 37 °C, garantindo que o OD600 do meio de cultura bacteriano esteja entre 0,6 e 0,8.
- Divida a cultura bacteriana e cultive em diferentes condições.
- Quando o OD600 da cultura bacteriana estiver entre 0,6 e 0,8, adicione 10 mL desta suspensão bacteriana a um tubo de ensaio de vidro.
- Divida cada cultura bacteriana em dois grupos: condições aeróbicas e anaeróbicas, e execute todas as operações em triplicata.
- Para o grupo aeróbio, envolver o tubo de ensaio que contém a suspensão bacteriana com folha de estanho e incubá-lo num banho-maria a 37 °C a temperatura constante.
- Para o grupo anaeróbico, enrole o tubo contendo a suspensão bacteriana com papel alumínio e transfira-o para uma incubadora anaeróbica. Remova a folha de estanho na incubadora anaeróbica e reduza a concentração de oxigênio na incubadora para <3%, bombeando-a e enchendo-a com nitrogênio. Feche o tubo de ensaio com uma rolha de vidro fosco, retire-o após a selagem e incube-o em banho-maria a 37 °C.
- A cada 6 h, pegue três tubos de ensaio de cada um dos dois grupos (aeróbio/anaeróbico) para observar o crescimento do biofilme na parte inferior e core seguindo a Etapa 4.3.
- Descarte a suspensão bacteriana e seque o biofilme.
- Retire os tubos de ensaio em diferentes momentos e aspire cuidadosamente a camada superior da suspensão bacteriana. Observe o biofilme branco aderido ao fundo do tubo de ensaio.
NOTA: Tome cuidado para não perturbar o biofilme ao aspirar a suspensão bacteriana. - Adicione cuidadosamente 2 mL de solução salina tamponada com fosfato (PBS) ao longo da parede do tubo de ensaio, agite-o suavemente para lavar as bactérias planctônicas adsorvidas no biofilme e aspire cuidadosamente o tampão PBS.
- Coloque o tubo de ensaio com o biofilme adsorvido no fundo no forno para secar por 30 min.
- Retire os tubos de ensaio em diferentes momentos e aspire cuidadosamente a camada superior da suspensão bacteriana. Observe o biofilme branco aderido ao fundo do tubo de ensaio.
- Mancha
- Retire os tubos de ensaio, adicione 2 mL de solução de coloração violeta a 0,1% a cada tubo de ensaio e core os biofilmes por 30 min em temperatura ambiente.
- Use uma pipeta para aspirar cuidadosamente a solução de corante violeta cristalino. Adicione cuidadosamente água destilada ao longo da parede do tubo de ensaio para lavar a solução de corante violeta cristal restante, repetindo 3x-5x até que a água destilada adicionada se torne quase incolor. Observe o biofilme roxo na parte inferior do tubo de ensaio.
- Seque novamente o tubo de ensaio.
- Dissolver o biofilme com etanol a 95% e medir a OD600 da solução de biofilme.
- Retire o tubo de ensaio seco, adicione 10 mL de etanol a 95% a cada tubo de ensaio e agite bem para garantir que o cristal violeta esteja totalmente dissolvido no etanol.
- Com um volume de 200 μL por poço, adicione cristal violeta em etanol a uma placa de 96 poços e meça sua absorbância em um comprimento de onda de 600 nm.
NOTA: De acordo com a lei de Beer-Lambert, a absorbância está linearmente relacionada à concentração da solução, de modo que o valor de OD600 pode refletir a concentração de cristal violeta, que reflete a quantidade de biofilme na suspensão bacteriana em diferentes momentos.
5. Teste de quimiotaxia bacteriana
- Preparar placas de ágar eutróficas diferenciais.
- Consulte a Etapa 1 para preparar um meio MH de meia dose contendo 0,5% de ágar, cada litro contendo 11,8 g de triptona, 23,6 g de extrato de levedura, 9,4 g de K2HPO4, 2,2 g de KH2PO4 e 5 g de ágar, pH ~ 7.
- Consulte a Etapa 1 para preparar 5x TB médio contendo 0.5% de ágar, cada litro contendo 59 g de triptona, 118 g de extrato de levedura, 47 g de K2HPO4, 11 g de KH2PO4 e 5 g de ágar, pH ~ 7.
- Autoclave a solução a 121 °C durante 20 min utilizando uma cápsula permeável ao ar ou uma película de vedação do frasco com um respiradouro de ventilação.
- Antes que o líquido seja resfriado e solidificado, despeje 25 mL de caldo MH de meia dose (contendo 0,5% de ágar) por prato, cubra o prato com uma tampa impressa em 3D e coloque-o em um armário de segurança biológica. Após o resfriamento, remova a tampa para observar o poço cilíndrico (1,4 cm de diâmetro) no meio semissólido.
NOTA: A tampa impressa em 3D com material de resina não pode ser esterilizada com vapor de alta temperatura. Para matar as bactérias da superfície, ele pode ser pulverizado com etanol a 95% e depois irradiado com uma lâmpada UV por 30 minutos em um armário de segurança biológica. Ao remover a tampa, aplique força na direção vertical e levante-a com cuidado para evitar danos ao ágar semissólido. - Antes que o caldo 5x TB (contendo 0,5% de ágar) solidifique, use uma pipeta para adicionar o caldo 5x TB ao poço na placa semissólida até que o caldo esteja nivelado com a superfície do meio.
- Resfrie a placa em um gabinete de segurança biológica para obter uma placa de ágar semissólida contendo corpos eutróficos. Tome cuidado para evitar a contaminação da placa por microrganismos ambientais.
NOTA: O meio semissólido ainda é um pouco fluido e, portanto, deve ser totalmente resfriado antes de ser armazenado de cabeça para baixo.
- Inoculação, cultivo e fotografia bacteriana
- Coloque a placa de ágar com o meio de cultura semissólido em um gabinete de segurança biológica e resfrie-a por ~ 30 min sob irradiação UV para evitar contaminação bacteriana.
- Use uma pipeta de 10 μL para absorver 4 μL da suspensão bacteriana cultivada a uma DO de ~0,6-0,8, insira a ponta da pipeta no centro das placas de Petri de plástico e pipete a suspensão bacteriana.
- Aguarde até que a suspensão bacteriana seja absorvida pelo meio por 1 min. Quando a suspensão bacteriana tiver sido totalmente absorvida, dividir a placa em dois grupos (aeróbio/anaeróbio) em triplicata.
- Selar o grupo aeróbio com fita de vedação e colocar essas placas de cabeça para baixo numa incubadora bioquímica a 37 °C para cultura estática. Selar o grupo anaeróbio numa caixa anaeróbia conforme descrito no passo 4.2, invertendo as placas a 37 °C para o crescimento.
- Verifique a propagação e migração de bactérias a cada 12 h (em 0 h, 12 h, 24 h, 36 h e 48 h) e use o sistema de imagem para tirar imagens da placa.
- Use o software ImageJ para calcular as distâncias de migração bacteriana.
- Importe o arquivo de imagem adquirido usando o sistema de imagem.
- Defina a barra de escala e aplique-a a todas as imagens.
- Ao tirar fotos, adicione uma régua, crie um segmento de linha, selecione um segmento de linha reta (por exemplo, 1 cm e, em seguida, defina o comprimento desse segmento de linha para 1 cm) e marque o comprimento do quadro.
- Abra a janela Definir escala ; clique em Analisar | Definir escala.
- Digite o comprimento real em Distância conhecida e Unidade de comprimento.
- Verifique Global.
- Insira o endereço da pasta da imagem original e o endereço do arquivo de saída.
- Use a ferramenta de linha reta para selecionar as comunidades uma a uma e ajuste a tolerância até que a linha reta da ferramenta se ajuste ao limite da colônia bacteriana que se estende para ambos os lados.
- Meça a distância de migração da colônia do centro para ambas as extremidades separadamente e derive o comprimento da linha reta clicando em Analisar | Medir.
- Repita as etapas 5.3.3-5.3.4 até que todas as comunidades sejam medidas e salve os resultados em um arquivo .csv para análise posterior.
Resultados
Este trabalho descreve as abordagens adotadas para caracterizar os micróbios isolados do microbioma hospedeiro (Figura 1). Como prova de conceito, três micróbios foram isolados do hospedeiro de ratos SD (C. stationis, S. cohnii e E. faecalis) e dois microrganismos adquiridos comercialmente (S. aureus ATCC 25923 e E. faecalis V583) foram testados usando este protocolo. Para estabelecer as necessidades de oxigênio de micróbios individuais usando FTM, adicionamos dois organismos de controle, um anaeróbio obrigatório (Fusobacterium nucleatum ATCC 25586) e um anaeróbio facultativo (Pseudomonas aeruginosa PAO1). Os resultados mostraram que os cinco micróbios testados eram anaeróbios facultativos (Figura 2A), consistente com os perfis relatados anteriormente desses micróbios11. Para elucidar suas necessidades de oxigênio, os micróbios foram cultivados em condições aeróbicas e anaeróbicas. Todos os micróbios testados exibiram uma curva de crescimento sigmoidal em condições aeróbicas e anaeróbicas; no entanto, a densidade microbiana, conforme indicado pelo OD600nm, mostrou que todos os cinco micróbios têm maior preferência por ambientes ricos em oxigênio (Figura 2B, C). Essas observações são consistentes com as habilidades microbianas de se infiltrar e infectar os ossos de ratos, que geralmente são considerados hipóxicos.
Os cinco isolados bacterianos formaram biofilmes naturalmente, onde a massa de biofilme produzida foi maior em condições anaeróbicas. Através da comparação da curva de crescimento, os biofilmes de E. faecalis e S. aureus ATCC 25923 foram encontrados ativamente formados durante a fase de crescimento estacionário em ambientes aeróbicos e anaeróbicos (Figura 3). Essa observação sugere que a formação de biofilme depende do estado de crescimento das células, possivelmente regulado por moléculas de sinalização intracelular que desencadeiam a formação de biofilme11. Essa dependência da formação de biofilme nas condições de crescimento é consistente com as condições de nutrientes e crescimento apresentadas pelo ambiente da matriz óssea hospedeira que carece de oxigênio e nutrientes.
Estudos sobre a patogênese dos micróbios estão frequentemente ligados à capacidade do micróbio de migrar para locais considerados propícios ao crescimento. Existem muitos estudos sobre quimiotaxia microbiana, mas não há uma abordagem padronizada para estudá-la. Além disso, o uso de produtos químicos não difusíveis tem sido considerado um fator limitante no estudo desse fenômeno. Aqui, desenvolvemos uma cobertura de resina produzida por meio de impressão 3D que padroniza a distância entre o reservatório químico e o ponto de inoculação (Figura Suplementar S1 e Figura Suplementar S2). Estudamos a migração dos micróbios para um ambiente rico em nutrientes, onde 5x TB foi usado como estimulante químico. Os micróbios foram monitorados por 48 h em condições aeróbicas e anaeróbicas, onde todos os cinco micróbios apresentaram diferentes graus de migração do tropismo (Figura 4A).
ImageJ foi usado para medir a distância de migração das bactérias (Figura 4B); A migração em direção ao reservatório parecia ser mais rápida do que a migração na direção oposta. A razão entre a distância de migração em direção ao reservatório e a na direção oposta mostra a rápida expansão da colônia microbiana devido à quimiotaxia microbiana (Figura 5B). Neste estudo, bactérias como S. aureus ATCC 25923 migraram mais rápido do que outros micróbios, como C. stationis. Curiosamente, o perfil de migração de culturas quimiotáticas em condições aeróbias e anaeróbias mostrou que algumas bactérias, como E. faecalis, apresentaram variação nos padrões de migração em condições aeróbicas e anaeróbias, em que uma rápida expansão foi observada em condições anaeróbias ao longo do tempo. De forma confusa, a cepa de laboratório E. faecalis V583 favoreceu um ambiente aeróbio para quimiotaxia. Assim, isso sugere que E. faecalis isolados de diferentes fontes têm diferentes requisitos de crescimento adaptados ao ambiente de crescimento.

Figura 1: Diagrama esquemático do processo de operação. (A) As bactérias são inoculadas em placas e depois em meio líquido e cultivadas até a fase de crescimento logarítmico. (B) Determinação da capacidade das bactérias de formar biofilmes sob diferentes condições (aeróbico/anaeróbico). Três amostras foram selecionadas para cada ponto de tempo (6 h) e repetidas em paralelo. (C) O protocolo para o experimento de tropismo químico de bactérias sob diferentes condições (aeróbico/anaeróbico). Clique aqui para ver uma versão maior desta figura.

Figura 2: Condições de crescimento microbiano. (A) O perfil de crescimento de bactérias cultivadas em meio de tioglicolato fluido (da esquerda para a direita estão I: Fusobacterium nucleatum ATCC 25586, II: Corynebacterium stationis, III: Staphylacoccus cohnii, IV: Enterococcus faecalis, V: Staphylacoccus aureus ATCC 25923, VI: Enterococcus faecalis V583 e VII: Pseudomonas aeruginosa PAO1). (B) Curva de crescimento de microrganismos isolados do hospedeiro em condições aeróbias. (C) Curva de crescimento de microrganismos isolados do hospedeiro em condições anaeróbias. Clique aqui para ver uma versão maior desta figura.
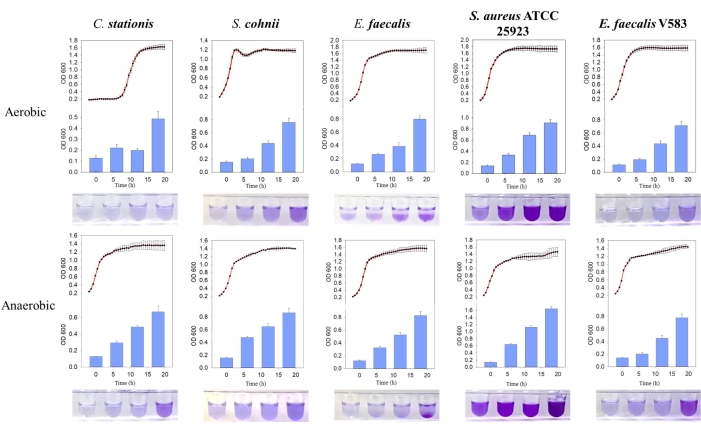
Figura 3: Comparação das curvas de crescimento e formação de biofilme de diferentes bactérias sob diferentes condições. Da esquerda para a direita estão Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 e Enterococcus faecalis V583. A curva vermelha é a curva de crescimento e o histograma azul é a quantidade de biofilme produzido. Clique aqui para ver uma versão maior desta figura.
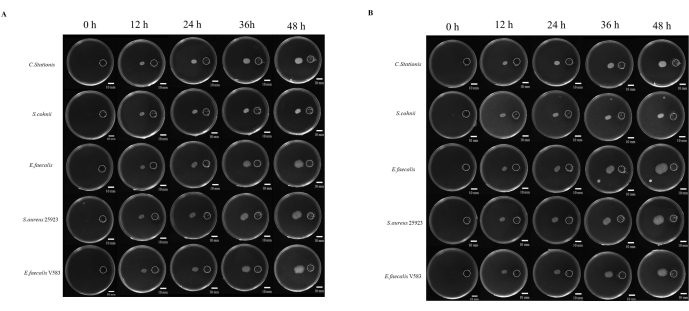
Figura 4: Crescimento microbiano em direção à eutrofização. (A) Condições aeróbicas, (B) condições anaeróbicas. Cinco tipos de bactérias (de cima para baixo são Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 e Enterococcus faecalis V583) tendem a crescer em direção à eutrofização na placa de nutrientes diferenciais. Barras de escala = 10 mm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Quimiotaxia de micróbios em diferentes condições (aeróbico/anaeróbico). (A) Os resultados da migração do tropismo químico de cinco bactérias em uma placa contendo ágar rico em nutrientes; o grupo esquerdo representa as condições aeróbicas e o grupo direito as condições anaeróbicas. Cada experimento foi repetido em triplicata em paralelo. (B) Análise de dados do tropismo químico. A parte superior representa as condições aeróbicas e a parte inferior as condições anaeróbicas. Da esquerda para a direita estão Corynebacterium stationis, Staphylacoccus cohnii, Enterococcus faecalis, Staphylacoccus aureus ATCC 25923 e Enterococcus faecalis V583. As colunas vermelha e azul são as distâncias de migração do corpo nutriente das bactérias que migram em direção e para longe do corpo nutriente. A linha é a diferença entre os dois valores (Vermelho - Azul). Barras de escala = 10 mm. Clique aqui para ver uma versão maior desta figura.
Figura Suplementar S1: Usando tampas impressas em 3D para fazer placas de ágar de diferença de nutrientes. (A) Use software para preparar renderizações de moldes de impressão 3D. (B) Molde de tampa plana impresso com resina 8.000. (C) Use o método acima para obter as placas de ágar de diferença de nutrientes. (D) Produção das placas de ágar de diferença de nutrientes. Clique aqui para baixar este arquivo.
Figura Suplementar S2: Construção de placas de ágar de diferença de nutrientes e medição da distância de migração bacteriana usando ImageJ. (A) A construção de placas de ágar de diferença de nutrientes usa uma tampa impressa em 3D (contendo uma saliência cilíndrica) para cobrir a placa. Depois que o ágar é resfriado, um poço cilíndrico é formado (o círculo vermelho), que é preenchido com ágar 5x TB. Este é então resfriado para obter placas de ágar de diferença de nutrientes. (B) Use o ImageJ para medir a distância de migração de bactérias em diferentes direções. Definir barra de escala (Analisar | Definir escala) e exportar a distância de migração usando Reta (Analisar | Medida). Clique aqui para baixar este arquivo.
Figura Suplementar S3: Padrões de crescimento de cinco bactérias em ágar médio M9 mínimo de 5x TB. O grupo esquerdo é para condições aeróbicas e o grupo direito é para condições anaeróbicas. Clique aqui para baixar este arquivo.
Figura Suplementar S4: Experimentos de controle em curvas de crescimento e quimiotaxia de bactérias anaeróbicas de Fusobacterium nucleatum ATCC 25586. (A) Determinação das curvas de crescimento de F. nucleatum ATCC 25586 sob condições aeróbicas e anaeróbicas. (B) Experimentos de quimiotaxia de F. nucleatum ATCC 25586 em placas de ágar MH-5x TB de meia dose sob diferentes condições de oxigênio. Ampliação parcial: Crescimento de F. nucleatum ATCC 25586 na placa em condições anaeróbicas após 48 h (ampliação parcial). Clique aqui para baixar este arquivo.
| Composto | Concentração (g/L) |
| Na2HPO4 | 6.78 |
| KH2PO4 | 3 |
| NaCl | 0.5 |
| NH4Cl | 1 |
| MgSO4.7H 2O | 0.493 |
| CaCl2 | 0.011 |
| Glicose | 4 |
Tabela 1: Componentes e conteúdo da mídia mínima M9.
Discussão
Isolamos e identificamos cinco espécies de bactérias por métodos sequenciais. O crescimento de bactérias tem necessidades mínimas de nutrientes: o meio mínimo - um meio contendo apenas sais inorgânicos, uma fonte de carbono e água. Embora as bactérias do grupo experimental tenham sido encontradas em placas sólidas de MH, usamos meio MH de meia dose para verificar a quimiotaxia das bactérias e obtivemos bons resultados. No entanto, também realizamos experimentos de controle usando meio mínimo. O meio básico M9 foi usado no experimento (ver Tabela 1 para sua composição e conteúdo), e o ágar 5x TB ainda foi usado para o bloco de ágar nutriente. Os resultados experimentais são mostrados na Figura Suplementar S3. Embora essas bactérias (exceto E. faecalis) cresçam lentamente e se movam lentamente em meio M9, há uma tendência geralmente semelhante (em direção ao crescimento em ágar nutriente), conforme observado nesses experimentos. No entanto, E. faecalis V583 não cresceu em meio M9 mínimo, possivelmente devido à falta de componentes necessários para E. faecalis crescer em meio M9. Portanto, recomendamos o uso de meio MH de meia dose como substrato deficiente em nutrientes para simular o crescimento e a migração bacteriana em condições deficientes em nutrientes. Isso também facilita o uso do software ImageJ para medir a distância pela qual as bactérias tendem a migrar.
Os biofilmes são geralmente definidos como comunidades microbianas associadas à superfície e são uma importante estratégia de sobrevivência microbiana. Organismos como Pseudomonas aeruginosa, Haemophilus influenzae, Streptococcus pneumoniae e Staphylococcus aureus podem ser encontrados em hospedeiros assintomáticos, e a descoberta de microrganismos aderentes in vivo é frequentemente referida como colonização, não infecção. Um problema muito importante é a falta de um modelo ideal de colonização animal12. Os micróbios demonstram ligações iniciais a superfícies carregadas antes da formação do biofilme, onde materiais como vidro e cloreto de polivinila (PVC) são considerados adequados para estudos relacionados ao biofilme. Estudos usando placas de PVC de 96 poços têm sido usados para estudar os biofilmes microbianos9, em que biofilmes de uma ou várias espécies podem resultar em biofilmes fracos ou densamente compactados10. Como tal, o uso da placa de PVC de 96 poços é considerado inadequado para biofilmes frouxamente embalados, pois a matriz do biofilme pode ser facilmente lavada durante o processo de coloração do biofilme. Portanto, contamos com tubos de ensaio de vidro para estudar a formação de biofilme microbiano (Figura 3).
Uma limitação importante desse método é que ele não funciona com microrganismos que crescem sob condições específicas e nem todas as bactérias podem migrar. Além disso, embora os biofilmes sejam um meio eficaz de ajudar os microrganismos a se defenderem contra ambientes externos adversos, nem todos os microrganismos hospedeiros são capazes de produzir biofilmes. Por exemplo, F. nucleatum ATCC 25586, mencionado anteriormente, que está associado a uma simbiose oral ou intestinal humana associada ao desenvolvimento de câncer de cólon17, só cresce especificamente em ambientes anaeróbicos, mas não produz biofilmes. Nós o usamos em experimentos FTM para verificar a eficácia do meio FT. O meio FT demonstrou ser eficaz no fornecimento de bactérias com concentrações gradientes de oxigênio.
Para comparação, testamos a curva de crescimento e o tropismo químico da bactéria anaeróbia F. nucleatum ATCC 25586 (Figura Suplementar S4). Nos experimentos de curva de crescimento (Figura Suplementar S4A), F. nucleatum ATCC 25586 não pôde crescer em condições aeróbias e apresentou agregação bacteriana no fundo dos poços em condições anaeróbias. Nos experimentos de quimiotaxia (Figura Suplementar S4B) também, F. nucleatum ATCC 25586 não cresceu em condições aeróbicas, e um baixo número de bactérias foi encontrado após inoculação in situ em condições anaeróbias por 48 h. Da mesma forma, como algumas bactérias não podem buscar ativamente condições de crescimento adequadas migrando, elas esperam por condições de crescimento adequadas entrando em um estado dormente de longo prazo18. Deve-se notar que o cultivo de bactérias anaeróbicas estritas requer um meio especial, como o meio de fermentação ET (as placas semissólidas devem ser suplementadas com 0,5% de ágar), que também é diferente do isolamento e identificação convencionais. Este método proposto é um método geral aplicável para caracterizar a maioria dos microrganismos hospedeiros, com a técnica sendo demonstrada para cinco micróbios, incluindo três micróbios isolados de ossos murinos e dois micróbios de nível laboratorial. Este protocolo ajudaria na identificação adequada de isolados de microbiota em estudos futuros.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
O desenvolvimento desta técnica foi apoiado pelos fundos da Fundação Nacional de Ciências Naturais do Fundo de Pesquisa da China para Jovens Cientistas Internacionais (22050410270), do Fundo Especial de Shenzhen para Inovação e Empreendedorismo de Talentos de Alto Nível no Exterior Peacock Team (KQTD20170810111314625) e do Programa de Equipe de Pesquisa Inovadora e Empreendedora de Guangdong (2019ZT08Y191). Gostaríamos de oferecer nossa sincera gratidão à senhorita Chen Xinyi por sua ajuda na revisão do documento e na gestão do laboratório.
Materiais
| Name | Company | Catalog Number | Comments |
| Chemical/Solution | |||
| 1% crystal violet dye solution | Solarbio | G1062 | 100 mL |
| Agar | Sigma-Aldrich | V900500 | Used to obtain semi-solid plates, 20 g |
| Centrifuge tube | Corning | 430790 | 15 mL |
| Fluid thioglycollate medium | Kinghunt | K0001 | 29.3 g |
| Mueller Hinton II Broth medium | Solarbio | NO.11865 | 100 g |
| Petri dishes | Bkman | B-SLPYM90-15 | Plastic Petri dishes, circular, 90 mm x 15 mm |
| Potassium Chloride | VETEC | WXBC4493V | 0.2 g |
| Potassium Dihydrogen Phosphate | aladdin | 04-11-7758 | 0.24 g |
| Sodium chloride | Macklin | S805275 | 8.0 g |
| Sodium phosphate dibasic | aladdin | 7558-79-4 | 1.44 g |
| Terrific Broth medium | Solarbio | LA2520 | 200 g |
| Kits/ Equipment | |||
| Anaerobic incubator | Longyue | ||
| Biochemical incubator | Blue pard | LRH-70 | |
| Microplate reader | Spark | ||
| Tanon 5200multi imaging system | Tanon | 5200CE | |
| Thermostatic water bath | Jinghong | DK-S28 |
Referências
- Bernardi, S., et al. Combining culture and culture-independent methods reveals new microbial composition of halitosis patients' tongue biofilm. MicrobiologyOpen. 9 (2), 958 (2020).
- Tellez, G., Latorre, J. D., Kuttappan, V. A., et al. Rye affects bacterial translocation, intestinal viscosity, microbiota composition and bone mineralization in Turkey poults. PLOS One. 10, (2015).
- Brewer, J. H. Clear liquid mediums for the "aerobic" cultivation of anaerobes. Journal of the American Medical Association. 115 (8), 598 (1940).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Liu, C., et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review. Frontiers in Microbiology. 11, 802 (2020).
- Kumar, A., et al. Biofilms: survival and defense strategy for pathogens. International Journal of Medical Microbiology. , (2017).
- Penesyan, A., et al. Secondary effects of antibiotics on microbial biofilms. Frontiers in Microbiology. 11, 2109 (2020).
- Bernardi, S., et al. Subinhibitory antibiotic concentrations enhance biofilm formation of clinical Enterococcus faecalis isolates. Antibiotics. 10 (7), 874 (2021).
- Tsukatani, T., Fumihiko, S., Rieko, K. A rapid and simple measurement method for biofilm formation inhibitory activity using 96-pin microtiter plate lids. World Journal of Microbiology and Biotechnology. 36 (12), 1-9 (2020).
- Hartmann, R., et al. Emergence of three-dimensional order and structure in growing biofilms. Nature Physics. 15, 251-256 (2019).
- Liu, Z., et al. Advances in bacterial biofilm management for maintaining microbiome homeostasis. Biotechnology Journal. 15 (10), 1900320 (2020).
- Hall-Stoodley, L., Stoodley, P. Evolving concepts in biofilm infections. Cellular Microbiology. 11 (7), 1034-1043 (2009).
- Røder, H. L., et al. Enhanced bacterial mutualism through an evolved biofilm phenotype. The ISME Journal. 12 (11), 2608-2618 (2018).
- Matilla, M. A., Tino, K. The effect of bacterial chemotaxis on host infection and pathogenicity. FEMS Microbiology Reviews. 42 (1), 052 (2018).
- Moreira, L. M., et al. Chemotactic signal transduction and phosphate metabolism as adaptive strategies during citrus canker induction by Xanthomonas citri. Functional & Integrative Genomics. 15 (2), 197-210 (2015).
- Konishi, H., et al. Bacterial chemotaxis towards polysaccharide pectin by pectin-binding protein. Scientific Reports. 10 (1), 1-12 (2020).
- Kostic, A. D., et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment. Cell Host & Microbe. 14 (2), 207-215 (2013).
- Kochan, T. J., et al. Updates to Clostridium difficile spore germination. Journal of Bacteriology. 200 (16), 00218 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados