Method Article
Hassas kesilmiş karaciğer dilimlerinin üretimi ve kültürü için optimize edilmiş ve basitleştirilmiş teknik
Bu Makalede
Özet
Fare karaciğerlerinin incelenmesi için Hassas Kesilmiş Karaciğer Dilimlerinin (PCLS) üretimi ve kültürü için bir protokol. Makale, yalnızca bir vibratoma erişimi olan standart laboratuvar ekipmanı gerektiren ve PCLS'nin en az 4 gün hayatta kalmasına izin veren protokolün temel yönlerine odaklanmaktadır.
Özet
Bu protokol, Hassas Kesilmiş Karaciğer Dilimlerinin (PCLS) oluşturulması ve kültürü için basit bir sistem sunar. PCLS, bozulmamış bir ortamdaki tüm hücreleri içerir ve bu nedenle, tüm organın mini bir modelini andırır. Karmaşık fenotiplerini çoğaltırken canlı dokuların incelenmesini sağlarlar. Bu protokol, bir vibratom ve standart laboratuvar ekipmanı kullanılarak fare karaciğerlerinden dilimlerin hazırlanmasına izin verir. PCLS'nin üretilmesi ve kültürlenmesi için protokoller standardizasyondan yoksundur ve ilgilenilen dokuya, kullanılan vibratom tipine ve oksijen ihtiyacına bağlı olarak oldukça büyük ölçüde değişebilir. Bunların, yalnızca temel bir vibratom ve ortak doku kültürü tesislerine erişimi olan bazı laboratuvarlarda çoğaltılması zor olabilir. Halihazırda mevcut olan çeşitli protokoller içindeki bazı önemli adımların önemine odaklanan bir protokol oluşturduk. Bu nedenle bu protokol, gömme yönteminin, kesme yönünün, dinamik ve statik bir sistemin önemini ve minimum kültür hacminin alaka düzeyini vurgular. Bu protokol, temel bir doku dilimleyiciye erişimi olan çoğu laboratuvarda basit bir şekilde oluşturulabilir ve çoğaltılabilir. Birlikte ele alındığında ve bu protokolü takip ederek, PCLS en az 4 gün hayatta kalabilir. PCLS, karaciğer gibi organlar için patofizyolojik ve terapötik taramayı incelemek için basit, ekonomik ve tekrarlanabilir bir modeldir.
Giriş
Hassas kesilmiş doku dilimleri (PCTS), organların ince kesitleridir. Komşu hücrelerin ve hücre dışı matrisin 3 boyutlu yönünü korurken, bir mini organı kopyalayan organın mimarisinin korunmasına izin verirler. Doku mimarisini korurken kolay erişimi, maliyet tasarrufu sağlaması ve daha az emek yoğun olması nedeniyle çekici bir modeldir.
PCTS, in vitro hücre çalışmaları ile in vivo hayvan araştırmaları arasındaki boşluğu doldurarak her iki modelin de dezavantajlarının çoğunun üstesinden gelir. PCTS, karaciğer 1, bağırsaklar 2,3, kolon2, beyin 4,5, akciğer 6,7,8, böbrek 9,10, dalak11,12, kalp13,14 gibi çeşitli organlardan ve ayrıca tümörlerden15,16 üretilmiştir. Ayrıca fare1, sıçan 17,18 gibi çeşitli hayvanlardan da kaynaklanabilir, aynı zamanda domuz19 ve insan cerrahi atıkları 15,20,21 de olabilirler. PCTS, etik ile ilgili konuları ima eden hayvanların kullanımını gerektirse de, bir hayvandan alınan organ birden fazla PCTS üretebilir, böylece NC3Rs yönergelerine (Azaltma, Değiştirme, İyileştirme)22 uygun olarak hayvan sayısını azaltırken, bireyler arası varyasyonları sınırlar.
İyileştirilmiş doku dilimleyicilerin, örneğin vibratom23'ün geliştirilmesi, heterojen kalınlık ve zayıf hayatta kalma oranı ile karakterize edilen manuel olarak kesilmiş dilimlerden, daha iyi korunmuş yapısal bütünlüğe sahip tekrarlanabilir daha ince dilimlere geçişe izin vermiştir.
Bununla birlikte, PCTS ve daha spesifik olarak, Hassas Kesilmiş Karaciğer Dilimleri (PCLS) hazırlama ve kültürü için protokoller literatürde önemli ölçüde farklılık gösterir ve özellikle dilimleme ekipmanı, ortam içeriği ve kültür koşulları gibi temel parametreler için standardizasyondan yoksundur. Protokoller ayrıca orijin dokusuna bağlı olarak gözle görülür şekilde değişebilir. Protokollerden bazıları, bazı karmaşık biyoreaktör sistemleri ile tamponun veya kültürün oksijenlenmesini gerektirecektir24. Genellikle farklı teknik yönlere ayrı ayrı odaklanırlar veya farklı dokular için tasarlanırlar ve ortalama bir laboratuvarda uygun maliyetli bir şekilde çoğaltılmaları genellikle maliyetli ve daha zor olabilir.
Burada, bu protokol, gömme yöntemi, kesme yönü, transwells25 kullanımı, dinamik bir kültür sistemi26 ve minimum kültür hacminin önemi gibi bazı kilit noktaları bir araya getirmektedir. Bu adımlardan bazıları daha önce bağımsız olarak veya fibroz27 veya tümör yanıtı28 gibi farklı bir bağlamda optimize edilmiştir. Bu protokol aynı zamanda, hem ustalaşması zor parametreler olan hem de literatürde sıklıkla ihmal edilen belirli dilimleyici türleri kullanılarak gömmenin ve kesmenin yönlendirilmesinin önemini vurgulamaktadır. Bu basit yöntem, kolay bir kurulumla ve ilkel bir doku dilimleyiciye erişimi olan standart laboratuvar ekipmanı kullanılarak en az 4 gün boyunca kültürde tutulan PCLS üretir.
Protokol
Yabani tip CD57Bl / 6J fareler Charles River Laboratories'den satın alındı. Fareler, kontrollü sıcaklık ve nem koşulları ve 12 saatlik bir ışık döngüsü ile ayrı ayrı havalandırılan kafeslerde barındırılan yiyecek ve suya ücretsiz erişime sahipti. 3 haftalık hayvanlar sakrifiye edildi ve karaciğerler perfüzyon olmadan hemen toplandı. Tüm hayvan çalışmaları, University College London Hayvan Refahı ve Etik İnceleme Kurulu tarafından yapılan yerel etik incelemenin ardından onaylandı ve İçişleri Bakanlığı proje lisansı PP9223137 altında ve İçişleri Bakanlığı (Hayvanlar) Bilimsel Prosedürler Yasası (1986) ve ARRIVE yönergelerine uygun olarak gerçekleştirildi. University College London'daki Biyolojik Hizmetler Birimi'nde standart uygulamaya uygun olarak hayvanlara verilen zararı sınırlamak için tüm çabalar gösterildi.
1. Deneme için ayarlama
- Hasattan önceki gün aşağıdaki adımları uygulayın.
- Bir şişe Krebs tozunu 1 L steril su içinde çözerek 1 L Krebs-Henseleit tamponu (KREBS) hazırlayın. 4 °C'ye kadar soğutun ve ıslak buz üzerinde tutun.
- Tepsiyi %70 etanol ile dezenfekte edin ve steril PBS ile durulayın. Kesim sırasında soğuk bir ortamın korunmasına yardımcı olmak için tepsiyi bir gece buzdolabında kalay folyoya sarılı tutun.
- Diğer tüm çıkarılabilir parçalara etanol püskürtün, steril PBS ile durulayın, kurumaya bırakın ve steril tutun. Bıçakları otoklavlayın ve kullanana kadar steril tutun.
- Steril suda% 4 w / v düşük erime noktalı agaroz hazırlayın. Yeniden süspanse edildikten ve eridikten sonra, agarozu buzdolabında 4 °C'de saklayın.
- Hasat gününde ve karaciğer hasadından önce, aşağıdaki adımları uygulayın.
- %4 düşük erime noktalı agarozu eritin ve kullanana kadar 37 °C'de bir su banyosunda tutun. Kullanmadan önce agarozun 37 °C'ye kadar soğuduğundan ve tüm kabarcıkların dağıldığından emin olun.
- 6, 12 ve 24 oyuklu plakalara oyuk başına sırasıyla 2.6 mL, 1.5 mL ve 0.7 mL ekleyerek kültür plakalarını hazırlayın. Her oyuğa 8 μm gözenekli ekler ekleyin. Plakaları 37 °C, %5 CO2 ve% 21 O2 seviyesine ayarlanmış nemlendirilmiş bir inkübatöre yerleştirin. Bu, ortamı ısıtırken pH'ın ayarlanmasına yardımcı olacaktır, böylece kültüre hazırdır.
- Dilimin her iki yüzüne de erişim sağlamak için dilimleri gözenekli 8 μm eklerle kültürleyin. Ortamı aşağıdaki gibi hazırlayın: William's Medium E (WME), 2 mM L-glutamin takviyesi, %10 Fetal Sığır Serumu (FBS), 100 U/mL penisilin ve 100 μg/mL streptomisin, 10 μg/mL Gentamisin, 25 mM D-Glikoz çözeltisi ve 15 mM HEPES çözeltisi.
2. Karaciğerin toplanması ve hazırlanması (15 dk)
- Hasattan önce tüm aletleri sterilize edin.
- Fareyi, bir izofluran maskesi kullanarak bilimsel amaçlarla hayvanların bakımı için yerel prosedürlere göre anestezi altına alın. Karın boşluğunu açmadan önce, hayvanın uygun şekilde uyuşturulduğundan emin olmak için ayak parmaklarının arasına sıkıştırın. Karaciğer hızlı bir şekilde çıkarılabilirse, fare CO2 boğulması veya servikal çıkık ile ötenazi yapılabilir. Prosedür son bir prosedür olduğundan, hayvanı etkilemeyeceği için göz merhemi kullanmayın.
- Karnınıza% 70 etanol püskürtün. İsteğe bağlı: Saçla kirlenmeyi önlemek için fareyi tıraş edin.
- Karın boşluğunu steril forseps ve makasla karın ortasından cildi ve karın zarını keserek açın. Karaciğeri diğer organlardan veya damarlardan nazikçe inceleyin ve loblara zarar vermekten kaçının.
- Tüm karaciğeri hemen buz gibi Krebs Buffer'da saklayın. Diğer tüm adımları buz üzerinde 4 ° C'de gerçekleştirin ve daha fazla hücre ölümünü önlemek için mümkün olan en kısa sürede karaciğer hazırlığına geçin.
3. Karaciğer loblarının gömülmesi (her karaciğer lobu için 25 dakika)
- Karaciğeri, buz gibi soğuk Krebs tamponu içeren buz üzerindeki bir Petri kabına aktarın ve tüm karaciğerin tamamen suya batırıldığından emin olun.
- Loblara zarar vermemek için künt forseps ve keskin, steril bir bıçak kullanarak her lobu ayrı ayrı ayırın.
- Bölümlemek için ilk lobu seçin ve kalan lobları gömme ve dilimleme için hazır olana kadar buz gibi bir Krebs tamponunda tutun.
- Gömmeye hazır düz kenarlara sahip daha yönetilebilir bir lob elde etmek için tüm kenarları kesin. Bu aynı zamanda, kesitlemeyi daha da kolaylaştırmak için lifli Glisson kapsülünün bir kısmının çıkarılmasına yardımcı olacaktır. Bunu, karaciğer yüzeylerini buz gibi bir Krebs tamponunda ıslak tutarken yapın.
- Islak buzun üzerine 3 cm'lik bir Petri kabı (veya benzeri) yerleştirin ve %4 düşük erime noktalı agarozu (zaten 37 °C su banyosunda) içine dökün. Lobun dibe batmasını ve düzgün bir şekilde gömülmesini önlerken, agarozun yukarı yönde soğumasını sağlamak için buz üzerinde iyi tutun.
- Agarozu 30 saniye daha soğumaya bırakın ve kesilmiş lobu içine yerleştirin. Lob, agaroz bloğunun ortasına yerleşecektir. Yerleştirme işlemi, her laboratuvar koşuluna ve kişisel deneyime uyacak şekilde pratik ve optimizasyon gerektirir.
- Gömülü lobu hala buz üzerinde 5 dakika buzdolabına koyun. Agaroz daha sonra net bir şekilde ayarlanmalıdır.
- Agaroz bloğunun dışını kesin. Agaroz bloğunu tabaktan çıkarın.
- Agarozu daha yönetilebilir bir boyutta kesin, üst tarafın ve vibratom platformuna yapıştırılan tarafın lobun üst kenarına paralel olduğundan emin olun.
- Dilimleme işlemine mümkün olduğunca çabuk başlayın, ancak agaroz bloğunun buz gibi bir Krebs tamponunda ve buz üzerinde tutulduğundan emin olun.
4. Karaciğer dilimleri üretimi (lob başına 40 dakika)
- Vibratomu 250 μm kalınlığında, 5 hızında ve 7 Hz frekansta kesmek için ayarlayın. Bunlar yol gösterici parametrelerdir; Kullanılan vibratom türüne bağlı olarak, bu optimizasyon gerektirebilir.
- Ortamı mümkün olduğunca steril tutmak için kesmeden önce vibratom ve tezgah alanlarına %70 etanol püskürtün.
- Tepsiyi vibratomun üzerine yerleştirin ve etrafına buz dökün. Bıçakları aşağıya doğru 10°'lik bir açıyla ve yatayın altına vibratomun üzerine yerleştirin.
- Vibratom tankını buz gibi soğuk Krebs tamponu ile doldurun. Platformun üzerine ince bir tabaka siyanoakrilat yapıştırıcı yerleştirin.
- Platforma yapıştırılacak agaroz bloğunun kenarını steril bir emici doku kullanarak kurutun.
- Agaroz bloğunu çıkarılabilir platforma yerleştirin. Enine kesilmesine izin vermek için lobu dik olarak konumlandırın. Dilimlerin boyutu küçülmesine rağmen, bu, kesim sırasında loba karşı olan basıncı sınırlayarak kesme işlemini büyük ölçüde kolaylaştırır.
- Yapıştırıcının sertleşmesi için 1 dakika bekleyin ve çıkarılabilir platformu tanka daldırın ve agaroz bloğunun tamamen Krebs tamponu ile kaplandığından emin olun.
- Başlangıç ve bitiş konumlarını ayarlayarak vibratomu kesim için programlayın. Karaciğer lobuna ulaşılana kadar başlangıçta daha kalın dilimler kesmeye başlayın.
- Doğru kalınlıkta kesilmeyebileceği için ilk dilimi atın. Dilimlere zarar vermemek için, karaciğer dilimlerini toplamak için forseps veya fırça yerine bir spatula kullanın.
NOT: %70 etanol ile dezenfekte edilmiş ve steril PBS ile durulanmış küçük bir fırça, kesme işlemi sırasında dokuyu nazikçe yönlendirmek için de kullanılabilir. - Gerekli dilim sayısına ulaşılana kadar işlemi tekrarlayın. Lob zaman zaman agarozdan kendini çıkarabilir ve daha fazla kullanımı engelleyebilir. Dilimleri kültüre kadar buz gibi soğuk Krebs tamponunda toplayın.
5. Karaciğer dilimlerinin inkübasyonu
- Dilimleri bir spatula kullanarak, ortamı ve ekleri içeren hazırlanmış kuyucuklara aktarın.
- Plakaları bir orbital çalkalayıcıya yerleştirin, hızı 130 rpm'ye ayarlayın ve 37 °C'de %5 CO2 ve %21 O2 içeren geleneksel bir hücre kültürü inkübatörü kullanarak inkübe edin. Nihai kültür hacmi, 6, 12 ve 24 oyuklu plakalarda sırasıyla oyuk başına 2.6 mL, 1.5 mL ve 0.7 mL'dir.
- Çalkalayıcının platformundan kaynaklanan aşırı ısının dağılmasını sağlamak için kültürdeki dilimleri içeren kültür plakasının altına boş bir plaka yerleştirin. Ortamı her 48 saatte bir değiştirin.
6. Hücre sağkalım testi
- Dilimleri 400 μL önceden ısıtılmış tam Williams' Medium E ortamı içeren 48 oyuklu bir plakaya aktarın ve 80 μL MTS (3- (4,5-dimetiltiyazol-2-il) -5- (3-karboksimetoksifenil) -2- (4-sülfofenil) -2H-tetrazolium) tetrazolyum reaktifi.
- 37 ° C'de 1 saat inkübasyonun ardından,% 5 CO2 bir çalkalayıcı üzerine, 200 μL ortamı 96 oyuklu bir plakaya aktarın ve çok kuyulu bir plaka okuyucu kullanarak 490 nm'de absorbansı ölçün. PBS'de tezgahta ve oda sıcaklığında 24 saat boyunca bırakılan dilimleri negatif kontrol olarak kullanın.
7. Histoloji boyama
- Ksilen ve etanol kullanarak bölümleri deparafininize edin ve rehidre edin, ardından deiyonize su ekleyin. Bölümleri 3 dakika boyunca Hematoksilen çözeltisi ile boyayın.
- Deiyonize su ile 5 dakika durulayın. Hızlı bir şekilde 10x asit etanole (1 mL konsantre HCL ve 400 mL %70 etanol) daldırın.
- 2 kez deiyonize suya durulayın ve fazla suyu kurulayın. Bölümleri 30 saniye boyunca Eosin'e batırın.
- % 95 etanole, daha sonra% 100 etanole, her biri 5 dakika, 3 kez dehidre edin. Bölümleri her biri 3 dakika boyunca ksilen 15x'e batırın. Lamelleri slaytların üzerine yerleştirin.
Sonuçlar
Hasatta, organın hızlı bir şekilde işlenmesini sağlamak ve organ hasarını önlemek için hayvanın perfüzyonu kasıtlı olarak ihmal edilir. Karaciğer, insizyonun ardından hızlı bir şekilde çıkarılır ve hemen buz gibi soğuk bir organ koruyucu tampona, örneğin Krebs tamponu 24,29'a yerleştirilir. Taze karaciğer dokusunun gömülmeden dilimlenmesi daha önce tarif edilmiş olmasına rağmen1, karaciğerin düşük erime noktalı agaroz30 (Şekil 1) içine gömülmesi, organ koruyucu bir tampon ile birlikte vibratom üzerinde optimum kesme koşullarını mümkün kılarak doku hasarını azaltacak ve kesit kalınlığında tekrarlanabilirliği artıracaktır. İnce kesitler daha fazla hücre katmanının besinlere ve oksijene31 erişmesine izin verdiği ve hücre ölümünü azalttığı için doku kalınlığı kritiktir. Ancak çok ince olan kesitlerin homojen bir şekilde kesilmesi zorlaşır. Tersine, 400 μm'den daha kalın dilimler, daha düşük bir besin penetrasyon oranı gösterecektir. Bölümler, bir insert (Şekil 1) kullanılarak bir sıvı-hava arayüzünde inkübe edildi ve bir çalkalayıcı üzerinde 37 ° C'de% 5 CO2 ve% 21 O2 ile inkübe edildi. Bölümler, hasadı takip eden 3 saat içinde bir kültür ortamında inkübe edilmelidir, bundan sonra hücre ölümü hızla gerçekleşir32.
PCLS'nin canlılığını belirlemek için, hücre canlılığı 4,5-dimetiltiyazol-2-il)-5- (3-karboksimetoksifenil) -2- (4-sülfofenil) -2H-tetrazolyum (MTS) testi ile değerlendirildi, bu da NAD (P) H'ye bağımlı dehidrojenazlar, yani metabolik olarak aktif hücreler, MTS'yi azaltmak için. MTS değerleri, ilgili dilim ağırlığına göre normalize edilmiştir. PCLS canlılığını optimize etmek için, 24 saatlik inkübasyondan sonra canlılığı sürdürmek için minimum hacimde bir kültür ortamı gerekliydi. 24 oyuklu plakada 0.7 mL'lik bir hacim, 12 oyuklu plakada 1.5 mL ve 6 oyuklu plakada 2.6 mL'ye kıyasla TMS tahlili ile canlılıkta önemli bir azalma gösterdi (p = 0.02) (Şekil 2A). Bu hacimler, bölümlerin hafifçe kaplanmasına izin verecek şekilde seçilmiştir, ancak kullanılan eklerin ve plakaların türüne bağlı olarak ayarlanması gerekebilir. Diğerleri gibi33, 12 oyuklu plakalar, daha küçük bir kültür ortamı hacminde optimal sağkalım için en iyi uzlaşma olarak kullanılır.
Çalkalamak önemlidir ve inkübasyondan 24 saat sonra statik bir kültüre kıyasla PCLS canlılığını %50 artırır (Şekil 2B). Çalkalama, transwell'lerin kullanımıyla optimize edilmiş kritik bir hava-sıvı arayüzü oluşturur ve bölümün her iki yüzüne de besin maddelerine ve oksijene erişim sağlar. Oksijen ve besin maddelerinin alımı, aynı zamanda transwell zarından geçen çalkalama hareketinin yarattığı sürekli akış ile de artar.
MTS testi, 1 saatlik inkübasyondan inkübasyonun 6. gününe kadar değerlendirildi. Hücre canlılığı, 6. günde önemli bir azalma (p = 0.05) gözlemlemeden önce inkübasyon sonrası 0. günden 4. güne kadar sabit kaldı (Şekil 2C). Hematoksilen ve eozin (H&E) boyaması ile değerlendirilen PCLS morfolojisi, inkübasyondan 5 gün sonrasına kadar safra kanallarında ve mimarisinde herhangi bir değişiklik göstermedi (Şekil 3A-D). 0. gün (Şekil 3A) ile karşılaştırıldığında, PCLS inkübasyon sonrası 1. gün (Şekil 3B) ve 2. gün (Şekil 3C) histolojik fark göstermedi, nükleer hiperkromazi, hafif inflamatuar infiltrat, inkübasyon sonrası 5. günde orta derecede hücre ölümü süreci lehine vakuolizasyon gösterdi (Şekil 3D). Birlikte ele alındığında, bu PCLS kültür protokolü, benzer koşullarda dilimler kullanan çalışmalarla tutarlı olarak en az 4 gün boyunca canlılık sağlar31.

Şekil 1: PCLS oluşturmak için protokolün şematik özeti. Bu rakam34'ten değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: PCLS kültürünün optimize edilmiş protokolü, 5 gün boyunca tatmin edici canlılık göstermektedir. (A) Kuyu boyutunun hücre proliferasyonu üzerindeki etkisi (n = 3). (B) Çalkalamanın hücre proliferasyonu üzerindeki etkisi (koşul başına n = 6). (C) Karaciğer bölümlerinden d0 ila d6 inkübasyon günlerinden MTS Hücre proliferasyon testi (zaman noktası başına n = 5). OD keyfi birim, taze ağırlığı dilimlemek için normalleştirilmiş. Grafikte ortalama ± SS görülmektedir. Eşleşmemiş 2 kuyruklu Student t-testi, ns=anlamlı değil, *p<0.05, **p<0.01. Bu rakam34'ten değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
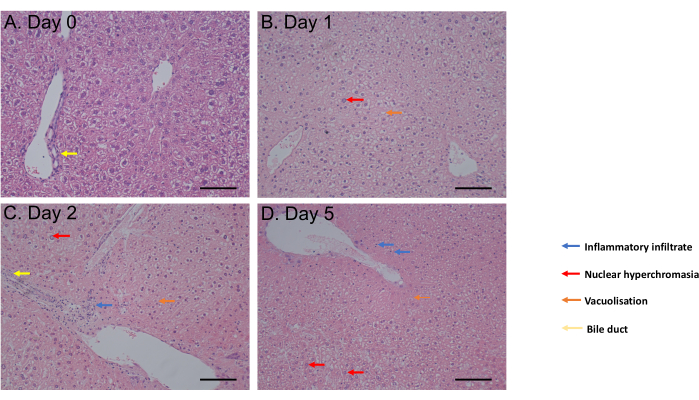
Şekil 3: Histoloji sonuçları. (M.S.) H&E boyamasını takiben karaciğer PCLS histolojisinin temsili görüntüleri. Ölçek çubuğu = 100 μM. Bu rakam34'ten değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
PCLS'nin üretilmesi ve kültürlenmesinin, en az 4 günlük bir yarı ömür sağlarken kolayca elde edilebileceğini gösteriyoruz. Bu protokol beş kritik adımı özetler: bu tür bir vibratom kullanılıyorsa gömme yöntemi, kesmenin oryantasyonu, dinamik bir kültür sistemi, minimum kültür hacmi ve kesici uçların kullanımı.
PCLS'nin üretimi ve kültürü için protokoller yaygın olarak mevcuttur. Bununla birlikte, standardizasyondan yoksundurlar; Protokolün benzer ve belirli noktalarına odaklanabilirler, ancak basit bir şekilde veya temel bir vibratoma erişimi olan çoğu laboratuvarda çoğaltılması zor olabilir. Vibratom veya doku dilimleyici türleri geniştir. Entegre bir soğutma sistemine sahip olup olmama gibi maliyet ve teknik özellikler açısından farklılık göstereceklerdir, ancak ortak özellikleri, salınımlı bir tıraş bıçağı kullanan kesme sistemleridir. Dilimleme dokuları ile ilgili temel fark, gömme gerekliliğidir. Bariz nedenlerden ve gömmenin canlılık üzerindeki etkisinden dolayı, ideal olarak kaçınılmalıdır. Ekleme gerektirmeyen bir başvuru dilimleyici örneği, Krumdieck dilimleyici35'tir. Bu tip dilimleyici, bir çekirdek kullanılırken dokunun soğutulmuş bir tamponda kesilmesine izin vererek, gömmeyi önlerken eşit boyutta dilimler üretir. Bununla birlikte, bu tür cihazlar, daha temel vibratomlardan daha maliyetli olma eğilimindedir ve çoğu laboratuvarda daha az yaygın olarak kullanılır veya bulunur. Bu protokolde kullanılana benzer vibratomlar, kimyasal olarak sabitlenmiş dokuların kesilmesi için zaten mevcut olma eğilimindedir, ancak karaciğer loblarının gömülmesini gerektirecektir. Bazıları, karaciğer dilimlerinin kesilmesinin, benzer bir vibratom1 gömülmeden ve kullanılmadan elde edilebileceğini göstermiştir; Bununla birlikte, deneyimlerimize göre, bunun yeniden üretilmesinin zor olduğu kanıtlanmıştır. Ayrıca, bu tip vibratom kullanılırken, 3D destekleyici agaroz jeli olmadan karaciğer dilimleme, hasarlı dilimlere ve eşit olmayan kalınlığa neden olur ve bu nedenle hücre ölümünü artırır. Bu protokol, karaciğer lobunun sagittal yerine enine kesilmesini içerir. Kesme adımı, ustalaşması zor bir tekniktir ve bildiğimiz kadarıyla, kesme yönü asla üzerinde durulmayan önemli bir ayrıntıdır. Kesme sırasında lobun oryantasyonu, karaciğer üzerindeki baskıyı azaltırken kesme işlemini büyük ölçüde kolaylaştırabilir. Hidrojel kullanımı da gelişmiş bir fayda olarak düşünülebilir36.
Bir sonraki önemli kriter, canlılığı artırmak için daha yüksek hacimlerde kültüre duyulan ihtiyaçtır. Daha fazla besin sağlamak ve daha fazla toksik safra asidi ürününü seyreltmek için daha yüksek hacimler önerilmiştir37. Çalkalama ile dinamik bir sistem eklemek ve Transwells kullanımı ile birleştirmek, sabit bir akış oluşturarak bölümün her iki yüzüne besin maddelerine ve potansiyel olarak oksijene erişimi iyileştirir 18,38,39. Transwell kullanımı ve dinamik bir sistemin avantajı, insan tümörü karaciğer dilimi yanıtları28 ve fibrozunmodellenmesi 26,27 gibi farklı bağlamlarda zaten kanıtlanmıştır. Bu protokol, avantajlarını daha geniş bir fizyolojik açıdan doğrular.
Williams' Medium E, PCLS40,41 için standart bir hücre kültürü ortamı olarak yaygın olarak seçilir. Glikoz ve serum ile takviye edilmiş ortam, dilimlerin42 canlılığını ve işlevselliğini korumada potansiyel fayda ile tanımlanmıştır. Ortamdaki glikoz konsantrasyonu genellikle 4 nM ila 36 nM arasında değişir43,44, ancak daha yüksek glikoz konsantrasyonunun canlılık veya oksidatif yanıt üzerindeki etkisi konusunda bir fikir birliği bulunamamıştır. İnsülin veya deksametazon35 ilavesinin uzun vadeli canlılığı iyileştirdiği iddia edilmektedir, ancak bu tür takviyelerin eklenmesi potansiyel olarak canlılık üzerinde aşağı yönlü bir etki ile ikincil insülin direncini indükleyebileceğinden bir fikir birliğine varılmamıştır45 .
Önceki veriler, 200 μm'den daha ince kesitlerin homojen olarak kesilmesinin zorlaştığını ve oksidatif stres gösterebileceğini, 400 μm'den daha kalın dilimlerin ise besin maddelerinin düşük penetrasyon oranını gösterdiğini göstermektedir 18,19,46. Ayrıca, PCLS görünümüne, doku üzerindeki etkilere ve kesme kolaylığına bağlı olarak 250 μm'lik bir kalınlık tercih edilir. Besinlerin veya terapötik ajanın PCLS'nin iç hücre katmanlarına nüfuzu, dinamik sistemin bir parçası olarak transwelller kullanılarak da büyük ölçüde iyileştirilmiştir 18,32. Bir maça kesme sisteminin entegrasyonu yoluyla eşit boyutta dilimler üretme avantajına sahip olan Krumdieck dilimleyicinin kullanılmasının aksine, protokol, dilimleme sonrası dilimlerin eşit boyutlarda yeniden boyutlandırılmasıyla uyarlanabilir. Bununla birlikte, boyut, ağırlık veya protein içeriğindeki değişkenlik deneyde ve bunun kültür ortamı üzerindeki etkisi ve dolayısıyla canlılık ve biyobelirteçler üzerindeki etkisi dikkate alınmalıdır. Bu nedenle, MTA tahlil okumaları, bu protokol kullanılırken, her dilimin taze ağırlığına normalleştirilir. Ayrıca, kalınlık heterojenliği gözlemlenebilir, ancak ne yazık ki, her tür dilimleyici kullanılarak gözlemlenmesi muhtemeldir. Kullanıcı, yönlerini değerlendirerek en az homojen dilimleri atmayı düşünebilir, ancak bu hala güvenilmez bir seçenek olarak kabul edilir ve PCTS'nin bir dezavantajı olmaya devam eder. Bu modelle ilişkili ana sınırlama, göreceli kısa vadeli uygulanabilirlik olmaya devam etmektedir, ancak halihazırda yayınlanmışolan 24,31 zaman çerçevesi içinde kalmaktadır. Bu canlılığı artırmak için oksijen mevcudiyeti arttırılabilir. Daha önce yayınlanmış bazı protokoller, metabolizmayı yukarı regüle eden ve daha uzun canlılık sağlayan karmaşık kültür ortamı ve %80'den yüksek oksijen konsantrasyonu gerektiriyordu 1,24,35,38. PCLS'yi oksijenlendirmek için kullanılan oksijen seviyelerini ve hücre hatlarını kültürlemek için kullanılan oksijen seviyelerini doğrudan karşılaştırmak da zordur. Oksijenin PCLS fizyolojisi üzerindeki etkilerine ilişkin veriler çok sınırlıdır18,47 ve daha yüksek oksijen konsantrasyonunun toksik reaktif oksijen türleri oluşturarak patofizyolojiyi ve fenotipi önemli ölçüde değiştirmesi muhtemeldir48.
Sonuç olarak, kısa ömürlü PCLS sınırlı ekipmanla üretilebilir ve güvenilir bir ex vivo model olarak kullanılabilir. Doku mimarisi karaciğer fizyolojisinde çok önemlidir ve PCLS'nin korunmasına izin vermesi, bu modelin neden daha yaygın bir şekilde düşünülmesi gerektiğinin bir başka örneğidir. Bu nedenle, hassas kesilmiş dilimler, bilimsel araştırmalarda daha tanınmış bir araç haline gelmelidir.
Açıklamalar
Açıklanacak herhangi bir rekabet menfaati yoktur.
Teşekkürler
Yazarlar, Mirabela Bandol, Samantha Richards, Louise Fisher, Rebecca Towns ve UCL Biyolojik Hizmetler personeline hayvan kolonilerinin yetiştirilmesi ve bakımı konusundaki yardımları için teşekkür eder. Bu çalışma, Birleşik Krallık Tıbbi Araştırma Konseyi Klinisyen Bilim İnsanı Bursu MR / T008024/1 (JB) ve NIHR Great Ormond Street Hastanesi Biyomedikal Araştırma Merkezi (JB) tarafından finanse edilerek desteklenmiştir. İfade edilen görüşler yazar(lar)a aittir ve NHS veya NIHR'nin görüşleri olmak zorunda değildir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
Referanslar
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır