Method Article
تقنية محسنة ومبسطة لإنتاج واستزراع شرائح الكبد المقطوعة بدقة
In This Article
Summary
بروتوكول لإنتاج واستزراع شرائح الكبد الدقيقة (PCLS) لدراسة كبد الفئران. تركز المقالة على الجوانب الرئيسية للبروتوكول ، والتي لا تتطلب سوى معدات مختبرية قياسية مع إمكانية الوصول إلى الاهتزاز وتسمح ببقاء PCLS لمدة 4 أيام على الأقل.
Abstract
يقدم هذا البروتوكول نظاما بسيطا لإنشاء واستزراع شرائح الكبد المقطوعة بدقة (PCLS). يحتوي PCLS على جميع الخلايا في بيئة سليمة ، وبالتالي فهو يشبه نموذجا صغيرا للعضو بأكمله. إنها تمكن من دراسة الأنسجة الحية مع تكرار أنماطها الظاهرية المعقدة. يسمح هذا البروتوكول بإعداد شرائح من كبد الفأر باستخدام اهتزاز ومعدات مختبرية قياسية. تفتقر بروتوكولات إنتاج وزراعة PCLS إلى التوحيد القياسي ويمكن أن تختلف بشكل كبير اعتمادا على الأنسجة ذات الاهتمام ونوع الاهتزاز المستخدم والحاجة إلى الأكسجين. قد يكون من الصعب تكاثرها في بعض المختبرات التي لا يمكنها الوصول إلا إلى مرافق الاهتزاز الأساسية ومرافق زراعة الأنسجة المشتركة. لقد وضعنا بروتوكولا يركز على أهمية بعض الخطوات الرئيسية ضمن البروتوكولات المتنوعة المتاحة بالفعل. لذلك ، يؤكد هذا البروتوكول على أهمية طريقة التضمين ، واتجاه القطع ، والنظام الديناميكي مقابل النظام الثابت ، وأهمية الحد الأدنى من حجم الثقافة. يمكن إنشاء هذا البروتوكول وإعادة إنتاجه بطريقة بسيطة في معظم المختبرات التي يمكنها الوصول إلى قطاعة الأنسجة الأساسية. مجتمعة واتباع هذا البروتوكول ، يمكن أن تظل PCLS على قيد الحياة لمدة لا تقل عن 4 أيام. PCLS هو نموذج بسيط واقتصادي وقابل للتكرار لدراسة الفحص الفيزيولوجي المرضي والعلاجي لأعضاء مثل الكبد.
Introduction
شرائح الأنسجة المقطوعة بدقة (PCTS) هي أقسام رقيقة من الأعضاء. إنها تسمح بالحفاظ على بنية العضو ، وتكرار عضو صغير مع الحفاظ على الجانب ثلاثي الأبعاد للخلايا المجاورة والمصفوفة خارج الخلية. إنه نموذج جذاب نظرا لسهولة الوصول إليه ، وتوفير التكاليف ، وخصائصه الأقل كثافة في العمالة مع الحفاظ على بنية الأنسجة.
تملأ معاهدة التعاون بشأن البراءات الفجوة بين دراسات الخلايا في المختبر والبحوث الحيوانية في الجسم الحي ، وتتغلب على معظم عيوب كلا النموذجين. تم إنشاء PCTS من أعضاء مختلفة ، مثل الكبد1 ، والأمعاء2،3 ، والقولون2 ، والدماغ4،5 ، والرئة6،7،8 ، والكلى9،10 ، والطحال11،12 ، والقلب13،14 ولكن أيضا الأورام15،16. يمكن أن تنشأ أيضا من مختلفة ، مثل الفأر1 والجرذ17،18 ولكن أيضا الخنزير19 والنفايات الجراحية البشرية15،20،21. وعلى الرغم من أن معاهدة التعاون بشأن البراءات تتطلب استخدام، مما يعني ضمنا مسائل أخلاقية ذات صلة، فإن العضو من واحد يمكن أن يولد معاهدة التعاون بشأن البراءات متعددة، مما يقلل من عدد بما يتفق مع المبادئ التوجيهية NC3Rs (الاختزال والاستبدال والتنقيح)22 مع الحد من الاختلافات بين الأفراد.
سمح تطوير تقطيع الأنسجة المحسنة ، على سبيل المثال ، الاهتزازات23 ، بالانتقال من الشرائح المقطوعة يدويا التي تتميز بسماكة غير متجانسة ومعدل بقاء ضعيف إلى شرائح أرق قابلة للتكرار مع سلامة هيكلية محفوظة بشكل أفضل.
ومع ذلك، فإن بروتوكولات معاهدة التعاون بشأن البراءات، وبشكل أكثر تحديدا، إعداد شرائح الكبد المقطوعة بدقة (PCLS) وثقافتها تختلف اختلافا كبيرا في الأدبيات وتفتقر إلى التوحيد القياسي، لا سيما بالنسبة للمعلمات الأساسية مثل معدات التقطيع والمحتوى المتوسط وظروف الاستزراع. يمكن أن تختلف البروتوكولات أيضا بشكل ملحوظ اعتمادا على الأنسجة الأصلية. ستتطلب بعض البروتوكولات أكسجة المخزن المؤقت أو الثقافة مع بعض أنظمة المفاعلات الحيوية المعقدة24. عادة ما تركز بشكل فردي على جوانب تقنية مختلفة أو مصممة لأنسجة مختلفة ويمكن أن تكون مكلفة وأكثر صعوبة في التكاثر في المختبر العادي بطريقة فعالة من حيث التكلفة.
هنا ، يجمع هذا البروتوكول بعض النقاط الرئيسية مثل طريقة التضمين ، واتجاه القطع ، واستخدام الآبار25 ، ونظام الاستزراع الديناميكي26 ، وأهمية الحد الأدنى من حجم الثقافة. تم تحسين بعض هذه الخطوات سابقا بشكل مستقل أو في سياق مختلف ، مثل التليف27 أو استجابة الورم28. يؤكد هذا البروتوكول أيضا على أهمية التضمين باستخدام أنواع معينة من القطاعات واتجاه القطع ، وكلاهما معلمان يصعب إتقانه وغالبا ما يتم إهماله في الأدبيات. تولد هذه الطريقة البسيطة PCLS يتم الاحتفاظ بها في المزرعة لمدة لا تقل عن 4 أيام مع سهولة الإعداد واستخدام معدات المختبر القياسية مع إمكانية الوصول إلى قطاعة الأنسجة البدائية.
Protocol
تم شراء الفئران CD57Bl / 6J من النوع البري من مختبرات نهر تشارلز. كان للفئران حرية الوصول إلى الطعام والماء ، وتوجد في أقفاص جيدة التهوية بشكل فردي مع ظروف درجة حرارة ورطوبة يتم التحكم فيها وبدورة ضوئية مدتها 12 ساعة. تم التضحية بالحيوانات التي تبلغ أعمارها 3 أسابيع ، وتم حصاد الكبد على الفور دون نضح. تمت الموافقة على جميع الأعمال الحيوانية بعد المراجعة الأخلاقية المحلية من قبل مجلس رعاية والمراجعة الأخلاقية في كلية لندن الجامعية وتم إجراؤها بموجب ترخيص مشروع وزارة الداخلية PP9223137 ووفقا لقانون الإجراءات العلمية لوزارة الداخلية () (1986) وإرشادات ARRIVE. تم بذل جميع الجهود للحد من الضرر الذي يلحق بالحيوانات وفقا للممارسة المعتادة في وحدة الخدمات البيولوجية في كلية لندن الجامعية.
1. الإعداد للتجربة
- في اليوم السابق للحصاد ، قم بتنفيذ الخطوات التالية.
- قم بإعداد 1 لتر من عازلة Krebs-Henseleit (KREBS) عن طريق إذابة قارورة واحدة من مسحوق Krebs في 1 لتر من الماء المعقم. قم بتبريده إلى 4 درجات مئوية واحتفظ به على الثلج الرطب.
- تطهير الدرج بنسبة 70٪ من الإيثانول واشطفه باستخدام PBS معقم. احتفظ بالصينية ملفوفة بورق قصدير في الثلاجة طوال الليل للمساعدة في الحفاظ على بيئة باردة أثناء التقطيع.
- رش جميع الأجزاء الأخرى القابلة للإزالة بالإيثانول ، واشطفها باستخدام PBS معقم ، واتركها حتى تجف ، واحتفظ بها معقمة. قم بتعقيم الشفرات واحتفظ بها معقمة حتى الاستخدام.
- تحضير 4٪ وزن / حجم من الاغاروز منخفض الذوبان في ماء معقم. بمجرد إعادة تعليقه وذوانه ، قم بتخزين الاغاروز في الثلاجة على حرارة 4 درجات مئوية.
- في يوم الحصاد وقبل حصاد الكبد ، قم بتنفيذ الخطوات التالية.
- قم بإذابة 4٪ من الاغاروز منخفض الذوبان واحتفظ به في حمام مائي عند 37 درجة مئوية حتى الاستخدام. تأكد من أن الاغاروز قد برد إلى 37 درجة مئوية وأن جميع الفقاعات قد تبددت قبل الاستخدام.
- قم بإعداد ألواح الاستزراع بإضافة 2.6 مل و 1.5 مل و 0.7 مل لكل بئر على التوالي في 6 و 12 و 24 لوحا جيدا. أضف 8 ميكرومتر إدخالات مسامية لكل بئر. ضع الألواح في حاضنة رطبة مضبوطة على 37 درجة مئوية ، و 5٪ ثاني أكسيد الكربون2 ، و 21٪ O2 . سيساعد ذلك في ضبط الرقم الهيدروجيني أثناء تسخين الوسائط ، بحيث تكون جاهزة للثقافة.
- قم بزراعة الشرائح بإدخالات مسامية 8 ميكرومتر للسماح بالوصول إلى وجهي الشريحة. قم بإعداد الوسائط على النحو التالي: أضف إلى William's Medium E (WME) ، مكمل 2 ملي مولار L-glutamine ، 10٪ مصل بقري للجنين (FBS) ، 100 U / مل بنسلين ، و 100 ميكروغرام / مل ستربتومايسين ، 10 ميكروغرام / مل جنتامايسين ، 25 ملي مولار محلول D-Glucose و 15 ملي مولار محلول HEPES.
2. جمع الكبد والتحضير (15 دقيقة)
- تعقيم جميع الأدوات قبل الحصاد.
- تخدير الفأر وفقا للإجراءات المحلية لرعاية للأغراض العلمية باستخدام قناع الأيزوفلوران. قبل فتح تجويف البطن ، اضغط بين أصابع القدم للتأكد من تخدير بشكل صحيح. إذا كان من الممكن إزالة الكبد بسرعة ، فيمكن القتل الرحيم للفأر عن طريق اختناق ثاني أكسيد الكربون2 أو خلع عنق الرحم. نظرا لأن الإجراء هو إجراء نهائي ، فلا تستخدم مرهم العين لأن هذا لن يؤثر على.
- رش البطن بنسبة 70٪ من الإيثانول. اختياري: احلق الماوس لمنع التلوث بالشعر.
- افتح تجويف البطن بملقط ومقص معقم عن طريق قطع الجلد والصفاق من منتصف البطن. قم بتشريح الكبد برفق من الأعضاء أو الأوعية الأخرى وتجنب إتلاف الفصوص.
- قم بتخزين الكبد بالكامل على الفور في Krebs Buffer المثلج. قم بتنفيذ جميع الخطوات الإضافية على الجليد عند 4 درجات مئوية وانتقل إلى تحضير الكبد في أسرع وقت ممكن لمنع المزيد من موت الخلايا.
3. تضمين فصوص الكبد (25 دقيقة لكل فص كبد)
- انقل الكبد إلى طبق بتري على ثلج يحتوي على عازلة كريبس المثلجة ، مع التأكد من أن الكبد كله مغمور بالكامل.
- افصل كل فص على حدة باستخدام ملقط حاد وسكين حاد ومعقم لتجنب إتلاف الفصوص.
- اختر الفص الأول للتقسيم واحتفظ بالفصوص المتبقية في مخزن كريبس البارد حتى تصبح جاهزة للتضمين والتقطيع.
- قم بقص جميع الحواف للحصول على فص أكثر قابلية للإدارة مع حواف مستقيمة جاهزة للتضمين. سيساعد هذا أيضا في إزالة بعض كبسولة جليسون الليفية لتسهيل التقسيم بشكل أكبر. افعل ذلك مع الحفاظ على أسطح الكبد رطبة في عازلة كريبس المثلجة.
- ضع طبق بتري مقاس 3 سم (أو ما شابه) على الثلج الرطب واسكب فيه 4٪ من الاغاروز منخفض الذوبان (بالفعل في حمام مائي 37 درجة مئوية). حافظ جيدا على الجليد للسماح للأغروز بالتبريد في اتجاه تصاعدي مع منع الفص من الغرق في القاع وتضمينه بشكل موحد.
- اترك الاغاروز ليبرد أكثر لمدة 30 ثانية وضع الفص المشذب فيه. سوف يستقر الفص في منتصف كتلة الاغاروز. تتطلب عملية التضمين الممارسة والتحسين لتناسب كل حالة معملية وتجربة شخصية.
- ضع الفص المدمج ، الذي لا يزال على الثلج ، في الثلاجة لمدة 5 دقائق. يجب بعد ذلك ضبط الاغاروز بوضوح.
- قطع الجزء الخارجي من كتلة الاغاروز. قم بإزاحة كتلة الاغاروز من الطبق.
- قم بقص الاغاروز إلى حجم أكثر قابلية للإدارة ، مع التأكد من أن الجانب العلوي والجانب الملتصق بمنصة الاهتزاز موازيان للحافة العلوية للفص.
- ابدأ عملية التقطيع في أسرع وقت ممكن ولكن تأكد من حفظ كتلة الاغاروز في مخزن كريبس بارد وعلى الجليد.
4. إنتاج شرائح الكبد (40 دقيقة لكل فص)
- اضبط الاهتزاز للقطع بسمك 250 ميكرومتر ، بسرعة 5 وتردد 7 هرتز. هذه هي المعايير التوجيهية. اعتمادا على نوع الاهتزاز المستخدم، قد يتطلب ذلك تحسينا.
- رش مناطق الاهتزاز ومقاعد البدلاء بنسبة 70٪ من الإيثانول قبل القطع للحفاظ على البيئة معقمة قدر الإمكان.
- ضع الصينية على الاهتزاز واسكب الثلج حولها. ضع الشفرات على الاهتزاز بزاوية 10 درجات لأسفل وأقل أفقيا.
- املأ خزان الاهتزاز بمحلول كريبس المثلج. ضع طبقة رقيقة من غراء سيانواكريليت على المنصة.
- جفف حافة كتلة الاغاروز التي سيتم لصقها على المنصة باستخدام نسيج ماص معقم.
- ضع كتلة الاغاروز على المنصة القابلة للإزالة. ضع الفص في وضع مستقيم للسماح بقطعه بشكل عرضي. على الرغم من تقليل حجم الشرائح ، إلا أن هذا يسهل عملية القطع بشكل كبير عن طريق الحد من الضغط على الفص أثناء القطع.
- انتظر 1 دقيقة حتى يتم تثبيت الغراء وغمرها في الخزان والتأكد من تغطية كتلة الاغاروز بالكامل بمخزن Krebs.
- قم ببرمجة الاهتزاز للقطع عن طريق ضبط وضعيتي البدء والإيقاف. ابدأ في تقطيع الشرائح السميكة في البداية حتى يتم الوصول إلى فص الكبد.
- تخلص من الشريحة الأولى ، حيث قد لا يتم قطعها إلى السماكة المناسبة. لتجنب إتلاف الشرائح ، استخدم ملعقة لجمع شرائح الكبد بدلا من الملقط أو الفرش.
ملاحظة: يمكن أيضا استخدام فرشاة صغيرة مطهرة بنسبة 70٪ من الإيثانول وشطفها ب PBS معقم لتوجيه الأنسجة برفق أثناء عملية القطع. - كرر العملية حتى يتم الوصول إلى العدد المطلوب من الشرائح. قد يزيح الفص نفسه أحيانا من الاغاروز ، مما يمنع المزيد من الاستخدام. اجمع الشرائح في عازلة كريبس المثلجة حتى الزراعة.
5. حضانة شرائح الكبد
- انقل الشرائح باستخدام ملعقة إلى الآبار المحضرة التي تحتوي على الوسائط والإدخالات.
- ضع الألواح على شاكر مداري ، واضبط السرعة على 130 دورة في الدقيقة ، واحتضن باستخدام حاضنة زراعة الخلايا التقليدية مع 5٪ CO2 و 21٪ O2 عند 37 درجة مئوية. الحجم النهائي للاستزراع هو 2.6 مل و 1.5 مل و 0.7 مل لكل بئر في ألواح 6 و 12 و 24 بئرا على التوالي.
- ضع طبقا فارغا واحدا أسفل لوحة الثقافة التي تحتوي على الشرائح في المزرعة للسماح بتبديد أي حرارة زائدة تنشأ من منصة شاكر. قم بتغيير الوسيط كل 48 ساعة.
6. اختبار بقاء الخلية
- انقل الشرائح إلى صفيحة مكونة من 48 بئرا تحتوي على 400 ميكرولتر من وسائط ويليامز المتوسطة E الكاملة الدافئة مسبقا وأضف 80 ميكرولتر من MTS (3- (4،5-ثنائي ميثيل ثيازول -2-يل) -5- (3-كربوكسي ميثوكسي فينيل) -2- (4-سلفوفينيل) -2H-tetrazolium).
- بعد الحضانة لمدة ساعة واحدة عند 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2 على شاكر ، انقل 200 ميكرولتر من الوسائط إلى صفيحة 96 بئرا ، وقم بقياس الامتصاص عند 490 نانومتر باستخدام قارئ لوحة متعدد الآبار. استخدم الشرائح المتبقية على المقعد في PBS وفي درجة حرارة الغرفة لمدة 24 ساعة كعناصر تحكم سلبية.
7. تلطيخ الأنسجة
- قم بإزالة البارافينات وإعادة ترطيب الأقسام باستخدام الزيلين والإيثانول ، متبوعا بالماء منزوع الأيونات. تلطيخ الأقسام بمحلول الهيماتوكسيلين لمدة 3 دقائق.
- اشطفه بالماء منزوع الأيونات لمدة 5 دقائق. اغمس بسرعة 10 مرات في الإيثانول الحمضي (1 مل من حمض الهيدروكلوريك المركز و 400 مل من 70٪ إيثانول).
- اشطف 2x في الماء منزوع الأيونات وامسح الماء الزائد. اغمس الأقسام في Eosin لمدة 30 ثانية.
- يجفف إلى 95٪ إيثانول ، ثم 100٪ إيثانول لمدة 5 دقائق ، 3 مرات لكل منهما. اغمس الأقسام في الزيلين 3x لمدة 15 دقيقة لكل منهما. ضع أغطية على الشرائح.
النتائج
عند الحصاد ، يتم حذف نضح عن قصد لضمان المعالجة السريعة للعضو ومنع تلف الأعضاء. يتم استخراج الكبد بسرعة بعد الشق ووضعه على الفور في مخزن مؤقت واقي للأعضاء مثلج ، على سبيل المثال ، عازلة كريبس24،29. على الرغم من أن تقطيع أنسجة الكبد الطازجة دون التضمين قد تم وصفهسابقا 1 ، فإن تضمين الكبد في agarose30 منخفض الذوبان (الشكل 1) جنبا إلى جنب مع عازلة واقية للأعضاء سيمكن من ظروف القطع المثلى على الاهتزاز ، مما يقلل من تلف الأنسجة ويزيد من قابلية التكاثر في سمك القسم. سمك الأنسجة أمر بالغ الأهمية لأن المقاطع الرقيقة تسمح لمزيد من طبقات الخلايا بالوصول إلى العناصر الغذائية والأكسجين31 وتقليل موت الخلايا. ومع ذلك ، يصبح من الصعب قطع الأقسام الرقيقة جدا بشكل متجانس. على العكس من ذلك ، ستظهر الشرائح التي يزيد سمكها عن 400 ميكرومتر معدل اختراق أقل للعناصر الغذائية. تم احتضان الأقسام في واجهة هواء سائل باستخدام ملحق (الشكل 1) واحتضانها بنسبة 5٪ ثاني أكسيد الكربون2 و 21٪ O2 عند 37 درجة مئوية على شاكر. يجب تحضين الأقسام في وسط استزراع في غضون 3 ساعات بعد الحصاد ، وبعد ذلك يحدث موت الخلايا بسرعة32.
لتحديد جدوى PCLS ، تم تقييم صلاحية الخلية عن طريق اختبار 4،5-dimethylthiazol-2-yl) -5- (3-carboxymethoxyphenyl) -2- (4-sulfophenyl) -2H-tetrazolium (MTS) ، والذي يتطلب نازعة الهيدروجين المعتمدة على NAD (P) H ، أي الخلايا النشطة الأيضية ، لتقليل MTS. تم تطبيع قيم MTS إلى وزن الشريحة المعنية. لتحسين جدوى PCLS ، كان الحد الأدنى من حجم وسط الاستزراع ضروريا للحفاظ على الجدوى بعد 24 ساعة من الحضانة. أظهر حجم 0.7 مل في 24 لوحة بئر انخفاضا كبيرا في الجدوى بواسطة مقايسة TMS (ص = 0.02) مقارنة ب 1.5 مل في 12 لوحة بئر و 2.6 مل في 6 ألواح آبار (الشكل 2 أ). تم اختيار هذه المجلدات للسماح بتغطية الأقسام قليلا ، ولكنها قد تحتاج إلى تعديل اعتمادا على نوع الإدخالات واللوحات المستخدمة. مثل33 ، يتم استخدام 12 لوحة بئر أخرى كأفضل حل وسط للبقاء الأمثل ضمن حجم أصغر من وسط الاستزراع.
يعد الاهتزاز أمرا ضروريا ويزيد من قابلية بقاء PCLS بنسبة 50٪ بعد 24 ساعة من الحضانة مقارنة بالثقافة الثابتة (الشكل 2 ب). يخلق الاهتزاز واجهة هواء سائلة مهمة ، محسنة باستخدام الآبار ، مما يسمح بالوصول إلى العناصر الغذائية والأكسجين لكلا وجهي القسم. يزداد امتصاص الأكسجين والمواد المغذية أيضا من خلال التدفق المستمر الناتج عن حركة الاهتزاز ، والتي تمر أيضا عبر غشاء الجيدات.
تم تقييم اختبار MTS من حضانة 1 ساعة حتى اليوم 6 من الحضانة. ظلت صلاحية الخلية ثابتة من اليوم 0 إلى اليوم 4 بعد الحضانة قبل ملاحظة انخفاض كبير (ص = 0.05) في اليوم 6 (الشكل 2 ج). لم يظهر مورفولوجيا PCLS التي تم تقييمها بواسطة تلطيخ الهيماتوكسيلين والأيوزين (H & E) عدم وجود تغيير في القنوات الصفراوية والهندسة المعمارية حتى 5 أيام بعد الحضانة (الشكل 3A-D). بالمقارنة مع اليوم 0 (الشكل 3 أ) ، لم تظهر PCLS أي اختلاف نسيجي في اليوم 1 (الشكل 3 ب) واليوم 2 (الشكل 3 ج) بعد الحضانة ، مع فرط اللون النووي ، والتسلل الالتهابي الخفيف ، والتفريغ لصالح عملية موت الخلايا المعتدلة في اليوم 5 بعد الحضانة (الشكل 3 د). مجتمعة ، يتيح بروتوكول ثقافة PCLS هذا الجدوى لمدة 4 أيام على الأقل ، بما يتفق مع الدراسات التي تستخدم شرائح في ظروف مماثلة31.

الشكل 1: تخطيطي يلخص بروتوكول إنشاء PCLS. تم تعديل هذا الرقم من34. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: يظهر البروتوكول الأمثل لثقافة PCLS قابلية مرضية لمدة 5 أيام. (أ) تأثير حجم البئر على تكاثر الخلايا (ن = 3). (ب) تأثير الاهتزاز على تكاثر الخلايا (ن = 6 لكل حالة). (ج) اختبار تكاثر الخلايا MTS من أقسام الكبد من d0 إلى d6 أيام من الحضانة (ن = 5 لكل نقطة زمنية). وحدة تعسفية OD ، تطبيع لشريحة الوزن الجديد. يوضح الرسم البياني متوسط ± SD. اختبار t للطالب ثنائي الذيل غير المقترن ، ns = غير مهم ، * ص <0.05 ، ** ص <0.01. تم تعديل هذا الرقم من34. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
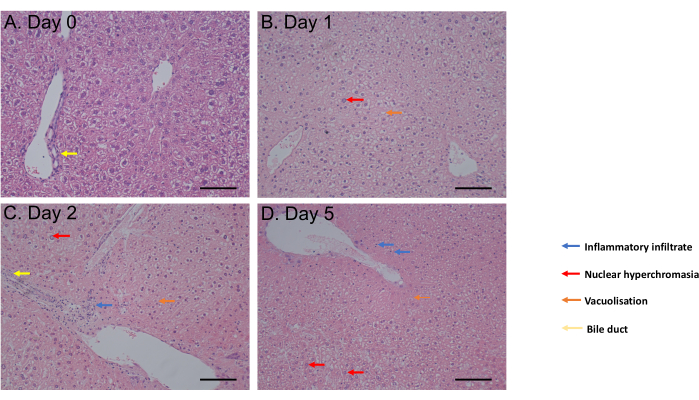
الشكل 3: نتائج الأنسجة. (أ-د) صور تمثيلية لأنسجة PCLS الكبدية بعد تلطيخ H& E. شريط المقياس = 100 ميكرومتر. تم تعديل هذا الرقم من34. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نحن نثبت أنه يمكن تحقيق إنتاج وزراعة PCLS بسهولة مع ضمان عمر نصف لا يقل عن 4 أيام. يلخص هذا البروتوكول خمس خطوات حاسمة: طريقة التضمين إذا تم استخدام هذا النوع من الاهتزاز ، واتجاه القطع ، ونظام ديناميكي للثقافة ، والحد الأدنى من حجم الثقافة ، واستخدام الإدخالات.
تتوفر بروتوكولات إنتاج وثقافة PCLS بشكل شائع. ومع ذلك ، فهي تفتقر إلى التوحيد القياسي. قد يركزون على نقاط متشابهة ومحددة من البروتوكول ولكن قد يكون من الصعب تكرارها بطريقة بسيطة أو في معظم المختبرات التي يمكنها الوصول إلى اهتزاز أساسي. أنواع الاهتزازات أو تقطيع الأنسجة واسعة. ستختلف في التكلفة والخصائص الفنية ، مثل وجود نظام تبريد متكامل أم لا ، ولكن ميزتها المشتركة هي نظام القطع الخاص بها باستخدام شفرة حلاقة متذبذبة. الفرق الرئيسي فيما يتعلق بتقطيع الأنسجة هو متطلبات التضمين. لأسباب واضحة وتأثير التضمين على الجدوى ، يجب تجنبه بشكل مثالي. أحد الأمثلة على مقسم التقطيع المرجعي الذي لا يتطلب التضمين هو قطاعة Krumdieck35. يسمح هذا النوع من القطاعة بقطع الأنسجة في مخزن مؤقت مبرد أثناء استخدام قلب ، مما ينتج عنه شرائح متساوية الحجم مع تجنب التضمين. ومع ذلك ، يميل هذا الجهاز إلى أن يكون أكثر تكلفة من الاهتزازات الأساسية وأقل استخداما أو توفرا في معظم المختبرات. تميل الاهتزازات مثل تلك المستخدمة في هذا البروتوكول إلى أن تكون متاحة بالفعل لقطع الأنسجة الثابتة كيميائيا ولكنها تتطلب تضمين فصوص الكبد. أظهر البعض أنه يمكن تحقيق قطع شرائح الكبد دون تضمين واستخدام اهتزازمماثل 1 ؛ ومع ذلك ، في تجربتنا ، ثبت أنه من الصعب إعادة إنتاجه. أيضا ، أثناء استخدام هذا النوع من الاهتزاز ، يتسبب تقطيع الكبد بدون هلام الاغاروز الداعم ثلاثي الأبعاد إلى تلف الشرائح وسمك غير متساو ، وبالتالي يزيد من موت الخلايا. يتضمن هذا البروتوكول قطع فص الكبد بشكل عرضي بدلا من السهمية. خطوة القطع هي تقنية يصعب إتقانها ، وعلى حد علمنا ، فإن اتجاه القطع هو تفاصيل مهمة لا يتم التركيز عليها أبدا. يمكن أن يؤدي اتجاه الفص أثناء القطع إلى تسهيل عملية القطع بشكل كبير مع تقليل الضغط على الكبد. يمكن أيضا اعتبار استخدام الهيدروجيل فائدة محسنة36.
المعيار المهم التالي هو الحاجة إلى كميات أكبر من الثقافة لزيادة الجدوى. تم بالفعل اقتراح كميات أكبر لتوفير المزيد من العناصر الغذائية وتخفيف منتجات الأحماض الصفراوية الأكثر سمية37. تؤدي إضافة نظام ديناميكي مع الاهتزاز وجنبا إلى جنب مع استخدام Transwells على تحسين الوصول إلى العناصر الغذائية وربما الأكسجين إلى كلا وجهي القسم من خلال إنشاء تدفق ثابت18،38،39. تم بالفعل إثبات استخدام transwell وميزة النظام الديناميكي في سياقات مختلفة ، مثل استجابات شريحة الكبد للورم البشري28 ونمذجة التليف26،27. يؤكد هذا البروتوكول ميزتها في الجانب الفسيولوجي الأوسع.
يتم اختيار ويليامز Medium E بشكل شائع كوسيط قياسي لزراعة الخلايا لPCLS 40،41. تم وصف الوسائط المكملة بالجلوكوز والمصل ذات الفائدة المحتملة في الحفاظ على صلاحية ووظائف الشرائح42. عادة ما يتراوح تركيز الجلوكوز في الوسط بين 4 نانومتر إلى 36 نانومتر43،44 ، ولكن لم يتم العثور على إجماع على تأثير تركيز الجلوكوز العالي على الجدوى أو الاستجابة التأكسدية. يزعم أن إضافة الأنسولين أو ديكساميثازون35 يحسن قابلية البقاء على المدى الطويل ، ولكن لم يتم التوصل إلى توافق في الآراء لأن إضافة هذه المكملات يمكن أن تحفز مقاومة الأنسولين الثانوية مع تأثير نهائي على الجدوى45 .
تظهر البيانات السابقة أن الأجزاء الأرق من 200 ميكرومتر يصعب قطعها بشكل متجانس ويمكن أن تظهر إجهادا تأكسديا ، بينما تظهر الشرائح التي يزيد سمكها عن 400 ميكرومتر معدل اختراق منخفض للمغذيات18،19،46. أيضا ، بناء على مظهر PCLS ، والتأثيرات على الملمس ، وسهولة القطع ، يفضل سمك 250 ميكرومتر. كما تم تحسين تغلغل العناصر الغذائية أو العامل العلاجي في طبقات الخلايا الداخلية ل PCLS بشكل كبير باستخدام الآبار كجزء من النظام الديناميكي 18،32. على عكس استخدام قطاعة Krumdieck التي تتميز بإنتاج شرائح متساوية الحجم من خلال دمج نظام القطع الأساسي ، يمكن تكييف البروتوكول عن طريق تغيير حجم الشرائح بأبعاد متساوية بعد التقطيع. ومع ذلك ، يجب مراعاة التباين في الحجم أو الوزن أو محتوى البروتين في التجربة وتأثيره على بيئة الاستزراع ، وبالتالي على الجدوى والمؤشرات الحيوية. لهذا السبب ، يتم تطبيع قراءات اختبار MTA ، أثناء استخدام هذا البروتوكول ، إلى الوزن الجديد لكل شريحة. أيضا ، يمكن ملاحظة عدم تجانس السماكة ، ولكن لسوء الحظ ، من المحتمل أن يتم ملاحظته باستخدام جميع أنواع القطاعات. يمكن للمستخدم التفكير في التخلص من الشرائح الأقل تجانسا من خلال تقييم جانبها ، لكن هذا لا يزال يعتبر خيارا غير موثوق به ويظل عيبا في معاهدة التعاون بشأن البراءات. يظل القيد الرئيسي المرتبط بهذا النموذج هو الجدوى النسبية على المدى القصير ، لكنه يقع ضمن الإطار الزمني المنشور بالفعل24،31. يمكن تعزيز توافر الأكسجين لزيادة هذه الجدوى. تتطلب بعض البروتوكولات المنشورة سابقا وسائط ثقافة معقدة وتركيز أكسجين أعلى من 80٪ ، مما يؤدي إلى تنظيم عملية التمثيل الغذائي وتوفير صلاحية أطول1،24،35،38. من الصعب أيضا مقارنة مستويات الأكسجين المستخدمة في أكسجة مركبات الكربون الكلورية متعددة الكلور ومستويات الأكسجين المستخدمة في زراعة خطوط الخلايا. البيانات المتعلقة بتأثيرات الأكسجين على فسيولوجيا PCLS محدودة للغاية18،47 ، ومن المرجح أن يؤدي تركيز الأكسجين العالي إلى تعديل الفيزيولوجيا المرضية والنمط الظاهري بشكل كبير عن طريق توليد أنواع الأكسجين التفاعلية السامة48.
في الختام ، يمكن إنتاج PCLS قصيرة العمر بمعدات محدودة واستخدامها كنموذج موثوق به خارج الجسم الحي . تعد بنية الأنسجة أمرا بالغ الأهمية في فسيولوجيا الكبد ، ويعد PCLS الذي يسمح بالحفاظ عليه مثالا آخر على سبب وجوب النظر في هذا النموذج بطريقة أكثر انتشارا. لذلك ، يجب أن تصبح الشرائح المقطوعة بدقة أداة أكثر شهرة في البحث العلمي.
Disclosures
لا توجد مصالح متنافسة يجب الكشف عنها.
Acknowledgements
يشكر المؤلفون ميرابيلا باندول وسامانثا ريتشاردز ولويز فيشر وريبيكا تاونز والموظفين من UCL Biological Services لمساعدتهم في تربية وصيانة مستعمرات. تم دعم هذا العمل بتمويل من زمالة العلماء السريريين لمجلس البحوث الطبية في المملكة المتحدة MR / T008024 / 1 (JB) ومركز أبحاث الطب الحيوي في مستشفى جريت أورموند ستريت (JB). الآراء المعبر عنها هي آراء المؤلف (المؤلفين) وليس بالضرورة آراء NHS أو NIHR.
Materials
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
References
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved