Method Article
Tecnica ottimizzata e semplificata per la produzione e la coltura di fette di fegato tagliate con precisione
In questo articolo
Riepilogo
Un protocollo per la produzione e la coltura di fette di fegato tagliate con precisione (PCLS) per lo studio dei fegati di topo. L'articolo si concentra sugli aspetti chiave del protocollo, che richiede solo attrezzature di laboratorio standard con accesso a un vibratomo e consente la sopravvivenza del PCLS per un minimo di 4 giorni.
Abstract
Questo protocollo presenta un sistema semplice per la creazione e la coltura di fette di fegato tagliate con precisione (PCLS). La PCLS contiene tutte le cellule in un ambiente intatto e, quindi, assomiglia a un mini modello dell'intero organo. Consentono lo studio di tessuti vivi replicando i loro fenotipi complessi. Questo protocollo consente la preparazione di fette di fegati di topo utilizzando un vibratomo e attrezzature di laboratorio standard. I protocolli per la produzione e la coltura di PCLS mancano di standardizzazione e possono variare drasticamente a seconda del tessuto di interesse, del tipo di vibratomo utilizzato e della necessità di ossigeno. Questi possono essere difficili da riprodurre in alcuni laboratori che hanno accesso solo a un vibratomo di base e a comuni strutture di coltura tissutale. Abbiamo messo insieme un protocollo incentrato sull'importanza di alcuni passaggi chiave all'interno dei vari protocolli già disponibili. Questo protocollo, quindi, sottolinea l'importanza del metodo di inclusione, l'orientamento del taglio, un sistema dinamico rispetto a uno statico e l'importanza di un volume minimo di coltura. Questo protocollo può essere stabilito e riprodotto in modo semplice nella maggior parte dei laboratori che hanno accesso a un'affettatrice di tessuti di base. Nel suo insieme e seguendo questo protocollo, la PCLS può rimanere in vita per un minimo di 4 giorni. La PCLS è un modello semplice, economico e riproducibile per studiare lo screening fisiopatologico e terapeutico di organi come il fegato.
Introduzione
Le fette di tessuto tagliate con precisione (PCTS) sono sezioni sottili di organi. Consentono la conservazione dell'architettura dell'organo replicando un mini-organo preservando l'aspetto tridimensionale delle cellule vicine e della matrice extracellulare. Si tratta di un modello interessante grazie alla sua facile accessibilità, al risparmio sui costi e alle caratteristiche meno laboriose, preservando al contempo l'architettura dei tessuti.
I PCTS colmano una lacuna tra gli studi su cellule in vitro e la ricerca in vivo sugli animali, superando la maggior parte degli svantaggi di entrambi i modelli. La PCTS è stata generata da vari organi, come il fegato1, l'intestino 2,3, il colon2, il cervello 4,5, il polmone 6,7,8, il rene 9,10, la milza11,12, il cuore13,14 ma anche i tumori15,16. Possono anche provenire da vari animali, come il topo1, il ratto17,18 ma anche il maiale19 e i rifiuti chirurgici umani 15,20,21. Sebbene la PCTS richieda l'uso di animali, il che implica problemi etici correlati, l'organo di un animale può generare più PCTS, riducendo così il numero di animali in accordo con le linee guida NC3Rs (Reduction, Replacement, Refinement)22 limitando al contempo le variazioni interindividuali.
Lo sviluppo di affettatrici tissutali migliorate, ad esempio i vibratomi23, ha permesso una transizione da fette tagliate manualmente caratterizzate da spessore eterogeneo e scarso tasso di sopravvivenza a fette più sottili riproducibili con un'integrità strutturale meglio conservata.
Tuttavia, i protocolli per la PCTS e, più specificamente, la preparazione e la coltura di fette di fegato tagliate con precisione (PCLS) variano in modo significativo in letteratura e mancano di standardizzazione, soprattutto per parametri essenziali come l'attrezzatura per l'affettatura, il contenuto medio e le condizioni di coltura. I protocolli possono anche variare notevolmente a seconda del tessuto di origine. Alcuni dei protocolli richiederanno l'ossigenazione del tampone o della coltura con alcuni complicati sistemi di bioreattori24. Di solito si concentrano individualmente su diversi aspetti tecnici o sono progettati per tessuti diversi e spesso possono essere costosi e più difficili da riprodurre in un laboratorio medio in modo economico.
Qui, questo protocollo mette insieme alcuni punti chiave come il metodo di inclusione, la direzione di taglio, l'uso di transwells25, un sistema di coltura dinamico26 e l'importanza di un volume minimo di coltura. Alcuni di questi passaggi sono stati precedentemente ottimizzati in modo indipendente o in un contesto diverso, come la fibrosi27 o la risposta tumorale28. Questo protocollo sottolinea anche l'importanza dell'incorporamento utilizzando determinati tipi di affettatrici e l'orientamento del taglio, entrambi parametri difficili da padroneggiare e spesso trascurati in letteratura. Questo semplice metodo genera PCLS mantenuti in coltura per un minimo di 4 giorni con una facile configurazione e utilizzando attrezzature di laboratorio standard con accesso a un'affettatrice rudimentale per tessuti.
Protocollo
I topi CD57Bl/6J wild-type sono stati acquistati dai Charles River Laboratories. I topi avevano libero accesso a cibo e acqua, alloggiati in gabbie ventilate individualmente con condizioni di temperatura e umidità controllate e con un ciclo di luce di 12 ore. Gli animali di 3 settimane venivano sacrificati e i fegati venivano prontamente raccolti senza perfusione. Tutti i lavori sugli animali sono stati approvati a seguito di una revisione etica locale da parte dell'University College London Animal Welfare and Ethical Review Board ed eseguiti sotto licenza del Ministero degli Interni PP9223137 e in conformità con l'Home Office (Animals) Scientific Procedures Act (1986) e le linee guida ARRIVE. Sono stati compiuti tutti gli sforzi per limitare i danni agli animali in conformità con la pratica standard presso l'Unità dei servizi biologici dell'University College di Londra.
1. Preparati per l'esperimento
- Il giorno prima della raccolta, eseguire i seguenti passaggi.
- Preparare 1 L di tampone Krebs-Henseleit (KREBS) sciogliendo un flaconcino di polvere di Krebs in 1 L di acqua sterile. Raffreddarlo a 4 °C e tenerlo su ghiaccio bagnato.
- Disinfettare la vaschetta con etanolo al 70% e risciacquare con PBS sterile. Conservare la teglia avvolta nella carta stagnola in frigorifero per una notte per mantenere un ambiente freddo durante il taglio.
- Spruzzare tutte le altre parti rimovibili con etanolo, risciacquare con PBS sterile, lasciare asciugare e mantenerle sterili. Autoclavare le lame in autoclave e mantenerle sterili fino al momento dell'uso.
- Preparare l'agarosio a basso punto di fusione al 4% p/v in acqua sterile. Una volta risospeso e sciolto, conservare l'agarosio in frigorifero a 4 °C.
- Il giorno della raccolta e prima della raccolta del fegato, eseguire i seguenti passaggi.
- Sciogliere l'agarosio al 4% a basso punto di fusione e tenerlo a bagnomaria a 37 °C fino al momento dell'utilizzo. Assicurarsi che l'agarosio si sia raffreddato a 37 °C e che tutte le bolle si siano dissipate prima dell'uso.
- Preparare le piastre di coltura aggiungendo rispettivamente 2,6 mL, 1,5 mL e 0,7 mL per pozzetto in piastre da 6, 12 e 24 pozzetti. Aggiungere inserti porosi da 8 μm a ciascun pozzetto. Posizionare le piastre in un incubatore umidificato impostato a 37 °C, 5% di CO2 e 21% di O2 . Questo aiuterà a regolare il pH mentre si riscalda il terreno, in modo che sia pronto per la coltura.
- Coltiva le fette con inserti porosi da 8 μm per consentire l'accesso a entrambe le facce della fetta. Preparare il terreno come segue: aggiungere al William's Medium E (WME), 2 mM di integratore di L-glutammina, 10% di siero fetale bovino (FBS), 100 U/mL di penicillina e 100 μg/mL di streptomicina, 10 μg/mL di gentamicina, 25 mM di soluzione di D-glucosio e 15 mM di soluzione HEPES.
2. Raccolta del fegato e preparazione (15 min)
- Sterilizzare tutti gli strumenti prima del raccolto.
- Anestetizzare il topo secondo le procedure locali per la cura degli animali per scopi scientifici utilizzando una maschera di isoflurano. Prima di aprire la cavità addominale, pizzicare tra le dita dei piedi per assicurarsi che l'animale sia adeguatamente anestetizzato. Se il fegato può essere rimosso rapidamente, il topo può essere soppresso mediante asfissia da CO2 o lussazione cervicale. Poiché la procedura è una procedura terminale, non usare unguento per gli occhi in quanto ciò non influenzerebbe l'animale.
- Spruzzare l'addome con etanolo al 70%. Opzionale: radere il mouse per evitare la contaminazione con i peli.
- Aprire la cavità addominale con pinze sterili e forbici tagliando la pelle e il peritoneo dal centro dell'addome. Sezionare delicatamente il fegato da altri organi o vasi sanguigni ed evitare di danneggiare i lobi.
- Conservare immediatamente l'intero fegato in Krebs Buffer ghiacciato. Eseguire tutti i passaggi successivi sul ghiaccio a 4 °C e procedere alla preparazione del fegato il più rapidamente possibile per prevenire un'ulteriore morte cellulare.
3. Incorporazione dei lobi epatici (25 minuti per ogni lobo epatico)
- Trasferire il fegato in una capsula di Petri con ghiaccio contenente tampone Krebs ghiacciato, assicurandosi che l'intero fegato sia completamente sommerso.
- Separa ogni lobo individualmente usando una pinza smussata e un coltello affilato e sterile per evitare di danneggiare i lobi.
- Scegli il primo lobo per il sezionamento e conserva i lobi rimanenti in un tampone Krebs ghiacciato fino a quando non sono pronti per l'inclusione e l'affettatura.
- Taglia tutti i bordi per ottenere un lobo più maneggevole con bordi dritti pronti per l'incorporamento. Questo aiuterà anche a rimuovere parte della capsula fibrosa di Glisson per facilitare ulteriormente il sezionamento. Fallo mantenendo le superfici del fegato bagnate in un tampone Krebs ghiacciato.
- Posizionare una capsula di Petri da 3 cm (o simile) su ghiaccio umido e versarvi l'agarosio a basso punto di fusione al 4% (già a bagnomaria a 37 °C). Tenere bene in ghiaccio per consentire all'agarosio di raffreddarsi verso l'alto, evitando che il lobo affondi sul fondo e lo incastri uniformemente.
- Lasciare raffreddare ulteriormente l'agarosio per 30 secondi e inserirvi il lobo tagliato. Il lobo si sistemerà al centro del blocco di agarosio. Il processo di incorporamento richiede pratica e ottimizzazione per adattarsi a ogni condizione di laboratorio ed esperienza personale.
- Mettere il lobo incorporato, ancora sul ghiaccio, in frigorifero per 5 minuti. L'agarosio dovrebbe quindi essere chiaramente fissato.
- Taglia l'esterno del blocco di agarosio. Staccare il blocco di agarosio dal piatto.
- Tagliare l'agarosio in una dimensione più maneggevole, assicurandosi che il lato superiore e il lato incollato alla piattaforma del vibratomo siano paralleli al bordo superiore del lobo.
- Iniziare il processo di affettatura il più rapidamente possibile, ma assicurarsi che il blocco di agarosio sia conservato in un tampone Krebs ghiacciato e sul ghiaccio.
4. Produzione di fette di fegato (40 minuti per lobo)
- Impostare il vibratomo per il taglio a uno spessore di 250 μm, con una velocità di 5 e una frequenza di 7 Hz. Questi sono parametri guida; A seconda del tipo di vibratomo utilizzato, questo potrebbe richiedere un'ottimizzazione.
- Spruzzare il vibratomo e le aree del banco con etanolo al 70% prima del taglio per mantenere l'ambiente il più sterile possibile.
- Posiziona la teglia sul vibratomo e versa del ghiaccio tutto intorno. Posizionare le lame sul vibratomo con un angolo di 10° verso il basso e al di sotto dell'orizzontale.
- Riempire il serbatoio del vibratomo con il tampone Krebs ghiacciato. Posizionare uno strato sottile di colla cianoacrilica sulla piattaforma.
- Asciugare il bordo del blocco di agarosio che verrà incollato sulla piattaforma utilizzando un fazzoletto assorbente sterile.
- Posizionare il blocco di agarosio sulla piattaforma rimovibile. Posizionare il lobo in posizione verticale per consentirne il taglio trasversale. Sebbene la dimensione delle fette sia ridotta, questo facilita drasticamente il processo di taglio limitando la pressione contro il lobo durante il taglio.
- Attendere 1 minuto affinché la colla si solidifichi e immergere la piattaforma rimovibile nel serbatoio e assicurarsi che il blocco di agarosio sia completamente coperto con tampone Krebs.
- Programmare il vibratomo per il taglio impostando le posizioni di avvio e di arresto. Inizia a tagliare inizialmente le fette più spesse fino a raggiungere il lobo del fegato.
- Scartare la prima fetta, poiché potrebbe non essere tagliata allo spessore corretto. Per evitare di danneggiare le fette, usa una spatola per raccogliere le fette di fegato invece di pinze o spazzole.
NOTA: Una piccola spazzola disinfettata con etanolo al 70% e risciacquata con PBS sterile può essere utilizzata anche per guidare delicatamente il tessuto durante il processo di taglio. - Ripetere il processo fino a raggiungere il numero di fette richiesto. Il lobo potrebbe occasionalmente staccarsi dall'agarosio, impedendone un ulteriore utilizzo. Raccogli le fette nel tampone Krebs ghiacciato fino alla cottura.
5. Incubazione di fette di fegato
- Trasferire le fette, con l'aiuto di una spatola, nei pozzetti preparati contenenti il terreno e gli inserti.
- Posizionare le piastre su un agitatore orbitale, impostare la velocità a 130 giri/min e incubare utilizzando un incubatore per colture cellulari convenzionale con il 5% di CO2 e il 21% di O2 a 37 °C. Il volume finale di coltura è di 2,6 mL, 1,5 mL e 0,7 mL per pozzetto in piastre da 6, 12 e 24 pozzetti, rispettivamente.
- Posizionare una piastra vuota sotto la piastra di coltura contenente le fette di coltura per consentire la dissipazione del calore eccessivo proveniente dalla piattaforma dell'agitatore. Cambiare il supporto ogni 48 ore.
6. Saggio di sopravvivenza cellulare
- Trasferire le fette in una piastra a 48 pozzetti contenente 400 μl di terreno completo Williams' Medium E preriscaldato e aggiungere 80 μl di reagente MTS (3-(4,5-dimetiltiazol-2-il)-5-(3-carbossimetossifenil)-2-(4-solfofenil)-2H-tetrazolio) tetrazolio.
- Dopo l'incubazione per 1 ora a 37 °C, il 5% di CO2 su un agitatore, trasferire 200 μL di terreno in una piastra a 96 pozzetti e misurare l'assorbanza a 490 nm utilizzando un lettore di piastre a più pozzetti. Utilizzare le fette lasciate sul banco in PBS e a temperatura ambiente per 24 h come controlli negativi.
7. Colorazione istologica
- Deparaffinare e reidratare le sezioni utilizzando xilene ed etanolo, seguiti da acqua deionizzata. Colorare le sezioni con la soluzione di ematossilina per 3 minuti.
- Risciacquare con acqua deionizzata per 5 min. Immergere rapidamente 10 volte in etanolo acido (1 mL di HCL concentrato e 400 mL di etanolo al 70%).
- Sciacquare 2 volte in acqua deionizzata e asciugare l'acqua in eccesso. Immergere le sezioni in Eosin per 30 s.
- Disidratare in etanolo al 95%, quindi in etanolo al 100% per 5 minuti, 3 volte ciascuno. Immergere le sezioni nello xilene 3 volte per 15 minuti ciascuna. Posizionare i vetrini coprioggetti sui vetrini.
Risultati
Al momento del prelievo, la perfusione dell'animale viene volutamente omessa per garantire una rapida elaborazione dell'organo e prevenire danni agli organi. Il fegato viene estratto rapidamente dopo l'incisione e immediatamente posto in un tampone protettivo per organi ghiacciato, ad esempio il tampone Krebs24,29. Sebbene l'affettatura del tessuto epatico fresco senza inclusione sia stata precedentemente descritta1, l'inclusione del fegato nell'agarosio30 a basso punto di fusione (Figura 1) combinata con un tampone protettivo per organi consentirà condizioni di taglio ottimali sul vibratomo, riducendo il danno tissutale e aumentando la riproducibilità nello spessore della sezione. Lo spessore dei tessuti è fondamentale in quanto le sezioni sottili consentono a più strati cellulari di accedere ai nutrienti e all'ossigeno31 e riducono la morte cellulare. Tuttavia, le sezioni troppo sottili diventano difficili da tagliare in modo omogeneo. Al contrario, fette più spesse di 400 μm mostreranno un tasso di penetrazione inferiore dei nutrienti. Le sezioni sono state incubate in un'interfaccia liquido-aria utilizzando un inserto (Figura 1) e incubate con il 5% di CO2 e il 21% di O2 a 37 °C su un agitatore. Le sezioni devono essere incubate in un terreno di coltura entro 3 ore dalla raccolta, dopodiché la morte cellulare avviene rapidamente32.
Per determinare la vitalità del PCLS, la vitalità cellulare è stata valutata mediante il saggio 4,5-dimetiltiazol-2-il)-5-(3-carbossimetossifenil)-2-(4-sulfofenil)-2H-tetrazolio (MTS), che richiede NAD(P)H-dipendenti deidrogenasi, cioè cellule metabolicamente attive, per ridurre l'MTS. I valori di MTS sono stati normalizzati al rispettivo peso della fetta. Per ottimizzare la vitalità del PCLS, un volume minimo di terreno di coltura era essenziale per sostenere la vitalità dopo 24 ore di incubazione. Un volume di 0,7 mL in piastre a 24 pozzetti ha mostrato una significativa riduzione della vitalità mediante saggio TMS (p = 0,02) rispetto a 1,5 mL in piastre a 12 pozzetti e 2,6 mL in piastre a 6 pozzetti (Figura 2A). Questi volumi sono stati scelti per consentire una leggera copertura delle sezioni, ma potrebbero richiedere una regolazione a seconda del tipo di inserti e piastre utilizzate. Come le altrepiastre da 33 e 12 pozzetti sono utilizzate come il miglior compromesso per una sopravvivenza ottimale all'interno di un volume inferiore di terreno di coltura.
L'agitazione è essenziale e aumenta la vitalità del PCLS del 50% a 24 ore dopo l'incubazione rispetto a una coltura statica (Figura 2B). L'agitazione crea un'interfaccia aria-liquido critica, ottimizzata con l'uso di pozzetti trans, consentendo l'accesso ai nutrienti e all'ossigeno su entrambe le facce della sezione. L'assorbimento di ossigeno e sostanze nutritive è aumentato anche dal flusso costante creato dal movimento di scuotimento, che passa anche attraverso la membrana del pozzetto.
Il test MTS è stato valutato da 1 ora di incubazione fino al giorno 6 di incubazione. La vitalità cellulare è rimasta costante dal giorno 0 al giorno 4 dopo l'incubazione prima di osservare una diminuzione significativa (p = 0,05) al giorno 6 (Figura 2C). La morfologia PCLS valutata mediante colorazione con ematossilina ed eosina (H&E) non ha mostrato alcun cambiamento dei dotti biliari e dell'architettura fino a 5 giorni dopo l'incubazione (Figura 3A-D). Rispetto al giorno 0 (Figura 3A), la PCLS non ha mostrato differenze istologiche al giorno 1 (Figura 3B) e al giorno 2 (Figura 3C) dopo l'incubazione, con ipercrostia nucleare, lieve infiltrato infiammatorio, vacuolizzazione a favore di un moderato processo di morte cellulare al giorno 5 dopo l'incubazione (Figura 3D). Nel complesso, questo protocollo di coltura PCLS consente la vitalità per almeno 4 giorni, in linea con gli studi che utilizzano fette in condizioni simili31.

Figura 1: Schema riassuntivo del protocollo per la generazione di PCLS. Questa cifra è stata modificata da34. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Il protocollo ottimizzato della coltura PCLS mostra una vitalità soddisfacente per 5 giorni. (A) Effetto della dimensione del pozzetto sulla proliferazione cellulare (n=3). (B) Effetto dello scuotimento sulla proliferazione cellulare (n=6 per condizione). (C) Saggio di proliferazione cellulare MTS da sezioni di fegato da d0 a d6 giorni di incubazione (n=5 per punto temporale). Unità arbitraria OD, normalizzata per affettare il peso fresco. Il grafico mostra la media ± SD. Test t dello studente a 2 code non accoppiato, ns = non significativo, *p<0.05, **p<0.01. Questa cifra è stata modificata da34. Clicca qui per visualizzare una versione più grande di questa figura.
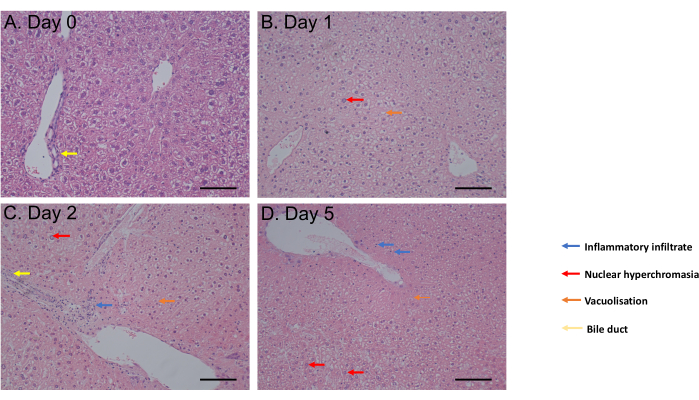
Figura 3: Risultati istologici. (A-D) Immagini rappresentative dell'istologia del PCLS epatico dopo la colorazione H&E. Barra di scala = 100 μM. Questa cifra è stata modificata da34. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Dimostriamo che la produzione e la coltura di PCLS possono essere facilmente ottenute garantendo un'emivita di almeno 4 giorni. Questo protocollo ricapitola cinque passaggi critici: il metodo di inclusione se si utilizza questo tipo di vibratomo, l'orientamento del taglio, un sistema dinamico di coltura, un volume minimo di coltura e l'uso di inserti.
I protocolli per la produzione e la coltura di PCLS sono comunemente disponibili. Tuttavia, mancano di standardizzazione; Potrebbero concentrarsi su punti simili e specifici del protocollo, ma possono essere difficili da replicare in modo semplice o nella maggior parte dei laboratori che hanno accesso a un vibratomo di base. I tipi di vibratomi o affettatrici di fazzoletti sono ampi. Variano in termini di costi e specificità tecniche, come avere o meno un sistema di raffreddamento integrato, ma la loro caratteristica comune è il loro sistema di taglio che utilizza una lama di rasoio oscillante. La differenza principale per quanto riguarda l'affettatura dei fazzoletti è il requisito per l'inclusione. Per ovvie ragioni e per l'impatto dell'integrazione sulla redditività, l'ideale sarebbe evitarlo. Un esempio di affettatrice di riferimento che non richiede l'incorporamento è l'affettatrice Krumdieck35. Questo tipo di affettatrice consente di tagliare il tessuto in un tampone raffreddato utilizzando un'anima, producendo fette di dimensioni uniformi evitando l'inclusione. Tuttavia, tali apparecchi tendono ad essere più costosi dei vibratomi più semplici e meno comunemente usati o disponibili nella maggior parte dei laboratori. I vibratomi come quello utilizzato in questo protocollo tendono ad essere già disponibili per il taglio di tessuti fissati chimicamente, ma richiedono l'inclusione dei lobi epatici. Alcuni hanno dimostrato che il taglio di fette di fegato può essere ottenuto senza l'incorporazione e utilizzando un vibratomo simile1; Tuttavia, nella nostra esperienza, questo si è rivelato difficile da riprodurre. Inoltre, durante l'utilizzo di questo tipo di vibratomo, l'affettamento del fegato senza un gel di agarosio di supporto 3D provoca fette danneggiate e spessore irregolare e, quindi, aumenta la morte cellulare. Questo protocollo prevede il taglio del lobo epatico trasversalmente anziché agittalmente. La fase di taglio è una tecnica difficile da padroneggiare e, per quanto ne sappiamo, l'orientamento del taglio è un dettaglio importante su cui non ci si concentra mai. L'orientamento del lobo durante il taglio può facilitare drasticamente il processo di taglio riducendo la pressione sul fegato. Anche l'uso dell'idrogel potrebbe essere considerato un vantaggio migliore36.
Il prossimo criterio importante è la necessità di volumi più elevati di coltura per aumentare la vitalità. È già stato suggerito che volumi più elevati forniscano più nutrienti e diluiscano i prodotti a base di acidi biliari più tossici37. L'aggiunta di un sistema dinamico con scuotimento e combinato con l'uso di Transwells migliora l'accesso ai nutrienti e potenzialmente all'ossigeno su entrambe le facce della sezione creando un flusso costante 18,38,39. L'uso di transwell e il vantaggio di un sistema dinamico sono già stati dimostrati in diversi contesti, come le risposte della fetta di fegato del tumore umano28 e per la modellazione della fibrosi26,27. Questo protocollo conferma il loro vantaggio in un aspetto fisiologico più ampio.
Il terreno E di Williams è comunemente scelto come terreno di coltura cellulare standard per PCLS40,41. Sono stati descritti terreni integrati con glucosio e siero con potenziali benefici nel preservare la vitalità e la funzionalità delle fette42. La concentrazione di glucosio nei terreni di solito varia tra 4 nM e 36 nM43,44, ma non è stato trovato consenso sull'effetto di una maggiore concentrazione di glucosio sulla vitalità o sulla risposta ossidativa. Si sostiene che l'aggiunta di insulina o desametasone35 migliori la vitalità a lungo termine, ma non è stato raggiunto alcun consenso in quanto l'aggiunta di tali integratori potrebbe potenzialmente indurre insulino-resistenza secondaria con un effetto a valle sulla vitalità45 .
I dati precedenti mostrano che le sezioni più sottili di 200 μm diventano difficili da tagliare in modo omogeneo e possono mostrare stress ossidativo, mentre le fette più spesse di 400 μm mostrano un basso tasso di penetrazione dei nutrienti 18,19,46. Inoltre, in base all'aspetto del PCLS, agli effetti sulla consistenza e alla facilità di taglio, è preferito uno spessore di 250 μm. Anche la penetrazione dei nutrienti o dell'agente terapeutico negli strati cellulari interni del PCLS è notevolmente migliorata utilizzando i transwell come parte del sistema dinamico 18,32. A differenza dell'utilizzo dell'affettatrice Krumdieck che ha il vantaggio di produrre fette di dimensioni uniformi attraverso l'integrazione di un sistema di taglio a nucleo, il protocollo può essere adattato ridimensionando le fette in uguali dimensioni dopo l'affettatura. Tuttavia, nell'esperimento deve essere considerata la variabilità delle dimensioni, del peso o del contenuto proteico e il suo impatto sull'ambiente di coltura e, quindi, sulla vitalità e sui biomarcatori. Per questo motivo, le letture del test MTA, pur utilizzando questo protocollo, vengono normalizzate al peso fresco di ciascuna fetta. Inoltre, si può osservare un'eterogenicità dello spessore, ma sfortunatamente è probabile che si osservi utilizzando tutti i tipi di affettatrici. L'utente potrebbe prendere in considerazione l'idea di scartare le fette meno omogenee valutandone l'aspetto, ma questa è ancora considerata un'opzione inaffidabile e rimane uno svantaggio del PCTS. Il principale limite associato a questo modello rimane la relativa redditività a breve termine, ma rientra nell'orizzonte temporale già pubblicato24,31. La disponibilità di ossigeno potrebbe essere migliorata per aumentare tale vitalità. Alcuni protocolli pubblicati in precedenza richiedevano terreni di coltura complessi e una concentrazione di ossigeno superiore all'80%, sovraregolando il metabolismo e fornendo una vitalità più lunga 1,24,35,38. È anche difficile confrontare direttamente i livelli di ossigeno utilizzati per ossigenare PCLS e i livelli di ossigeno utilizzati per coltivare linee cellulari. I dati sugli effetti dell'ossigeno sulla fisiologia della PCLS sono molto limitati18,47 ed è probabile che una maggiore concentrazione di ossigeno modifichi sostanzialmente la fisiopatologia e il fenotipo generando specie tossiche reattive dell'ossigeno48.
In conclusione, i PCLS di breve durata possono essere prodotti con attrezzature limitate e utilizzati come modello ex vivo affidabile. L'architettura dei tessuti è fondamentale nella fisiologia del fegato e la PCLS che ne consente la conservazione è un altro esempio del motivo per cui questo modello dovrebbe essere considerato in modo più prevalente. Le fette tagliate con precisione dovrebbero, quindi, diventare uno strumento più riconosciuto nella ricerca scientifica.
Divulgazioni
Non vi è alcun interesse concorrente da divulgare.
Riconoscimenti
Gli autori ringraziano Mirabela Bandol, Samantha Richards, Louise Fisher, Rebecca Towns e lo staff dell'UCL Biological Services per il loro aiuto nell'allevamento e nel mantenimento delle colonie animali. Questo lavoro è stato sostenuto da finanziamenti del Medical Research Council del Regno Unito Clinician Scientist Fellowship MR/T008024/1 (JB) e del NIHR Great Ormond Street Hospital Biomedical Research Centre (JB). Le opinioni espresse sono quelle dell'autore o degli autori e non necessariamente quelle del NHS o del NIHR.
Materiali
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
Riferimenti
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon