Method Article
Técnica otimizada e simplificada para a produção e cultura de fatias de fígado cortadas com precisão
Neste Artigo
Resumo
Um protocolo para a produção e cultura de fatias de fígado cortadas com precisão (PCLS) para o estudo de fígados de camundongos. O artigo enfoca os principais aspectos do protocolo, que requer apenas equipamento de laboratório padrão com acesso a um vibratomo e permite a sobrevivência do PCLS por um período mínimo de 4 dias.
Resumo
Este protocolo apresenta um sistema simples para a criação e cultura de fatias de fígado cortadas com precisão (PCLS). O PCLS contém todas as células em um ambiente intacto e, portanto, se assemelha a um mini modelo de todo o órgão. Eles permitem o estudo de tecidos vivos enquanto replicam seus fenótipos complexos. Este protocolo permite a preparação de fatias de fígados de camundongos usando um vibratomo e equipamento de laboratório padrão. Os protocolos para produção e cultura de PCLS carecem de padronização e podem variar drasticamente dependendo do tecido de interesse, do tipo de vibratomo usado e da necessidade de oxigênio. Estes podem ser difíceis de reproduzir em alguns laboratórios que têm apenas acesso a um vibratomo básico e instalações comuns de cultura de tecidos. Reunimos um protocolo com foco na importância de algumas etapas-chave dentro dos vários protocolos já disponíveis. Este protocolo, portanto, enfatiza a importância do método de embutimento, a orientação do corte, um sistema dinâmico versus estático e a relevância de um volume mínimo de cultura. Este protocolo pode ser estabelecido e reproduzido de maneira simples na maioria dos laboratórios que têm acesso a um fatiador de tecido básico. Tomados em conjunto e seguindo este protocolo, o PCLS pode permanecer vivo por um período mínimo de 4 dias. O PCLS é um modelo simples, econômico e reprodutível para estudar a triagem fisiopatológica e terapêutica de órgãos como o fígado.
Introdução
Fatias de tecido cortadas com precisão (PCTS) são seções finas de órgãos. Eles permitem a preservação da arquitetura do órgão replicando um mini-órgão, preservando o aspecto tridimensional das células vizinhas e da matriz extracelular. É um modelo atraente devido ao seu fácil acesso, economia de custos e características menos trabalhosas, preservando a arquitetura do tecido.
O PCTS preenche uma lacuna entre os estudos celulares in vitro e a pesquisa animal in vivo, superando a maioria das desvantagens de ambos os modelos. A PCTS foi gerada a partir de vários órgãos, como fígado1, intestinos 2,3, cólon2, cérebro 4,5, pulmão 6,7,8, rim 9,10, baço11,12, coração13,14 mas também tumores15,16. Eles também podem se originar de vários animais, como camundongo1, rato17,18, mas também porco19 e resíduos cirúrgicos humanos 15,20,21. Embora os PCTS exijam o uso de animais, implicando em questões éticas, o órgão de um animal pode gerar múltiplos PCTS, reduzindo assim o número de animais de acordo com as diretrizes NC3Rs (Redução, Substituição, Refinamento)22 e limitando as variações interindividuais.
O desenvolvimento de fatiadores de tecido aprimorados, por exemplo, vibratomos23, permitiu uma transição de fatias cortadas manualmente caracterizadas por espessura heterogênea e baixa taxa de sobrevivência para fatias mais finas reprodutíveis com integridade estrutural mais bem preservada.
No entanto, os protocolos para PCTS e, mais especificamente, preparação e cultura de fatias de fígado de corte de precisão (PCLS) variam significativamente na literatura e carecem de padronização, especialmente para parâmetros essenciais, como equipamento de fatiamento, teor de meio e condições de cultura. Os protocolos também podem variar visivelmente dependendo do tecido de origem. Alguns dos protocolos exigirão oxigenação do tampão ou cultura com alguns sistemas complicados de biorreatores24. Eles geralmente se concentram individualmente em diferentes aspectos técnicos ou são projetados para diferentes tecidos e muitas vezes podem ser caros e mais difíceis de reproduzir no laboratório médio de maneira econômica.
Aqui, este protocolo reúne alguns pontos-chave, como o método de incorporação, a direção do corte, o uso de transpoços25, um sistema de cultura dinâmico26 e a importância de um volume mínimo de cultura. Algumas dessas etapas foram previamente otimizadas de forma independente ou em um contexto diferente, como fibrose27 ou resposta tumoral28. Este protocolo também enfatiza a importância da incorporação usando certos tipos de fatiadores e a orientação do corte, que são parâmetros difíceis de dominar e muitas vezes negligenciados na literatura. Este método simples gera PCLS mantido em cultura por um período mínimo de 4 dias com uma configuração fácil e usando equipamento de laboratório padrão com acesso a um cortador de tecido rudimentar.
Protocolo
Camundongos CD57Bl / 6J do tipo selvagem foram comprados da Charles River Laboratories. Os camundongos tiveram livre acesso a comida e água, alojados em gaiolas ventiladas individualmente com condições controladas de temperatura e umidade e com um ciclo de luz de 12 h. Animais com 3 semanas de idade foram sacrificados e os fígados foram prontamente colhidos sem perfusão. Todo o trabalho com animais foi aprovado após revisão ética local pelo Conselho de Revisão Ética e Bem-Estar Animal da University College London e realizado sob a licença de projeto do Home Office PP9223137 e de acordo com a Lei de Procedimentos Científicos do Home Office (Animais) (1986) e as diretrizes ARRIVE. Todos os esforços foram feitos para limitar os danos aos animais de acordo com a prática padrão da Unidade de Serviços Biológicos da University College London.
1. Prepare-se para o experimento
- No dia anterior à colheita, execute as seguintes etapas.
- Prepare 1 L de tampão Krebs-Henseleit (KREBS) dissolvendo um frasco de pó de Krebs em 1 L de água estéril. Arrefecer até 4 °C e mantê-lo sobre gelo húmido.
- Desinfete a bandeja com etanol a 70% e enxágue com PBS estéril. Mantenha a bandeja embrulhada em papel alumínio na geladeira durante a noite para ajudar a manter um ambiente frio durante o corte.
- Pulverize todas as outras partes removíveis com etanol, enxágue com PBS estéril, deixe secar e mantenha-as estéreis. Autoclave as lâminas e mantenha-as estéreis até o uso.
- Prepare agarose de baixo ponto de fusão a 4% p / v em água estéril. Depois de ressuspensa e derretida, conservar a agarose no frigorífico a 4 °C.
- No dia da colheita e antes da colheita do fígado, execute as seguintes etapas.
- Derreta a agarose de baixo ponto de fusão a 4% e mantenha-a em banho-maria a 37 °C até o uso. Certifique-se de que a agarose esfriou até 37 °C e que todas as bolhas se dissiparam antes de usar.
- Prepare as placas de cultura adicionando, respectivamente, 2,6 mL, 1,5 mL e 0,7 mL por poço em placas de 6, 12 e 24 poços. Adicione inserções porosas de 8 μm a cada poço. Coloque as placas em uma incubadora umidificada ajustada para 37 °C, 5% de CO2 e 21% de nível de O2 . Isso ajudará a ajustar o pH enquanto aquece o meio, para que esteja pronto para a cultura.
- Cultivar as fatias com insertos porosos de 8 μm para permitir o acesso a ambas as faces da fatia. Prepare o meio da seguinte forma: Adicione ao meio de William E (WME), suplemento de L-glutamina 2 mM, soro bovino fetal (FBS) a 10%, penicilina 100 U / mL e estreptomicina 100 μg / mL, 10 μg / mL de gentamicina, solução de D-glicose 25 mM e solução de HEPES 15 mM.
2. Coleta de fígado e preparação (15 min)
- Esterilize todos os instrumentos antes da colheita.
- Anestesiar o camundongo de acordo com os procedimentos locais para o cuidado de animais para fins científicos, usando uma máscara de isoflurano. Antes de abrir a cavidade abdominal, aperte entre os dedos dos pés para garantir que o animal esteja devidamente anestesiado. Se o fígado puder ser removido rapidamente, o camundongo pode ser sacrificado por asfixia por CO2 ou luxação cervical. Como o procedimento é um procedimento terminal, não use pomada para os olhos, pois isso não afetaria o animal.
- Pulverize o abdômen com etanol 70%. Opcional: Raspe o mouse para evitar contaminação com pelos.
- Abra a cavidade abdominal com pinças e tesouras estéreis, cortando a pele e o peritônio do meio do abdômen. Disseque o fígado suavemente de outros órgãos ou vasos e evite danificar os lobos.
- Armazene todo o fígado imediatamente em Krebs Buffer gelado. Execute todas as etapas seguintes no gelo a 4 °C e prossiga para a preparação do fígado o mais rápido possível para evitar mais morte celular.
3. Incorporação dos lobos do fígado (25 min para cada lobo do fígado)
- Transfira o fígado para uma placa de Petri no gelo contendo tampão Krebs gelado, certificando-se de que todo o fígado esteja totalmente submerso.
- Separe cada lóbulo individualmente usando uma pinça romba e uma faca afiada e estéril para evitar danificar os lóbulos.
- Escolha o primeiro lóbulo para seccionar e mantenha os lóbulos restantes em um tampão Krebs gelado até que estejam prontos para serem incorporados e fatiados.
- Corte todas as bordas para obter um lóbulo mais gerenciável com bordas retas prontas para incorporação. Isso também ajudará a remover parte da cápsula fibrosa de Glisson para facilitar ainda mais o seccionamento. Faça isso mantendo as superfícies do fígado molhadas em um tampão Krebs gelado.
- Coloque uma placa de Petri de 3 cm (ou similar) sobre gelo úmido e despeje a agarose de baixo ponto de fusão a 4% (já em banho-maria a 37 ° C). Mantenha bem no gelo para permitir que a agarose esfrie para cima, evitando que o lóbulo afunde e incorpore-o uniformemente.
- Deixe a agarose esfriar ainda mais por 30 s e coloque o lóbulo aparado nela. O lóbulo se acomodará no meio do bloco de agarose. O processo de incorporação requer prática e otimização para se adequar a todas as condições de laboratório e experiência pessoal.
- Coloque o lóbulo embutido, ainda no gelo, na geladeira por 5 min. A agarose deve então ser claramente definida.
- Corte a parte externa do bloco de agarose. Desaloje o bloco de agarose do prato.
- Corte a agarose em um tamanho mais manejável, garantindo que o lado superior e o lado colado à plataforma do vibratomo fiquem paralelos à borda superior do lóbulo.
- Inicie o processo de fatiamento o mais rápido possível, mas certifique-se de que o bloco de agarose seja mantido em um tampão Krebs gelado e no gelo.
4. Produção de fatias de fígado (40 min por lóbulo)
- Defina o vibratomo para corte com uma espessura de 250 μm, com uma velocidade de 5 e uma frequência de 7 Hz. Esses são parâmetros orientadores; Dependendo do tipo de vibratomo usado, isso pode exigir otimização.
- Pulverize as áreas do vibratomo e da bancada com etanol 70% antes de cortar para manter o ambiente o mais estéril possível.
- Coloque a bandeja no vibratomo e despeje gelo ao redor. Coloque as lâminas no vibratomo em um ângulo de 10° para baixo e abaixo da horizontal.
- Encha o tanque de vibratomo com tampão Krebs gelado. Coloque uma fina camada de cola de cianoacrilato na plataforma.
- Seque a borda do bloco de agarose que será colado na plataforma usando um tecido absorvente estéril.
- Coloque o bloco de agarose na plataforma removível. Posicione o lóbulo na vertical para permitir que seja cortado transversalmente. Embora o tamanho das fatias seja reduzido, isso facilita drasticamente o processo de corte, limitando a pressão contra o lóbulo durante o corte.
- Aguarde 1 minuto para que a cola endureça e submerja a plataforma removível no tanque e certifique-se de que o bloco de agarose esteja completamente coberto com tampão Krebs.
- Programe o vibratomo para corte definindo as posições de início e parada. Comece a cortar fatias mais grossas inicialmente até atingir o lóbulo do fígado.
- Descarte a primeira fatia, pois pode não ser cortada na espessura certa. Para evitar danificar as fatias, use uma espátula para coletar as fatias de fígado em vez de pinças ou escovas.
NOTA: Uma pequena escova desinfetada com etanol 70% e enxaguada com PBS estéril também pode ser usada para guiar suavemente o tecido durante o processo de corte. - Repita o processo até atingir o número necessário de fatias. O lóbulo pode ocasionalmente se desalojar da agarose, impedindo o uso posterior. Colete as fatias em um tampão Krebs gelado até a cultura.
5. Incubação de fatias de fígado
- Transfira as fatias, usando uma espátula, para os poços preparados contendo a mídia e as inserções.
- Coloque as placas em um agitador orbital, ajuste a velocidade em 130 rpm e incube usando uma incubadora de cultura de células convencional com 5% de CO2 e 21% de O2 a 37 °C. O volume final de cultura é de 2,6 mL, 1,5 mL e 0,7 mL por poço em placas de 6, 12 e 24 poços, respectivamente.
- Coloque uma placa vazia abaixo da placa de cultura que contém as fatias em cultura para permitir que qualquer calor excessivo proveniente da plataforma do agitador seja dissipado. Troque o meio a cada 48 h.
6. Ensaio de sobrevivência celular
- Transfira as fatias para uma placa de 48 poços contendo 400 μL de meio Medium E de Williams completo pré-aquecido e adicione 80 μL de MTS (3- (4,5-dimetiltiazol-2-il) -5- (3-carboximetoxifenil) -2- (4-sulfofenil) -2H-tetrazólio) reagente de tetrazólio).
- Após a incubação por 1 h a 37 °C, 5% de CO2 em um agitador, transfira 200 μL de meio para uma placa de 96 poços e meça a absorbância a 490 nm usando um leitor de placas de vários poços. Utilizar as fatias deixadas na bancada em PBS e à temperatura ambiente durante 24 h como controlos negativos.
7. Coloração histológica
- Desparafinizar e reidratar as seções usando xileno e etanol, seguido de água deionizada. Manchar as secções com solução de hematoxilina durante 3 min.
- Enxágüe com água deionizada por 5 min. Mergulhe rapidamente 10x em etanol ácido (1 mL de HCL concentrado e 400 mL de etanol a 70%).
- Enxágue 2x em água deionizada e seque o excesso de água. Mergulhe as seções em Eosin por 30 s.
- Desidrate em etanol a 95% e, em seguida, etanol a 100% por 5 min, 3x cada. Mergulhe as seções em xileno 3x por 15 minutos cada. Coloque lamínulas nas lâminas.
Resultados
Na colheita, a perfusão do animal é propositalmente omitida para garantir o processamento rápido do órgão e evitar danos aos órgãos. O fígado é extraído rapidamente após a incisão e imediatamente colocado em um tampão protetor de órgãos gelado, por exemplo, tampão Krebs24,29. Embora o corte de tecido hepático fresco sem incorporação tenha sido descrito anteriormente1, a inclusão do fígado em agarose30 de baixo ponto de fusão (Figura 1) combinada com um tampão protetor de órgãos permitirá condições ideais de corte no vibratoma, reduzindo o dano tecidual e aumentando a reprodutibilidade na espessura da seção. A espessura do tecido é crítica, pois seções finas permitem que mais camadas de células acessem nutrientes e oxigênio31 e reduzam a morte celular. No entanto, seções muito finas tornam-se difíceis de cortar de forma homogênea. Por outro lado, fatias com espessura superior a 400 μm apresentarão uma menor taxa de penetração de nutrientes. As seções foram incubadas em uma interface líquido-ar usando um inserto (Figura 1) e incubadas com 5% de CO2 e 21% deO2 a 37 °C em um agitador. As seções devem ser incubadas em um meio de cultura dentro de 3 h após a colheita, após o que a morte celular ocorre rapidamente32.
Para determinar a viabilidade do PCLS, a viabilidade celular foi avaliada pelo ensaio de 4,5-dimetiltiazol-2-il)-5-(3-carboximetoxifenil)-2-(4-sulfofenil)-2H-tetrazólio (MTS), que requer desidrogenases dependentes de NAD(P)H, ou seja, células metabolicamente ativas, para reduzir o MTS. Os valores de MTS foram normalizados para o respectivo peso de fatia. Para otimizar a viabilidade do PCLS, um volume mínimo de meio de cultura foi essencial para sustentar a viabilidade após 24 h de incubação. Um volume de 0,7 mL em placas de 24 poços mostrou uma redução significativa da viabilidade pelo ensaio TMS (p = 0,02) em comparação com 1,5 mL em placas de 12 poços e 2,6 mL em placas de 6 poços (Figura 2A). Esses volumes foram escolhidos para permitir que as seções fossem ligeiramente cobertas, mas podem precisar de ajustes dependendo do tipo de insertos e placas utilizadas. Como outros33, placas de 12 poços são usadas como o melhor compromisso para a sobrevivência ideal dentro de um volume menor de meio de cultura.
A agitação é essencial e aumenta a viabilidade do PCLS em 50% em 24 h após a incubação em comparação com uma cultura estática (Figura 2B). A agitação cria uma interface ar-líquido crítica, otimizada com o uso de transwells, permitindo o acesso a nutrientes e oxigênio para ambas as faces da seção. A absorção de oxigênio e nutrientes também é aumentada pelo fluxo constante criado pelo movimento de agitação, que também passa pela membrana do transpoço.
O ensaio MTS foi avaliado a partir de 1 h de incubação até o dia 6 de incubação. A viabilidade celular permaneceu constante do dia 0 ao dia 4 pós-incubação antes de observar uma diminuição significativa (p = 0,05) no dia 6 (Figura 2C). A morfologia do PCLS avaliada pela coloração de hematoxilina e eosina (H&E) não mostrou alteração dos ductos biliares e da arquitetura até 5 dias após a incubação (Figura 3A-D). Em comparação com o dia 0 (Figura 3A), o PCLS não mostrou diferença histológica no dia 1 (Figura 3B) e no dia 2 (Figura 3C) pós-incubação, com hipercromasia nuclear, infiltrado inflamatório leve, vacuolização em favor de um processo moderado de morte celular no dia 5 pós-incubação (Figura 3D). Em conjunto, esse protocolo de cultura de PCLS permite viabilidade por pelo menos 4 dias, consistente com estudos que utilizaram fatias em condições semelhantes31.

Figura 1: Esquema resumindo o protocolo para geração de PCLS. Este número foi modificado de34. Clique aqui para ver uma versão maior desta figura.

Figura 2: Protocolo otimizado de cultura de PCLS mostra viabilidade satisfatória por 5 dias. (A) Efeito do tamanho do poço na proliferação celular (n=3). (B) Efeito da agitação na proliferação celular (n = 6 por condição). (C) Ensaio de proliferação de células MTS de seções hepáticas de d0 a d6 dias de incubação (n = 5 por ponto de tempo). Unidade arbitrária OD, normalizada para fatiar o peso fresco. O gráfico mostra a média ± DP. Teste t de Student bicaudal não pareado, ns=não significativo, *p<0,05, **p<0,01. Este número foi modificado de34. Clique aqui para ver uma versão maior desta figura.
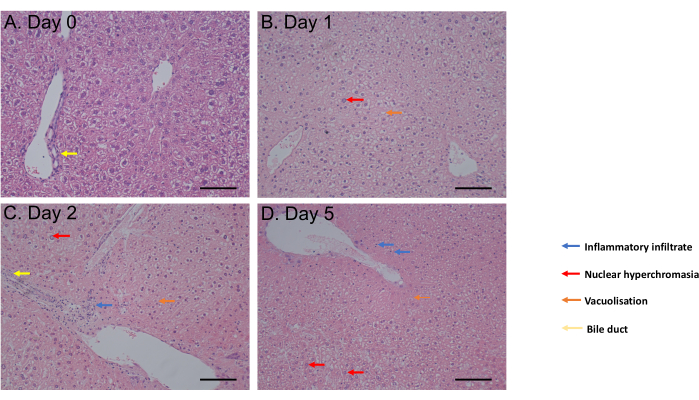
Figura 3: Resultados histológicos. (A-D) Imagens representativas da histologia do PCLS hepático após coloração H & E. Barra de escala = 100 μM. Este número foi modificado de34. Clique aqui para ver uma versão maior desta figura.
Discussão
Demonstramos que a produção e a cultura de PCLS podem ser facilmente alcançadas, garantindo uma meia-vida de pelo menos 4 dias. Este protocolo recapitula cinco etapas críticas: o método de incorporação se este tipo de vibratomo for usado, a orientação do corte, um sistema dinâmico de cultura, um volume mínimo de cultura e o uso de inserções.
Protocolos para a produção e cultura de PCLS estão comumente disponíveis. No entanto, eles carecem de padronização; Eles podem se concentrar em pontos semelhantes e específicos do protocolo, mas podem ser difíceis de replicar de maneira simples ou na maioria dos laboratórios que têm acesso a um vibratoma básico. Os tipos de vibratomos ou fatiadores de tecido são amplos. Eles variam em custo e especificidades técnicas, como ter um sistema de refrigeração integrado ou não, mas sua característica comum é o sistema de corte usando uma lâmina de barbear oscilante. A principal diferença em relação ao corte de tecidos é a exigência de incorporação. Por razões óbvias e pelo impacto da incorporação na viabilidade, o ideal é evitá-la. Um exemplo de uma segmentação de dados de referência que não requer incorporação é a segmentação de dados Krumdieck35. Este tipo de fatiador permite que o tecido seja cortado em um tampão resfriado enquanto usa um núcleo, produzindo fatias de tamanho uniforme, evitando a incorporação. No entanto, esse aparelho tende a ser mais caro do que os vibratomos mais básicos e menos comumente usado ou disponível na maioria dos laboratórios. Vibratomos como o usado neste protocolo tendem a já estar disponíveis para o corte de tecidos quimicamente fixados, mas exigirão a incorporação dos lobos do fígado. Alguns mostraram que o corte de fatias de fígado pode ser feito sem incorporar e usar um vibratomo1 semelhante; no entanto, em nossa experiência, isso se mostrou difícil de reproduzir. Além disso, ao usar esse tipo de vibratome, o corte do fígado sem um gel de agarose de suporte 3D causa fatias danificadas e espessura irregular e, portanto, aumenta a morte celular. Este protocolo envolve o corte do lobo do fígado transversalmente em vez de sagitalmente. A etapa de corte é uma técnica difícil de dominar e, até onde sabemos, a orientação do corte é um detalhe importante que nunca é focado. A orientação do lóbulo durante o corte pode facilitar drasticamente o processo de corte, reduzindo a pressão sobre o fígado. O uso de hidrogel também pode ser considerado um benefício melhorado36.
O próximo critério importante é a necessidade de maiores volumes de cultura para aumentar a viabilidade. Volumes maiores já foram sugeridos para fornecer mais nutrientes e diluir produtos de ácidos biliares mais tóxicos37. A adição de um sistema dinâmico com agitação e combinado com o uso de Transwells melhora o acesso a nutrientes e potencialmente oxigênio para ambas as faces da seção, criando um fluxo constante 18,38,39. O uso do transwell e a vantagem de um sistema dinâmico já foram comprovados em diferentes contextos, como respostas de corte de fígado de tumor humano28 e para a modelagem de fibrose26,27. Este protocolo confirma sua vantagem em um aspecto fisiológico mais amplo.
O meio E de Williams é comumente escolhido como meio de cultura celular padrão para PCLS40,41. Meios suplementados com glicose e soro têm sido descritos com potencial benefício na preservação da viabilidade e funcionalidade dos cortes42. A concentração de glicose no meio geralmente varia entre 4 nM a 36 nM43,44, mas não foi encontrado consenso sobre o efeito de uma maior concentração de glicose na viabilidade ou na resposta oxidativa. Alega-se que a adição de insulina ou dexametasona35 melhora a viabilidade a longo prazo, mas não se chegou a um consenso, pois a adição de tais suplementos poderia potencialmente induzir resistência secundária à insulina com um efeito a jusante na viabilidade45.
Dados anteriores mostram que cortes mais finos que 200 μm tornam-se difíceis de cortar de forma homogênea e podem apresentar estresse oxidativo, enquanto cortes mais grossos que 400 μm apresentam baixa taxa de penetração de nutrientes 18,19,46. Além disso, com base na aparência do PCLS, efeitos na textura e facilidade de corte, uma espessura de 250 μm é favorecida. A penetração dos nutrientes ou agente terapêutico nas camadas celulares internas do PCLS também é muito melhorada usando transwells como parte do sistema dinâmico 18,32. Ao contrário do uso do fatiador Krumdieck, que tem a vantagem de produzir fatias de tamanho uniforme por meio da integração de um sistema de corte com núcleo, o protocolo pode ser adaptado redimensionando as fatias em dimensões iguais após o corte. No entanto, a variabilidade de tamanho, peso ou teor de proteína deve ser considerada no experimento e seu impacto no ambiente de cultura e, portanto, na viabilidade e nos biomarcadores. Por esse motivo, as leituras do ensaio MTA, ao usar este protocolo, são normalizadas para o peso fresco de cada fatia. Além disso, a heterogeneidade da espessura pode ser observada, mas, infelizmente, é provável que seja observada usando todos os tipos de fatiadores. O usuário pode considerar descartar as fatias menos homogêneas avaliando seu aspecto, mas isso ainda é considerado uma opção não confiável e continua sendo uma desvantagem do PCTS. A principal limitação associada a esse modelo continua sendo a relativa viabilidade de curto prazo, mas está dentro do prazo já publicado24,31. A disponibilidade de oxigênio pode ser aumentada para aumentar essa viabilidade. Alguns protocolos publicados anteriormente exigiam meios de cultura complexos e concentração de oxigênio superior a 80%, regulando positivamente o metabolismo e proporcionando maior viabilidade 1,24,35,38. Também é difícil comparar diretamente os níveis de oxigênio usados para oxigenar o PCLS e os níveis de oxigênio usados para cultivar linhagens celulares. Os dados sobre os efeitos do oxigênio na fisiologia do PCLS são muito limitados18,47, e uma maior concentração de oxigênio provavelmente modifica substancialmente a fisiopatologia e o fenótipo, gerando espécies reativas tóxicasde oxigênio 48.
Em conclusão, o PCLS de curta duração pode ser produzido com equipamento limitado e usado como um modelo ex vivo confiável. A arquitetura do tecido é crucial na fisiologia do fígado, e o PCLS permitindo que ele seja preservado é outro exemplo de por que esse modelo deve ser considerado de maneira mais predominante. As fatias de corte de precisão devem, portanto, se tornar uma ferramenta mais reconhecida na pesquisa científica.
Divulgações
Não há interesse conflitante a ser divulgado.
Agradecimentos
Os autores agradecem a Mirabela Bandol, Samantha Richards, Louise Fisher, Rebecca Towns e à equipe dos Serviços Biológicos da UCL por sua ajuda na criação e manutenção das colônias de animais. Este trabalho foi apoiado por financiamento do Conselho de Pesquisa Médica do Reino Unido Clinician Scientist Fellowship MR / T008024 / 1 (JB) e do NIHR Great Ormond Street Hospital Biomedical Research Center (JB). As opiniões expressas são do(s) autor(es) e não necessariamente do NHS ou do NIHR.
Materiais
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
Referências
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados