Method Article
טכניקה אופטימלית ופשוטה לייצור ותרבות של פרוסות כבד בחיתוך מדויק
In This Article
Summary
פרוטוקול לייצור ותרבית של פרוסות כבד בחיתוך מדויק (PCLS) לחקר כבדי עכברים. המאמר מתמקד בהיבטים מרכזיים של הפרוטוקול, הדורש רק ציוד מעבדה סטנדרטי עם גישה לוויברטום ומאפשר הישרדות של PCLS למשך 4 ימים לפחות.
Abstract
פרוטוקול זה מציג מערכת פשוטה ליצירה ותרבית של פרוסות כבד בחיתוך מדויק (PCLS). PCLS מכיל את כל התאים בסביבה שלמה, ולכן דומה למודל קטן של האיבר כולו. הם מאפשרים לחקור רקמות חיות תוך שכפול הפנוטיפים המורכבים שלהן. פרוטוקול זה מאפשר הכנת פרוסות מכבדי עכברים באמצעות ויברטום וציוד מעבדה סטנדרטי. פרוטוקולים לייצור וטיפוח PCLS חסרים סטנדרטיזציה ויכולים להשתנות באופן דרסטי למדי בהתאם לרקמה המעניינת, סוג הוויברטום בו נעשה שימוש והצורך בחמצן. אלה יכולים להיות קשים לשכפול במעבדות מסוימות שיש להן גישה רק לוויברטום בסיסי ולמתקני תרבית רקמות נפוצים. גיבשנו פרוטוקול המתמקד בחשיבותם של כמה צעדים מרכזיים במסגרת הפרוטוקולים המגוונים שכבר קיימים. פרוטוקול זה, אם כן, מדגיש את החשיבות של שיטת ההטמעה, כיוון החיתוך, מערכת דינמית לעומת סטטית והרלוונטיות של נפח מינימלי של תרבות. ניתן להקים ולשכפל פרוטוקול זה בצורה פשוטה ברוב המעבדות שיש להן גישה לפורס רקמות בסיסי. ביחד ובהתאם לפרוטוקול זה, PCLS יכול להישאר בחיים לפחות 4 ימים. PCLS הוא מודל פשוט, חסכוני וניתן לשחזור לחקר בדיקות פתופיזיולוגיות וטיפוליות לאיברים כמו הכבד.
Introduction
פרוסות רקמה בחיתוך מדויק (PCTS) הן חלקים דקים של איברים. הם מאפשרים לשמר את הארכיטקטורה של האיבר המשכפל מיני איבר תוך שמירה על ההיבט התלת מימדי של תאים שכנים ומטריצה חוץ-תאית. זהו מודל מושך בשל הגישה הקלה שלו, החיסכון בעלויות והמאפיינים הפחות עתירי עבודה תוך שמירה על ארכיטקטורת הרקמות.
PCTS ממלאים פער בין מחקרי תאים במבחנה למחקר בבעלי חיים in vivo, ומתגברים על רוב החסרונות של שני המודלים. PCTS נוצר מאיברים שונים, כגון כבד1, מעיים 2,3, מעיגס 2, מוח 4,5, ריאות 6,7,8, כליות 9,10, טחול11,12, לב13,14 אך גם גידולים15,16. הם יכולים גם להגיע מבעלי חיים שונים, כגון עכבר1, חולדה17,18 אך גם חזיר19 ופסולת כירורגית אנושית 15,20,21. למרות ש-PCTS דורש שימוש בבעלי חיים, מה שמרמז על סוגיות אתיות, האיבר מבעל חיים אחד יכול לייצר PCTS מרובים, ובכך להפחית את מספר בעלי החיים בהסכמה עם הנחיות NC3Rs (הפחתה, החלפה, עידון)22 תוך הגבלת וריאציות בין-אישיות.
הפיתוח של פורסות רקמות משופרות, למשל, ויברטומות23, איפשר מעבר מפרוסות חתוכות ידנית המאופיינות בעובי הטרוגני ושיעור הישרדות נמוך לפרוסות דקות יותר הניתנות לשחזור עם שלמות מבנית שנשמרה טוב יותר.
עם זאת, פרוטוקולים עבור PCTS, וליתר דיוק, הכנה ותרבית של פרוסות כבד בחיתוך מדויק (PCLS) משתנים באופן משמעותי בספרות וחסרים סטנדרטיזציה, במיוחד עבור פרמטרים חיוניים כגון ציוד חיתוך, תוכן בינוני ותנאי תרבית. הפרוטוקולים יכולים גם להשתנות באופן ניכר בהתאם לרקמת המקור. חלק מהפרוטוקולים ידרשו חמצון של המאגר או התרבית עם כמה מערכות ביו-ריאקטור מסובכות24. הם בדרך כלל מתמקדים בנפרד בהיבטים טכניים שונים או מיועדים לרקמות שונות ולעתים קרובות יכולים להיות יקרים ומאתגרים יותר לשכפול במעבדה הממוצעת בצורה חסכונית.
כאן, פרוטוקול זה מאגד כמה נקודות מפתח כגון שיטת ההטמעה, כיוון החיתוך, השימוש בשקעים25, מערכת תרבית דינמית26 והחשיבות של נפח מינימלי של תרבות. חלק מהשלבים הללו עברו אופטימיזציה בעבר באופן עצמאי או בהקשר אחר, כגון פיברוזיס27 או תגובת גידול28. פרוטוקול זה מדגיש גם את החשיבות של הטמעה באמצעות סוגים מסוימים של פורסים וכיוון החיתוך, שהם שניהם פרמטרים קשים לשליטה ולעתים קרובות מוזנחים בספרות. שיטה פשוטה זו מייצרת PCLS הנשמר בתרבית למשך 4 ימים לפחות עם התקנה קלה ושימוש בציוד מעבדה סטנדרטי עם גישה לפורס רקמות בסיסי.
Protocol
עכברי CD57Bl/6J מסוג פרא נרכשו ממעבדות צ'ארלס ריבר. לעכברים הייתה גישה חופשית למזון ומים, שוכנו בכלובים מאווררים בנפרד עם תנאי טמפרטורה ולחות מבוקרים ועם מחזור אור של 12 שעות. בעלי חיים בני 3 שבועות הוקרבו, וכבדים נקטפו מיד ללא זלוף. כל העבודות בבעלי חיים אושרו לאחר ביקורת אתית מקומית על ידי מועצת הביקורת האתית והרווחה של בעלי החיים של אוניברסיטת קולג' לונדון ובוצעו תחת רישיון פרויקט של משרד הפנים PP9223137 ובהתאם לחוק הנהלים המדעיים של משרד הפנים (בעלי חיים) (1986) והנחיות ARRIVE. כל המאמצים נעשו כדי להגביל את הפגיעה בבעלי חיים בהתאם לנוהג המקובל ביחידה לשירותים ביולוגיים ביוניברסיטי קולג' לונדון.
1. התכוננו לניסוי
- ביום שלפני הקטיף, בצע את השלבים הבאים.
- הכן 1 ליטר של מאגר קרבס-הנסלייט (KREBS) על ידי המסת בקבוקון אחד של אבקת קרבס ל-1 ליטר מים סטריליים. מצננים אותו ל-4 מעלות צלזיוס ושומרים אותו על קרח רטוב.
- מחטאים את המגש עם 70% אתנול ושוטפים עם PBS סטרילי. שמור את המגש עטוף בנייר כסף במקרר למשך הלילה כדי לסייע בשמירה על סביבה קרה בזמן החיתוך.
- יש לרסס את כל שאר החלקים הניתנים להסרה באתנול, לשטוף עם PBS סטרילי, להשאיר לייבוש ולשמור אותם סטריליים. חיטוי הלהבים ושמור אותם סטריליים עד לשימוש.
- הכן 4% w/v אגרוז נמס נמוך במים סטריליים. לאחר ההשעיה וההמסה, יש לאחסן את האגרוז במקרר בחום של 4 מעלות צלזיוס.
- ביום הקציר ולפני קציר הכבד, בצע את הצעדים הבאים.
- ממיסים את האגרוז הנמס הנמוך של 4% ושומרים אותו באמבט מים בטמפרטורה של 37 מעלות צלזיוס עד לשימוש. יש לוודא שהאגרוז התקרר ל-37 מעלות צלזיוס ושכל הבועות התפזרו לפני השימוש.
- הכן את צלחות התרבות על ידי הוספת 2.6 מ"ל, 1.5 מ"ל ו -0.7 מ"ל לבאר בהתאמה לצלחות 6, 12 ו -24 באר. הוסיפו 8 מיקרומטר תוספות נקבוביות לכל באר. הנח את הצלחות באינקובטור לח המוגדר לרמת 37 מעלות צלזיוס, 5% CO2 ו-21% O2 . זה יעזור להתאים את ה-pH תוך חימום המדיה, כך שהיא מוכנה לתרבית.
- תרבית את הפרוסות עם תוספות נקבוביות של 8 מיקרומטר כדי לאפשר גישה לשני הפנים של הפרוסה. הכן את המדיה באופן הבא: הוסף ל-William's Medium E (WME), תוסף L-גלוטמין 2 מ"מ, סרום בקר עוברי 10% (FBS), 100 U/mL פניצילין ו-100 מיקרוגרם/מ"ל סטרפטומיצין, 10 מיקרוגרם/מ"ל גנטמיצין, תמיסת D-גלוקוז 25 מ"מ ותמיסת HEPES 15 מ"מ.
2. איסוף כבד והכנה (15 דקות)
- עקר את כל המכשירים לפני הקציר.
- להרדים את העכבר על פי נהלים מקומיים לטיפול בבעלי חיים למטרות מדעיות באמצעות מסכת איזופלורן. לפני פתיחת חלל הבטן, צבט בין אצבעות הרגליים כדי לוודא שהחיה מורדמת כראוי. אם ניתן להסיר את הכבד במהירות, ניתן להמית את העכבר על ידי חנקCO2 או פריקת צוואר הרחם. מכיוון שההליך הוא הליך סופני, אל תשתמש במשחת עיניים מכיוון שהדבר לא ישפיע על בעל החיים.
- יש לרסס את הבטן באתנול 70%. אופציונלי: לגלח את העכבר כדי למנוע זיהום בשיער.
- פתח את חלל הבטן בעזרת מלקחיים סטריליים ומספריים על ידי חיתוך העור והצפק מאמצע הבטן. נתח את הכבד בעדינות מאיברים או כלי דם אחרים והימנע מפגיעה באונות.
- יש לאחסן את כל הכבד מיד ב-Krebs Buffer קר כקרח. בצע את כל השלבים הנוספים על הקרח בטמפרטורה של 4 מעלות צלזיוס והמשך להכנת הכבד במהירות האפשרית כדי למנוע מוות נוסף של תאים.
3. הטמעת אונות הכבד (25 דקות לכל אונת כבד)
- מעבירים את הכבד לצלחת פטרי על קרח המכילה בופר קרבס קר כקרח, ומוודאים שהכבד כולו שקוע במלואו.
- הפרד כל אונה בנפרד באמצעות מלקחיים קהים וסכין חדה וסטרילית כדי למנוע נזק לאונות.
- בחר את האונה הראשונה לחיתוך ושמור את האונות הנותרות במאגר קרבס קר כקרח עד שהן מוכנות להטמעה וחיתוך.
- חותכים את כל הקצוות כדי לקבל אונה קלה יותר לניהול עם קצוות ישרים מוכנים להטמעה. זה גם יעזור להסיר חלק מהקפסולה הסיבית של גליסון כדי להקל עוד יותר על החתך. עשו זאת תוך שמירה על משטחי הכבד רטובים במאגר קרבס קר כקרח.
- מניחים צלחת פטרי בגודל 3 ס"מ (או דומה) על קרח רטוב ויוצקים לתוכה את האגרוז הנמס 4% (כבר באמבט מים של 37 מעלות צלזיוס). שמור היטב על הקרח כדי לאפשר לאגרוז להתקרר בכיוון כלפי מעלה תוך מניעת שקיעת האונה לתחתית והטמעתה בצורה אחידה.
- השאירו את האגרוז להתקרר עוד יותר למשך 30 שניות והניחו לתוכה את האונה הקצוצה. האונה תתייצב באמצע גוש האגרוז. תהליך ההטמעה דורש תרגול ואופטימיזציה כדי להתאים לכל תנאי מעבדה וניסיון אישי.
- מניחים את האונה המוטבעת, עדיין על קרח, במקרר למשך 5 דקות. לאחר מכן יש להגדיר את האגרוז בבירור.
- חותכים את החלק החיצוני של גוש האגרוז. עקור את גוש האגרוז מהצלחת.
- חותכים את האגרוז לגודל הניתן לניהול יותר, ומוודאים שהצד העליון והצד המודבק לפלטפורמת הוויברטום מקבילים לקצה העליון של האונה.
- התחל את תהליך החיתוך במהירות האפשרית אך ודא שגוש האגרוז נשמר במאגר קרבס קר כקרח ועל קרח.
4. ייצור פרוסות כבד (40 דקות לאונה)
- הגדר את הוויברטום לחיתוך בעובי של 250 מיקרומטר, במהירות של 5 ובתדר של 7 הרץ. אלה פרמטרים מנחים; בהתאם לסוג הוויברטום בו נעשה שימוש, זה עשוי לדרוש אופטימיזציה.
- רססו את אזורי הוויברטום והספסל ב-70% אתנול לפני החיתוך כדי לשמור על הסביבה סטרילית ככל האפשר.
- מניחים את המגש על הוויברטום ויוצקים קרח סביבו. הנח את הלהבים על הוויברטום בזווית של 10° כלפי מטה ומתחת לאופק.
- מלאו את מיכל הוויברטום במאגר קרבס קר כקרח. הניחו שכבה דקה של דבק ציאנואקרילט על הרציף.
- יבש את קצה גוש האגרוז שיודבק על הרציף באמצעות רקמה סופגת סטרילית.
- הנח את בלוק האגרוז על הפלטפורמה הנשלפת. מקם את האונה זקופה כדי לאפשר לחתוך אותה לרוחב. למרות שגודל הפרוסות מצטמצם, הדבר מקל באופן דרסטי על תהליך החיתוך על ידי הגבלת הלחץ על האונה בזמן החיתוך.
- המתן דקה אחת עד שהדבק יתייצב ויטבול את הפלטפורמה הנשלפת לתוך המיכל וודא שבלוק האגרוז מכוסה לחלוטין במאגר קרבס.
- תכנת את הוויברטום לחיתוך על ידי הגדרת מצבי ההתחלה והעצירה. התחל לחתוך פרוסות עבות יותר בתחילה עד שמגיעים לאונה הכבד.
- השלך את הפרוסה הראשונה, מכיוון שייתכן שהיא לא נחתכת לעובי הנכון. כדי להימנע מפגיעה בפרוסות, השתמש במרית כדי לאסוף את פרוסות הכבד במקום מלקחיים או מברשות.
הערה: ניתן להשתמש במברשת קטנה מחוטאת ב-70% אתנול ושטופה ב-PBS סטרילי כדי להנחות בעדינות את הרקמה במהלך תהליך החיתוך. - חזור על התהליך עד להגעה למספר הפרוסות הנדרש. האונה עלולה לעקור את עצמה מדי פעם מהאגרוז, ולמנוע שימוש נוסף. אוספים את הפרוסות למאגר קרבס קר כקרח עד לתרבות.
5. דגירה של פרוסות כבד
- מעבירים את הפרוסות, בעזרת מרית, לבארות המוכנות המכילות את המדיה והתוספות.
- הנח את הלוחות על שייקר מסלולי, הגדר את המהירות ל-130 סל"ד ודגר באמצעות חממת תרבית תאים קונבנציונלית עם 5% CO2 ו-21% O2 ב-37 מעלות צלזיוס. נפח התרבות הסופי הוא 2.6 מ"ל, 1.5 מ"ל ו -0.7 מ"ל לבאר בצלחות של 6, 12 ו -24 בארות, בהתאמה.
- הניחו צלחת ריקה אחת מתחת לצלחת התרבות המכילה את הפרוסות בתרבית כדי לאפשר פיזור חום מוגזם שמקורו בפלטפורמת השייקר. החלף את המדיום כל 48 שעות.
6. בדיקת הישרדות תאים
- העבירו את הפרוסות לצלחת של 48 בארות המכילה 400 מיקרוליטר של מדיה Medium E מלאה של וויליאמס שחוממה מראש והוסיפו 80 מיקרוליטר של MTS (3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium) מגיב טטרזוליום.
- לאחר הדגירה למשך שעה אחת ב-37 מעלות צלזיוס, 5% CO2 על שייקר, העבירו 200 מיקרוליטר של מדיה לצלחת של 96 בארות, ומדדו את הספיגה ב-490 ננומטר באמצעות קורא צלחות מרובות בארות. השתמש בפרוסות שנותרו על הספסל ב-PBS ובטמפרטורת החדר למשך 24 שעות כבקרות שליליות.
7. צביעה היסטולוגית
- הפזר והתייבש מחדש את החלקים באמצעות קסילן ואתנול, ואחריהם מים נטולי יונים. מכתימים את החלקים בתמיסת המטוקסילין למשך 3 דקות.
- שוטפים במים נטולי יונים למשך 5 דקות. טבלו במהירות פי 10 באתנול חומצי (1 מ"ל HCL מרוכז ו-400 מ"ל אתנול 70%).
- יש לשטוף פעמיים במים נטולי יונים ולנגב עודפי מים. טובלים את החלקים באוזין למשך 30 שניות.
- יש לייבש ל-95% אתנול, ולאחר מכן ל-100% אתנול למשך 5 דקות, פי 3 כל אחד. טובלים חלקים בקסילן 3x למשך 15 דקות כל אחד. הנח כיסויים על מגלשות.
תוצאות
בעת הקציר, הזלוף של החיה מושמט בכוונה כדי להבטיח עיבוד מהיר של האיבר ולמנוע נזק לאיברים. הכבד נשאב במהירות לאחר החתך ומונח מיד במאגר מגן איברים קר כקרח, למשל, בופר קרבס24,29. למרות שחיתוך רקמת כבד טרייה ללא הטבעה תואר בעבר1, הטמעת הכבד באגרוז30 נמס נמוך (איור 1) בשילוב עם מאגר מגן איברים יאפשרו תנאי חיתוך אופטימליים על הוויברטום, יפחיתו נזק לרקמות ויגדילו את יכולת השחזור בעובי החתך. עובי הרקמה הוא קריטי מכיוון שחלקים דקים מאפשרים ליותר שכבות תאים לגשת לחומרים מזינים וחמצן31 ולהפחית את מוות התאים. עם זאת, קטעים דקים מדי הופכים קשים לחיתוך הומוגני. לעומת זאת, פרוסות עבות מ -400 מיקרומטר יראו קצב חדירה נמוך יותר של חומרים מזינים. החלקים הודגרו בממשק נוזל-אוויר באמצעות תוספת (איור 1) והודגרו עם 5% CO2 ו-21% O2 ב-37 מעלות צלזיוס על שייקר. יש לדגור את החלקים במדיום תרבית תוך 3 שעות לאחר הקטיף, ולאחר מכן מוות תאים מתרחש במהירות32.
כדי לקבוע את הכדאיות של PCLS, כדאיות התאים הוערכה על ידי בדיקת 4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium (MTS), הדורשת דהידרוגנאזות תלויות NAD(P)H, כלומר תאים פעילים מטבולית, כדי להפחית MTS. ערכי MTS נורמלו למשקל הפרוסה המתאים. כדי לייעל את כדאיות ה-PCLS, נפח מינימלי של מדיום תרבית היה חיוני לשמירה על הכדאיות לאחר 24 שעות של דגירה. נפח של 0.7 מ"ל ב-24 לוחות בארות הראה ירידה משמעותית בכדאיות על ידי בדיקת TMS (p = 0.02) בהשוואה ל-1.5 מ"ל ב-12 לוחות בארות ו-2.6 מ"ל ב-6 לוחות בארות (איור 2A). נפחים אלה נבחרו כדי לאפשר כיסוי קל של החלקים, אך ייתכן שיהיה צורך להתאים אותם בהתאם לסוג התוספות והצלחות בהן נעשה שימוש. כמו אחרים33, 12 צלחות באר משמשות כפשרה הטובה ביותר להישרדות אופטימלית בנפח קטן יותר של מדיום תרבית.
טלטול הוא חיוני ומגדיל את כדאיות ה-PCLS ב-50% ב-24 שעות לאחר הדגירה בהשוואה לתרבית סטטית (איור 2B). טלטול יוצר ממשק אוויר-נוזל קריטי, המותאם לשימוש במעברים, ומאפשר גישה לחומרים מזינים וחמצן לשני הצדדים של הקטע. ספיגת החמצן והחומרים המזינים מוגברת גם על ידי הזרימה המתמדת שנוצרת על ידי תנועת הרעידה, העוברת גם דרך קרום הטרנסוול.
בדיקת MTS הוערכה משעה אחת של דגירה עד ליום 6 של הדגירה. כדאיות התא נותרה קבועה מהיום ה-0 עד היום הרביעי לאחר הדגירה לפני שנצפתה ירידה משמעותית (p = 0.05) ביום השישי (איור 2C). מורפולוגיה של PCLS שהוערכה על ידי צביעת המטוקסילין ואאוזין (H&E) לא הראתה שינוי בדרכי המרה ובארכיטקטורה עד 5 ימים לאחר הדגירה (איור 3A-D). בהשוואה ליום 0 (איור 3A), PCLS לא הראה הבדל היסטולוגי ביום 1 (איור 3B) וביום 2 (איור 3C) לאחר הדגירה, עם היפרכרומזיה גרעינית, חדירה דלקתית קלה, ואקואוליזציה לטובת תהליך מוות תאים מתון ביום 5 לאחר הדגירה (איור 3D). יחד, פרוטוקול תרבית PCLS זה מאפשר כדאיות למשך 4 ימים לפחות, בהתאם למחקרים המשתמשים בפרוסות בתנאים דומים31.

איור 1: סיכום סכמטי של הפרוטוקול ליצירת PCLS. נתון זה שונהמ-34. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: פרוטוקול אופטימלי של תרבית PCLS מראה כדאיות משביעת רצון למשך 5 ימים. (A) השפעת גודל הבאר על התפשטות התאים (n=3). (B) השפעת טלטול על התפשטות תאים (n=6 לכל מצב). (C) בדיקת התפשטות תאי MTS מקטעי כבד מ-d0 עד d6 ימי דגירה (n=5 לנקודת זמן). יחידה שרירותית OD, מנורמלת לפרוס משקל טרי. הגרף מציג ממוצע ± SD. מבחן t של סטודנט דו-זנבי לא מזווג, ns=לא מובהק, *p<0.05, **p<0.01. נתון זה שונהמ-34. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
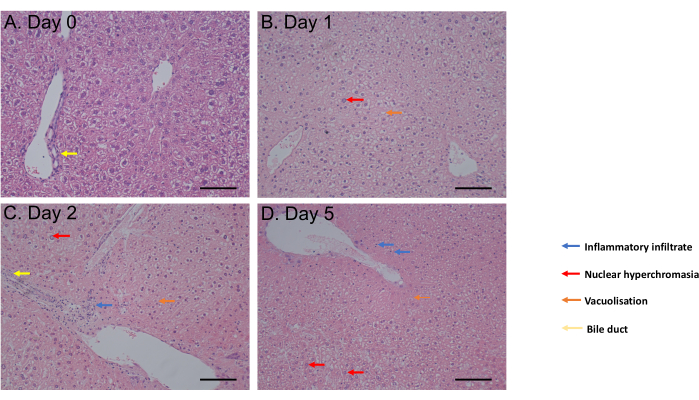
איור 3: תוצאות היסטולוגיה. (א-ד) תמונות מייצגות של היסטולוגיה של PCLS בכבד לאחר צביעת H&E. סרגל קנה מידה = 100 מיקרומטר. נתון זה שונהמ-34. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
אנו מדגימים כי ניתן להשיג בקלות ייצור וטיפוח PCLS תוך הבטחת זמן מחצית חיים של 4 ימים לפחות. פרוטוקול זה מסכם חמישה שלבים קריטיים: שיטת ההטמעה אם נעשה שימוש בסוג זה של ויברטום, כיוון החיתוך, מערכת דינמית של תרבית, נפח מינימלי של תרבית ושימוש בתוספות.
פרוטוקולים לייצור ותרבות של PCLS זמינים בדרך כלל. עם זאת, הם חסרים סטנדרטיזציה; הם עשויים להתמקד בנקודות דומות וספציפיות של הפרוטוקול אך יכולים להיות קשים לשכפול בצורה פשוטה או ברוב המעבדות שיש להן גישה לרטט בסיסי. סוגי הוויברטומות או פורסות הרקמות הם רחבים. הם ישתנו בעלות ובמאפיינים הטכניים, כגון מערכת קירור משולבת או לא, אך המאפיין המשותף שלהם הוא מערכת החיתוך שלהם באמצעות סכין גילוח מתנודד. ההבדל העיקרי בכל הנוגע לחיתוך רקמות הוא הדרישה להטמעה. מסיבות ברורות והשפעת ההטמעה על הכדאיות, יש להימנע מכך באופן אידיאלי. דוגמה אחת לפורס ייחוס שאינו דורש הטבעה הוא פורס קרומדיק35. סוג זה של פורס מאפשר לחתוך את הרקמה במאגר מקורר תוך שימוש בליבה, לייצר פרוסות בגודל שווה תוך הימנעות מהטבעה. עם זאת, מכשירים כאלה נוטים להיות יקרים יותר מוויברטומים בסיסיים יותר ופחות נפוצים או זמינים ברוב המעבדות. ויברטומות כמו זו המשמשת בפרוטוקול זה נוטות להיות זמינות כבר לחיתוך רקמות קבועות כימית, אך ידרשו הטמעה של אונות הכבד. יש שהראו כי ניתן להשיג חיתוך פרוסות כבד ללא הטמעה ושימוש בוויברטומה דומה1; עם זאת, מניסיוננו, זה הוכח כקשה לשחזור. כמו כן, בזמן שימוש בסוג זה של ויברטום, חיתוך כבד ללא ג'ל אגרוז תומך בתלת מימד גורם לפרוסות פגומות ולעובי לא אחיד ולכן מגביר את מוות התאים. פרוטוקול זה כולל חיתוך אונת הכבד לרוחב במקום סגיטלית. שלב החיתוך הוא טכניקה שקשה לשלוט בה, ולמיטב ידיעתנו, כיוון החיתוך הוא פרט חשוב שאף פעם לא מתמקדים בו. כיוון האונה במהלך החיתוך יכול להקל באופן דרסטי על תהליך החיתוך תוך הפחתת הלחץ על הכבד. השימוש בהידרוג'ל יכול להיחשב גם כיתרון משופר36.
הקריטריון החשוב הבא הוא הצורך בכמויות גדולות יותר של תרבות כדי להגדיל את הכדאיות. נפחים גבוהים יותר כבר הוצעו כדי לספק יותר חומרים מזינים ולדלל יותר מוצרי חומצות מרה רעילים37. הוספת מערכת דינמית עם טלטול ובשילוב עם שימוש ב-Transwells משפרת את הגישה לחומרים מזינים ופוטנציאל לחמצן לשני הצדדים של הקטע על ידי יצירת זרימה קבועה 18,38,39. השימוש בטרנסוול והיתרון של מערכת דינמית כבר הוכחו בהקשרים שונים, כגון תגובות פרוסת כבד של גידול אנושי28 ולמידול פיברוזיס26,27. פרוטוקול זה מאשר את יתרונם בהיבט פיזיולוגי רחב יותר.
מדיום E של וויליאמס נבחר בדרך כלל כמדיום תרבית תאים סטנדרטי עבור PCLS40,41. מדיה משלימה עם גלוקוז וסרום תוארה עם תועלת פוטנציאלית בשמירה על הכדאיות והפונקציונליות של פרוסות42. ריכוז הגלוקוז במדיה נע בדרך כלל בין 4 ננומטר ל-36 ננומטר43,44, אך לא נמצא קונצנזוס לגבי ההשפעה של ריכוז גלוקוז גבוה יותר על הכדאיות או התגובה החמצונית. נטען כי תוספת של אינסולין או דקסמתזון35 משפרת את הכדאיות לטווח הארוך, אך לא הושגה הסכמה מכיוון שתוספת של תוספים כאלה עלולה לגרום לתנגודת משנית לאינסולין עם השפעה במורד הזרם על הכדאיות45.
נתונים קודמים מראים שקטעים דקים מ-200 מיקרומטר הופכים קשים לחיתוך הומוגני ויכולים להראות מתח חמצוני, בעוד שפרוסות עבות מ-400 מיקרומטר מראות שיעור חדירה נמוך של חומרים מזינים 18,19,46. כמו כן, בהתבסס על מראה PCLS, השפעות על המרקם וקלות החיתוך, מועדף עובי של 250 מיקרומטר. חדירת החומרים המזינים או החומר הטיפולי לשכבות התאים הפנימיות של ה-PCLS משופרת מאוד גם באמצעות טרנסוולס כחלק מהמערכת הדינמית 18,32. בניגוד לשימוש בפורס קרומדיק, שיש לו את היתרון בייצור פרוסות בגודל שווה באמצעות שילוב של מערכת חיתוך ליבה, ניתן להתאים את הפרוטוקול על ידי שינוי גודל הפרוסות במידות שוות לאחר החיתוך. עם זאת, יש לקחת בחשבון את השונות בגודל, במשקל או בתכולת החלבון בניסוי ואת השפעתה על סביבת התרבית, ולכן על הכדאיות והסמנים הביולוגיים. מסיבה זו, קריאות בדיקת ה-MTA, תוך שימוש בפרוטוקול זה, מנורמלות למשקל הטרי של כל פרוסה. כמו כן, ניתן להבחין בהטרוגניות עובי, אך למרבה הצער, סביר להניח שהיא תיצפה באמצעות כל סוגי הפורסות. המשתמש יכול לשקול להשליך את הפרוסות הפחות הומוגניות על ידי הערכת ההיבט שלהן, אך זו עדיין נחשבת לאפשרות לא אמינה ונותרה חיסרון של PCTS. המגבלה העיקרית הקשורה למודל זה נותרה הכדאיות היחסית לטווח הקצר, אך היא נופלת במסגרת הזמן שכבר פורסמה24,31. ניתן לשפר את זמינות החמצן כדי להגביר את הכדאיות הזו. חלק מהפרוטוקולים שפורסמו בעבר דרשו מצע תרבית מורכב וריכוז חמצן גבוה מ-80%, ויסות חילוף החומרים ומתן כדאיות ארוכה יותר 1,24,35,38. קשה גם להשוות ישירות את רמות החמצן המשמשות לחמצון PCLS ורמות החמצן המשמשות לתרבית קווי תאים. הנתונים על השפעות החמצן על הפיזיולוגיה של PCLS מוגבלים מאוד18,47, וריכוז חמצן גבוה יותר עשוי לשנות את הפתופיזיולוגיה ואת הפנוטיפ באופן משמעותי על ידי יצירת מיני חמצן רעילים48.
לסיכום, ניתן לייצר PCLS קצר מועד עם ציוד מוגבל ולהשתמש בו כמודל ex vivo אמין. ארכיטקטורת רקמות היא חיונית בפיזיולוגיה של הכבד, ו-PCLS המאפשר לשמר אותה היא דוגמה נוספת מדוע יש לשקול מודל זה בצורה רווחת יותר. פרוסות חתוכות מדויקות צריכות, אם כן, להפוך לכלי מוכר יותר במחקר מדעי.
Disclosures
אין שום אינטרס מתחרה שצריך לחשוף.
Acknowledgements
המחברים מודים למירבלה בנדול, סמנתה ריצ'רדס, לואיז פישר, רבקה טאונס ולצוות מהשירותים הביולוגיים של UCL על עזרתם בגידול ותחזוקה של מושבות החיות. עבודה זו נתמכה על ידי מימון של מועצת המחקר הרפואי הבריטית MR/T008024/1 (JB) ומרכז המחקר הביו-רפואי של בית החולים גרייט אורמונד סטריט (JB). הדעות המובעות הן של המחבר(ים) ולאו דווקא של ה-NHS או ה-NIHR.
Materials
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
References
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved