Method Article
정밀하게 절단된 간 절편의 생산 및 배양을 위한 최적화되고 단순화된 기술
요약
마우스 간 연구를 위한 PCLS(Precision-cut Liver Slices)의 생산 및 배양을 위한 프로토콜입니다. 이 기사는 비브라톰에 액세스할 수 있는 표준 실험실 장비만 필요하고 최소 4일 동안 PCLS의 생존을 허용하는 프로토콜의 주요 측면에 중점을 둡니다.
초록
이 프로토콜은 PCLS(Precision-cut Liver Slices)의 생성 및 배양을 위한 간단한 시스템을 제공합니다. PCLS는 모든 세포를 온전한 환경에 포함하므로 전체 장기의 미니 모델과 유사합니다. 이를 통해 살아있는 조직을 연구하는 동시에 복잡한 표현형을 복제할 수 있습니다. 이 프로토콜은 비브라톰 및 표준 실험실 장비를 사용하여 마우스 간에서 절편을 준비할 수 있도록 합니다. PCLS를 생산하고 배양하기 위한 프로토콜은 표준화되어 있지 않으며 관심 조직, 사용되는 비브라톰 유형 및 산소의 필요성에 따라 상당히 달라질 수 있습니다. 이는 기본 진동체와 일반적인 조직 배양 시설에만 접근할 수 있는 일부 실험실에서 재현하기 어려울 수 있습니다. 우리는 이미 사용 가능한 다양한 프로토콜 내에서 몇 가지 주요 단계의 중요성에 초점을 맞춘 프로토콜을 구성했습니다. 따라서 이 프로토콜은 임베딩 방법, 절단 방향, 동적 대 정적 시스템, 최소 배양 부피의 관련성의 중요성을 강조합니다. 이 프로토콜은 기본 조직 슬라이서에 액세스할 수 있는 대부분의 실험실에서 간단한 방식으로 확립하고 재현할 수 있습니다. 이 프로토콜을 종합하여 따르면 PCLS는 최소 4일 동안 생존할 수 있습니다. PCLS는 간과 같은 장기에 대한 병태생리학 및 치료적 스크리닝을 연구하기 위한 간단하고 경제적이며 재현 가능한 모델입니다.
서문
정밀 절단 조직 절편(PCTS)은 장기의 얇은 부분입니다. 그들은 미니 장기를 복제하는 기관의 구조를 보존하는 동시에 이웃 세포와 세포 외 기질의 3차원 측면을 보존할 수 있습니다. 조직 구조를 보존하면서 쉽게 접근할 수 있고 비용이 절감되며 노동 집약적이지 않은 특성으로 인해 매력적인 모델입니다.
PCTS는 체외 세포 연구와 생체 내 동물 연구 사이의 간극을 메우며 두 모델의 대부분의 단점을 극복합니다. PCTS는 간1, 장 2,3, 결장2, 뇌 4,5, 폐 6,7,8, 신장 9,10, 비장 11,12, 심장13,14뿐만 아니라 종양15,16과 같은 다양한 기관에서 생성되었습니다. 그들은 또한 마우스1, 쥐17,18뿐만 아니라 돼지19 및 인간 수술 폐기물 15,20,21과 같은 다양한 동물에서 유래 할 수 있습니다. PCTS는 윤리적 관련 문제를 암시하는 동물의 사용을 요구하지만, 한 동물의 장기가 여러 개의 PCTS를 생성할 수 있으므로 NC3Rs 지침(Reduction, Replacement, Refinement)22에 따라 개체 수를 줄이면서 개인 간 변동을 제한할 수 있습니다.
예를 들어 vibratomes23과 같은 개선된 조직 슬라이서의 개발로 인해 두께가 불균일하고 생존율이 낮은 것을 특징으로 하는 수동 절단 절편에서 구조적 무결성이 더 잘 보존된 재현 가능한 더 얇은 절편으로 전환할 수 있었습니다.
그러나 PCTS, 특히 PCLS(Precision-cut Liver Slices) 준비 및 배양에 대한 프로토콜은 문헌에서 크게 다르며 특히 슬라이싱 장비, 배지 함량 및 배양 조건과 같은 필수 매개변수에 대한 표준화가 부족합니다. 프로토콜은 또한 기원 조직에 따라 눈에 띄게 달라질 수 있습니다. 프로토콜 중 일부는 일부 복잡한 생물반응기 시스템을 사용하여 완충액 또는 배양액의 산소화를 필요로 합니다24. 일반적으로 서로 다른 기술적 측면에 개별적으로 초점을 맞추거나 다른 조직을 위해 설계되었으며 종종 비용이 많이 들고 일반 실험실에서 비용 효율적인 방식으로 복제하는 것이 더 어려울 수 있습니다.
여기서, 이 프로토콜은 포매 방법, 절단 방향, 트랜스웰(transwells)25의 사용, 동적 배양 시스템(26 ) 및 최소 배양 부피의 중요성과 같은 몇 가지 핵심 사항을 결합합니다. 이러한 단계 중 일부는 이전에 독립적으로 또는 섬유증27 또는 종양 반응28과 같은 다른 맥락에서 최적화되었습니다. 이 프로토콜은 또한 특정 유형의 슬라이서를 사용한 임베딩의 중요성과 절단 방향을 강조하는데, 이는 모두 마스터하기 어려운 매개변수이며 문헌에서 종종 무시됩니다. 이 간단한 방법은 기초적인 조직 슬라이서에 액세스할 수 있는 표준 실험실 장비를 사용하여 쉽게 설정하고 최소 4일 동안 배양에서 유지되는 PCLS를 생성합니다.
프로토콜
야생형 CD57Bl/6J 마우스는 Charles River Laboratories에서 구입했습니다. 생쥐는 온도와 습도가 조절되고 12시간의 광 주기로 개별적으로 환기가 되는 케이지에 수용된 음식과 물에 자유롭게 접근할 수 있었습니다. 3주가 된 동물을 제물로 바치고, 관류 없이 간을 즉시 적출하였다. 모든 동물 작업은 유니버시티 칼리지 런던 동물 복지 및 윤리 검토 위원회(University College London Animal Welfare and Ethical Review Board)의 현지 윤리 검토에 따라 승인되었으며 Home Office 프로젝트 라이선스 PP9223137 따라 Home Office (Animals) Scientific Procedures Act(1986) 및 ARRIVE 지침에 따라 수행되었습니다. 유니버시티 칼리지 런던(University College London)의 생물 서비스 부서(Biological Services Unit)의 표준 관행에 따라 동물에 대한 피해를 제한하기 위해 모든 노력을 기울였습니다.
1. 실험 설정
- 수확 전날에 다음 단계를 수행하십시오.
- 크렙스 파우더 바이알 1개를 멸균수 1L에 용해시켜 크렙스-헨셀레이트 완충액(KREBS) 1L를 준비합니다. 4°C로 식힌 후 젖은 얼음 위에 올려 보관합니다.
- 트레이를 70% 에탄올로 소독하고 멸균 PBS로 헹굽니다. 은박지로 싸서 트레이를 냉장고에 밤새 보관하면 절단하는 동안 추운 환경을 유지하는 데 도움이 됩니다.
- 다른 모든 분리 가능한 부품에 에탄올을 뿌리고 멸균 PBS로 헹구고 건조시킨 다음 멸균 상태로 유지하십시오. 블레이드를 오토클레이브하고 사용할 때까지 멸균 상태로 유지하십시오.
- 멸균 물에 4% w/v 저융점 아가로스를 준비합니다. 다시 현탁시키고 녹이면 아가로스를 4°C의 냉장고에 보관하십시오.
- 수확 당일과 간 수확 전에 다음 단계를 수행하십시오.
- 4%의 저융점 아가로스를 녹여 사용할 때까지 37°C의 수조에 보관합니다. 사용하기 전에 아가로스가 37°C로 냉각되고 모든 거품이 사라졌는지 확인하십시오.
- 웰당 2.6mL, 1.5mL 및 0.7mL를 각각 6, 12 및 24웰 플레이트에 첨가하여 배양 플레이트를 준비합니다. 각 웰에 8μm 다공성 인서트를 추가합니다. 플레이트를 37°C, 5% CO2 및 21% O2 수준으로 설정된 가습 인큐베이터에 넣습니다. 이렇게 하면 배지를 예열하는 동안 pH를 조정하는 데 도움이 되어 배양 준비가 완료됩니다.
- 다공성 8μm 인서트로 슬라이스를 배양하여 슬라이스의 양쪽 면에 접근할 수 있도록 합니다. 다음과 같이 배지를 준비합니다: William's Medium E(WME), 2mM L-글루타민 보충제, 10% 소 태아 혈청(FBS), 100U/mL 페니실린 및 100μg/mL 스트렙토마이신, 10μg/mL 겐타마이신, 25mM D-글루코스 용액 및 15mM HEPES 용액을 추가합니다.
2. 간 채취 및 준비(15분)
- 수확하기 전에 모든 기구를 살균하십시오.
- 과학적 목적을 위해 동물을 돌보기 위한 현지 절차에 따라 isoflurane 마스크를 사용하여 마우스를 마취합니다. 복강을 열기 전에 발가락 사이를 꼬집어 동물이 제대로 마취되었는지 확인하십시오. 간을 빨리 제거할 수 있는 경우 마우스는 CO2 질식 또는 자궁 경부 탈구로 안락사될 수 있습니다. 시술은 말기 시술이므로 동물에게 영향을 미치지 않으므로 안연고를 사용하지 마십시오.
- 복부에 70% 에탄올을 뿌립니다. 선택 사항: 머리카락이 더럽혀지지 않도록 마우스를 면도합니다.
- 복부 중앙에서 피부와 복막을 잘라 멸균 집게와 가위로 복강을 엽니다. 간을 다른 장기나 혈관으로부터 부드럽게 절개하고 엽이 손상되지 않도록 한다.
- 전체 간을 얼음처럼 차가운 크렙스 버퍼에 즉시 보관하십시오. 4°C의 얼음 위에서 모든 추가 단계를 수행하고 가능한 한 빨리 간 준비를 진행하여 추가 세포 사멸을 방지합니다.
3. 간엽 매립(각 간엽당 25분)
- 얼음처럼 차가운 크렙스 완충액이 들어 있는 얼음 위의 페트리 접시에 간을 옮겨 넣고 간 전체가 완전히 잠겼는지 확인합니다.
- 뭉툭한 집게와 날카롭고 멸균된 칼을 사용하여 엽이 손상되지 않도록 각 엽을 개별적으로 분리합니다.
- 절편을 위한 첫 번째 엽을 선택하고 나머지 엽은 임베딩 및 슬라이싱할 준비가 될 때까지 얼음처럼 차가운 크렙스 버퍼에 보관합니다.
- 모든 가장자리를 잘라 삽입할 준비가 된 직선 모서리가 있는 보다 관리하기 쉬운 로브를 만듭니다. 이것은 또한 섬유질인 Glisson의 캡슐 중 일부를 제거하여 절단을 더욱 용이하게 하는 데 도움이 됩니다. 얼음처럼 차가운 크렙스 완충액에서 간 표면을 적신 상태로 유지하면서 이 작업을 수행합니다.
- 젖은 얼음에 3cm 페트리 접시(또는 이와 유사한 것)를 놓고 4%의 저융 아가로스(이미 37°C 수조에 있음)를 붓습니다. 얼음 위에 잘 보관하여 아가로스가 위쪽 방향으로 식도록 하면서 엽이 바닥으로 가라앉는 것을 방지하고 균일하게 고정합니다.
- 아가로스를 30초 동안 더 식히고 트리밍된 엽을 그 안에 넣습니다. 엽은 아가로스 블록의 중간에 정착합니다. 임베딩 프로세스에는 모든 실험실 조건과 개인 경험에 맞는 연습과 최적화가 필요합니다.
- 얼음 위에 묻힌 엽을 냉장고에 5분 동안 넣습니다. 그런 다음 아가로스를 명확하게 설정해야 합니다.
- 아가로스 블록의 바깥쪽을 잘라냅니다. 접시에서 아가로스 블록을 제거합니다.
- 아가로스를 보다 관리하기 쉬운 크기로 자르고 윗면과 비브라톰 플랫폼에 접착된 면이 로브의 위쪽 가장자리와 평행이 되도록 합니다.
- 가능한 한 빨리 슬라이싱 과정을 시작하되 아가로스 블록은 얼음처럼 차가운 크렙스 버퍼와 얼음 위에 보관해야 합니다.
4. 간 슬라이스 생산 (엽 당 40 분)
- 250μm의 두께, 속도 5, 주파수 7Hz로 절단용 진동을 설정합니다. 이것들은 안내 매개 변수입니다. 사용된 비브라톰의 유형에 따라 최적화가 필요할 수 있습니다.
- 절단하기 전에 비브라톰과 벤치 영역에 70% 에탄올을 분사하여 환경을 가능한 한 멸균 상태로 유지하십시오.
- 트레이를 비브라톰 위에 놓고 그 주위에 얼음을 붓습니다. 블레이드를 아래쪽으로 10° 각도로, 수평으로 아래로 비브라톰에 놓습니다.
- 비브라톰 탱크를 얼음처럼 차가운 크렙스 버퍼로 채웁니다. 플랫폼에 시아노아크릴레이트 접착제를 얇게 바르십시오.
- 멸균 흡수 조직을 사용하여 플랫폼에 접착될 아가로스 블록의 가장자리를 건조시킵니다.
- 아가로스 블록을 이동식 플랫폼에 놓습니다. 로브가 가로로 절단될 수 있도록 로브를 똑바로 세웁니다. 슬라이스의 크기가 줄어들지만 절단하는 동안 로브에 대한 압력을 제한하여 절단 과정을 크게 용이하게 합니다.
- 접착제가 고정될 때까지 1분 동안 기다렸다가 탈착식 플랫폼을 탱크에 담그고 아가로스 블록이 Krebs 버퍼로 완전히 덮여 있는지 확인합니다.
- 시작 및 정지 위치를 설정하여 절단을 위한 진동을 프로그래밍합니다. 간엽에 도달할 때까지 처음에는 두꺼운 조각을 자르기 시작합니다.
- 첫 번째 조각은 올바른 두께로 절단되지 않을 수 있으므로 버리십시오. 조각이 손상되지 않도록 집게나 브러시 대신 주걱을 사용하여 간 조각을 모으십시오.
알림: 70% 에탄올로 소독하고 멸균 PBS로 헹군 작은 브러시를 사용하여 절단 과정에서 조직을 부드럽게 안내할 수도 있습니다. - 필요한 슬라이스 수에 도달할 때까지 이 과정을 반복합니다. 엽은 때때로 아가로스에서 떨어져 나와 더 이상 사용하지 못할 수 있습니다. 배양될 때까지 슬라이스를 얼음처럼 차가운 크렙스 완충액에 모읍니다.
5. 간 절편의 배양
- 주걱을 사용하여 슬라이스를 매체와 삽입물이 들어 있는 준비된 웰로 옮깁니다.
- 플레이트를 오비탈 셰이커에 놓고 속도를 130rpm으로 설정한 다음 37°C에서 5% CO2 및 21% O2의 기존 세포 배양 인큐베이터를 사용하여 배양합니다. 배양의 최종 부피는 6, 12 및 24웰 플레이트에서 웰당 각각 2.6mL, 1.5mL 및 0.7mL입니다.
- 배양된 슬라이스가 들어 있는 배양 플레이트 아래에 빈 플레이트 하나를 놓아 셰이커의 플랫폼에서 발생하는 과도한 열을 발산할 수 있도록 합니다. 48시간마다 매체를 교체하십시오.
6. 세포 생존 분석
- 400μL의 예열된 완전한 Williams' Medium E 배지를 포함하는 48웰 플레이트로 슬라이스를 옮기고 80μL의 MTS(3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium) 테트라졸륨 시약을 추가합니다.
- 37°C에서 1시간 동안 배양한 후 5% CO2 를 셰이커에 넣고 200μL의 매체를 96웰 플레이트로 옮기고 멀티웰 플레이트 리더를 사용하여 490nm에서 흡광도를 측정합니다. PBS의 벤치에 남겨두고 실온에서 24시간 동안 네거티브 대조군으로 사용하십시오.
7. 조직학 염색
- 크실렌과 에탄올을 사용하여 섹션을 탈파라핀화하고 재수화한 다음 탈이온수를 사용합니다. Hematoxylin 용액으로 섹션을 3분 동안 염색합니다.
- 탈이온수로 5분 동안 헹굽니다. 산 에탄올(농축 HCL 1mL 및 70% 에탄올 400mL)에 빠르게 10배 담그십시오.
- 탈이온수에 2번 헹구고 여분의 물을 닦아냅니다. 섹션을 Eosin에 30초 동안 담그십시오.
- 95% 에탄올로 탈수한 다음 100% 에탄올로 각각 3회씩 5분 동안 탈수합니다. 절편을 자일렌에 3회씩 15분씩 담급니다. 슬라이드에 커버 슬립을 놓습니다.
결과
수확 시 장기의 신속한 처리를 보장하고 장기 손상을 방지하기 위해 동물의 관류를 의도적으로 생략합니다. 절개 후 간을 신속하게 추출하고 즉시 얼음처럼 차가운 장기 보호 완충액(예: Krebs 완충액24,29)에 넣습니다. 임베딩하지 않고 신선한 간 조직을 절단하는 것은이전에 설명되었지만1, 장기 보호 버퍼와 결합된 저융점 아가로스30(그림 1)에 간을 임베딩하면 진동체에서 최적의 절단 조건을 얻을 수 있어 조직 손상을 줄이고 절편 두께의 재현성을 높일 수 있습니다. 얇은 절편은 더 많은 세포층이 영양소와 산소에 접근할 수 있도록 하고31 세포 사멸을 줄이기 때문에 조직 두께가 중요합니다. 그러나 너무 얇은 단면은 균일하게 절단하기 어려워집니다. 반대로 400μm보다 두꺼운 슬라이스는 영양소의 침투율이 낮습니다. 절편을 인서트(그림 1)를 사용하여 액체-공기 계면에서 배양하고 셰이커에서 37°C에서 5%CO2 및 21%O2로 배양했습니다. 절편은 수확 후 3시간 이내에 배양 배지에서 배양해야 하며, 그 후 세포 사멸이 빠르게 발생합니다32.
PCLS의 생존력을 결정하기 위해 4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium(MTS) 분석으로 세포 생존율을 평가했으며, 이는 MTS를 줄이기 위해 NAD(P)H 의존성 탈수소효소, 즉 대사 활성 세포가 필요합니다.MTS 값은 각 슬라이스 가중치로 정규화되었습니다. PCLS 생존력을 최적화하기 위해서는 배양 24시간 후 생존력을 유지하기 위해 최소한의 배양 배지가 필수적이었습니다. 24개의 웰 플레이트에서 0.7mL의 부피는 12개의 웰 플레이트에서 1.5mL, 6개의 웰 플레이트에서 2.6mL에 비해 TMS 분석에 의한 생존율(p = 0.02)의 현저한 감소를 보여주었습니다(그림 2A). 이러한 볼륨은 섹션을 약간 덮을 수 있도록 선택되었지만 사용된 인서트 및 플레이트의 유형에 따라 조정이 필요할 수 있습니다. 다른33과 마찬가지로 12개의 웰 플레이트는 더 적은 양의 배양 배지 내에서 최적의 생존을 위한 최상의 절충안으로 사용됩니다.
진탕은 필수적이며 정적 배양에 비해 배양 후 24시간에 PCLS 생존율을 50% 증가시킵니다(그림 2B). 쉐이킹은 트랜스웰 사용으로 최적화된 중요한 공기-액체 계면을 생성하여 단면의 양쪽 면에 영양분과 산소에 접근할 수 있도록 합니다. 산소와 영양소의 흡수는 또한 트랜스웰 멤브레인을 통과하는 흔들림 운동에 의해 생성되는 일정한 흐름에 의해 증가합니다.
MTS 분석은 배양 1시간부터 배양 6일차까지 평가되었습니다. 세포 생존율은 배양 후 0일째부터 4일째까지 일정하게 유지된 후 6일째에 유의한 감소(p = 0.05)를 관찰했습니다(그림 2C). 헤마톡실린 및 에오신(H&E) 염색으로 평가한 PCLS 형태는 배양 후 최대 5일까지 담관 및 구조에 변화가 없는 것으로 나타났습니다(그림 3A-D). 0일(그림 3A)과 비교했을 때, PCLS는 배양 후 1일(그림 3B)과 2일(그림 3C)에 조직학적 차이를 보이지 않았으며, 핵 과색소증, 경미한 염증성 침윤, 배양 후 5일째에 중등도의 세포 사멸 과정을 선호했습니다(그림 3D). 종합하면, 이 PCLS 배양 프로토콜은 최소 4일 동안 생존력을 가능하게 하며, 이는 유사한 조건에서 절편을 사용한 연구와 일치합니다31.

그림 1: PCLS를 생성하기 위한 프로토콜을 요약한 회로도. 이 수치는34에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: PCLS 배양의 최적화된 프로토콜은 5일 동안 만족스러운 생존력을 보여줍니다. (A) 세포 증식에 대한 웰 크기의 효과(n=3). (B) 세포 증식에 대한 진탕의 영향(조건당 n=6). (C) 배양 d0일에서 d6일까지의 간 절편에서 MTS 세포 증식 분석(시점당 n=5). OD 임의 단위로, 새로운 가중치를 슬라이스하도록 정규화됩니다. 그래프는 평균 ± SD를 보여줍니다. 짝을 이루지 않은 2-tailed 스튜던트 t-검정, ns=유의하지 않음, *p<0.05, **p<0.01. 이 수치는34에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
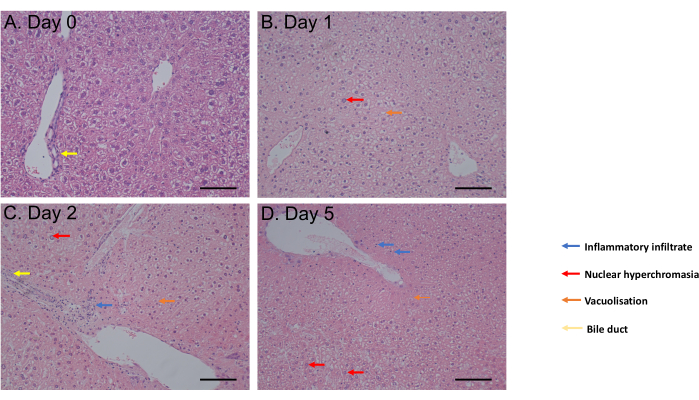
그림 3: 조직학 결과. (A-D) H&E 염색 후 간 PCLS의 조직학의 대표적인 이미지. 눈금자 = 100μM. 이 수치는34에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
우리는 PCLS의 생산 및 배양이 최소 4일의 반감기를 보장하면서 쉽게 달성될 수 있음을 보여줍니다. 이 프로토콜은 이러한 유형의 비브라톰이 사용되는 경우 임베딩 방법, 절단 방향, 동적 배양 시스템, 최소 배양 부피 및 인서트 사용의 5가지 중요한 단계를 요약합니다.
PCLS의 생산 및 배양을 위한 프로토콜이 일반적으로 사용 가능합니다. 그러나 표준화가 부족합니다. 프로토콜의 유사하고 구체적인 지점에 초점을 맞출 수 있지만 간단한 방식으로 복제하거나 기본 진동에 액세스할 수 있는 대부분의 실험실에서 복제하기 어려울 수 있습니다. 진동자 또는 조직 슬라이서의 종류는 넓습니다. 통합 냉각 시스템의 유무와 같은 비용 및 기술적 특수성은 다양하지만 공통적인 특징은 진동 면도날을 사용하는 절단 시스템입니다. 조직 슬라이싱과 관련된 주요 차이점은 임베딩에 대한 요구 사항입니다. 명백한 이유와 임베딩이 생존 가능성에 미치는 영향 때문에 이상적으로는 피해야 합니다. 임베딩이 필요하지 않은 참조 슬라이서의 한 예는 Krumdieck 슬라이서(35)입니다. 이러한 유형의 슬라이서는 코어를 사용하는 동안 냉각된 버퍼에서 조직을 절단할 수 있도록 하여 포매를 피하면서 균일한 크기의 슬라이스를 생성할 수 있습니다. 그러나, 이러한 장치는 더 많은 염기성 진동자보다 더 비싸고, 대부분의 실험실에서 덜 일반적으로 사용되거나 이용 가능한 경향이 있다. 이 프로토콜에 사용된 것과 같은 진동종은 화학적으로 고정된 조직을 절단하는 데 이미 사용할 수 있는 경향이 있지만 간엽의 매립이 필요합니다. 일부는 유사한 비브라톰 1을 삽입하고 사용하지 않고도 간 절편을 절단할 수 있음을 보여주었습니다. 그러나 우리의 경험에 따르면 이것은 재현하기 어려운 것으로 입증되었습니다. 또한 이러한 유형의 비브라톰을 사용하는 동안 3D 지원 아가로스 젤 없이 간 슬라이싱을 하면 슬라이스가 손상되고 두께가 고르지 않아 세포 사멸이 증가합니다. 이 프로토콜은 간엽을 궁수형이 아닌 가로로 절단하는 것입니다. 절단 단계는 마스터하기 어려운 기술이며, 우리가 아는 한 절단 방향은 결코 초점을 맞추지 않는 중요한 세부 사항입니다. 절단 중 로브의 방향은 간에 가해지는 압력을 줄이면서 절단 과정을 크게 촉진할 수 있습니다. 하이드로겔의 사용은 또한 개선된 혜택으로 간주될 수 있다36.
다음으로 중요한 기준은 생존 가능성을 높이기 위해 더 많은 양의 배양이 필요하다는 것입니다. 더 많은 양이 더 많은 영양분을 제공하고 더 많은 독성 담즙산 생성물을 희석하기 위해 이미 제안되었습니다37. 진탕을 동반한 동적 시스템을 추가하고 트랜스웰을 사용하여 일정한 흐름을 생성함으로써 단면의 양쪽 면에 영양분과 잠재적으로 산소에 대한 접근을 향상시킵니다 18,38,39. 트랜스웰의 사용과 동적 시스템의 이점은 인간 종양 간 절편 반응 28 및 섬유증 모델링26,27과 같은 다양한 맥락에서 이미 입증되었습니다. 이 프로토콜은 더 넓은 생리학적 측면에서 이점을 확인합니다.
Williams의 Medium E는 일반적으로 PCLS40,41의 표준 세포 배양 배지로 선택됩니다. 포도당 및 혈청으로 보충된 배지는 절편의 생존력 및 기능을 보존하는 데 잠재적인 이점을 갖는 것으로 설명되어 왔다42. 매체의 포도당 농도는 일반적으로 4 nM에서 36 nM 43,44 사이이지만 더 높은 포도당 농도가 생존 능력이나 산화 반응에 미치는 영향에 대해서는 합의가 이루어지지 않았습니다. 인슐린 또는 덱사메타손(dexamethasone)35의 첨가는 장기적인 생존력을 향상시킨다고 주장되지만, 이러한 보충제의 첨가는 잠재적으로 생존력에 대한 다운스트림 효과와 함께 2차 인슐린 저항성을 유발할 수 있기 때문에 합의에 도달하지 못했다45.
이전 데이터에 따르면 200μm보다 얇은 절편은 균일하게 절단하기 어려워지고 산화 스트레스를 나타낼 수 있는 반면, 400μm보다 두꺼운 절편은 영양소의 낮은 침투율을 보여줍니다 18,19,46. 또한 PCLS 외관, 질감에 미치는 영향 및 절단 용이성에 따라 250μm의 두께가 선호됩니다. PCLS의 내부 세포층에 있는 영양소 또는 치료제의 침투는 또한 동적 시스템 18,32의 일부로 트랜스웰을 사용하여 크게 개선됩니다. 코어 절단 시스템의 통합을 통해 균일한 크기의 슬라이스를 생산할 수 있는 장점이 있는 Krumdieck 슬라이서를 사용하는 것과는 대조적으로, 슬라이싱 후 동일한 치수로 슬라이스의 크기를 조정하여 프로토콜을 조정할 수 있습니다. 그러나 실험에서 크기, 중량 또는 단백질 함량의 가변성과 배양 환경에 미치는 영향, 따라서 생존력 및 바이오마커에 미치는 영향을 고려해야 합니다. 이러한 이유로 MTA 분석 판독값은 이 프로토콜을 사용하는 동안 각 슬라이스의 새로운 중량으로 정규화됩니다. 또한 두께 이질성을 관찰할 수 있지만 불행히도 모든 유형의 슬라이서를 사용하여 관찰할 수 있습니다. 사용자는 측면을 평가하여 가장 균일하지 않은 슬라이스를 버리는 것을 고려할 수 있지만 이는 여전히 신뢰할 수 없는 옵션으로 간주되며 PCTS의 단점으로 남아 있습니다. 이 모델과 관련된 주요 한계는 상대적인 단기 생존 가능성으로 남아 있지만 이미 발표된 기간 내에 있습니다24,31. 이러한 생존력을 높이기 위해 산소 가용성을 높일 수 있습니다. 이전에 발표된 일부 프로토콜은 복잡한 배양 배지와 산소 농도가 80% 이상이어야 하며, 이는 신진대사를 상향 조절하고 더 긴 생존력을 제공해야 합니다 1,24,35,38. 또한 PCLS에 산소를 공급하는 데 사용되는 산소 수준과 세포주를 배양하는 데 사용되는 산소 수준을 직접 비교하는 것도 어렵습니다. 산소가 PCLS 생리학에 미치는 영향에 대한 데이터는 매우 제한적이며, 18,47 산소농도가 높을수록 독성 활성산소종을 생성함으로써 병태생리학 및 표현형을 실질적으로 변형시킬 수 있다48.
결론적으로, 수명이 짧은 PCLS는 제한된 장비로 생산할 수 있으며 신뢰할 수 있는 생체 외 모델로 사용할 수 있습니다. 조직 구조는 간 생리학에서 매우 중요하며, 이를 보존할 수 있는 PCLS는 이 모델을 보다 보편적인 방식으로 고려해야 하는 또 다른 예입니다. 따라서 정밀하게 절단된 슬라이스는 과학 연구에서 더 인정받는 도구가 되어야 합니다.
공개
공개해야 할 경쟁 이해관계는 없습니다.
감사의 말
저자는 동물 군집의 번식과 유지에 도움을 준 Mirabela Bandol, Samantha Richards, Louise Fisher, Rebecca Towns 및 UCL Biological Services의 직원에게 감사를 표합니다. 이 연구는 영국 의학 연구 위원회(United Kingdom Medical Research Council) 임상의 과학자 펠로우십 MR/T008024/1(JB) 및 NIHR Great Ormond Street Hospital Biomedical Research Centre(JB)의 자금 지원을 받았습니다. 표현된 견해는 저자의 견해이며 반드시 NHS 또는 NIHR의 견해는 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
참고문헌
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유