Method Article
精密にカットされた肝臓スライスの生産と培養のための最適化および簡素化された技術
要約
マウス肝臓の研究のための精密カット肝臓スライス(PCLS)の生産と培養のためのプロトコル。この記事では、ビブラトームにアクセスできる標準的な実験装置のみを必要とし、PCLSを最低4日間生存させることができるという、プロトコルの主要な側面に焦点を当てています。
要約
このプロトコルは、精密カット肝臓スライス(PCLS)の作成と培養のための簡単なシステムを提供します。PCLSは、すべての細胞を無傷の環境に含まれているため、臓器全体のミニモデルに似ています。彼らは、複雑な表現型を再現しながら、生きた組織の研究を可能にします。このプロトコルでは、ビブラトームと標準的な実験装置を使用してマウス肝臓からスライスを調製することができます。PCLSの作製と培養のためのプロトコルは標準化されておらず、目的の組織、使用するビブラトームの種類、酸素の必要性によって大きく異なります。これらは、基本的なビブラトームと一般的な組織培養施設しか利用できない一部の研究室では再現が難しい場合があります。私たちは、すでに利用可能なさまざまなプロトコル内のいくつかの重要なステップの重要性に焦点を当てたプロトコルをまとめました。したがって、このプロトコルは、埋め込み方法、切断方向、動的システムと静的システム、および最小量の培養の関連性の重要性を強調しています。このプロトコールは、基本的な組織スライサーを利用できるほとんどの研究室で簡単な方法で確立および再現できます。このプロトコルに従えば、PCLSは最低4日間生存することができます。PCLSは、肝臓などの臓器の病態生理学的および治療的スクリーニングを研究するための、シンプルで経済的、かつ再現性の高いモデルです。
概要
精密切開組織切片(PCTS)は、臓器の薄い切片です。それらは、隣接する細胞と細胞外マトリックスの3次元側面を維持しながら、ミニ臓器を複製する器官の構造の保存を可能にします。これは、組織のアーキテクチャを維持しながら、アクセスが容易で、コストを節約し、労働集約的でない特性により、魅力的なモデルです。
PCTSは、in vitro細胞研究とin vivo動物研究の間のギャップを埋め、両モデルのほとんどの欠点を克服します。PCTSは、肝臓1、腸2、3、結腸2、脳4,5、肺6,7,8、腎臓9,10、脾臓11,12、心臓13,14などのさまざまな臓器から生成されていますが、腫瘍15,16も生成されています。それらはまた、マウス1、ラット17,18だけでなく、ブタ19およびヒトの外科的廃棄物15,20,21のような様々な動物に由来することができる。PCTSは動物の使用を要求し、倫理的な問題を示唆しているが、1匹の動物の臓器は複数のPCTSを生成することができ、それによりNC3Rsガイドライン(Reduction、Replacement、Refinement)22に準拠して動物の数を減らし、個体間のばらつきを制限する。
改良された組織スライサー、例えば、ビブラトーム23の開発により、不均一な厚さと低い生存率を特徴とする手作業で切断されたスライスから、構造的完全性がよりよく保存された再現性のあるより薄いスライスへの移行が可能になりました。
しかし、PCTS、より具体的には精密カット肝臓スライス(PCLS)の調製と培養のプロトコルは、文献によって大きく異なり、特にスライス装置、培地含有量、培養条件などの重要なパラメータについて標準化されていません。プロトコルは、起源の組織によっても著しく異なる場合があります。いくつかのプロトコルは、いくつかの複雑なバイオリアクターシステム24を用いて、緩衝液または培養物の酸素化を必要とするであろう。通常、それらは異なる技術的側面に個別に焦点を当てているか、異なる組織用に設計されているため、多くの場合、コストがかかり、平均的な実験室で費用対効果の高い方法で再現するのがより困難になる可能性があります。
ここで、このプロトコルは、埋め込み方法、切断の方向、トランズウェル25の使用、動的培養システム26 、および最小限の培養量の重要性などのいくつかの重要なポイントをまとめています。これらのステップの一部は、以前は独立して、または線維症27 または腫瘍反応28のように異なる状況で最適化されてきた。このプロトコルは、特定の種類のスライサーを使用した埋め込みの重要性と、習得が難しいパラメーターであり、文献では無視されがちな切断の向きも強調しています。この簡単な方法は、簡単なセットアップと、基本的な組織スライサーにアクセスできる標準的な実験装置を使用して、最低4日間培養に保持されたPCLSを生成します。
プロトコル
野生型CD57Bl/6JマウスはCharles River Laboratoriesから購入しました。マウスは、温度と湿度の条件が制御され、12時間の光サイクルで個別に換気されたケージに収容され、餌と水に自由にアクセスできました。生後3週間の動物を屠殺し、肝臓を灌流せずに速やかに収穫しました。すべての動物作業は、ユニバーシティ・カレッジ・ロンドンの動物福祉・倫理審査委員会による現地の倫理審査を経て承認され、内務省のプロジェクトライセンスPP9223137に基づき、内務省(動物)科学手続法(1986年)およびARRIVEガイドラインに従って実施されました。ユニバーシティ・カレッジ・ロンドンのバイオロジカル・サービス・ユニットの標準的な慣行に従って、動物への危害を制限するためにあらゆる努力が払われました。
1. 実験の準備をする
- 収穫の前日に、次の手順を実行してください。
- クレブス粉末のバイアル1本を1Lの滅菌水に溶解して、クレブス・ヘンセライト緩衝液(KREBS)1Lを調製します。4°Cまで冷まし、濡れた氷の上に置いてください。
- トレイを70%エタノールで消毒し、滅菌PBSですすいでください。トレイを錫ホイルで包んで冷蔵庫に一晩置いておけば、切断中に寒い環境を保つことができます。
- 他のすべての取り外し可能な部品にエタノールをスプレーし、滅菌PBSですすぎ、乾燥させて、滅菌状態に保ちます。ブレードをオートクレーブし、使用するまで無菌状態に保ちます。
- 滅菌水に4% w/v低融点アガロースを調製します。再懸濁して溶かしたら、アガロースを4°Cの冷蔵庫で保存します。
- 収穫日と肝臓の収穫前に、次の手順を実行してください。
- 4%低融点アガロースを溶かし、使用するまで37°Cの水浴に保管します。使用前に、アガロースが37°Cまで冷え、すべての気泡が消えていることを確認してください。
- ウェルあたりそれぞれ2.6 mL、1.5 mL、および0.7 mLを6、12、および24ウェルプレートに添加して、培養プレートを調製します。各ウェルに8μmの多孔質インサートを追加します。プレートを37°C、5%CO2、および21%O2 レベルに設定された加湿インキュベーターに入れます。これにより、培地を温めながらpHを調整することができ、培地を培養する準備が整います。
- 多孔質の8μmインサートでスライスを培養し、スライスの両面にアクセスできるようにします。次のように培地を準備します:William's Medium E(WME)に、2 mM L-グルタミンサプリメント、10%ウシ胎児血清(FBS)、100 U / mLペニシリン、100 μg / mLストレプトマイシン、10 μg / mLゲンタマイシン、25 mM D-グルコース溶液、15 mM HEPES溶液。.
2. 肝臓の採取と調製 (15分)
- 収穫前にすべての器具を滅菌してください。
- イソフルランマスクを使用して、科学的な目的で動物の世話をするための地域の手順に従ってマウスに麻酔をかけます。腹腔を開く前に、つま先の間をつまんで、動物が適切に麻酔されていることを確認してください。肝臓を迅速に除去できる場合、マウスはCO2 窒息または子宮頸部脱臼によって安楽死させることができます。この処置は末期の処置であるため、動物に影響を与えないため、眼軟膏を使用しないでください。
- 腹部に70%エタノールをスプレーします。オプション:髪の毛の混入を防ぐためにマウスを剃ります。
- 腹部の中央から皮膚と腹膜を切開することにより、滅菌鉗子とはさみで腹腔を開きます。肝臓を他の臓器や血管からそっと解剖し、葉を傷つけないようにします。
- 肝臓全体は、氷冷したクレブスバッファーにすぐに保管してください。4°Cの氷上ですべてのステップを実行し、細胞死を防ぐためにできるだけ早く肝臓の準備に進みます。
3.肝葉の埋め込み(肝葉ごとに25分)
- 肝臓を氷冷したクレブス緩衝液を含む氷の上のシャーレに移し、肝臓全体が完全に沈んでいることを確認します。
- 鈍い鉗子と鋭利な滅菌ナイフを使用して、各ローブを個別に分離し、ローブの損傷を防ぎます。
- セクショニング用の最初のローブを選択し、残りのローブを氷冷したクレブスバッファーに保持します。これは、埋め込みとスライスの準備ができるまでです。
- すべてのエッジをカットして、埋め込みの準備ができているストレートエッジを備えた、より扱いやすいローブを取得します。これはまた、繊維状のグリッソン嚢の一部を除去して、切片化をさらに促進するのに役立ちます。これは、肝臓の表面を氷のように冷たいクレブスバッファーで濡らしたままにしながら行います。
- 3cmのシャーレ(または同様のもの)を濡れた氷の上に置き、4%の低融点アガロース(すでに37°Cの水浴中)を注ぎます。アガロースが上方向に冷えるように氷の上に置いておくと、ローブが底に沈み込み、均一に埋め込まれるのを防ぎます。
- アガロースを放置してさらに30秒間冷却し、トリミングしたローブをアガロースに入れます。ローブはアガロースブロックの中央に落ち着きます。埋め込みプロセスには、すべてのラボ条件と個人的な経験に適した練習と最適化が必要です。
- 埋め込まれたローブを氷の上に置いたまま、冷蔵庫に5分間置きます。その後、アガロースを明確に設定する必要があります。
- アガロースブロックの外側を切り取ります。アガロースブロックを皿から取り除きます。
- アガロースをより扱いやすいサイズにカットし、上側とビブラートプラットフォームに接着された側がローブの上端と平行になるようにします。
- できるだけ早くスライスプロセスを開始しますが、アガロースブロックが氷のように冷たいクレブスバッファーと氷上に保持されていることを確認してください。
4.肝臓スライスの生産(ローブあたり40分)
- 切断用ビブラトームを厚さ250μm、速度5、周波数7Hzに設定します。これらはガイドパラメータです。使用するビブラトームのタイプによっては、最適化が必要な場合があります。
- 切断する前に、ビブラトームとベンチエリアに70%エタノールをスプレーして、環境をできるだけ無菌に保ちます。
- トレイをビブラートに置き、その周りに氷を注ぎます。ブレードを下向きに10°、水平より下に10°の角度でビブラトームに置きます。
- ビブラトームタンクに氷冷したクレブスバッファーを入れます。シアノアクリレート接着剤の薄層をプラットフォームに置きます。
- プラットフォームに接着されるアガロースブロックの端を、滅菌済みの吸収組織を使用して乾燥させます。
- アガロースブロックを取り外し可能なプラットフォームに置きます。ローブを直立させて、横方向に切断できるようにします。スライスのサイズは小さくなりますが、これにより、切断中のローブに対する圧力が制限されるため、切断プロセスが大幅に容易になります。
- 接着剤が固まるまで1分待って取り外し可能なプラットフォームをタンクに沈め、アガロースブロックがクレブスバッファーで完全に覆われていることを確認します。
- 開始位置と停止位置を設定して、カット用のビブラトームをプログラムします。肝葉に達するまで、最初に厚いスライスの切断を開始します。
- 最初のスライスは、正しい厚さにカットされていない可能性があるため、破棄します。スライスの損傷を避けるために、鉗子やブラシの代わりにヘラを使用して肝臓スライスを収集します。
注:70%エタノールで消毒し、滅菌PBSですすいだ小さなブラシを使用して、切断プロセス中に組織を優しくガイドすることもできます。 - 必要なスライス数に達するまで、このプロセスを繰り返します。ローブがアガロースから外れることがあり、それ以上の使用が妨げられます。スライスを氷冷したクレブスバッファーに培養するまで集めます。
5.肝臓スライスのインキュベーション
- スパチュラを使用して、スライスを培地とインサートを含む準備済みのウェルに移します。
- プレートをオービタルシェーカーに置き、速度を130rpmに設定し、従来の細胞培養インキュベーターを使用して5%CO2および21%O2を37°Cでインキュベートします。 培養の最終容量は、ウェルあたり2.6 mL、1.5 mL、および24ウェルプレートで1.5 mL、および0.7 mLです。
- 培養中のスライスが入った培養プレートの下に空のプレートを1つ置き、シェーカーのプラットフォームから発生する過度の熱を放散できるようにします。48時間ごとに媒体を交換してください。
6. 細胞生存アッセイ
- 予熱した完全Williams' Medium E培地400 μLを含む48ウェルプレートにスライスを移し、80 μLのMTS(3-(4,5-ジメチルチアゾール-2-イル)-5-(3-カルボキシメトキシフェニル)-2-(4-スルホフェニル)-2H-テトラゾリウム)テトラゾリウム試薬を加えます。
- 37°C、5% CO2 で1時間インキュベートした後、シェーカー上で200μLの培地を96ウェルプレートに移し、マルチウェルプレートリーダーを使用して490nmでの吸光度を測定します。PBSのベンチに放置されたスライスを、室温で24時間ネガティブコントロールとして使用します。
7. 組織学染色
- キシレンとエタノールを使用して切片を脱パラフィンして再水和し、続いて脱イオン水を使用します。切片をヘマトキシリン溶液で3分間染色します。
- 脱イオン水で5分間すすいでください。酸性エタノール(濃縮HCL1 mLと70%エタノール400 mL)に10倍すばやく浸します。
- 脱イオン水に2倍すすぎ、余分な水を吸い取ります。切片をエオシンに30秒間浸します。
- 95%エタノールに脱水し、次に100%エタノールを5分間、各3回脱水します。切片をキシレンに3回ずつ15分間浸します。スライドにカバースリップを置きます。
結果
収穫時には、臓器の迅速な処理を確保し、臓器の損傷を防ぐために、動物の灌流は意図的に省略されます。肝臓は切開後すぐに抽出され、すぐに氷のように冷たい臓器保護緩衝液、例えば、クレブス緩衝液24,29に入れられます。埋め込まずに新鮮な肝臓組織をスライスすることは以前に説明されていますが1、低融点のアガロース30(図1)に肝臓を埋め込み、臓器保護バッファーと組み合わせることで、ビブラトーム上での最適な切断条件が可能になり、組織の損傷が軽減され、切片の厚さの再現性が向上します。薄い切片は、より多くの細胞層が栄養素と酸素31にアクセスし、細胞死を減らすことを可能にするため、組織の厚さは重要です。しかし、薄すぎる切片は均一に切断するのが難しくなります。逆に、400μmより厚いスライスは、栄養素の浸透率が低くなります。切片をインサート(図1)を用いて液体-空気界面でインキュベートし、シェーカー上で37°Cで5%CO2および21%O2とインキュベートしました。切片は、収穫後3時間以内に培地中でインキュベートし、その後、細胞死が急速に起こる32。
PCLSの生存率を決定するために、細胞生存率は4,5-ジメチルチアゾール-2-イル)-5-(3-カルボキシメトキシフェニル)-2-(4-スルホフェニル)-2H-テトラゾリウム(MTS)アッセイによって評価されました。これには、NAD(P)H依存性デヒドロゲナーゼ、すなわち代謝活性細胞が必要です。MTS値は、それぞれのスライス重量に正規化されています。PCLSの生存率を最適化するためには、24時間のインキュベーション後も生存率を維持するために、最小限の量の培地が不可欠でした。24ウェルプレート中の0.7 mLの容量は、TMSアッセイによる生存率の有意な低下を示しました(p = 0.02)12ウェルプレートで1.5 mL、6ウェルプレートで2.6 mL(図2A)。これらのボリュームは、セクションをわずかに覆うことができるように選択されていますが、使用するインサートやプレートのタイプによっては調整が必要な場合があります。他の33と同様に、12ウェルプレートは、少量の培地内で最適な生存のための最良の妥協点として使用されます。
振とうは必須であり、インキュベーション後24時間でPCLSの生存率が静止培養と比較して50%向上します(図2B)。振とうと、トランズウェルを使用して最適化された重要な気液界面が作成され、セクションの両面に栄養素と酸素へのアクセスが可能になります。酸素と栄養素の取り込みは、振とう動作によって生成される一定の流れによっても増加し、それはトランズウェル膜も通過します。
MTS アッセイは、1 時間のインキュベーションからインキュベーションの 6 日目まで評価しました。細胞生存率はインキュベーション後0日目から4日目まで一定でしたが、6日目に有意な減少(p = 0.05)が観察されました(図2C)。ヘマトキシリンおよびエオシン(H&E)染色によって評価されたPCLS形態は、インキュベーション後5日まで胆管および構造の変化を示さなかった(図3A-D)。0日目(図3A)と比較して、PCLSはインキュベーション後1日目(図3B)および2日目(図3C)に組織学的差を示さず、核高色素性、軽度の炎症性浸潤、空胞化により、インキュベーション後5日目に中等度の細胞死プロセスを支持しました(図3D)。まとめると、このPCLS培養プロトコルは、同様の条件でスライスを使用した研究と一致して、少なくとも4日間の生存率を可能にする31。

図1:PCLSを生成するためのプロトコルをまとめた概略図。 この数値は34から変更されています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:PCLS培養の最適化されたプロトコルは、5日間で十分な生存率を示しています。 (A)ウェルサイズが細胞増殖に及ぼす影響(n = 3)。(B)細胞増殖に対する振とうの影響(条件あたりn = 6)。(C)インキュベーションのd0からd6日までの肝臓切片からのMTS細胞増殖アッセイ(n=5/時点)。OD任意の単位、新鮮な重量をスライスするように正規化。グラフは平均±SDを示しています。対応のない両側スチューデントのt検定、ns=有意ではない、*p<0.05、**p<0.01。この数値は34から変更されています。 この図の拡大版を表示するには、ここをクリックしてください。
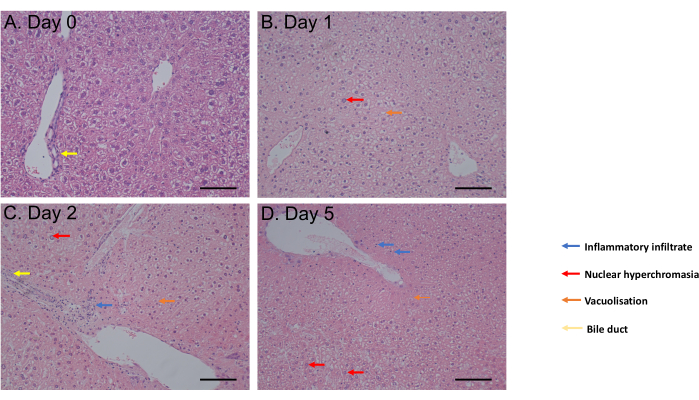
図3:組織学の結果。 (A-D)H&E染色後の肝臓PCLSの組織学の代表的な画像。スケールバー = 100 μM。この数値は34から変更されています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
PCLSの作製と培養は、少なくとも4日間の半減期を確保しながら簡単に達成できることを実証しています。このプロトコルは、このタイプのビブラートを使用する場合の埋め込み方法、切断の向き、動的な培養システム、最小限の培養量、およびインサートの使用という5つの重要なステップを要約しています。
PCLSの生産と培養のためのプロトコルは一般的に利用可能です。ただし、標準化が欠けています。それらは、プロトコルの類似した特定のポイントに焦点を当てているかもしれませんが、簡単な方法で再現したり、基本的なビブラトームにアクセスできるほとんどのラボで再現するのは難しい場合があります。ビブラトームやティッシュスライサーの種類は多岐にわたります。それらは、統合された冷却システムを持っているかどうかなど、コストと技術的な特異性が異なりますが、共通の特徴は、振動するカミソリの刃を使用した切断システムです。組織のスライスに関する主な違いは、埋め込みの要件です。明らかな理由と、埋め込みが生存率に与える影響を考えると、理想的には避けるべきです。埋め込みを必要としない参照のスライサーの一例は、Krumdieckスライサー35です。このタイプのスライサーは、コアを使用しながら冷却されたバッファーで組織を切断することができ、埋め込みを避けながら均一なサイズのスライスを生成することができます。しかし、このような装置は、より基本的なビブラトームよりも高価になる傾向があり、ほとんどの研究室であまり一般的に使用されていないか、または利用できません。このプロトコルで使用されるようなバイブラトームは、化学的に固定された組織の切断にすでに利用できる傾向がありますが、肝葉の埋め込みが必要になります。肝臓スライスの切断は、同様のビブラートームを埋め込んで使用せずに達成できることを示す人もいます1。しかし、私たちの経験では、これを再現するのは難しいことが証明されています。また、このタイプのビブラトームを使用している間、3D支持アガロースゲルなしで肝臓をスライスすると、スライスが損傷し、厚さが不均一になり、細胞死が増加します。このプロトコルでは、肝葉を矢状ではなく横方向に切断します。切断ステップは習得するのが難しい技術であり、私たちの知る限り、切断方向は決して焦点を当てることのない重要な詳細です。切断中のローブの向きは、肝臓への圧力を軽減しながら、切断プロセスを大幅に促進することができます。ハイドロゲルの使用は、改善された利点36と見なすこともできる。
次に重要な基準は、生存率を高めるためには、より多くの培養が必要であるということです。より多くの栄養素を提供し、より有毒な胆汁酸製品を希釈するために、より多くの量がすでに提案されています37。振とうと動的システムを追加し、トランズウェルの使用と組み合わせると、一定の流れ18,38,39を作り出すことにより、セクションの両側面への栄養素と潜在的に酸素へのアクセスが改善されます。トランズウェルの使用と動的システムの利点は、ヒト腫瘍の肝臓スライス応答28や線維症のモデリング26,27など、さまざまな状況ですでに証明されています。このプロトコルは、より広範な生理学的側面におけるそれらの利点を確認します。
Williamsの培地Eは、PCLS40,41の標準的な細胞培養培地として一般的に選択されています。グルコースおよび血清を添加した培地は、スライス42の生存率および機能性を維持する上での潜在的有益性を有することが記載されている。培地中のグルコース濃度は通常、4 nMから36 nM43,44の間で変動しますが、高グルコース濃度が生存率または酸化応答に及ぼす影響についてはコンセンサスは見つかりませんでした。インスリンまたはデキサメタゾン35の追加は、長期的な生存率を改善すると主張されているが、そのようなサプリメントの追加は、生存率45に対する下流の影響を与える二次的なインスリン抵抗性を潜在的に誘発する可能性があるため、コンセンサスに達していない。
以前のデータでは、200μmより薄い切片は均一に切断するのが難しく、酸化ストレスを示す可能性がある一方で、400μmより厚い切片は栄養素の浸透率が低いことが示されています18,19,46。また、PCLSの外観、風合いへの影響、切断のしやすさなどから、厚さは250μmが好まれます。PCLSの内部細胞層における栄養素または治療剤の浸透も、ダイナミックシステム18,32の一部としてトランズウェルを使用して大幅に改善される。コア切断システムの統合を通じて均一なサイズのスライスを生成する利点を持つKrumdieckスライサーの使用とは対照的に、プロトコルはスライス後にスライスを等しい寸法にサイズ変更することによって適応させることができます。ただし、実験では、サイズ、重量、またはタンパク質含有量の変動性、およびそれが培養環境、したがって生存率とバイオマーカーに与える影響を考慮する必要があります。このため、MTAアッセイの測定値は、このプロトコルを使用している間、各スライスの新鮮な重量に正規化されます。また、膜厚の不均一性も観察できますが、残念ながら、すべての種類のスライサーを使用して観察される可能性があります。ユーザーは、その様相を評価することで、最も均質でないスライスを破棄することを検討することもできますが、これは依然として信頼性の低いオプションと見なされ、PCTSの欠点のままです。このモデルに関連する主な制限は、相対的な短期的な実行可能性のままですが、すでに公開されている時間枠内に収まります 24,31。酸素の利用可能性を高めて、そのような生存率を高めることができます。以前に発表されたいくつかのプロトコルは、複雑な培養培地と80%を超える酸素濃度を必要とし、代謝をアップレギュレーションし、より長い生存率を提供しました1,24,35,38。また、PCLSの酸素化に使用される酸素レベルと細胞株の培養に使用される酸素レベルを直接比較することも困難です。PCLS生理学に対する酸素の影響に関するデータは非常に限られており18,47、より高い酸素濃度は、有毒な活性酸素種48を生成することにより、病態生理学および表現型を大幅に変更する可能性があります。
結論として、短寿命のPCLSは限られた装置で作製し、信頼性の高い ex vivo モデルとして使用することができます。組織構造は肝臓の生理学において重要であり、PCLSがそれを保存することを可能にすることは、このモデルがより一般的な方法で考慮されるべき理由の別の例です。したがって、精密にカットされたスライスは、科学研究においてより認識されるツールになるはずです。
開示事項
開示すべき競合する利益はありません。
謝辞
著者は、ミラベラ・バンドール、サマンサ・リチャーズ、ルイーズ・フィッシャー、レベッカ・タウンズ、およびUCLバイオロジカルサービスのスタッフに、動物のコロニーの繁殖と維持を支援してくれたことに感謝します。この研究は、英国医学研究評議会の臨床医科学者フェローシップMR/T008024/1(JB)およびNIHRグレートオーモンドストリート病院生物医学研究センター(JB)からの資金提供によって支援されました。表明された見解は著者のものであり、必ずしもNHSまたはNIHRの見解ではありません。
資料
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
参考文献
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved