Method Article
Technique optimisée et simplifiée pour la production et la culture de tranches de foie coupées avec précision
Dans cet article
Résumé
Un protocole pour la production et la culture de tranches de foie coupées avec précision (PCLS) pour l’étude des foies de souris. L’article se concentre sur les aspects clés du protocole, qui ne nécessite qu’un équipement de laboratoire standard avec accès à un vibratome et permet la survie du PCLS pendant un minimum de 4 jours.
Résumé
Ce protocole présente un système simple pour la création et la culture de tranches de foie coupées avec précision (PCLS). Le PCLS contient toutes les cellules dans un environnement intact et, par conséquent, ressemble à un mini-modèle de l’organe entier. Ils permettent d’étudier les tissus vivants tout en reproduisant leurs phénotypes complexes. Ce protocole permet la préparation de coupes à partir de foies de souris à l’aide d’un vibratome et d’un équipement de laboratoire standard. Les protocoles de production et de culture du PCLS manquent de standardisation et peuvent varier considérablement en fonction du tissu d’intérêt, du type de vibratome utilisé et du besoin d’oxygène. Ceux-ci peuvent être difficiles à reproduire dans certains laboratoires qui n’ont accès qu’à un vibratome de base et à des installations de culture de tissus communes. Nous avons mis au point un protocole axé sur l’importance de certaines étapes clés au sein des différents protocoles déjà disponibles. Ce protocole met donc l’accent sur l’importance de la méthode d’encastrement, de l’orientation de la coupe, d’un système dynamique versus statique, et de la pertinence d’un volume minimum de culture. Ce protocole peut être établi et reproduit de manière simple dans la plupart des laboratoires qui ont accès à un slicer tissulaire de base. Dans l’ensemble et en suivant ce protocole, le PCLS peut rester en vie pendant au moins 4 jours. Le PCLS est un modèle simple, économique et reproductible pour étudier le dépistage physiopathologique et thérapeutique d’organes tels que le foie.
Introduction
Les coupes de tissu découpées avec précision (PCTS) sont de fines sections d’organes. Ils permettent de préserver l’architecture de l’organe en répliquant un mini-organe tout en préservant l’aspect tridimensionnel des cellules voisines et de la matrice extracellulaire. Il s’agit d’un modèle attrayant en raison de sa facilité d’accès, de ses économies et de ses caractéristiques moins exigeantes en main-d’œuvre tout en préservant l’architecture tissulaire.
Les PCTS comblent un vide entre les études cellulaires in vitro et la recherche animale in vivo, en surmontant la plupart des inconvénients des deux modèles. La PCTS a été générée à partir de divers organes, tels que le foie1, les intestins 2,3, le côlon2, le cerveau 4,5, le poumon 6,7,8, le rein 9,10, la rate11,12, le cœur 13,14 mais aussi les tumeurs15,16. Ils peuvent également provenir de divers animaux, tels que la souris1, le rat17,18 mais aussi le porc19 et les déchets chirurgicaux humains 15,20,21. Bien que les PCTS nécessitent l’utilisation d’animaux, ce qui implique des problèmes éthiques, l’organe d’un animal peut générer plusieurs PCTS, réduisant ainsi le nombre d’animaux en accord avec les directives NC3R (Réduction, Remplacement, Raffinement)22 tout en limitant les variations interindividuelles.
La mise au point de trancheurs tissulaires améliorés, par exemple les vibratomes23, a permis de passer de tranches coupées manuellement caractérisées par une épaisseur hétérogène et un faible taux de survie à des tranches plus minces reproductibles avec une intégrité structurelle mieux préservée.
Cependant, les protocoles pour la préparation et la culture des PCTS et, plus précisément, des tranches de foie coupées avec précision (PCLS) varient considérablement dans la littérature et manquent de normalisation, en particulier pour des paramètres essentiels tels que l’équipement de tranchage, le contenu du milieu et les conditions de culture. Les protocoles peuvent également varier sensiblement en fonction du tissu d’origine. Certains des protocoles nécessiteront l’oxygénation du tampon ou de la culture avec des systèmes de bioréacteur compliqués24. Ils se concentrent généralement individuellement sur différents aspects techniques ou sont conçus pour différents tissus et peuvent souvent être coûteux et plus difficiles à reproduire dans un laboratoire moyen de manière rentable.
Ici, ce protocole rassemble quelques points clés tels que la méthode d’encastrement, le sens de coupe, l’utilisation de transwells25, un système de culture dynamique26 et l’importance d’un volume minimal de culture. Certaines de ces étapes ont déjà été optimisées indépendamment ou dans un contexte différent, comme la fibrose27 ou la réponse tumorale28. Ce protocole met également l’accent sur l’importance de l’enrobage à l’aide de certains types de slicers et de l’orientation de la coupe, deux paramètres difficiles à maîtriser et souvent négligés dans la littérature. Cette méthode simple génère des PCLS maintenus en culture pendant au moins 4 jours avec une installation facile et à l’aide d’un équipement de laboratoire standard avec accès à une trancheuse de tissus rudimentaire.
Protocole
Des souris CD57Bl/6J de type sauvage ont été achetées aux Laboratoires Charles River. Les souris avaient un accès libre à la nourriture et à l’eau, logées dans des cages ventilées individuellement avec des conditions de température et d’humidité contrôlées et avec un cycle de lumière de 12 heures. Les animaux âgés de 3 semaines ont été sacrifiés, et les foies ont été rapidement récoltés sans perfusion. Tous les travaux sur les animaux ont été approuvés à la suite d’un examen éthique local par le Conseil d’examen et de bien-être des animaux de l’University College London et effectués dans le cadre d’une licence de projet du ministère de l’Intérieur PP9223137 et conformément à la loi sur les procédures scientifiques du ministère de l’Intérieur (animaux) (1986) et aux directives ARRIVE. Tous les efforts ont été déployés pour limiter les dommages causés aux animaux, conformément à la pratique courante de l’unité des services biologiques de l’University College London.
1. Préparez-vous à l’expérience
- La veille de la récolte, effectuez les étapes suivantes.
- Préparez 1 L de tampon Krebs-Henseleit (KREBS) en dissolvant un flacon de poudre Krebs dans 1 L d’eau stérile. Refroidissez-le à 4 °C et conservez-le sur de la glace humide.
- Désinfectez le plateau avec de l’éthanol à 70 % et rincez avec du PBS stérile. Conservez le plateau enveloppé dans du papier d’aluminium au réfrigérateur pendant la nuit pour aider à maintenir un environnement froid pendant la coupe.
- Vaporisez toutes les autres pièces amovibles avec de l’éthanol, rincez avec du PBS stérile, laissez sécher et maintenez-les stériles. Autoclavez les lames et maintenez-les stériles jusqu’à utilisation.
- Préparez de l’agarose à bas point de fusion à 4 % p/v dans de l’eau stérile. Une fois remis en suspension et fondu, conservez l’agarose au réfrigérateur à 4 °C.
- Le jour de la récolte et avant la récolte du foie, effectuez les étapes suivantes.
- Faites fondre l’agarose à bas point de fusion à 4 % et conservez-la dans un bain-marie à 37 °C jusqu’à utilisation. Assurez-vous que l’agarose a refroidi à 37 °C et que toutes les bulles se sont dissipées avant utilisation.
- Préparez les plaques de culture en ajoutant respectivement 2,6 ml, 1,5 ml et 0,7 ml par puits dans des plaques de 6, 12 et 24 puits. Ajoutez des inserts poreux de 8 μm dans chaque puits. Placez les plaques dans un incubateur humidifié réglé à 37 °C, 5 % de CO2 et 21 % de niveau O2 . Cela aidera à ajuster le pH tout en réchauffant le substrat, afin qu’il soit prêt pour la culture.
- Cultivez les tranches avec des inserts poreux de 8 μm pour permettre l’accès aux deux faces de la tranche. Préparez le milieu comme suit : Ajoutez-le au milieu E de William’s (WME), à 2 mM de supplément de L-glutamine, à 10 % de sérum de veau fœtal (FBS), à 100 μg/mL de pénicilline, à 100 μg/mL de streptomycine, à 10 μg/mL de gentamycine, à 25 mM de solution de D-glucose et à 15 mM de solution d’HEPES.
2. Prélèvement du foie et préparation (15 min)
- Stérilisez tous les instruments avant la récolte.
- Anesthésier la souris selon les procédures locales pour le soin des animaux à des fins scientifiques à l’aide d’un masque isoflurane. Avant d’ouvrir la cavité abdominale, pincez entre les orteils pour vous assurer que l’animal est correctement anesthésié. Si le foie peut être retiré rapidement, la souris peut être euthanasiée par asphyxie au CO2 ou luxation cervicale. Comme il s’agit d’une procédure terminale, n’utilisez pas de pommade oculaire car cela n’affecterait pas l’animal.
- Vaporisez l’abdomen avec de l’éthanol à 70 %. Facultatif : Rasez la souris pour éviter la contamination par les poils.
- Ouvrez la cavité abdominale à l’aide d’une pince stérile et de ciseaux en coupant la peau et le péritoine à partir du milieu de l’abdomen. Disséquez doucement le foie des autres organes ou vaisseaux et évitez d’endommager les lobes.
- Conservez immédiatement le foie entier dans un tampon Krebs glacé. Effectuez toutes les étapes suivantes sur la glace à 4 °C et procédez à la préparation du foie le plus rapidement possible pour éviter une nouvelle mort cellulaire.
3. Enrobage des lobes hépatiques (25 min pour chaque lobe hépatique)
- Transférez le foie dans une boîte de Pétri sur de la glace contenant un tampon Krebs glacé, en vous assurant que tout le foie est complètement immergé.
- Séparez chaque lobe individuellement à l’aide d’une pince émoussée et d’un couteau tranchant et stérile pour éviter d’endommager les lobes.
- Choisissez le premier lobe pour la section et conservez les lobes restants dans un tampon Krebs glacé jusqu’à ce qu’ils soient prêts pour l’enrobage et le tranchage.
- Coupez tous les bords pour obtenir un lobe plus facile à gérer avec des bords droits prêts à être intégrés. Cela aidera également à retirer une partie de la capsule fibreuse de Glisson pour faciliter davantage la section. Faites-le tout en gardant les surfaces du foie humides dans un tampon Krebs glacé.
- Placez une boîte de Pétri de 3 cm (ou similaire) sur de la glace humide et versez-y l’agarose à bas point de fusion à 4 % (déjà dans un bain-marie à 37 °C). Conservez bien sur de la glace pour permettre à l’agarose de refroidir vers le haut tout en empêchant le lobe de s’enfoncer au fond et en l’incrustant uniformément.
- Laissez l’agarose refroidir pendant 30 secondes et placez-y le lobe taillé. Le lobe va se déposer au milieu du bloc d’agarose. Le processus d’intégration nécessite de la pratique et de l’optimisation pour s’adapter à chaque condition de laboratoire et à chaque expérience personnelle.
- Placez le lobe encastré, toujours sur de la glace, au réfrigérateur pendant 5 min. L’agarose doit alors être clairement pris.
- Coupez l’extérieur du bloc d’agarose. Délogez le bloc d’agarose du plat.
- Coupez l’agarose à une taille plus gérable, en veillant à ce que la face supérieure et la face collée à la plate-forme du vibratome soient parallèles au bord supérieur du lobe.
- Commencez le processus de tranchage le plus rapidement possible, mais assurez-vous que le bloc d’agarose est conservé dans un tampon Krebs glacé et sur de la glace.
4. Production de tranches de foie (40 min par lobe)
- Réglez le vibratome pour la coupe à une épaisseur de 250 μm, avec une vitesse de 5 et une fréquence de 7 Hz. Ce sont des paramètres directeurs ; Selon le type de vibratome utilisé, cela peut nécessiter une optimisation.
- Vaporisez le vibratome et la paillasse avec de l’éthanol à 70 % avant la coupe pour garder l’environnement aussi stérile que possible.
- Placez le plateau sur le vibratome et versez de la glace tout autour. Placez les lames sur le vibratome à un angle de 10° vers le bas et en dessous de l’horizontale.
- Remplissez le réservoir du vibratome avec un tampon Krebs glacé. Placez une fine couche de colle cyanoacrylate sur la plate-forme.
- Séchez le bord du bloc d’agarose qui sera collé sur la plate-forme à l’aide d’un tissu absorbant stérile.
- Placez le bloc d’agarose sur la plate-forme amovible. Positionnez le lobe à la verticale pour lui permettre d’être coupé transversalement. Bien que la taille des tranches soit réduite, cela facilite considérablement le processus de coupe en limitant la pression contre le lobe pendant la coupe.
- Attendez 1 min que la colle prenne et immergez la plate-forme amovible dans le réservoir et assurez-vous que le bloc d’agarose est complètement recouvert d’un tampon Krebs.
- Programmez le vibratome pour la coupe en réglant les positions de démarrage et d’arrêt. Commencez par couper des tranches plus épaisses jusqu’à ce que le lobe du foie soit atteint.
- Jetez la première tranche, car elle pourrait ne pas être coupée à la bonne épaisseur. Pour éviter d’endommager les tranches, utilisez une spatule pour recueillir les tranches de foie au lieu de pinces ou de brosses.
REMARQUE : Une petite brosse désinfectée à 70 % d’éthanol et rincée avec du PBS stérile peut également être utilisée pour guider doucement le tissu pendant le processus de coupe. - Répétez le processus jusqu’à ce que le nombre requis de tranches soit atteint. Le lobe peut parfois se déloger de l’agarose, empêchant toute utilisation ultérieure. Recueillir les tranches dans un tampon Krebs glacé jusqu’à la culture.
5. Incubation de tranches de foie
- Transférez les tranches, à l’aide d’une spatule, dans les puits préparés contenant le milieu et les inserts.
- Placez les plaques sur un agitateur orbital, réglez la vitesse à 130 tr/min et incubez à l’aide d’un incubateur de culture cellulaire conventionnel avec 5 % de CO2 et 21 % d’O2 à 37 °C. Le volume final de culture est de 2,6 ml, 1,5 ml et 0,7 ml par puits dans des plaques de 6, 12 et 24 puits, respectivement.
- Placez une plaque vide sous la plaque de culture contenant les tranches en culture pour permettre à toute chaleur excessive provenant de la plate-forme de l’agitateur de se dissiper. Changez de milieu toutes les 48 h.
6. Essai de survie cellulaire
- Transférez les tranches dans une plaque à 48 puits contenant 400 μL de média complet Williams’s Medium E préchauffé et ajoutez 80 μL de réactif de tétrazolium MTS (3-(4,5-diméthylthiazol-2-yl)-5-(3-carboxyméthoxyphényl)-2-(4-sulfophényl)-2H-tétrazolium).
- Après une incubation de 1 h à 37 °C, 5 % de CO2 dans un agitateur, transvaser 200 μL de milieu dans une plaque à 96 puits et mesurer l’absorbance à 490 nm à l’aide d’un lecteur de plaques multipuits. Utilisez des tranches laissées sur la paillasse dans du PBS et à température ambiante pendant 24 h comme témoins négatifs.
7. Coloration histologique
- Déparaffiniser et réhydrater les sections à l’aide de xylène et d’éthanol, puis d’eau déminéralisée. Colorer les sections avec une solution d’hématoxyline pendant 3 min.
- Rincer à l’eau déminéralisée pendant 5 min. Trempez rapidement 10 fois dans de l’éthanol acide (1 mL de HCL concentré et 400 mL d’éthanol à 70 %).
- Rincez 2 fois à l’eau déminéralisée et épongez l’excès d’eau. Trempez les tronçons dans Eosin pendant 30 s.
- Déshydrater en éthanol à 95 %, puis à 100 % d’éthanol pendant 5 min, 3 fois chacun. Tremper les sections dans le xylène 3x pendant 15 minutes chacune. Placez les lamelles sur les diapositives.
Résultats
Lors de la récolte, la perfusion de l’animal est délibérément omise pour assurer un traitement rapide de l’organe et éviter les lésions organiques. Le foie est extrait rapidement après l’incision et immédiatement placé dans un tampon protecteur d’organe glacé, par exemple le tampon Krebs24,29. Bien que le tranchage de tissu hépatique frais sans enrobage aitété décrit précédemment1, l’enrobage du foie dans de l’agarose à faible point de fusion30 (Figure 1) combiné à un tampon protecteur d’organe permettra des conditions de coupe optimales sur le vibratome, réduisant les lésions tissulaires et augmentant la reproductibilité de l’épaisseur de la section. L’épaisseur des tissus est essentielle car les sections minces permettent à davantage de couches cellulaires d’accéder aux nutriments et à l’oxygène31 et de réduire la mort cellulaire. Cependant, les sections trop fines deviennent difficiles à couper de manière homogène. À l’inverse, les tranches de plus de 400 μm d’épaisseur présenteront un taux de pénétration des nutriments plus faible. Les sections ont été incubées dans une interface liquide-air à l’aide d’un insert (figure 1) et incubées avec 5 % de CO2 et 21 % d’O2 à 37 °C sur un agitateur. Les sections doivent être incubées dans un milieu de culture dans les 3 heures suivant la récolte, après quoi la mort cellulaire se produit rapidement32.
Pour déterminer la viabilité du PCLS, la viabilité cellulaire a été évaluée par un test de 4,5-diméthylthiazol-2-yl)-5-(3-carboxyméthoxyphényl)-2-(4-sulfophényl)-2H-tétrazolium (MTS), qui nécessite des déshydrogénases NAD(P)H-dépendantes, c’est-à-dire des cellules métaboliquement actives, pour réduire le MTS. Les valeurs MTS ont été normalisées en fonction du poids de la tranche respective. Pour optimiser la viabilité du PCLS, un volume minimal de milieu de culture était essentiel pour maintenir la viabilité après 24 h d’incubation. Un volume de 0,7 mL dans les plaques de 24 puits a montré une réduction significative de la viabilité par dosage par SMT (p = 0,02) comparativement à 1,5 mL dans les plaques de 12 puits et à 2,6 mL dans les plaques de 6 puits (figure 2A). Ces volumes ont été choisis pour permettre de couvrir légèrement les sections, mais ils peuvent nécessiter des ajustements en fonction du type d’inserts et de plaques utilisés. Comme d’autresplaques 33, 12 puits sont utilisées comme le meilleur compromis pour une survie optimale dans un plus petit volume de milieu de culture.
L’agitation est essentielle et augmente la viabilité du PCLS de 50 % 24 h après l’incubation par rapport à une culture statique (figure 2B). L’agitation crée une interface air-liquide critique, optimisée grâce à l’utilisation de puits de transbordement, permettant l’accès aux nutriments et à l’oxygène sur les deux faces de la section. L’absorption d’oxygène et de nutriments est également augmentée par le flux constant créé par le mouvement de secousse, qui passe également à travers la membrane du transwell.
Le test MTS a été évalué de 1 h d’incubation jusqu’au jour 6 de l’incubation. La viabilité cellulaire est demeurée constante du jour 0 au jour 4 après l’incubation avant d’observer une diminution significative (p = 0,05) au jour 6 (figure 2C). La morphologie du PCLS évaluée par coloration à l’hématoxyline et à l’éosine (H&E) n’a montré aucun changement des voies biliaires et de l’architecture jusqu’à 5 jours après l’incubation (figure 3A-D). Par rapport au jour 0 (Figure 3A), la PCLS n’a montré aucune différence histologique au jour 1 (Figure 3B) et au jour 2 (Figure 3C) après l’incubation, avec une hyperchromasie nucléaire, un infiltrat inflammatoire léger, une vacuolisation en faveur d’un processus de mort cellulaire modéré au jour 5 après l’incubation (Figure 3D). L’ensemble de ce protocole de culture PCLS permet une viabilité d’au moins 4 jours, ce qui correspond à des études utilisant des coupes dans des conditions similaires31.

Figure 1 : Schéma résumant le protocole de génération de PCLS. Ce chiffre a été modifié par rapport à34. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Le protocole optimisé de la culture PCLS montre une viabilité satisfaisante pendant 5 jours. (A) Effet de la taille du puits sur la prolifération cellulaire (n=3). (B) Effet de l’agitation sur la prolifération cellulaire (n = 6 par condition). (C) Test de prolifération cellulaire MTS à partir de coupes de foie de j0 à j6 jours d’incubation (n = 5 par point temporel). OD unité arbitraire, normalisée pour trancher le poids frais. Le graphique montre la moyenne ± écart-type. Test t de Student non apparié à 2 queues, ns = non significatif, *p<0,05, **p<0,01. Ce chiffre a été modifié par rapport à34. Veuillez cliquer ici pour voir une version agrandie de cette figure.
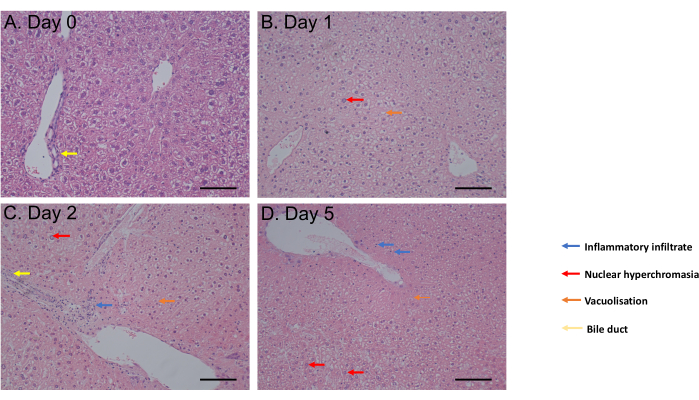
Figure 3 : Résultats histologiques. (A-D) Images représentatives de l’histologie du PCLS hépatique après coloration H&E. Barre d’échelle = 100 μM. Ce chiffre a été modifié par rapport à34. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Nous démontrons que la production et la culture de PCLS peuvent être facilement réalisées tout en assurant une demi-vie d’au moins 4 jours. Ce protocole récapitule cinq étapes critiques : la méthode d’encastrement si ce type de vibratome est utilisé, l’orientation de la coupe, un système dynamique de culture, un volume minimal de culture et l’utilisation d’inserts.
Des protocoles pour la production et la culture du PCLS sont couramment disponibles. Cependant, ils manquent de standardisation ; Ils peuvent se concentrer sur des points similaires et spécifiques du protocole, mais peuvent être difficiles à reproduire de manière simple ou dans la plupart des laboratoires qui ont accès à un vibratome de base. Les types de vibratomes ou de trancheuses de tissus sont larges. Ils varient en termes de coût et de spécificités techniques, comme le fait d’avoir un système de refroidissement intégré ou non, mais leur caractéristique commune est leur système de coupe à l’aide d’une lame de rasoir oscillante. La principale différence en ce qui concerne les mouchoirs à trancher est la nécessité d’enrobage. Pour des raisons évidentes et l’impact de l’intégration sur la viabilité, il devrait idéalement être évité. Un exemple de slicer de référence qui ne nécessite pas d’intégration est le slicerKrumdieck 35. Ce type de trancheuse permet de couper le tissu dans un tampon refroidi tout en utilisant un noyau, produisant des tranches de taille uniforme tout en évitant l’encastrement. Cependant, ces appareils ont tendance à être plus coûteux que les vibratomes plus basiques et moins couramment utilisés ou disponibles dans la plupart des laboratoires. Les vibratomes tels que celui utilisé dans ce protocole ont tendance à être déjà disponibles pour la coupe des tissus fixés chimiquement, mais nécessiteront l’enrobage des lobes hépatiques. Certains ont montré qu’il est possible de couper des tranches de foie sans enrober et utiliser un vibratome similaire1 ; Cependant, d’après notre expérience, cela s’est avéré difficile à reproduire. De plus, lors de l’utilisation de ce type de vibratome, le tranchage du foie sans gel d’agarose de support 3D provoque des tranches endommagées et une épaisseur inégale et, par conséquent, augmente la mort cellulaire. Ce protocole consiste à couper le lobe du foie transversalement au lieu de sagittaire. L’étape de coupe est une technique difficile à maîtriser, et à notre connaissance, l’orientation de la coupe est un détail important sur lequel on ne se concentre jamais. L’orientation du lobe pendant la coupe peut faciliter considérablement le processus de coupe tout en réduisant la pression sur le foie. L’utilisation de l’hydrogel pourrait également être considérée comme un bénéfice amélioré36.
Le prochain critère important est la nécessité d’augmenter les volumes de culture pour accroître la viabilité. Des volumes plus élevés ont déjà été suggérés pour fournir plus de nutriments et diluer plus de produits toxiques à base d’acides biliaires37. L’ajout d’un système dynamique avec secousses et combiné à l’utilisation de Transwells améliore l’accès aux nutriments et potentiellement à l’oxygène sur les deux faces de la section en créant un débit constant 18,38,39. L’utilisation de transwell et l’avantage d’un système dynamique ont déjà été prouvés dans différents contextes, tels que les réponses en coupe de foie de tumeur humaine28 et pour la modélisation de la fibrose26,27. Ce protocole confirme leur avantage dans un aspect physiologique plus large.
Le milieu E de Williams est couramment choisi comme milieu de culture cellulaire standard pour PCLS40,41. Des milieux supplémentés en glucose et en sérum ont été décrits avec un avantage potentiel dans la préservation de la viabilité et de la fonctionnalité des tranches42. La concentration de glucose dans les milieux varie généralement entre 4 nM et 36 nM43,44, mais aucun consensus n’a été trouvé sur l’effet d’une concentration plus élevée de glucose sur la viabilité ou la réponse oxydative. L’ajout d’insuline ou de dexaméthasone35 est censé améliorer la viabilité à long terme, mais aucun consensus n’a été atteint car l’ajout de tels suppléments pourrait potentiellement induire une résistance secondaire à l’insuline avec un effet en aval sur la viabilité45 .
Les données précédentes montrent que les sections de plus de 200 m d’épaisseur deviennent difficiles à couper de manière homogène et peuvent présenter un stress oxydatif, tandis que les tranches de plus de 400 m d’épaisseur présentent un faible taux de pénétration des nutriments 18,19,46. De plus, sur la base de l’aspect PCLS, des effets sur la texture et de la facilité de coupe, une épaisseur de 250 μm est privilégiée. La pénétration des nutriments ou de l’agent thérapeutique dans les couches cellulaires internes du PCLS est également grandement améliorée à l’aide de transwells dans le cadre du système dynamique 18,32. Contrairement à l’utilisation de la trancheuse Krumdieck qui présente l’avantage de produire des tranches de taille égale grâce à l’intégration d’un système de coupe de noyau, le protocole peut être adapté en redimensionnant les tranches en dimensions égales après le tranchage. Cependant, la variabilité de la taille, du poids ou de la teneur en protéines doit être prise en compte dans l’expérience et son impact sur l’environnement de culture et, par conséquent, sur la viabilité et les biomarqueurs. Pour cette raison, les lectures d’analyse MTA, lors de l’utilisation de ce protocole, sont normalisées en fonction du poids frais de chaque tranche. De plus, une hétérogénicité d’épaisseur peut être observée, mais malheureusement, elle est susceptible d’être observée en utilisant tous les types de trancheurs. L’utilisateur pourrait envisager d’éliminer les tranches les moins homogènes en évaluant leur aspect, mais cela reste considéré comme une option peu fiable et reste un inconvénient du PCTS. La principale limitation associée à ce modèle reste la viabilité relative à court terme, mais il s’inscrit dans le délai déjà publié 24,31. La disponibilité de l’oxygène pourrait être améliorée pour accroître cette viabilité. Certains protocoles précédemment publiés nécessitaient des milieux de culture complexes et une concentration en oxygène supérieure à 80 %, régulant à la hausse le métabolisme et offrant une viabilité plus longue 1,24,35,38. Il est également difficile de comparer directement les niveaux d’oxygène utilisés pour oxygéner les PCLS et les niveaux d’oxygène utilisés pour cultiver des lignées cellulaires. Les données sur les effets de l’oxygène sur la physiologie du PCLS sont très limitées18,47, et une concentration plus élevée d’oxygène est susceptible de modifier considérablement la physiopathologie et le phénotype en générant des espèces réactives toxiques de l’oxygène48.
En conclusion, les PCLS à courte durée de vie peuvent être produits avec un équipement limité et utilisés comme un modèle ex vivo fiable. L’architecture tissulaire est cruciale dans la physiologie du foie, et le PCLS permettant de la préserver est un autre exemple de la raison pour laquelle ce modèle devrait être considéré de manière plus prédominante. Les tranches découpées avec précision devraient donc devenir un outil plus reconnu dans la recherche scientifique.
Déclarations de divulgation
Il n’y a aucun intérêt concurrent à divulguer.
Remerciements
Les auteurs remercient Mirabela Bandol, Samantha Richards, Louise Fisher, Rebecca Towns et le personnel des services biologiques de l’UCL pour leur aide dans la reproduction et l’entretien des colonies animales. Ce travail a été soutenu par le financement de la bourse MR/T008024/1 (JB) du Medical Research Council du Royaume-Uni et du Centre de recherche biomédicale (JB) du NIHR Great Ormond Street Hospital. Les opinions exprimées sont celles de l’auteur ou des auteurs et ne sont pas nécessairement celles du NHS ou du NIHR.
matériels
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
Références
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon