Method Article
Оптимизированная и упрощенная технология производства и культивирования прецизионно нарезанных ломтиков печени
В этой статье
Резюме
Протокол производства и культивирования прецизионно нарезанных срезов печени (PCLS) для исследования печени мышей. В статье основное внимание уделяется ключевым аспектам протокола, который требует только стандартного лабораторного оборудования с доступом к вибратому и позволяет выживать PCLS в течение как минимум 4 дней.
Аннотация
Этот протокол представляет собой простую систему для создания и культивирования прецизионно нарезанных ломтиков печени (PCLS). PCLS содержит все клетки в неповрежденной среде и, следовательно, напоминает мини-модель целого органа. Они позволяют изучать живые ткани, воспроизводя их сложные фенотипы. Этот протокол позволяет проводить подготовку срезов из печени мышей с помощью вибратома и стандартного лабораторного оборудования. Протоколы производства и культивирования PCLS не стандартизированы и могут сильно различаться в зависимости от интересующей ткани, типа используемого вибратома и потребности в кислороде. Их может быть трудно воспроизвести в некоторых лабораториях, которые имеют доступ только к базовому вибратому и обычным средствам для культивирования тканей. Мы составили протокол, в котором особое внимание уделяется важности некоторых ключевых шагов в рамках уже имеющихся протоколов. Таким образом, этот протокол подчеркивает важность метода встраивания, ориентацию разреза, динамическую систему по сравнению со статической, а также актуальность минимального объема культуры. Этот протокол может быть разработан и воспроизведен простым способом в большинстве лабораторий, имеющих доступ к базовому срезу тканей. В совокупности и в соответствии с этим протоколом PCLS может оставаться в живых не менее 4 дней. PCLS является простой, экономичной и воспроизводимой моделью для изучения патофизиологического и терапевтического скрининга таких органов, как печень.
Введение
Прецизионно вырезанные срезы тканей (ПКТ) представляют собой тонкие срезы органов. Они позволяют сохранить архитектуру органа, реплицирующегося мини-органом, сохраняя при этом трехмерный аспект соседних клеток и внеклеточного матрикса. Это привлекательная модель благодаря легкому доступу, экономичности и менее трудоемким характеристикам при сохранении архитектуры ткани.
ПКТ заполняет пробел между исследованиями клеток in vitro и исследованиями in vivo на животных, преодолевая большинство недостатков обеих моделей. ПКТС был получен из различных органов, таких как печень1, кишечник 2,3, толстая кишка2, мозг 4,5, легкие 6,7,8, почки 9,10, селезенка11,12, сердце13,14, а также опухоли15,16. Они также могут происходить от различных животных, таких как мышь1, крыса17,18, а также свинья19 и человеческие хирургические отходы 15,20,21. Несмотря на то, что ПКТ требуют использования животных, что подразумевает этические проблемы, орган одного животного может генерировать несколько ПХТ, тем самым сокращая количество животных в соответствии с руководящими принципами NC3Rs (Сокращение, Замена, Уточнение)22 при одновременном ограничении межиндивидуальных вариаций.
Разработка усовершенствованных тканевых слайсеров, например, вибротомов23, позволила перейти от нарезанных вручную срезов, характеризующихся неоднородной толщиной и низкой приживаемостью, к воспроизводимым более тонким срезам с лучшей сохраненной структурной целостностью.
Тем не менее, протоколы подготовки и культивирования прецизионно нарезанных ломтиков печени (PCLS) значительно различаются в литературе и не стандартизированы, особенно в отношении таких важных параметров, как оборудование для нарезки, содержание среды и условия культивирования. Протоколы также могут заметно различаться в зависимости от ткани происхождения. Некоторые из протоколов потребуют насыщения кислородом буфера или культуры с помощью некоторых сложных биореакторных систем24. Обычно они сосредоточены на различных технических аспектах или предназначены для разных тканей и часто могут быть дорогостоящими и сложными для воспроизведения в обычной лаборатории экономически эффективным способом.
В данном протоколе сведены воедино некоторые ключевые моменты, такие как метод встраивания, направление разрезания, использование трансвеллов25, динамическая система культивирования26 и важность минимального объема культуры. Некоторые из этих этапов ранее были оптимизированы независимо или в другом контексте, например, фиброз27 или ответ опухоли28. Этот протокол также подчеркивает важность встраивания с использованием определенных типов срезов и ориентации резки, которые являются сложными параметрами для освоения и часто игнорируются в литературе. Этот простой метод позволяет получать PCLS, поддерживаемый в культуре в течение как минимум 4 дней с простой настройкой и использованием стандартного лабораторного оборудования с доступом к рудиментарному тканевому срезу.
протокол
Мыши дикого типа CD57Bl/6J были приобретены у Charles River Laboratories. Мыши имели свободный доступ к пище и воде, содержались в индивидуально вентилируемых клетках с контролируемой температурой и влажностью и с 12-часовым световым циклом. Животных в возрасте 3 недель приносили в жертву, а печень быстро заготавливали без перфузии. Все работы с животными были одобрены после местной этической экспертизы Советом по благополучию животных и этической экспертизе Университетского колледжа Лондона и выполнены в соответствии с лицензией проекта Министерства внутренних дел PP9223137 и в соответствии с Законом о научных процедурах Министерства внутренних дел (животные) (1986 г.) и руководящими принципами ARRIVE. Были предприняты все усилия для ограничения вреда животным в соответствии со стандартной практикой Отдела биологических служб Университетского колледжа Лондона.
1. Подготовьтесь к эксперименту
- За день до сбора урожая выполните следующие действия.
- Приготовьте 1 л буфера Кребса-Хенселеита (KREBS), растворив один флакон порошка Кребса в 1 л стерильной воды. Охладите его до 4 °C и держите на мокром льду.
- Продезинфицируйте лоток 70% этанолом и промойте стерильным PBS. Оставьте противень завернутым в фольгу в холодильнике на ночь, чтобы сохранить холодную среду во время резки.
- Все остальные съемные детали сбрызните этанолом, промойте стерильным PBS, дайте высохнуть и держите их стерильными. Откройте лезвия в автоклаве и держите их стерильными до использования.
- Приготовьте 4% w/v легкоплавкую агарозу в стерильной воде. После ресуспензии и расплавления агарозу храните в холодильнике при температуре 4 °C.
- В день сбора урожая и перед сбором урожая печени выполните следующие действия.
- Растопите 4% низкоплавкую агарозу и держите ее на водяной бане при температуре 37 °C до использования. Перед использованием убедитесь, что агароза остыла до 37 °C и все пузырьки рассеялись.
- Подготовьте культуральные планшеты, добавив соответственно 2,6 мл, 1,5 мл и 0,7 мл на лунку в 6, 12 и 24 луночные планшеты. Добавьте в каждую лунку пористые вставки по 8 мкм. Поместите планшеты во увлажненный инкубатор с температурой 37 °C, 5%CO2 и 21%O2 . Это поможет скорректировать pH во время прогрева среды, чтобы она была готова к выращиванию.
- Культивируйте срезы с помощью пористых вставок 8 мкм, чтобы обеспечить доступ к обеим сторонам среза. Приготовьте среду следующим образом: добавьте в William's Medium E (WME) 2 мМ добавки L-глютамина, 10% фетальную бычью сыворотку (FBS), 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина, 10 мкг/мл гентамицина, 25 мМ раствор D-глюкозы и 15 мМ раствор HEPES.
2. Забор печени и подготовка (15 мин)
- Стерилизуйте все инструменты перед сбором урожая.
- Обезболите мышь в соответствии с местными процедурами ухода за животными в научных целях с помощью изофлурановой маски. Перед вскрытием брюшной полости защипните между пальцами ног, чтобы убедиться, что животное должным образом обезболито. Если печень может быть быстро удалена, мышь может быть усыплена путем удушения CO2 или вывиха шейки матки. Поскольку процедура является терминальной, не используйте глазную мазь, так как это не повлияет на животное.
- Опрыскайте брюшную полость 70% этанолом. Дополнительно: Побрейте мышь, чтобы предотвратить загрязнение волосами.
- Вскрыть брюшную полость стерильными щипцами и ножницами, разрезав кожу и брюшину с середины живота. Аккуратно отделяйте печень от других органов или сосудов и избегайте повреждения долей.
- Храните целую печень сразу же в ледяном буфере Кребса. Все дальнейшие действия выполняйте на льду при температуре 4 °C и как можно быстрее приступайте к подготовке печени, чтобы предотвратить дальнейшую гибель клеток.
3. Заделка долей печени (по 25 мин для каждой доли печени)
- Переложите печень в чашку Петри на льду, содержащую ледяной буфер Кребса, убедившись, что вся печень полностью погружена в воду.
- Отделите каждую долю по отдельности с помощью тупых щипцов и острого стерильного ножа, чтобы не повредить мочки.
- Выберите первую долю для секционирования и храните оставшиеся доли в ледяном буфере Кребса до тех пор, пока они не будут готовы к заделке и нарезке.
- Обрежьте все края, чтобы получить более послушную долю с прямыми краями, готовыми к заделке. Это также поможет удалить часть волокнистой капсулы Глиссона, чтобы еще больше облегчить секцию. Делайте это, сохраняя поверхности печени влажными в ледяном буфере Кребса.
- Поставьте чашку Петри диаметром 3 см (или аналогичную) на влажный лед и вылейте в нее 4% малоплавкую агарозу (уже на водяной бане 37 °C). Хорошо держите на льду, чтобы дать агарозе остыть в восходящем направлении, предотвращая при этом опускание мочки на дно и равномерно заделывая ее.
- Оставьте агарозу для дальнейшего остывания на 30 с и поместите в нее обрезанную мочку. Мочка остановится в середине агарозного блока. Процесс встраивания требует практики и оптимизации, чтобы соответствовать любым лабораторным условиям и личному опыту.
- Поместите встроенную мочку, все еще на льду, в холодильник на 5 минут. После этого агароза должна четко закрепиться.
- Отрежьте внешнюю сторону агарозного блока. Выбейте агарозный брусок из формы.
- Разрежьте агарозу до более удобного размера, следя за тем, чтобы верхняя сторона и сторона, приклеенная к платформе вибратома, были параллельны верхнему краю лопасти.
- Начните процесс нарезки как можно быстрее, но убедитесь, что агарозный блок хранится в ледяном буфере Кребса и на льду.
4. Получение ломтиков печени (40 мин на долю)
- Установите вибратом для резки на толщину 250 мкм, с частотой вращения 5 и частотой 7 Гц. Это руководящие параметры; В зависимости от типа используемого вибратома, это может потребовать оптимизации.
- Перед резкой распылите вибратом и скамью 70% этанола, чтобы сохранить окружающую среду как можно более стерильной.
- Поставьте противень на вибратом и полейте его льдом. Поместите лезвия на вибратом под углом 10° вниз и ниже горизонтальной.
- Наполните бак вибратома ледяным буфером Кребса. Нанесите на платформу тонкий слой цианоакрилатного клея.
- Край агарозного блока, который будет приклеиваться к платформе, высушите с помощью стерильной абсорбирующей ткани.
- Поместите агарозный блок на съемную платформу. Расположите мочаку вертикально, чтобы ее можно было разрезать поперечно. Несмотря на то, что размер ломтиков уменьшается, это значительно облегчает процесс резки, ограничивая давление на кулачок во время резки.
- Подождите 1 минуту, пока клей схватится, погрузите съемную платформу в бак и убедитесь, что агарозный блок полностью покрыт буфером Кребса.
- Запрограммируйте вибратом для резки, установив начальное и конечное положения. Начинайте нарезать более толстые ломтики до тех пор, пока не будет достигнута доля печени.
- Выбросьте первый ломтик, так как он может быть не обрезан до нужной толщины. Чтобы не повредить срезы, используйте шпатель для сбора срезов печени вместо щипцов или щеток.
ПРИМЕЧАНИЕ: Небольшая щетка, продезинфицированная 70% этанолом и промытая стерильным PBS, также может использоваться для мягкого направления ткани в процессе резки. - Повторяйте процесс до тех пор, пока не будет достигнуто необходимое количество ломтиков. Мочка может время от времени отсоединяться от агарозы, препятствуя дальнейшему использованию. Соберите ломтики в ледяной буфер Кребса до посева.
5. Инкубация срезов печени
- Переложите ломтики с помощью шпателя в подготовленные лунки, содержащие среду и вкладыши.
- Поместите планшеты на орбитальный встряхиватель, установите скорость на 130 об/мин и инкубируйте с помощью обычного инкубатора для клеточных культур с 5% CO2 и 21% O2 при 37 °C. Конечный объем культуры составляет 2,6 мл, 1,5 мл и 0,7 мл на лунку в 6, 12 и 24-луночных планшетах соответственно.
- Поместите одну пустую тарелку под тарелку для культуры, содержащую ломтики в культуре, чтобы позволить рассеять чрезмерное тепло, исходящее от платформы шейкера. Меняйте среду каждые 48 часов.
6. Анализ выживаемости клеток
- Переложите срезы в 48-луночный планшет, содержащий 400 мкл предварительно подогретой полной среды Вильямса Medium E, и добавьте 80 мкл реагента MTS (3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфоффенил)-2H-тетразолий) реагента тетразолий.
- После инкубации в течение 1 ч при 37 °C 5%CO2 в шейкер перелейте 200 мкл среды в 96-луночный планшет и измерьте абсорбцию при длине волны 490 нм с помощью многолуночного планшетного ридера. Используйте ломтики, оставленные на скамейке в PBS и при комнатной температуре в течение 24 часов в качестве отрицательного контроля.
7. Гистологическое окрашивание
- Депарафинизация и регидратация секций с использованием ксилола и этанола с последующей деионизацией воды. Окрашивайте срезы раствором гематоксилина в течение 3 мин.
- Смыть деионизированной водой в течение 5 минут. Быстро опустите в 10 раз кислый этанол (1 мл концентрированного HCL и 400 мл 70% этанола).
- Промойте 2 раза в деионизированной воде и промокните лишнюю воду. Опустите срезы в Эозин на 30 с.
- Обезвоживайте до 95% этанола, затем до 100% этанола в течение 5 минут, по 3 раза каждый. Окуните секции в ксилол 3 раза по 15 минут каждая. Разместите покровные листы на горках.
Результаты
При заборе перфузия животного намеренно не проводится, чтобы обеспечить быструю обработку органа и предотвратить его повреждение. Печень быстро извлекается после разреза и сразу же помещается в ледяной буфер для защиты органов, например, буферКребса 24,29. Несмотря нато, что срезание свежей ткани печени без встраивания было описано ранее1, встраивание печени в легкоплавкую агарозу30 (рис. 1) в сочетании с органозащитным буфером обеспечит оптимальные условия разрезания вибратома, уменьшая повреждение тканей и увеличивая воспроизводимость толщины среза. Толщина ткани имеет решающее значение, так как тонкие срезы позволяют большему количеству слоев клеток получать доступ к питательным веществам икислороду31 и снижают гибель клеток. Однако слишком тонкие участки становится трудно однородно резать. И наоборот, ломтики толщиной более 400 мкм будут иметь меньшую скорость проникновения питательных веществ. Секции инкубировали на границе раздела жидкость-воздух с помощью вставки (рис. 1) и инкубировали с 5% CO2 и 21%O2 при 37 °C на шейкере. Секции должны быть инкубированы в питательной среде в течение 3 ч после сбора, после чего происходит быстрая гибельклеток32.
Для определения жизнеспособности PCLS жизнеспособность клеток оценивали с помощью анализа 4,5-диметилтиазол-2-ил)-5-(3-карбоксиметофенил)-2-(4-сульфоффенил)-2H-тетразолия (MTS), для снижения MTS которого требуются NAD(P)H-зависимые дегидрогеназы, т.е. метаболически активные клетки. Значения MTS нормализованы до соответствующей массы среза. Для оптимизации жизнеспособности PCLS минимальный объем питательной среды был необходим для поддержания жизнеспособности после 24 ч инкубации. Объем 0,7 мл в 24-луночных планшетах показал значительное снижение жизнеспособности при анализе ТМС (p = 0,02) по сравнению с 1,5 мл в 12-луночных планшетах и 2,6 мл в 6-луночных планшетах (рис. 2А). Эти объемы были выбраны таким образом, чтобы можно было немного покрыть секции, но они могут нуждаться в корректировке в зависимости от типа используемых вставок и пластин. Как и другие33, 12-луночные планшеты используются в качестве наилучшего компромисса для оптимальной выживаемости в меньшем объеме питательной среды.
Встряхивание имеет важное значение и повышает жизнеспособность PCLS на 50% через 24 ч после инкубации по сравнению со статической культурой (рис. 2B). Встряхивание создает критически важную границу раздела воздух-жидкость, оптимизированную с помощью трансвеллов, обеспечивая доступ питательных веществ и кислорода к обеим сторонам секции. Поглощение кислорода и питательных веществ также увеличивается за счет постоянного потока, создаваемого встряхивающим движением, которое также проходит через трансвелловую мембрану.
Анализ MTS оценивали с 1 ч инкубации до 6 суток инкубации. Жизнеспособность клеток оставалась постоянной с 0-го по 4-й день после инкубации, прежде чем наблюдалось значительное снижение (p = 0,05) на 6-й день (рис. 2C). Морфология PCLS, оцененная с помощью окрашивания гематоксилином и эозином (H&E), не показала изменений желчных протоков и архитектуры в течение 5 дней после инкубации (рис. 3A-D). По сравнению с 0-м днем (Рисунок 3A), PCLS не показал гистологической разницы на 1-й день (Рисунок 3B) и на 2-й день (Рисунок 3C) после инкубации, с ядерной гиперхромазией, легким воспалительным инфильтратом, вакуолизацией в пользу умеренного процесса гибели клеток на 5-й день после инкубации (Рисунок 3D). В совокупности этот протокол культивирования PCLS обеспечивает жизнеспособность в течение как минимум 4 дней, что согласуется с исследованиями с использованием срезов в аналогичных условиях31.

Рисунок 1: Схема, обобщающая протокол для генерации PCLS. Эта цифра была изменена с34. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Оптимизированный протокол культивирования PCLS показывает удовлетворительную жизнеспособность в течение 5 дней. (A) Влияние размера лунки на пролиферацию клеток (n=3). (B) Влияние тряски на пролиферацию клеток (n=6 на условие). (C) MTS Анализ пролиферации клеток из срезов печени от d0 до d6 дней инкубации (n=5 за время). Наружная условная единица, нормализованная для среза свежего веса. На графике показано среднее значение ± SD. Непарный двуххвостый t-критерий Стьюдента, ns=не значимый, *p<0.05, **p<0.01. Эта цифра была изменена с34. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
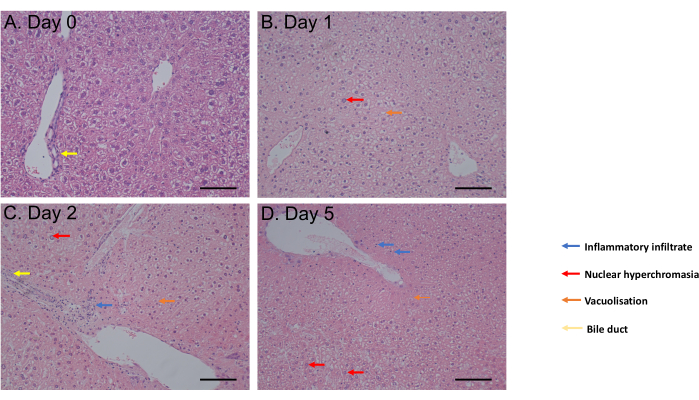
Рисунок 3: Результаты гистологии. (А-Г) Репрезентативные изображения гистологии ПЦЛ печени после окрашивания H&E. Масштабная линейка = 100 мкМ. Эта цифра была изменена с34. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Мы демонстрируем, что производство и культивирование PCLS может быть легко достигнуто при обеспечении периода полувыведения не менее 4 дней. Этот протокол кратко излагает пять важнейших этапов: метод встраивания, если используется этот тип вибратома, ориентация резки, динамическая система культуры, минимальный объем культуры и использование вставок.
Протоколы производства и культивирования PCLS широко доступны. Тем не менее, им не хватает стандартизации; Они могут быть сосредоточены на схожих и конкретных пунктах протокола, но их может быть трудно воспроизвести простым способом или в большинстве лабораторий, имеющих доступ к базовому вибратому. Типы вибротомов или тканевых слайсеров широки. Они будут различаться по стоимости и техническим характеристикам, например, иметь встроенную систему охлаждения или нет, но их общей особенностью является система резки с помощью качающегося лезвия бритвы. Основное отличие в отношении среза тканей заключается в требовании к заделке. По очевидным причинам и из-за влияния встраивания на жизнеспособность, в идеале его следует избегать. Одним из примеров ссылочного среза, не требующего внедрения, является срезКрумдика 35. Этот тип слайсера позволяет резать ткань в охлажденном буфере с использованием сердцевины, получая срезы равномерного размера, избегая при этом зарастания. Тем не менее, такие устройства, как правило, более дорогие, чем более простые вибротомы, и менее часто используются или доступны в большинстве лабораторий. Вибротомы, подобные тому, который используется в этом протоколе, как правило, уже доступны для разрезания химически фиксированных тканей, но потребуют встраивания долей печени. Некоторые показали, что разрезание срезов печени может быть достигнуто без встраивания и с использованием аналогичноговибратома 1; Однако, по нашему опыту, это оказалось трудно воспроизвести. Кроме того, при использовании этого типа вибратома срезание печени без поддерживающего 3D агарозного геля приводит к повреждению срезов и неравномерной толщине и, следовательно, увеличивает гибель клеток. Этот протокол предполагает разрезание доли печени поперечно, а не сагиттально. Этап резки является сложной техникой для освоения, и, насколько нам известно, ориентация резки является важной деталью, на которой никогда не акцентируется внимание. Ориентация лопасти во время резки может значительно облегчить процесс резки при одновременном снижении давления на печень. Использование гидрогеля также можно рассматривать как улучшенную пользу36.
Следующим важным критерием является необходимость больших объемов культуры для повышения жизнеспособности. Уже было предложено использовать более высокие объемы, чтобы обеспечить больше питательных веществ и разбавить более токсичные продукты желчных кислот37. Добавление динамической системы с встряхиванием и в сочетании с использованием Transwells улучшает доступ питательных веществ и, возможно, кислорода к обеим сторонам секции за счет создания постоянного потока 18,38,39. Использование трансвелла и преимущество динамической системы уже были доказаны в различных контекстах, таких как реакция на срез печени опухоли человека28 и для моделирования фиброза26,27. Данный протокол подтверждает их преимущество в более широком физиологическом аспекте.
Среда Е Вильямса обычно выбирается в качестве стандартной среды для клеточных культур для PCLS 40,41. Было описано, что среда с добавками глюкозы и сыворотки обладает потенциальной пользой для сохранения жизнеспособности и функциональности срезов42. Концентрация глюкозы в средах обычно колеблется от 4 нМ до 36 нМ43,44, но не было найдено единого мнения о влиянии более высокой концентрации глюкозы на жизнеспособность или окислительную реакцию. Утверждается, что добавление инсулина или дексаметазона35 улучшает долгосрочную жизнеспособность, но консенсус не был достигнут, поскольку добавление таких добавок потенциально может вызвать вторичную резистентность к инсулину с последующим эффектом нажизнеспособность.
Предыдущие данные показывают, что срезы толще 200 мкм становятся трудно однородно разрезаемыми и могут проявлять окислительный стресс, в то время как срезы толще 400 мкм демонстрируют низкую скорость проникновения питательных веществ 18,19,46. Кроме того, исходя из внешнего вида PCLS, влияния на текстуру и простоты резки, предпочтение отдается толщине 250 мкм. Проникновение питательных веществ или терапевтического агента во внутренние клеточные слои PCLS также значительно улучшается при использовании трансвеллов как части динамической системы 18,32. В отличие от использования слайсера Крумдика, преимущество которого заключается в получении ломтиков одинакового размера за счет интеграции системы нарезки стержня, протокол может быть адаптирован путем изменения размера ломтиков в равных размерах после нарезки. Тем не менее, в эксперименте следует учитывать изменчивость размера, массы или содержания белка и ее влияние на среду культивирования и, следовательно, на жизнеспособность и биомаркеры. По этой причине показания анализа MTA при использовании этого протокола нормализуются в соответствии с весом каждого среза. Также может наблюдаться неоднородность толщины, но, к сожалению, она, скорее всего, будет наблюдаться при использовании всех типов слайсеров. Пользователь мог бы рассмотреть возможность отбрасывания наименее однородных срезов, оценив их аспект, но это все равно считается ненадежным вариантом и остается недостатком PCTS. Основным ограничением, связанным с этой моделью, остается относительная краткосрочная жизнеспособность, но она попадает в уже опубликованный таймфрейм24,31. Доступность кислорода может быть увеличена для повышения такой жизнеспособности. Некоторые ранее опубликованные протоколы требовали концентрации сложных питательных сред и кислорода выше 80%, повышая метаболизм и обеспечивая более длительную жизнеспособность 1,24,35,38. Также трудно напрямую сравнивать уровни кислорода, используемые для насыщения кислородом PCLS, и уровни кислорода, используемые для культивирования клеточных линий. Данные о влиянии кислорода на физиологию PCLS очень ограничены18,47, и более высокая концентрация кислорода, вероятно, существенно изменит патофизиологию и фенотип, образуя токсичные активные формы кислорода48.
В заключение следует отметить, что PCLS с коротким сроком службы могут производиться с ограниченным использованием оборудования и использоваться в качестве надежной модели ex vivo . Тканевая архитектура имеет решающее значение в физиологии печени, и PCLS, позволяющая сохранить ее, является еще одним примером того, почему эту модель следует рассматривать в более широком смысле. Таким образом, прецизионно нарезанные ломтики должны стать более признанным инструментом в научных исследованиях.
Раскрытие информации
Не существует конкурирующих интересов, подлежащих раскрытию.
Благодарности
Авторы благодарят Мирабелу Бандоль, Саманту Ричардс, Луизу Фишер, Ребекку Таунс и сотрудников Биологической службы Университетского колледжа Лондона за помощь в разведении и поддержании колоний животных. Эта работа была поддержана финансированием Совета по медицинским исследованиям Соединенного Королевства Стипендия клинициста-ученого MR/T008024/1 (JB) и Центра биомедицинских исследований (JB) больницы NIHR Great Ormond Street. Выраженные мнения принадлежат автору (авторам) и не обязательно совпадают с мнением NHS или NIHR.
Материалы
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
Ссылки
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены