Method Article
Técnica optimizada y simplificada para la producción y el cultivo de láminas de hígado cortadas con precisión
En este artículo
Resumen
Un protocolo para la producción y el cultivo de rodajas de hígado cortadas con precisión (PCLS) para el estudio de hígados de ratón. El artículo se centra en aspectos clave del protocolo, que solo requiere un equipo de laboratorio estándar con acceso a un vibratomo y permite la supervivencia del PCLS durante un mínimo de 4 días.
Resumen
Este protocolo presenta un sistema sencillo para la creación y el cultivo de rodajas de hígado cortadas con precisión (PCLS). El PCLS contiene todas las células en un entorno intacto y, por lo tanto, se asemeja a un mini modelo de todo el órgano. Permiten el estudio de tejidos vivos mientras replican sus fenotipos complejos. Este protocolo permite la preparación de lonchas de hígado de ratón utilizando un vibratomo y equipo de laboratorio estándar. Los protocolos para producir y cultivar PCLS carecen de estandarización y pueden variar drásticamente según el tejido de interés, el tipo de vibratomo utilizado y la necesidad de oxígeno. Estos pueden ser difíciles de reproducir en algunos laboratorios que solo tienen acceso a un vibratomo básico e instalaciones comunes de cultivo de tejidos. Hemos elaborado un protocolo que se centra en la importancia de algunos pasos clave dentro de los diversos protocolos ya disponibles. Este protocolo, por lo tanto, enfatiza la importancia del método de incrustación, la orientación de corte, un sistema dinámico frente a uno estático y la relevancia de un volumen mínimo de cultivo. Este protocolo se puede establecer y reproducir de forma sencilla en la mayoría de los laboratorios que tienen acceso a un cortador de tejidos básico. En conjunto y siguiendo este protocolo, el PCLS puede permanecer vivo durante un mínimo de 4 días. PCLS es un modelo sencillo, económico y reproducible para estudiar el cribado fisiopatológico y terapéutico de órganos como el hígado.
Introducción
Los cortes de tejido cortados con precisión (PCTS, por sus siglas en inglés) son secciones delgadas de órganos. Permiten la preservación de la arquitectura del órgano replicando un mini-órgano, al tiempo que preservan el aspecto tridimensional de las células vecinas y la matriz extracelular. Es un modelo atractivo debido a su fácil acceso, ahorro de costos y características menos laboriosas, al tiempo que preserva la arquitectura del tejido.
Los PCTS llenan un vacío entre los estudios in vitro con células y la investigación in vivo con animales, superando la mayoría de las desventajas de ambos modelos. El PCTS se ha generado a partir de varios órganos, como el hígado1, los intestinos 2,3, el colon2, el cerebro 4,5, el pulmón 6,7,8, el riñón 9,10, el bazo11,12, el corazón13,14 pero también tumores15,16. También pueden proceder de diversos animales, como el ratón1, la rata17,18, pero también el cerdo19 y los residuos quirúrgicos humanos 15,20,21. A pesar de que el PCTS requiere el uso de animales, lo que implica cuestiones éticas relacionadas, el órgano de un animal puede generar múltiples PCTS, reduciendo así el número de animales de acuerdo con las directrices NC3Rs (Reducción, Reemplazo, Refinamiento)22 y limitando las variaciones interindividuales.
El desarrollo de cortadores de tejidos mejorados, por ejemplo, los vibrátomos23, ha permitido una transición de cortes cortados manualmente caracterizados por un grosor heterogéneo y una tasa de supervivencia baja a cortes más delgados y reproducibles con una integridad estructural mejor conservada.
Sin embargo, los protocolos para la preparación y el cultivo de PCTS y, más específicamente, para la preparación y el cultivo de cortes de hígado cortados con precisión (PCLS) varían significativamente en la literatura y carecen de estandarización, especialmente para parámetros esenciales como el equipo de corte, el contenido del medio y las condiciones de cultivo. Los protocolos también pueden variar notablemente en función del tejido de origen. Algunos de los protocolos requerirán la oxigenación del tampón o el cultivo con algunos sistemas de biorreactores complicados24. Por lo general, se enfocan individualmente en diferentes aspectos técnicos o están diseñados para diferentes tejidos y, a menudo, pueden ser costosos y más difíciles de reproducir en el laboratorio promedio de una manera rentable.
Aquí, este protocolo reúne algunos puntos clave como el método de incrustación, la dirección de corte, el uso de transpocillos25, un sistema de cultivo dinámico26 y la importancia de un volumen mínimo de cultivo. Algunos de estos pasos se han optimizado previamente de forma independiente o en un contexto diferente, como la fibrosis27 o la respuesta tumoral28. Este protocolo también enfatiza la importancia de la incrustación usando ciertos tipos de cortadoras y la orientación del corte, que son parámetros difíciles de dominar y a menudo descuidados en la literatura. Este sencillo método genera PCLS mantenidos en cultivo durante un mínimo de 4 días con una fácil configuración y utilizando equipos de laboratorio estándar con acceso a un cortador de tejidos rudimentario.
Protocolo
Se compraron ratones CD57Bl/6J de tipo salvaje de Charles River Laboratories. Los ratones tenían libre acceso a comida y agua, alojados en jaulas ventiladas individualmente con condiciones controladas de temperatura y humedad y con un ciclo de luz de 12 horas. Los animales de 3 semanas de edad fueron sacrificados y los hígados fueron prontamente extraídos sin perfusión. Todo el trabajo con animales fue aprobado después de la revisión ética local por parte de la Junta de Revisión Ética y Bienestar Animal del University College London y se realizó bajo la licencia de proyecto del Ministerio del Interior PP9223137 y de acuerdo con la Ley de Procedimientos Científicos del Ministerio del Interior (Animales) (1986) y las directrices de ARRIVE. Se hicieron todos los esfuerzos posibles para limitar el daño a los animales de acuerdo con la práctica estándar de la Unidad de Servicios Biológicos del University College de Londres.
1. Prepárate para el experimento
- El día antes de la cosecha, realice los siguientes pasos.
- Prepare 1 L de tampón Krebs-Henseleit (KREBS) disolviendo un vial de polvo Krebs en 1 L de agua estéril. Enfríelo a 4 °C y manténgalo sobre hielo húmedo.
- Desinfecte la bandeja con etanol al 70% y enjuague con PBS estéril. Mantenga la bandeja envuelta en papel de aluminio en el refrigerador durante la noche para ayudar a mantener un ambiente frío mientras corta.
- Rocíe todas las demás partes extraíbles con etanol, enjuague con PBS estéril, déjelas secar y manténgalas estériles. Esterilizar las cuchillas en autoclave y mantenerlas estériles hasta su uso.
- Prepare agarosa de bajo punto de fusión al 4% p/v en agua estéril. Una vez resuspendida y derretida, guarde la agarosa en la nevera a 4 °C.
- El día de la cosecha y antes de la cosecha del hígado, realice los siguientes pasos.
- Derretir la agarosa de bajo punto de fusión al 4% y mantenerla al baño maría a 37 °C hasta su uso. Asegúrese de que la agarosa se haya enfriado a 37 °C y que todas las burbujas se hayan disipado antes de usarla.
- Prepare las placas de cultivo añadiendo respectivamente 2,6 mL, 1,5 mL y 0,7 mL por pocillo en placas de 6, 12 y 24 pocillos. Agregue insertos porosos de 8 μm a cada pocillo. Coloque las placas en una incubadora humidificada a 37 °C, 5% deCO2 y 21% deO2 . Esto ayudará a ajustar el pH mientras se calienta el medio, para que esté listo para el cultivo.
- Cultive las lonchas con insertos porosos de 8 μm para permitir el acceso a ambas caras de la loncha. Prepare el medio de la siguiente manera: Agregue al medio E de William's (WME), 2 mM de suplemento de L-glutamina, 10% de suero fetal bovino (FBS), 100 U/mL de penicilina y 100 μg/mL de estreptomicina, 10 μg/mL de gentamicina, 25 mM de solución de D-glucosa y 15 mM de solución HEPES.
2. Recolección de hígado y preparación (15 min)
- Esterilice todos los instrumentos antes de la cosecha.
- Anestesiar al ratón de acuerdo con los procedimientos locales para el cuidado de animales con fines científicos mediante el uso de una máscara de isoflurano. Antes de abrir la cavidad abdominal, apriete entre los dedos de los pies para asegurarse de que el animal esté correctamente anestesiado. Si el hígado se puede extirpar rápidamente, el ratón puede ser sacrificado por asfixia con CO2 o dislocación cervical. Como el procedimiento es un procedimiento terminal, no use ungüento para los ojos, ya que esto no afectaría al animal.
- Rocíe el abdomen con etanol al 70%. Opcional: Afeitar el ratón para evitar la contaminación con el vello.
- Abrir la cavidad abdominal con pinzas estériles y tijeras cortando la piel y el peritoneo desde la mitad del abdomen. Diseccione el hígado suavemente de otros órganos o vasos y evite dañar los lóbulos.
- Guarde todo el hígado inmediatamente en Krebs Buffer helado. Realice todos los pasos adicionales en el hielo a 4 °C y proceda a la preparación del hígado lo más rápido posible para evitar una mayor muerte celular.
3. Incrustación de los lóbulos hepáticos (25 min para cada lóbulo hepático)
- Transfiera el hígado a una placa de Petri sobre hielo que contenga tampón Krebs helado, asegurándose de que todo el hígado esté completamente sumergido.
- Separe cada lóbulo individualmente con pinzas romas y un cuchillo afilado y estéril para evitar dañar los lóbulos.
- Elija el primer lóbulo para seccionar y mantenga los lóbulos restantes en un tampón Krebs helado hasta que estén listos para incrustar y cortar.
- Corte todos los bordes para obtener un lóbulo más manejable con bordes rectos listos para incrustar. Esto también ayudará a eliminar parte de la cápsula fibrosa de Glisson para facilitar aún más el seccionamiento. Haga esto mientras mantiene las superficies del hígado húmedas en un tampón Krebs helado.
- Coloque una placa de Petri de 3 cm (o similar) sobre hielo húmedo y vierta el 4% de agarosa de bajo punto de fusión (ya en un baño de agua a 37 ° C) en ella. Manténgalo bien en hielo para permitir que la agarosa se enfríe en dirección ascendente mientras evita que el lóbulo se hunda hasta el fondo y se incruste de manera uniforme.
- Deje que la agarosa se enfríe aún más durante 30 s y coloque el lóbulo recortado en ella. El lóbulo se asentará en el centro del bloque de agarosa. El proceso de incrustación requiere práctica y optimización para adaptarse a todas las condiciones de laboratorio y experiencia personal.
- Coloque el lóbulo incrustado, aún en hielo, en el refrigerador durante 5 minutos. A continuación, la agarosa debe estar claramente fijada.
- Corta la parte exterior del bloque de agarosa. Desaloje el bloque de agarosa del plato.
- Corta la agarosa en un tamaño más manejable, asegurándote de que la parte superior y el lado pegado a la plataforma del vibratomo estén paralelos al borde superior del lóbulo.
- Comience el proceso de corte lo más rápido posible, pero asegúrese de que el bloque de agarosa se mantenga en un tampón Krebs helado y en hielo.
4. Producción de rodajas de hígado (40 min por lóbulo)
- Ajuste el vibratomo para cortar a un grosor de 250 μm, con una velocidad de 5 y una frecuencia de 7 Hz. Estos son parámetros orientativos; Dependiendo del tipo de vibratomo utilizado, esto puede requerir optimización.
- Rocíe el vibratomo y las áreas del banco con etanol al 70% antes de cortar para mantener el ambiente lo más estéril posible.
- Coloque la bandeja en el vibratomo y vierta hielo a su alrededor. Coloque las cuchillas en el vibratomo en un ángulo de 10° hacia abajo y por debajo de la horizontal.
- Llene el tanque de vibratomo con tampón Krebs helado. Coloque una capa delgada de pegamento de cianoacrilato sobre la plataforma.
- Seque el borde del bloque de agarosa que se pegará a la plataforma con un pañuelo absorbente estéril.
- Coloque el bloque de agarosa en la plataforma extraíble. Coloque el lóbulo en posición vertical para permitir que se corte transversalmente. Aunque el tamaño de las rodajas se reduce, esto facilita drásticamente el proceso de corte al limitar la presión contra el lóbulo durante el corte.
- Espere 1 minuto a que el pegamento se asiente y sumerja la plataforma extraíble en el tanque y asegúrese de que el bloque de agarosa esté completamente cubierto con tampón Krebs.
- Programe el vibratomo para el corte ajustando las posiciones de inicio y parada. Comience a cortar rodajas más gruesas inicialmente hasta que llegue al lóbulo del hígado.
- Deseche la primera rebanada, ya que es posible que no se corte al grosor correcto. Para evitar dañar las rodajas, use una espátula para recoger las rodajas de hígado en lugar de pinzas o cepillos.
NOTA: También se puede utilizar un pequeño cepillo desinfectado con etanol al 70% y enjuagado con PBS estéril para guiar suavemente el tejido durante el proceso de corte. - Repita el proceso hasta alcanzar el número requerido de rebanadas. El lóbulo puede ocasionalmente desprenderse de la agarosa, impidiendo su uso posterior. Recoja las rodajas en un tampón Krebs helado hasta el cultivo.
5. Incubación de rodajas de hígado
- Transfiera las rodajas, con una espátula, a los pocillos preparados que contienen los medios y los insertos.
- Coloque las placas en un agitador orbital, ajuste la velocidad a 130 rpm e incube utilizando una incubadora de cultivo celular convencional con 5% de CO2 y 21% de O2 a 37 °C. El volumen final de cultivo es de 2,6 mL, 1,5 mL y 0,7 mL por pocillo en placas de 6, 12 y 24 pocillos, respectivamente.
- Coloque una placa vacía debajo de la placa de cultivo que contiene las rodajas en cultivo para permitir que se disipe el calor excesivo que se origina en la plataforma del agitador. Cambiar el medio cada 48 h.
6. Ensayo de supervivencia celular
- Transfiera las rodajas a una placa de 48 pocillos que contenga 400 μL de medio E medio Williams completo precalentado y agregue 80 μL de reactivo de tetrazolio MTS (3-(4,5-dimetiltiazol-2-il)-5-(3-carboximetoxifenil)-2-(4-sulfofenil)-2H-tetrazolio).
- Después de la incubación durante 1 h a 37 °C, 5% de CO2 en un agitador, transfiera 200 μL de medio a una placa de 96 pocillos y mida la absorbancia a 490 nm utilizando un lector de placas de pocillos múltiples. Utilice las lonchas que se dejan en el banco en PBS y a temperatura ambiente durante 24 h como controles negativos.
7. Tinción histológica
- Desparafinar y rehidratar las secciones con xileno y etanol, seguido de agua desionizada. Teñir las secciones con solución de hematoxilina durante 3 min.
- Enjuague con agua desionizada durante 5 min. Sumerja rápidamente 10 veces en etanol ácido (1 mL de HCL concentrado y 400 mL de etanol al 70%).
- Enjuague 2 veces en agua desionizada y seque el exceso de agua. Sumerja las secciones en eosina durante 30 s.
- Deshidratar en etanol al 95%, luego en etanol al 100% durante 5 minutos, 3 veces cada uno. Sumerja las secciones en xileno 3 veces durante 15 minutos cada una. Coloque los cubreobjetos en los portaobjetos.
Resultados
En la cosecha, la perfusión del animal se omite deliberadamente para garantizar un procesamiento rápido del órgano y evitar daños en el órgano. El hígado se extrae rápidamente después de la incisión y se coloca inmediatamente en un tampón protector de órganos helado, por ejemplo, tampón Krebs24,29. Aunque se ha descrito previamente el corte de tejido hepático fresco sin inclusión1, la inclusión del hígado en agarosa30 de bajo punto de fusión (Figura 1) combinada con un tampón protector de órganos permitirá condiciones de corte óptimas en el vibratomo, reduciendo el daño tisular y aumentando la reproducibilidad en el grosor de la sección. El grosor del tejido es crítico, ya que las secciones delgadas permiten que más capas celulares accedan a los nutrientes y al oxígeno31 y reducen la muerte celular. Sin embargo, las secciones que son demasiado delgadas se vuelven difíciles de cortar de manera homogénea. Por el contrario, las rodajas de más de 400 μm de grosor mostrarán una menor tasa de penetración de nutrientes. Las secciones se incubaron en una interfaz líquido-aire utilizando un inserto (Figura 1) y se incubaron con 5% de CO2 y 21% deO2 a 37 °C en un agitador. Las secciones deben incubarse en un medio de cultivo dentro de las 3 h siguientes a la cosecha, después de lo cual la muerte celular ocurre rápidamente32.
Para determinar la viabilidad de PCLS, se evaluó la viabilidad celular mediante el ensayo de 4,5-dimetiltiazol-2-il)-5-(3-carboximetoxifenil)-2-(4-sulfofenil)-2H-tetrazolio (MTS), que requiere deshidrogenasas dependientes de NAD(P)H, es decir, células metabólicamente activas, para reducir el MTS. Los valores de MTS se han normalizado al peso de corte respectivo. Para optimizar la viabilidad de PCLS, un volumen mínimo de medio de cultivo fue esencial para mantener la viabilidad después de 24 h de incubación. Un volumen de 0,7 mL en placas de 24 pocillos mostró una reducción significativa de la viabilidad mediante el ensayo TMS (p = 0,02) en comparación con 1,5 mL en placas de 12 pocillos y 2,6 mL en placas de 6 pocillos (Figura 2A). Estos volúmenes se eligieron para permitir que las secciones estuvieran ligeramente cubiertas, pero podrían necesitar ajustes según el tipo de plaquitas y placas utilizadas. Al igual que otros33, se utilizan placas de 12 pocillos como el mejor compromiso para una supervivencia óptima dentro de un volumen más pequeño de medio de cultivo.
La agitación es esencial y aumenta la viabilidad de PCLS en un 50% a las 24 h después de la incubación en comparación con un cultivo estático (Figura 2B). La agitación crea una interfaz aire-líquido crítica, optimizada con el uso de transpozos, lo que permite el acceso a nutrientes y oxígeno a ambas caras de la sección. La absorción de oxígeno y nutrientes también se incrementa por el flujo constante creado por el movimiento de agitación, que también pasa a través de la membrana transwell.
El ensayo MTS se evaluó desde 1 h de incubación hasta el día 6 de incubación. La viabilidad celular se mantuvo constante desde el día 0 hasta el día 4 después de la incubación antes de observar una disminución significativa (p = 0,05) en el día 6 (Figura 2C). La morfología de PCLS evaluada por tinción con hematoxilina y eosina (H&E) no mostró cambios en los conductos biliares ni en la arquitectura hasta 5 días después de la incubación (Figura 3A-D). En comparación con el día 0 (Figura 3A), el PCLS no mostró diferencias histológicas en el día 1 (Figura 3B) y el día 2 (Figura 3C) después de la incubación, con hipercromasia nuclear, infiltrado inflamatorio leve, vacuolización a favor de un proceso de muerte celular moderado en el día 5 después de la incubación (Figura 3D). En conjunto, este protocolo de cultivo de PCLS permite la viabilidad durante al menos 4 días, lo que es coherente con los estudios que utilizan cortes en condiciones similares31.

Figura 1: Esquema que resume el protocolo para generar PCLS. Esta cifra ha sido modificada de34. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: El protocolo optimizado de cultivo de PCLS muestra una viabilidad satisfactoria durante 5 días. (A) Efecto del tamaño del pocillo sobre la proliferación celular (n=3). (B) Efecto del temblor sobre la proliferación celular (n = 6 por condición). (C) Ensayo de proliferación celular MTS a partir de secciones hepáticas de d0 a d6 días de incubación (n = 5 por punto de tiempo). Unidad arbitraria de diámetro exterior, normalizada para cortar el peso fresco. El gráfico muestra la media ± SD. Prueba t de Student de 2 colas no apareada, ns=no significativa, *p<0.05, **p<0.01. Esta cifra ha sido modificada de34. Haga clic aquí para ver una versión más grande de esta figura.
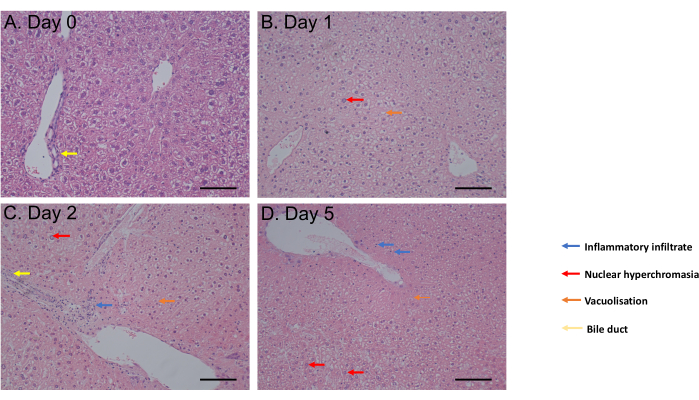
Figura 3: Resultados histológicos. (A-D) Imágenes representativas de la histología del PCLS hepático después de la tinción con H&E. Barra de escala = 100 μM. Esta cifra ha sido modificada de34. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Demostramos que la producción y el cultivo de PCLS se pueden lograr fácilmente al tiempo que garantizamos una vida media de al menos 4 días. Este protocolo recapitula cinco pasos críticos: el método de inclusión si se utiliza este tipo de vibratomo, la orientación del corte, un sistema dinámico de cultivo, un volumen mínimo de cultivo y el uso de insertos.
Los protocolos para la producción y el cultivo de PCLS están comúnmente disponibles. Sin embargo, carecen de estandarización; Pueden centrarse en puntos similares y específicos del protocolo, pero pueden ser difíciles de replicar de una manera sencilla o en la mayoría de los laboratorios que tienen acceso a un vibrátomo básico. Los tipos de vibrátomos o cortadores de tejidos son amplios. Variarán en costo y especificidades técnicas, como tener un sistema de enfriamiento integrado o no, pero su característica común es su sistema de corte mediante una cuchilla de afeitar oscilante. La principal diferencia con respecto al corte de tejidos es el requisito de incrustación. Por razones obvias y por el impacto de la incorporación en la viabilidad, lo ideal es evitarlo. Un ejemplo de segmentación de datos de referencia que no requiere incrustación es la segmentación de datosKrumdieck 35. Este tipo de cortadora permite que el tejido se corte en un tampón enfriado mientras se usa un núcleo, produciendo rodajas de tamaño uniforme y evitando la incrustación. Sin embargo, estos aparatos tienden a ser más costosos que los vibrátomos más básicos y se utilizan con menos frecuencia o están disponibles en la mayoría de los laboratorios. Los vibratomos como el utilizado en este protocolo tienden a estar ya disponibles para el corte de tejidos fijados químicamente, pero requerirán la inclusión de los lóbulos del hígado. Algunos han demostrado que el corte de rodajas de hígado se puede lograr sin incrustar y usando un vibratomo similar1; Sin embargo, en nuestra experiencia, esto ha resultado difícil de reproducir. Además, al usar este tipo de vibratomo, el corte de hígado sin un gel de agarosa de soporte 3D causa cortes dañados y grosores desiguales y, por lo tanto, aumenta la muerte celular. Este protocolo consiste en cortar el lóbulo del hígado transversalmente en lugar de sagitalmente. El paso de corte es una técnica difícil de dominar y, hasta donde sabemos, la orientación del corte es un detalle importante en el que nunca se centra. La orientación del lóbulo durante el corte puede facilitar drásticamente el proceso de corte al tiempo que reduce la presión sobre el hígado. El uso del hidrogel también podría considerarse como un beneficio mejorado36.
El siguiente criterio importante es la necesidad de mayores volúmenes de cultivo para aumentar la viabilidad. Ya se ha sugerido que volúmenes más altos proporcionan más nutrientes y diluyen productos de ácidos biliares más tóxicos37. La adición de un sistema dinámico con agitación y combinado con el uso de Transwells mejora el acceso a nutrientes y potencialmente oxígeno a ambas caras de la sección al crear un flujo constante 18,38,39. El uso de transwell y la ventaja de un sistema dinámico ya han sido probados en diferentes contextos, como las respuestas de corte de hígado en tumores humanos28 y para el modelado de fibrosis26,27. Este protocolo confirma su ventaja en un aspecto fisiológico más amplio.
El medio E de Williams se elige comúnmente como medio de cultivo celular estándar para PCLS40,41. Se ha descrito que los medios suplementados con glucosa y suero tienen un beneficio potencial para preservar la viabilidad y la funcionalidad de las rodajas42. La concentración de glucosa en los medios suele variar entre 4 nM y 36 nM43,44, pero no se ha encontrado consenso sobre el efecto de una mayor concentración de glucosa sobre la viabilidad o la respuesta oxidativa. Se afirma que la adición de insulina o dexametasona35 mejora la viabilidad a largo plazo, pero no se ha llegado a un consenso, ya que la adición de dichos suplementos podría inducir una resistencia secundaria a la insulina con un efecto posterior sobre la viabilidad45 .
Los datos anteriores muestran que las secciones más delgadas de 200 μm se vuelven difíciles de cortar de manera homogénea y pueden mostrar estrés oxidativo, mientras que las secciones más gruesas de 400 μm muestran una baja tasa de penetración de nutrientes 18,19,46. Además, en función de la apariencia de PCLS, los efectos sobre la textura y la facilidad de corte, se favorece un grosor de 250 μm. La penetración de los nutrientes o agente terapéutico en las capas celulares internas del PCLS también mejora considerablemente utilizando transpocillos como parte del sistema dinámico 18,32. A diferencia del uso de la cortadora Krumdieck, que tiene la ventaja de producir rebanadas de tamaño uniforme mediante la integración de un sistema de corte central, el protocolo se puede adaptar redimensionando las rebanadas en dimensiones iguales después del corte. Sin embargo, en el experimento se debe tener en cuenta la variabilidad en tamaño, peso o contenido de proteínas y su impacto en el entorno de cultivo y, por lo tanto, en la viabilidad y los biomarcadores. Por esta razón, las lecturas del ensayo MTA, al utilizar este protocolo, se normalizan al peso fresco de cada rebanada. Además, se puede observar heterogenicidad del grosor, pero desafortunadamente, es probable que se observe utilizando todo tipo de cortadoras. El usuario podría considerar la posibilidad de descartar los segmentos menos homogéneos evaluando su aspecto, pero esto sigue considerándose una opción poco fiable y sigue siendo un inconveniente del PCTS. La principal limitación asociada a este modelo sigue siendo la viabilidad relativa a corto plazo, pero se encuentra dentro del marco temporal ya publicado24,31. La disponibilidad de oxígeno podría mejorarse para aumentar dicha viabilidad. Algunos protocolos publicados anteriormente requerían medios de cultivo complejos y una concentración de oxígeno superior al 80%, regulando al alza el metabolismo y proporcionando una viabilidad más prolongada 1,24,35,38. También es difícil comparar directamente los niveles de oxígeno utilizados para oxigenar PCLS y los niveles de oxígeno utilizados para cultivar líneas celulares. Los datos sobre los efectos del oxígeno en la fisiología del PCLS son muy limitados18,47, y es probable que una mayor concentración de oxígeno modifique sustancialmente la fisiopatología y el fenotipo al generar especies reactivas de oxígeno tóxicas48.
En conclusión, los PCLS de vida corta pueden producirse con equipos limitados y utilizarse como un modelo ex vivo fiable. La arquitectura de los tejidos es crucial en la fisiología hepática, y el hecho de que el PCLS permita su conservación es otro ejemplo de por qué este modelo debe considerarse de una manera más prevalente. Por lo tanto, las rodajas cortadas con precisión deberían convertirse en una herramienta más reconocida en la investigación científica.
Divulgaciones
No hay ningún interés contradictorio que deba ser revelado.
Agradecimientos
Los autores agradecen a Mirabela Bandol, Samantha Richards, Louise Fisher, Rebecca Towns y al personal de los Servicios Biológicos de UCL por su ayuda con la cría y el mantenimiento de las colonias de animales. Este trabajo fue financiado por el Consejo de Investigación Médica del Reino Unido Clinician Scientist Fellowship MR/T008024/1 (JB) y el Centro de Investigación Biomédica (JB) del NIHR Great Ormond Street Hospital. Las opiniones expresadas son las del autor o autores y no necesariamente las del NHS o del NIHR.
Materiales
| Name | Company | Catalog Number | Comments |
| 3 cm petri dish | Any | any suitable for cell culture | |
| 6, 12, 24 well culture plate | Any | any suitable for cell culture | |
| Cyanoacrylate super glue | Any | ||
| D-Glucose | Gibco | A24940 | |
| Eosin | Merck | HT110316 | |
| Ethanol | Any | ||
| Fetal Bovine serum | ThermoFisher | 26400044 | |
| Gentamycin | Gibco | 15750060 | |
| Hematoxylin | Merck | 51275 | |
| HEPES | Gibco | H0887 | |
| inserts 8um, for 12 well plates | Strastedt | 83.3931.800 | |
| inserts 8um, for 24 well plates | Strastedt | 83.3932.800 | |
| inserts 8um, for 6 well plates | Strastedt | 83.3930.800 | |
| KREBS | Merck | K3753 | |
| Laminar Flow Hood | Hepa air filtration | ||
| Low melting agarose | ThermoFisher | 16520050 | |
| MTS tetrazolium reagent | Abcam | ab197010 | |
| multi-well plate reader | Any | ||
| PBS tablets | ThermoFisher | P4417 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| Scalpel blade | Any | ||
| Surgical forceps | Any | with a flat square-tip | |
| Surgical scissors | Any | ||
| Vibratome | Leica | VT1000 S | |
| William’s Medium E with GlutaMAX (WME) | ThermoFisher | W4125 |
Referencias
- Pearen, M. A., et al. Murine precision-cut liver slices as an ex vivo model of liver biology. J Vis Exp. (157), e60992 (2020).
- De Kanter, R., et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon. Xenobiotica. 34 (3), 229-241 (2004).
- van de Kerkhof, E. G., de Graaf, I. A., Ungell, A. L., Groothuis, G. M. Induction of metabolism and transport in human intestine: validation of precision-cut slices as a tool to study induction of drug metabolism in human intestine in vitro. Drug Metab Dispos. 36 (3), 604-613 (2008).
- Nogueira, G. O., Garcez, P. P., Bardy, C., Cunningham, M. O., Sebollela, A. Modeling the human brain with ex vivo slices and in vitro organoids for translational neuroscience. Front Neurosci. 16, 838594 (2022).
- Ucar, B., Stefanova, N., Humpel, C. Spreading of aggregated alpha-Synuclein in sagittal organotypic mouse brain slices. Biomolecules. 12 (2), 163 (2022).
- Liu, G., et al. Precision cut lung slices: an ex vivo model for assessing the impact of immunomodulatory therapeutics on lung immune responses. Arch Toxicol. 95 (8), 2871-2877 (2021).
- Klouda, T., Kim, H., Kim, J., Visner, G., Yuan, K. Precision cut lung slices as an efficient tool for ex vivo pulmonary vessel structure and contractility studies. J Vis Exp. (171), e62392 (2021).
- Viana, F., O'Kane, C. M., Schroeder, G. N. Precision-cut lung slices: A powerful ex vivo model to investigate respiratory infectious diseases. Mol Microbiol. 117 (3), 578-588 (2022).
- De Kanter, R., et al. Drug-metabolizing activity of human and rat liver, lung, kidney and intestine slices. Xenobiotica. 32 (5), 349-362 (2002).
- Stribos, E. G. D., Seelen, M. A., van Goor, H., Olinga, P., Mutsaers, H. A. M. Murine precision-cut kidney slices as an ex vivo model to evaluate the role of transforming growth factor-beta1 signaling in the onset of renal fibrosis. Front Physiol. 8, 1026 (2017).
- James, K., Skibinski, G., Hoffman, P. A comparison of the performance in vitro of precision cut tissue slices and suspensions of human spleen with special reference to immunoglobulin and cytokine production. Hum Antibodies Hybridomas. 7 (4), 138-150 (1996).
- Tatibana, M., Kita, K., Asai, T. Stimulation by 6-azauridine of carbamoyl phosphate synthesis for pyrimidine biosynthesis in mouse spleen slices. Eur J Biochem. 128 (2-3), 625-629 (1982).
- Camelliti, P., et al. Adult human heart slices are a multicellular system suitable for electrophysiological and pharmacological studies. J Mol Cell Cardiol. 51 (3), 390-398 (2011).
- Liu, Z., et al. Comparative analysis of adeno-associated virus serotypes for gene transfer in organotypic heart slices. J Transl Med. 18 (1), 437 (2020).
- Zimmermann, M., et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses. Int J Oncol. 34 (5), 1247-1256 (2009).
- Philouze, P., et al. CD44, gamma-H2AX, and p-ATM expressions in short-term ex vivo culture of tumour slices predict the treatment response in patients with oral squamous cell carcinoma. Int J Mol Sci. 23 (2), 877 (2022).
- Tigges, J., et al. Optimization of long-term cold storage of rat precision-cut lung slices with a tissue preservation solution. Am J Physiol Lung Cell Mol Physiol. 321 (6), L1023-L1035 (2021).
- Olinga, P., et al. Comparison of five incubation systems for rat liver slices using functional and viability parameters. J Pharmacol Toxicol Methods. 38 (2), 59-69 (1997).
- Ou, Q., et al. Physiological biomimetic culture system for pig and human heart slices. Circ Res. 125 (6), 628-642 (2019).
- Martin, C. Human lung slices: New uses for an old model. Am J Respir Cell Mol Biol. 65 (5), 471-472 (2021).
- Sewald, K., Danov, O. Infection of human precision-cut lung slices with the Influenza virus. Methods Mol Biol. 2506, 119-134 (2022).
- . Available from: https://www.nc3rs.org.uk (2023)
- Iulianella, A. Cutting thick sections using a vibratome. Cold Spring Harb Protoc. 2017 (6), (2017).
- Szalowska, E., et al. Effect of oxygen concentration and selected protocol factors on viability and gene expression of mouse liver slices. Toxicol In Vitro. 27 (5), 1513-1524 (2013).
- Kenerson, H. L., Sullivan, K. M., Labadie, K. P., Pillarisetty, V. G., Yeung, R. S. Protocol for tissue slice cultures from human solid tumors to study therapeutic response. STAR Protoc. 2 (2), 100574 (2021).
- Paish, H. L., et al. A bioreactor technology for modeling fibrosis in human and rodent precision-cut liver slices. Hepatology. 70 (4), 1377-1391 (2019).
- Dewyse, L., et al. Improved precision-cut liver slice cultures for testing drug-induced liver fibrosis. Front Med (Lausanne). 9, 862185 (2022).
- Jagatia, R., et al. Patient-derived precision cut tissue slices from primary liver cancer as a potential platform for preclinical drug testing. EBioMedicine. 97, 104826 (2023).
- Koch, A., et al. Murine precision-cut liver slices (PCLS): a new tool for studying tumor microenvironments and cell signaling ex vivo. Cell Commun Signal. 12, 73 (2014).
- Brugger, M., et al. High precision-cut liver slice model to study cell-autonomous antiviral defense of hepatocytes within their microenvironment. JHEP Rep. 4 (5), 100465 (2022).
- Dewyse, L., Reynaert, H., van Grunsven, L. A. Best practices and progress in precision-cut liver slice cultures. Int J Mol Sci. 22 (13), 7137 (2021).
- Lerche-Langrand, C., Toutain, H. J. Precision-cut liver slices: characteristics and use for in vitro pharmaco-toxicology. Toxicology. 153 (1-3), 221-253 (2000).
- van de Kerkhof, E. G., de Graaf, I. A., de Jager, M. H., Meijer, D. K., Groothuis, G. M. Characterization of rat small intestinal and colon precision-cut slices as an in vitro system for drug metabolism and induction studies. Drug Metab Dispos. 33 (11), 1613-1620 (2005).
- Perocheau, D., et al. Ex vivo precision-cut liver slices model disease phenotype and monitor therapeutic response for liver monogenic diseases. F1000Res. 12, 1580 (2023).
- de Graaf, I. A., et al. Preparation and incubation of precision-cut liver and intestinal slices for application in drug metabolism and toxicity studies. Nat Protoc. 5 (9), 1540-1551 (2010).
- Bailey, K. E., et al. Embedding of precision-cut lung slices in engineered hydrogel biomaterials supports extended ex vivo culture. Am J Respir Cell Mol Biol. 62 (1), 14-22 (2020).
- Graaf, I. A., Groothuis, G. M., Olinga, P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs. Expert Opin Drug Metab Toxicol. 3 (6), 879-898 (2007).
- Leeman, W. R., van de Gevel, I. A., Rutten, A. A. Cytotoxicity of retinoic acid, menadione and aflatoxin B(1) in rat liver slices using Netwell inserts as a new culture system. Toxicol In Vitro. 9 (3), 291-298 (1995).
- Schumacher, K., et al. Perfusion culture improves the maintenance of cultured liver tissue slices. Tissue Eng. 13 (1), 197-205 (2007).
- Jetten, M. J., et al. Interindividual variation in response to xenobiotic exposure established in precision-cut human liver slices. Toxicology. 323, 61-69 (2014).
- Duryee, M. J., et al. Precision-cut liver slices from diet-induced obese rats exposed to ethanol are susceptible to oxidative stress and increased fatty acid synthesis. Am J Physiol Gastrointest Liver Physiol. 306 (3), G208-G217 (2014).
- Starokozhko, V., et al. Maintenance of drug metabolism and transport functions in human precision-cut liver slices during prolonged incubation for 5 days. Arch Toxicol. 91 (5), 2079-2092 (2017).
- Vickers, A. E., et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis. Toxicol Sci. 82 (2), 534-544 (2004).
- Boess, F., et al. Gene expression in two hepatic cell lines, cultured primary hepatocytes, and liver slices compared to the in vivo liver gene expression in rats: possible implications for toxicogenomics use of in vitro systems. Toxicol Sci. 73 (2), 386-402 (2003).
- Zhang, W. Y., et al. Amelioration of insulin resistance by scopoletin in high-glucose-induced, insulin-resistant HepG2 cells. Horm Metab Res. 42 (13), 930-935 (2010).
- Smith, J. T., et al. Effect of slice thickness on liver lesion detection and characterisation by multidetector CT. J Med Imaging Radiat Oncol. 54 (3), 188-193 (2010).
- Drobner, C., Glockner, R., Muller, D. Optimal oxygen tension conditions for viability and functioning of precision-cut liver slices. Exp Toxicol Pathol. 52 (4), 335-338 (2000).
- Hart, N. A., et al. Oxygenation during hypothermic rat liver preservation: an in vitro slice study to demonstrate beneficial or toxic oxygenation effects. Liver Transpl. 11 (11), 1403-1411 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados