Research Article
Hipoksik HT22 Hücrelerinde AMPK/Sirt1/HIF-1α Yolu ile Salidrosid'in Mitokondriyal Korumasına İlişkin Mekanistik Bilgiler
Bu Makalede
Özet
Bu çalışma, salidrositin hipoksik HT22 hücreleri üzerinde, kısmen AMPK / Sirt1 / HIF-1α yolu yoluyla mitokondriyal koruyucu etkiler uyguladığı benzersiz bir mekanizma tanımlamıştır.
Özet
Rhodiola crenulata'nın (Hook. f. et Thoms.) H. Ohba'nın aktif bir bileşeni olan Salidrosid (Sal), hipoksik koşullar altında metabolizmayı iyileştirerek ve beyin hücrelerinin enerji arzını artırarak mitokondriyal koruyucu etkiler gösterdiği bulunmuştur. Bununla birlikte, etki mekanizması tam olarak açıklığa kavuşturulmamıştır. Bu çalışmada, Sal'ın nükleotid (ATP, ADP ve AMP) seviyeleri üzerindeki etkilerini analiz etmek için ilk olarak yüksek performanslı sıvı kromatografisi kullanılmıştır. Farklı türlerdeki hücrelerde ve dokularda ilaç hedef katılımını doğrulamak ve ölçmek için yaygın olarak kullanılan bir moleküler etkileşim yöntemi olan hücresel termal kayma testi (CETSA), daha sonra Sal'ın AMPK/Sirt1/HIF-1α yolu ile ilgili proteinler için afinitesini doğrulamak için seçildi. Sonuçlar, Sal'ın hipoksik HT22 hücrelerinde ATP ve ADP seviyelerini arttırdığını, AMP seviyelerini ise azalttığını ortaya koydu. Ayrıca Sal, AMPKα, p-AMPKα, Sirt1 ve HIF-1α proteinlerine stabil bağlanma sergiledi. Sonuç olarak, Sal, nükleotid içeriğini düzenlemek için AMPK/Sirt1/HIF-1α yolunu modüle ederek mitokondriyal koruyucu etkiler uygulayabilir. Bu çalışma, hücre örneklerinde nükleotid içerik analizi için metodolojik bir referans sağlar ve geleneksel Çin tıbbından türetilen bileşikler için hedeflerin belirlenmesine ve keşfedilmesine katkıda bulunur.
Giriş
Beyin, yüksek metabolik talepleri, sınırlı glikolitik kapasitesi ve oksidatif fosforilasyona bağımlılığı nedeniyle oksijene karşı oldukça hassastır. Sonuç olarak, yüksek irtifalarda düşük oksijenli bir ortama maruz kalmak kolayca hipobarik hipoksik beyin hasarına (HHBI) yol açabilir1,2. Epidemiyolojik çalışmalar, yüksek irtifalara alışkın olmayan bireyler hızlı bir şekilde yüksek rakımlı bölgelere çıktıklarında, akut dağ hastalığı insidansının %75'e kadar çıkabileceğini ve ciddi vakalar için ölüm oranının yaklaşık %1 olduğunu göstermektedir. Ayrıca, tıbbi bakımın yokluğunda, yüksek irtifa serebral veya pulmoner ödem için ölüm oranları %40'a kadar çıkabilir3,4.
HHBI, geniş bir klinik semptom spektrumu ile kendini gösterir. Hafif ila orta dereceli vakalar baş ağrısı, baş dönmesi ve hafıza kaybınıiçerebilirken 5, ciddi vakalar bilişsel bozulmaya, bilinç değişikliğine ve potansiyel olarak ölümcül sonuçlara neden olabilir5. Yüksek rakımlı bölgelerde HHBI'nin önlenmesi ve tedavisi, tıbbi araştırmaların önemli bir odak noktası haline gelmiştir. Önleyici stratejiler öncelikle yeterli dinlenme, dengeli beslenme, doğru beslenme ve uygun fiziksel egzersiz dahil olmak üzere yüksek irtifa ortamlarında uyarlanabilir eğitimi içerir 6,7. Ek olarak, beyin hücrelerini korumayı ve serebral hipoksiyi hafifletmeyi amaçlayan farmakolojik müdahaleler, mevcut HHBI araştırmalarının merkezinde yer almaktadır.
Mitokondri, hücresel enerji taleplerini karşılamak için adenozin trifosfat (ATP) sentezleyerek hücreler içinde birincil enerji üretim merkezleri olarak hizmet eder. Hipoksik koşullar altında, mitokondriyal enerji üretimi azalır, bu da ATP seviyelerinin azalmasına ve hücre fonksiyonunun bozulmasına neden olur8. Hipoksik yaralanma ayrıcaCa2+ ve pH homeostazının mitokondriyal regülasyonunu bozarak apoptoz ve nekrozutetikler 9,10. Mitokondriyal disfonksiyon ile hipoksik beyin hasarı arasında karşılıklı olarak güçlendirici bir ilişki vardır. Bir yandan, hipoksinin neden olduğu mitokondriyal bozukluk, hücresel enerji metabolizmasını daha da azaltarak oksijen eksikliğini şiddetlendirir ve bir kısır döngü yaratır. Öte yandan, mitokondriyal disfonksiyon hücre içi Ca2+ seviyelerini yükseltir, apoptotik kaskadları aktive eder ve hücre ölümüneyol açar 11. Hipoksik beyin hasarının altında yatan mekanizmalar karmaşık kalmasına ve tam olarak anlaşılamamış olmasına rağmen, çok sayıda çalışma, bozulmuş nöronal mitokondriyal enerji metabolizmasını patogenezinde kritik bir faktör olarak tanımlamıştır12,13. Bu nedenle, mitokondriyal fonksiyonun daha fazla araştırılması, hipoksik beyin hasarı için potansiyel terapötik hedefler hakkında değerli bilgiler sağlayabilir.
Salidroside (Sal), plato bitkisi Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba'dan ekstrakte edilen aktif bir bileşendir ve gıda, sağlık ürünleri ve eczacılıkta yaygın olarak kullanılmaktadır14. Sal'ın moleküler formülü C14H20O7'dir ve aynı zamanda 2- (4-hidroksifenil) -etil β-D-glukopiranozit olarak da bilinir. Anti-hipoksi, antioksidan, anti-yorgunluk, anti-tümör, immünomodülatör, anti-inflamatuar ve kardiyovasküler ve serebrovasküler koruyucu etkiler dahil olmak üzere çeşitli farmakolojik özelliklere sahiptir 15,16,17. Bunlar arasında, anti-hipoksi etkisi en iyi belgelenenlerden biridir. Son çalışmalar, farelerde plato kaynaklı beyin hasarı üzerindeki önleyici ve terapötik etkileri için potansiyel bir mekanizma olarak Sal'ın önemli mitokondriyal koruyucu etkilerini giderek daha fazla vurgulamıştır14,18. Bununla birlikte, Sal'ın ATP, ADP ve AMP seviyelerini etkilediği kesin moleküler mekanizmalar tam olarak anlaşılamamıştır.
AMP ile aktive olan protein kinaz (AMPK), hücresel enerji homeostazının korunmasına yardımcı olan önemli bir enerji sensörü görevi görür. AMPK'nın aktivasyonu Sirtuin 1'i (Sirt1) uyararak hücre içi NAD + seviyelerinde19 bir artışa yol açar. Çalışmalar, Sirt1'in hipoksi20'ye hücresel yanıtı koordine etmek için hipoksi ile indüklenebilir faktör 1-alfa'yı (HIF-1α) düzenleyebildiğini göstermiştir. Önceki araştırmalar, Sal'ın nöronal mitokondriyal geçirgenlik geçiş gözeneğinin açılmasını engellediğini, HIF-1α aracılı mitokondriyal enerji süreçlerini düzenlediğini, nöronal apoptozu zayıflattığını ve kan-beyin bariyeri bütünlüğünü koruduğunu, böylece sıçanları plato kaynaklı beyin hasarından koruduğunu göstermiştir14,21. Bununla birlikte, Sal'ın ATP ve metabolitleri, ADP ve AMP üzerindeki etkisi belirsizliğini korumaktadır.
Bunu araştırmak için, bu üç nükleotidin seviyelerini ölçmek için ilk olarak yüksek performanslı sıvı kromatografisi (HPLC) kullanıldı. Ek olarak, sağlam hücrelerde22 ligand-protein etkileşimlerini incelemek için 2013 yılında tanıtılan yaygın olarak kullanılan bir biyofiziksel teknik olan hücresel termal kayma testi (CETSA) kullanılmıştır. Bu yöntem, farklı türlerdeki hücrelerde ve dokularda ilaç hedefi etkileşimini doğrulamak ve ölçmek için yaygın olarak uygulanır. Spesifik olarak, hedef hücre lizatlarının ilaçla belirli bir süre boyunca değişen sıcaklıklarda birlikte inkübe edilmesinden sonra, ilaca bağlı protein, artan termal stabilite sergiler, bu da onu denatürasyon ve çökelmeye daha az eğilimli hale getirir. Çökeltilmiş bağlanmamış proteinler daha sonra santrifüjleme yoluyla uzaklaştırılır ve ilaç-hedef etkileşimleri daha sonra süpernatant22'nin western blot analizi yoluyla tanımlanır. Sal'ın potansiyel moleküler hedeflerini belirlemek için, AMPK/Sirt1/HIF-1α yolu ile ilgili proteinlerle bağlanma afinitesini değerlendirmek için CETSA seçildi.
Protokol
Bu çalışmada kullanılan reaktiflerin ve ekipmanların ticari detayları Malzeme Tablosunda verilmiştir.
1. Çözelti hazırlama
- % 10 fetal sığır serumu ve% 1 penisilin-streptomisin ekleyerek tam Dulbecco'nun modifiye Eagle ortamını (DMEM) hazırlayın.
- 3 mg Sal'ı 500 μL fosfat tamponlu salin (PBS) içinde çözerek 20 mM'lik bir Sal çözeltisi hazırlayın21.
- 0,45 μm organik membran kullanarak 500 mL kromatografik olarak saf asetonitril (mobil faz A) süzün.
- 1 L deiyonize suya 3,5 mL reaktif I ekleyerek 1000 mL mobil faz B hazırlayın. Nükleotid (ATP, ADP ve AMP) içerik tahlil kitinin talimatlarını izleyerek pH'ı reaktif II ile 6.15'e ayarlayın (bkz. Malzeme Tablosu).
NOT: Reaktif I ve reaktif II, nükleotid (ATP, ADP ve AMP) içerik tahlil kitine dahildir. - 0,22 μm sulu membran kullanarak mobil faz B'yi filtreleyin.
NOT: Mobil faz B, hazırlandıktan hemen sonra kullanılmalıdır. Mobil faz A ve B, hava kabarcıklarını gidermek için kullanmadan önce 30 dakika boyunca sonikleştirilmelidir. - 0.5 μM, 0.1 μM, 0.05 μM, 0.01 μM ve 0.005 μM ATP, ADP ve AMP serisi standart çözeltiler elde etmek için 1 μM ATP, ADP ve AMP standart stok çözeltisini deiyonize su ile seyreltin.
- 0,22 μm iğne tipi mikro gözenekli filtre membranı kullanarak standart çözelti serisini filtreleyin.
NOT: Seri standart çözeltileri saklamak için kahverengi enjeksiyon şişeleri kullanılmalıdır. Hazırlanan standart çözelti serisi mümkün olan en kısa sürede kullanılmalıdır.
2. Hücre kültürü
NOT: HT22 hücre kültürü ve CoCl2 ile uyarılan hipoksi modeli, önceki bir raporagöre kurulmuştur 21.
- HT22 hücrelerini 37 ° C'de% 5 CO2 ile% 80 olana kadar Petri kabında kültür birleşimine ulaşılır. Hücreleri 1 dakika boyunca% 0.25 tripsin ile sindirin.
- Tohum 2 × 105 hücreleri, adım 2.1'den tam DMEM (ilaç tedavisi olmayan kontrol grubu) veya ilacı içeren tam DMEM (250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal ve 250 μM CoCl2 + 10 μM Dor + 20 μM Sal) ile 6 oyuklu plakalara yerleştirin. % 5 CO2 ile 37 ° C'de 24 saat inkübe edin.
NOT: Her grupta üç paralel örnek oluşturulmuştur.
3. Nükleotid (ATP, ADP ve AMP) içerik analizi
- Adım 2.2'den itibaren 6 oyuklu plakalardaki her bir oyuka 1 mL ekstraksiyon reaktifi I ekleyin.
NOT: Ekstraksiyon reaktifi I, nükleotid (ATP, ADP ve AMP) içerik tahlil kitine dahildir (bkz. Malzeme Tablosu). - Ultrasonik hücre bozulma aparatı kullanarak bir buz banyosunda sonikasyon yaparak hücreleri parçalayın (güç: 300 W, 3 sn için ultrasonik dalgalar, 7 s aralık, toplam süre: 3 dakika).
- Parçalanmış hücreleri 10.304 × g'da 4 ° C'de 10 dakika boyunca yüksek hızlı soğutmalı bir santrifüj kullanarak santrifüjleyin.
- Adım 3.3'ten 0.75 mL süpernatanı 2.0 mL'lik bir tüpe aktarın. 0.75 mL ekstraksiyon reaktifi II ekleyin, bir vorteks karıştırıcı kullanarak çalkalayın ve karıştırın ve 4 ° C'de 10 dakika boyunca 10.304 × g'da tekrar santrifüjleyin.
NOT: Ekstraksiyon reaktifi II, nükleotid (ATP, ADP ve AMP) içerik tahlil kitine dahildir. - Süpernatanı adım 3.4'ten pipetleyin ve 0.22 μm iğne tipi mikro gözenekli filtre membranı kullanarak kahverengi bir şişeye süzün.
NOT: Ekstrakte edilen numunedeki ATP, ADP ve AMP kararlı değildir. Tüm deneysel prosedürler düşük sıcaklıklarda veya buz üzerinde yapılmalıdır. Numuneler mümkün olan en kısa sürede işlenmeli ve test edilmelidir. - Kromatografi yazılımını açın ve aşağıdaki parametreleri ayarlayın: enjeksiyon hacmi: 10 μL; sütun sıcaklığı: 27 °C; akış hızı: 0.8 mL / dak; algılama dalga boyu: 254 nm; Algılama süresi: 70 dk. Gradyan elüsyon prosedürünü Tablo 1'e göre ayarlayın.
- Örneği otomatik olarak enjekte etmek ve adım 3.6'da ayarlanan programa göre seri standart çözümlerde (adım 1.7) ve örnek çözümlerde (adım 3.5) ATP, ADP ve AMP içeriğini algılamak için yürüt düğmesine tıklayın.
NOT: Deneyin sonunda, tıkanmayı önlemek için kromatografik sütunu %98 mobil faz B ile yıkayın. - ATP, ADP ve AMP'nin standart eğrilerini, grafik ve istatistiksel analiz yazılımı kullanarak, x ekseninde seri standart konsantrasyonlar ve y ekseninde tepe alanları ile çizin.
- Adım 3.8'deki standart eğri denklemini kullanarak örneklerdeki ATP, ADP ve AMP içeriğini hesaplayın.
4. Hücresel termal kayma deneyi (CETSA)
- Hücreleri tekrar tekrar pipetleyerek proteaz inhibitörü içeren lizat (lizat: proteaz inhibitörü = 100:1) kullanarak bir Petri kabında normal HT22 hücrelerini 20 dakika boyunca parçalayın.
NOT: Protein bozulmasını önlemek için bu adımı bir buz banyosunda gerçekleştirin. - Hücre lizatını adım 4.1'den toplayın ve bir ultrasonik hücre bozulma aparatı kullanarak bir buz banyosunda sonikat yapın (güç: 300 W, 3 sn için ultrasonik dalgalar, 7 s aralık, toplam süre: 3 dakika). 10.304 × g'da, 4 ° C'de 20 dakika santrifüjleyin ve süpernatanı toplayın.
NOT: Süpernatanı 14 parçaya bölün: Sal ile madeni para için 7 grup ve kontrol olarak PBS ile madeni para kuşağı için 7 grup. Sal ile muamele edilen grup için, numune başına 100 μL süpernatan ve 0.1 μL 20 μM Sal ekleyin. Kontrol grubu için, numune başına 100 μL süpernatan ve 0.1 μL PBS ekleyin. - Her numuneyi oda sıcaklığında 30 dakika inkübe edin, ardından metal bir ısıtma sıcaklık kontrol cihazı kullanarak 37 °C, 42 °C, 47 °C, 52 °C, 57 °C, 62 °C ve 67 °C'de 3 dakika inkübe edin.
- Adım 4.3'ten itibaren numuneleri 10.304 × g'da 4 ° C'de 20 dakika boyunca santrifüjleyin ve süpernatanı bir pipet kullanarak toplayın.
- Üreticinin talimatlarını izleyerek bir BCA protein konsantrasyonu test kiti kullanarak adım 4.4'ten süpernatantın toplam protein konsantrasyonunu ölçün (bkz. Malzeme Tablosu).
- Üreticinin talimatlarını izleyerek bir PAGE jel hızlı hazırlama kiti kullanarak %10 ayırma jeli hazırlayın (bkz. Malzeme Tablosu).
- Ayırma jelinin kuyucuklarına 3 μL önceden boyanmış renkli protein işaretleyicisi ve 14 μL numune yükleyin (oyuk başına nihai protein miktarı: 20 μg).
- Ayrılmış proteinleri elde etmek için jeli 80-100 mV'de 1 saat boyunca elektroforez tamponu kullanarak çalıştırın.
- Proteinleri adım 4.8'den hızlı membran transfer çözeltisi ve 30 dakika boyunca 400 mA'da bir sandviç yapı (pamuk-filtre kağıdı-PVDF membran-protein jel-filtre kağıdı-pamuk) kullanarak bir PVDF membranına aktarın.
- PVDF membranlarını oda sıcaklığında 1-2 saat boyunca% 5 sığır serum albümini (BSA) çözeltisi ile adım 4.9'dan bloke edin.
NOT: 5 mg BSA tozunu 100 mL TBS tamponu ve% 0.05 Tween 20 içeren 100 mL TBST çözeltisi içinde çözerek% 5 BSA çözeltisi hazırlayın. - PVDF membranlarını step 4.10'dan itibaren gece boyunca 4 ° C'de 5 mL seyreltilmiş primer antikor ile inkübe edin.
NOT: Primer antikoru BSA çözeltisi (1:1000 oranında) içinde seyreltin. - Bağlanmamış primer antikorları çıkarmak için PVDF membranlarını TBST ile her biri 5 dakika boyunca üç kez yıkayın.
- Adım 4.12'den itibaren zarları seyreltilmiş yaban turpu peroksidaz (HRP) ile bağlı ikincil antikor ile oda sıcaklığında 2 saat boyunca bir renk giderme çalkalayıcı üzerinde inkübe edin.
NOT: HRP'ye bağlı ikincil antikoru BSA çözeltisinde (1: 10.000 oranında) seyreltin. - Artık ikincil antikoru çıkarmak için membranları TBST ile her biri 5 dakika boyunca üç kez yıkayın.
- Adım 4.14'ten itibaren zarları ECL kemilüminesans geliştiricisi ile kaplayın, ardından bir görüntüleme sistemi kullanarak hedef protein sinyalini görüntüleyin.
NOT: Floresan söndürmeyi önlemek için bu adımı karanlıkta gerçekleştirin. - ImageJ yazılımını kullanarak hedef proteinlerin gri değerini analiz edin ve miktarını belirleyin (bkz.
Sonuçlar
HPLC tarafından tespit edilen ATP, ADP ve AMP için standart eğriler sırasıyla Y = 7006.5X - 222.99, Y = 5217.3X - 17.796 ve Y = 9280.1X + 22.749 idi (Şekil 1A-C). Her grupta HPLC ile ölçülen nükleotid içerikleri standart eğriler kullanılarak hesaplandı (Şekil 1D-I). CoCl2'nin HT22 hücrelerinde ATP ve ADP düzeylerini kontrol grubuna göre anlamlı derecede azalttığı bulundu (P < 0.01, Şekil 1J,K). Ayrıca, bir AMPK inhibitörü olan dorsomorfinin (Dor) uygulanması, CoCl2 ile tedavi edilen gruba kıyasla ATP ve ADP seviyelerinde belirgin bir azalmaya yol açmıştır (P < 0.01, Şekil 1J, K). Bununla birlikte, Sal ile tedavi, CoCl2 ile tedavi edilen gruba göre ATP ve ADP seviyelerini önemli ölçüde arttırdı (P < 0.05, Şekil 1J, K).
Daha ileri analizler, CoCl2 ile tedavi edilen grupta AMP seviyelerinin önemli ölçüde arttığını, Sal tedavisinin ise bu dalgalanmayı etkili bir şekilde sınırladığını ortaya koydu (P < 0.01, Şekil 1L). Uygun mitokondriyal fonksiyon, hücre içi ATP, ADP ve AMP homeostazının yanı sıra normal hücresel fizyolojik fonksiyonların sürdürülmesi için gereklidir. Mitokondrinin fonksiyonel durumu, ATP, ADP ve AMP'nin dönüşüm oranını ve dengesini doğrudan etkiler. Mitokondriyal hasar veya işlev bozukluğu, ATP sentezini bozabilir ve ADP ve AMP'nin dönüşüm oranlarını azaltabilir, böylece hücresel enerji arzını ve metabolik dengeyi bozabilir.
Bu bulgular, Sal'ın ATP, ADP ve AMP dönüşümünü modüle ederek HT22 hücrelerinde hipoksik hasarı hafifletebileceğini düşündürmektedir. Ek olarak, Mitokondri ile ilişkili proteinlere Sal bağlanmasının CETSA analizi, Sal tedavisini takiben AMPKα, p-AMPKα, Sirt1 ve HIF-1α'nın termal stabilitesinde bir artış göstermiştir. Bu, Sal'ın bu proteinlerle etkileşime girebileceğini düşündürmektedir (Şekil 2), önceki çalışmalardan elde edilen bulgularla tutarlıolarak 21,23,24.
VERI KULLANILABILIRLIĞI:
Tüm ham veriler sağlanır (Ek Dosya 1 ve Ek Dosya 2).

Şekil 1: Sal'ın nükleotid (ATP, ADP ve AMP) içeriği üzerindeki etkisi. (A-C) ATP (A), ADP (B) ve AMP (C) için standart eğriler. (D-I) Farklı tedavi gruplarında ATP, ADP ve AMP içeriğinin belirlenmesi için temsili HPLC eğrileri. (J-L) Farklı tedavi gruplarında ATP, ADP ve AMP içeriğinin istatistiksel analizi (kontrol, 250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal ve 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). (n = 3, *P < 0.05, **P < 0.01). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
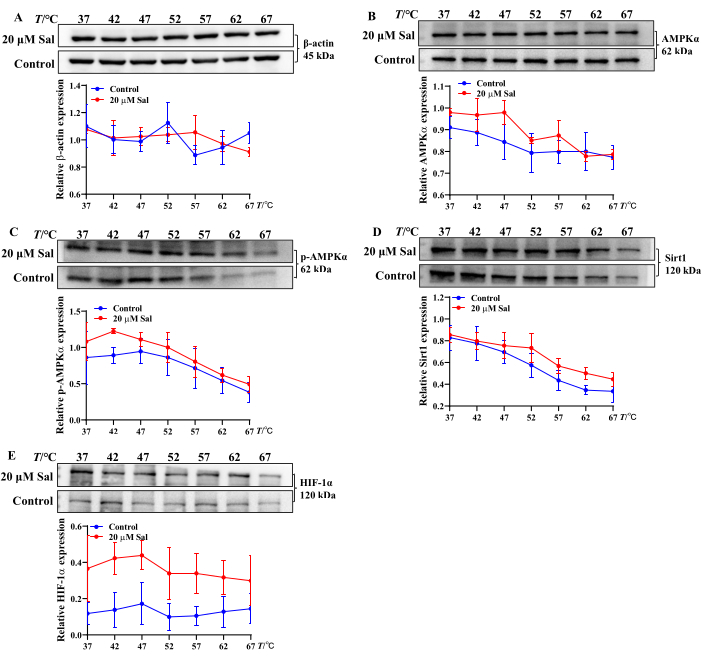
Şekil 2: CETSA yöntemi kullanılarak AMPK/Sirt1/HIF-1α yolağı ile ilişkili proteinlere Sal bağlanma özelliklerinin değerlendirilmesi. HT22 hücrelerinde β-Aktin (A), AMPKα (B), p-AMPKα (C), Sirt1 (D) ve HIF-1α (E) protein bantları ve ekspresyon eğilimleri CETSA ile değerlendirildi (n=3). Sal'ın farklı proteinlerle bağlanma özellikleri, değişen sıcaklıklarda istatistiksel ve grafik yazılımı kullanılarak analiz edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Zaman (dk) | Mobil aşama | |
| Çözücü A | Çözücü B | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
Tablo 1: Mobil faz elüsyon prosedürü.
Ek Dosya 1: HPLC ile ATP, ADP ve AMP'yi tespit etmek için ham veriler. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2: CETSA protein bantları. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Mitokondri, HHBI 23,24,25'in terapötik önlenmesinde rol oynayan anahtar organellerdir. Grup tarafından yapılan önceki çalışmalar, Sal'ın AMPK, Sirt1 ve HIF-1α protein ekspresyonunu düzenlediğini, nöronal mitokondriyal fonksiyonu geliştirdiğini ve HHBI21,24'e karşı koruma sağladığını doğrulamıştır. Bununla birlikte, Sal'ın hipoksik hücrelerdeki nükleotidler üzerindeki doğrudan etkisi daha fazla araştırma gerektirir. Ek olarak, bileşiklerin ve proteinlerin değişen sıcaklık koşulları altında bağlanma potansiyelinin değerlendirilmesi, etkileşimlerini anlamak için çok önemlidir.
Bu yönleri ele almak için, bu çalışma, Sal'ın HPLC kullanarak HT22 hücrelerinde mitokondriyal ATP, ADP ve AMP seviyeleri üzerindeki etkisini incelemiş ve mitokondriyal enerji metabolizmasındaki rolü hakkında doğrudan bilgi sağlamıştır. Önceki bir çalışmayadayanarak 18, HT22 hücrelerinde hipoksiyi indüklemek için 250 μM CoCl2 seçildi. Sonuçlar, Sal'ın hipoksik HT22 hücrelerinde AMP içeriğini azaltırken ATP ve ADP seviyelerini önemli ölçüde artırdığını göstermiştir (Şekil 1). Gruptan elde edilen önceki bulgularla birleştiğinde, bu sonuçlar Sal'ın hipoksik nöronlarda mitokondri üzerinde koruyucu bir etki gösterdiğini daha da doğrulamaktadır.
AMPK, ökaryotlarda enerji metabolizmasını düzenleyen yüksek oranda korunmuş bir protein kinazdır. Çeşitli substratları fosforile ederek glikoz metabolizmasını, yağ asidi sentezini ve mitokondriyal biyogenezi koordine etmek için hücresel ATP, ADP ve AMP seviyelerindeki değişiklikleri algılar26. AMPK'nın aktivasyonu, enerji üretimini teşvik eder ve özellikle hücre içi ATP seviyelerinin azalmasına ve yüksek AMP seviyelerine yanıt olarak enerji harcamasını bastırır27. Ek olarak, AMPK, glukoamilazı fosforile ederek, enzimatik katalizi değiştirerek ve fosfoarginin-arginin havuzundan28 hızla ATP üreterek ATP rezervlerini arttırır.
Bu çalışmada, Sal'ınnükleotid seviyeleri 29 üzerindeki etkilerini araştırmak için seçici fosforile bir AMPK inhibitörü olan Dor kullanıldı. HPLC, tek başına veya Sal ile kombinasyon halinde Dor'a maruz kalan CoCl2 ile muamele edilmiş HT22 hücrelerinde ATP, ADP ve AMP seviyelerini ölçmek için kullanıldı. Bulgular, Sal'ın ATP/ADP/AMP oranını modüle ettiğini ve böylece hipoksiye karşı nöroprotektif etkiler gösterdiğini göstermektedir (Şekil 1). Yerleşik HPLC yöntemi, biyoaktif bileşiklerin hücresel düzeyde nükleotidler üzerindeki etkilerini doğrudan değerlendirmek için sezgisel, basit ve verimli bir yaklaşım sağlar.
HIF-1α, hipoksik stimülasyona yanıt olarak aktive edilen bir transkripsiyon faktörüdür. Hipoksik koşullar altında, HIF-1α'nın stabilitesi önemli ölçüde artar ve sitoplazmadan çekirdeğe yer değiştirmesine izin verir, burada HIF-1β30 ile bir heterodimer oluşturur. Bu süreç, anjiyogenez, glikoz metabolizması ve glikoliz 31,32,33 ile ilgili genlerin ekspresyonunu teşvik eder. Ek olarak, HIF-1α stabilitesinin, oksidatif fosforilasyon sırasında mitokondriyal fonksiyon ve hücre içiO2 seviyeleri ile yüksek oranda ilişkili olduğu gösterilmiştir31. Bununla birlikte, hipoksinin neden olduğu mitokondriyal disfonksiyon, yetersiz hücre içi enerji kaynağına yol açar ve bu da hipoksiye hücresel adaptasyonu düzenlemek için HIF-1α yolunu aktive eder31,32.
Sirtuin ailesinin bir üyesi olan Sirt1, deasetilasyon yoluyla HIF-1α protein stabilitesini azaltan ve böylece nükleer birikimini sınırlayan NAD + bağımlı bir deasetilazdır32. Hipoksik koşullar altında, azalmış hücre içi ATP seviyeleri, fosforilasyon 31,32,33 yoluyla HIF-1α ve ilişkili proteinlerin hücre içi taşınmasını, stabilitesini ve transkripsiyonel aktivitesini etkileyen AMPK aktivitesinin artmasına neden olur. Ek olarak, Sirt1 ve AMPK, HIF-1α ve koaktivatörler arasındaki etkileşimi modüle eder, böylece transkripsiyonel aktivitesini düzenler ve hipoksi33'e hücresel adaptasyonu daha da kolaylaştırır. Hipoksi ile yaralanmış beyin hücrelerinde, AMPK, Sirt1 ve HIF-1α, hücre içi enerji homeostazını sürdürmek ve metabolik süreçleri düzenlemek için etkileşime girer.
Bileşik-protein komplekslerinin termostabilitesini ve bağlanma potansiyelini in vitro olarak değerlendirmek için basit ve verimli yöntemler, ligand bağlanması üzerine proteinlerin stabilitesini değerlendiren teknikleri içerir. Bileşik-protein etkileşimlerinin, proteinlerin termostabilitesini arttırdığı, onları sıcaklığa bağlı denatürasyona karşı daha az hassas hale getirdiği ve nispeten kararlı bir protein verimi ile sonuçlandığı iyi bilinmektedir. Western blot analizi ile birleştirilen hücresel termal kayma testi (CETSA), kesin bağlanma bölgesini ortaya çıkarmasa da, ilaç-hedef etkileşimlerini ve potansiyel hedef dışı etkileri incelemek için düşük maliyetli ve verimli bir yaklaşım sağlar22,34. CETSA, farklı türlerdeki hücre ve dokularda ilaç hedefi etkileşimini doğrulamak ve ölçmek için yaygın olarak kullanılmaktadır.
Bu çalışmada, Sal'ın hücresel düzeyde AMPKα, p-AMPKα, Sirt1 ve HIF-1α ile etkileşime girip girmediğini değerlendirmek için CETSA kullanılmıştır. Isıl işlemi takiben Sal, bu proteinlerin ekspresyonunu arttırdı ve kararlı Sal-AMPKα, Sal-p-AMPKα, Sal-Sirt1 ve Sal-HIF-1α komplekslerinin oluşumunu düşündürdü (Şekil 2). Bu bulgular önceki deneysel sonuçlarla uyumludur21,24. Bu nedenle CETSA-western blot, in vitro olarak bileşik-protein etkileşimlerinin ve termostabilitenin büyük ölçekli taraması için sağlam ve verimli bir yaklaşım olarak hizmet eder.
HPLC ve CETSA teknikleri kullanılarak Sal'ın mitokondriyal enerji metabolizması üzerindeki koruyucu mekanizmalarına ilişkin içgörülere rağmen, bazı sınırlamalar devam etmektedir. CETSA, bileşiklerin protein termostabilitesini nasıl etkilediğine dair amino asit düzeyinde bilgi sağlamaz. Potansiyel bir gelişme, proteinler içindeki bileşik bağlama bölgelerini görsel olarak tanımlamak için CETSA'nın görüntüleme teknolojileriyle entegrasyonu olacaktır ve bileşik-protein komplekslerinin ısıya bağlı denatürasyona nasıl direndiğine dair daha net bir anlayış sunar. Bunu başarmak, daha fazla bilimsel yenilik ve rafine deneysel tasarım gerektirir. Ek olarak, CETSA'yı lokalize yüzey plazmon rezonansı ve diferansiyel taramalı florimetri gibi diğer moleküler etkileşim teknikleriyle tamamlamak, bileşik-protein etkileşimlerinin daha kapsamlı bir analizini sağlayacaktır35.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (82274207 ve 82474185), Sichuan Eyaleti Bilim ve Teknoloji Departmanı (2024NSFSC1845), Sichuan Eyaleti Bilim ve Teknoloji Departmanı Gençleri için Bilim Vakfı (2023NSFSC1776), Ningxia Temel Araştırma ve Geliştirme Programı (2023BEG02012), Çin Çin Tıbbı Derneği'nin 2024-2026 (2024-QNRC2-B07) için Genç Yetenek Destek Projesi ve Xinglin Scholar Research tarafından desteklenmiştir TCM Chengdu Üniversitesi'nin (XKTD2022013 ve QJJJ2024027) Tanıtım Projesi.
YAZAR KATKISI:
Xiaobo Wang, Yating Zhang, Ya Hou, Rui Li ve Xianli Meng bu projeyi tasarladı. Yating Zhang, Ya Hou ve Tingting Kuang deneyleri gerçekleştirdi ve verileri analiz etti. Yating Zhang ve Hong Jiang el yazmasını yazdı. Xiaobo Wang ve Xianli Meng el yazmasını gözden geçirdi. Tüm yazarlar son makaleyi okumuş ve onaylamıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
Referanslar
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108(2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532(2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77(2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094(2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146(2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762(2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568(2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404(2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529(2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617(2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278(2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843(2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82(2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318(2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858(2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182(2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127(2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287(2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır