Research Article
Insights mecanicistas sobre a proteção mitocondrial do salidrosídeo via via AMPK/Sirt1/HIF-1α em células HT22 hipóxicas
Neste Artigo
Resumo
O presente estudo identificou um mecanismo único pelo qual o salidrosídeo exerce efeitos protetores mitocondriais em células HT22 hipóxicas, em parte através da via AMPK/Sirt1/HIF-1α.
Resumo
Descobriu-se que o salidrosídeo (Sal), um ingrediente ativo da Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba exerce efeitos protetores mitocondriais, melhorando o metabolismo e aumentando o suprimento de energia das células cerebrais em condições hipóxicas. No entanto, seu mecanismo de ação não foi totalmente esclarecido. No presente estudo, a cromatografia líquida de alta eficiência foi empregada pela primeira vez para analisar os efeitos do Sal nos níveis de nucleotídeos (ATP, ADP e AMP). O ensaio de deslocamento térmico celular (CETSA), um método de interação molecular amplamente utilizado para validar e quantificar o envolvimento do alvo do medicamento em células e tecidos em diferentes espécies, foi então escolhido para confirmar a afinidade de Sal por proteínas relacionadas à via AMPK / Sirt1 / HIF-1α. Os resultados revelaram que Sal aumentou os níveis de ATP e ADP em células HT22 hipóxicas enquanto reduzia os níveis de AMP. Além disso, Sal exibiu ligação estável às proteínas AMPKα, p-AMPKα, Sirt1 e HIF-1α. Em conclusão, o Sal pode exercer efeitos protetores mitocondriais modulando a via AMPK/Sirt1/HIF-1α para regular o conteúdo de nucleotídeos. Este estudo fornece um referencial metodológico para análise de conteúdo de nucleotídeos em amostras de células e contribui para a identificação e descoberta de alvos para compostos derivados da medicina tradicional chinesa.
Introdução
O cérebro é altamente sensível ao oxigênio devido às suas altas demandas metabólicas, capacidade glicolítica limitada e dependência da fosforilação oxidativa. Como resultado, a exposição a um ambiente com baixo teor de oxigênio em grandes altitudes pode levar prontamente à lesão cerebral hipóxica hipobárica (HHBI)1,2. Estudos epidemiológicos indicam que quando indivíduos não aclimatados a grandes altitudes ascendem rapidamente a regiões de alta altitude, a incidência de doença aguda da montanha pode chegar a 75%, com uma taxa de letalidade de aproximadamente 1% para casos graves. Além disso, na ausência de cuidados médicos, as taxas de mortalidade por edema cerebral ou pulmonar de grandes altitudes podem chegar a 40%3,4.
O ICHB apresenta um amplo espectro de sintomas clínicos. Casos leves a moderados podem incluir dores de cabeça, tontura e perda de memória5, enquanto casos graves podem resultar em comprometimento cognitivo, alteração da consciência e resultados potencialmente fatais5. A prevenção e o tratamento do HHBI em regiões de alta altitude tornaram-se um foco importante da pesquisa médica. As estratégias preventivas envolvem principalmente o treinamento adaptativo em ambientes de alta altitude, incluindo repouso adequado, dieta bem balanceada, nutrição adequada e exercícios físicos adequados 6,7. Além disso, as intervenções farmacológicas destinadas a proteger as células cerebrais e aliviar a hipóxia cerebral permanecem centrais para a pesquisa atual do HHBI.
As mitocôndrias servem como centros primários de produção de energia dentro das células, sintetizando trifosfato de adenosina (ATP) para atender às demandas de energia celular. Em condições hipóxicas, a produção de energia mitocondrial diminui, levando à redução dos níveis de ATP e ao comprometimento da função celular8. A lesão hipóxica também interrompe a regulação mitocondrial do Ca2+ e a homeostase do pH, desencadeando apoptose e necrose 9,10. Existe uma relação que se reforça mutuamente entre a disfunção mitocondrial e a lesão cerebral hipóxica. Por um lado, o comprometimento mitocondrial induzido por hipóxia exacerba a deficiência de oxigênio, reduzindo ainda mais o metabolismo energético celular, criando um ciclo vicioso. Por outro lado, a disfunção mitocondrial eleva os níveis intracelulares de Ca2+, ativando cascatas apoptóticas e levando à morte celular11. Embora os mecanismos subjacentes à lesão cerebral hipóxica permaneçam complexos e não totalmente compreendidos, vários estudos identificaram o metabolismo energético mitocondrial neuronal prejudicado como um fator crítico em sua patogênese12,13. Portanto, uma exploração mais aprofundada da função mitocondrial pode fornecer informações valiosas sobre potenciais alvos terapêuticos para lesão cerebral hipóxica.
O salidrosídeo (Sal) é um ingrediente ativo extraído da planta do planalto Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba e é amplamente utilizado em alimentos, produtos de saúde e produtos farmacêuticos14. A fórmula molecular do Sal é C14H20O7, e também é conhecido como 2- (4-hidroxifenil) -etil β-D-glicopiranosídeo. Possui diversas propriedades farmacológicas, incluindo efeitos anti-hipóxia, antioxidante, antifadiga, antitumoral, imunomodulador, anti-inflamatório e protetor cardiovascular e cerebrovascular 15,16,17. Entre estes, seu efeito anti-hipóxia é um dos mais bem documentados. Estudos recentes têm destacado cada vez mais os efeitos protetores mitocondriais significativos do Sal como um mecanismo potencial para seus efeitos preventivos e terapêuticos na lesão cerebral induzida por platô em camundongos14,18. No entanto, os mecanismos moleculares precisos pelos quais o Sal influencia os níveis de ATP, ADP e AMP permanecem pouco compreendidos.
A proteína quinase ativada por AMP (AMPK) atua como um sensor de energia chave que ajuda a manter a homeostase da energia celular. A ativação da AMPK estimula a Sirtuína 1 (Sirt1), levando a um aumento nos níveis intracelulares de NAD+ 19. Estudos mostraram que Sirt1 pode regular o fator 1-alfa induzível por hipóxia (HIF-1α) para coordenar a resposta celular à hipóxia20. Pesquisas anteriores demonstraram que o Sal inibe a abertura do poro de transição da permeabilidade mitocondrial neuronal, regula os processos de energia mitocondrial mediados pelo HIF-1α, atenua a apoptose neuronal e mantém a integridade da barreira hematoencefálica, protegendo assim os ratos da lesão cerebral induzida pelo platô14,21. No entanto, o efeito do Sal no ATP e seus metabólitos, ADP e AMP, permanece incerto.
Para investigar isso, a cromatografia líquida de alta eficiência (HPLC) foi empregada pela primeira vez para quantificar os níveis desses três nucleotídeos. Além disso, foi utilizado o ensaio de deslocamento térmico celular (CETSA), uma técnica biofísica amplamente utilizada introduzida em 2013 para estudar as interações ligante-proteína em células intactas22. Este método é comumente aplicado para validar e quantificar o envolvimento do alvo do medicamento em células e tecidos em diferentes espécies. Especificamente, após a co-incubação de lisados de células-alvo com o medicamento em temperaturas variadas por um período definido, a proteína ligada ao medicamento exibe maior estabilidade térmica, tornando-a menos propensa à desnaturação e precipitação. As proteínas não ligadas precipitadas são então removidas por centrifugação e as interações medicamento-alvo são subsequentemente identificadas por meio da análise de western blot do sobrenadante22. Para identificar potenciais alvos moleculares de Sal, o CETSA foi selecionado para avaliar sua afinidade de ligação com proteínas relacionadas à via AMPK / Sirt1 / HIF-1α.
Protocolo
Os detalhes comerciais dos reagentes e do equipamento usado neste estudo são fornecidos na Tabela de Materiais.
1. Preparação da solução
- Prepare o meio de Eagle modificado completo de Dulbecco (DMEM) adicionando 10% de soro fetal bovino e 1% de penicilina-estreptomicina.
- Prepare uma solução de Sal 20 mM dissolvendo 3 mg de Sal em 500 μL de solução salina tamponada com fosfato (PBS) 21 .
- Filtrar 500 ml de acetonitrilo cromatograficamente puro (fase móvel A) utilizando uma membrana orgânica de 0,45 μm.
- Prepare 1000 mL de fase móvel B adicionando 3,5 mL de reagente I a 1 L de água deionizada. Ajuste o pH para 6,15 com o reagente II, seguindo as instruções do kit de ensaio de conteúdo de nucleotídeos (ATP, ADP e AMP) (consulte a Tabela de Materiais).
NOTA: O reagente I e o reagente II estão incluídos no kit de ensaio de conteúdo de nucleotídeos (ATP, ADP e AMP). - Filtrar a fase móvel B utilizando uma membrana aquosa de 0,22 μm.
NOTA: A fase móvel B deve ser usada imediatamente após a preparação. As fases móveis A e B devem ser sonicadas por 30 minutos antes do uso para remover bolhas de ar. - Dilua uma solução estoque padrão de ATP, ADP e AMP de 1 μM com água deionizada para obter soluções padrão das séries ATP, ADP e AMP de 0,5 μM, 0,1 μM, 0,05 μM, 0,01 μM e 0,005 μM.
- Filtrar a série de soluções-padrão utilizando uma membrana filtrante microporosa do tipo agulha de 0,22 μm.
NOTA: Devem ser utilizados frascos de injecção castanhos para armazenar as soluções-padrão em série. A série preparada de soluções-padrão deve ser usada o mais rápido possível.
2. Cultura celular
NOTA: A cultura de células HT22 e o modelo de hipóxia estimulada por CoCl2 foram estabelecidos de acordo com um relatório anterior21.
- Cultive células HT22 a 37 ° C com 5% de CO2 até que 80% de confluência seja alcançada na placa de Petri. Digerir as células com tripsina a 0,25% por 1 min.
- Semeie 2 × 105 células da etapa 2.1 em placas de 6 poços com DMEM completo (grupo controle sem tratamento medicamentoso) ou DMEM completo contendo o medicamento (250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal e 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). Incubar durante 24 h a 37 °C com 5% de CO2.
NOTA: Três amostras paralelas foram montadas em cada grupo.
3. Ensaio de conteúdo de nucleotídeos (ATP, ADP e AMP)
- Adicione 1 mL de reagente de extração I a cada poço nas placas de 6 poços da etapa 2.2.
NOTA: O reagente de extração I está incluído no kit de ensaio de conteúdo de nucleotídeos (ATP, ADP e AMP) (consulte a Tabela de Materiais). - Lise as células por sonicação em banho de gelo usando um aparelho ultrassônico de ruptura celular (potência: 300 W, ondas ultrassônicas por 3 s, intervalo de 7 s, tempo total: 3 min).
- Centrifugar as células lisadas a 10,304 × g durante 10 min a 4 °C utilizando uma centrifugadora refrigerada de alta velocidade.
- Transfira 0,75 mL de sobrenadante da etapa 3.3 para um tubo de 2,0 mL. Adicionar 0,75 ml de reagente de extracção II, agitar e misturar com um misturador de vórtice e centrifugar novamente a 10,304 × g durante 10 min a 4 °C.
NOTA: O reagente de extração II está incluído no kit de ensaio de conteúdo de nucleotídeos (ATP, ADP e AMP). - Pipetar o sobrenadante do passo 3.4 e filtrá-lo utilizando uma membrana filtrante microporosa do tipo agulha de 0,22 μm para um frasco castanho.
NOTA: ATP, ADP e AMP na amostra extraída não são estáveis. Todos os procedimentos experimentais devem ser realizados a baixas temperaturas ou no gelo. As amostras devem ser processadas e testadas o mais rápido possível. - Abra o software de cromatografia e defina os seguintes parâmetros: volume de injeção: 10 μL; temperatura da coluna: 27 °C; vazão: 0,8 mL/min; comprimento de onda de detecção: 254 nm; Duração da detecção: 70 min. Definir o procedimento de eluição do gradiente de acordo com o quadro 1.
- Clique no botão executar para injetar automaticamente a amostra e detectar o conteúdo de ATP, ADP e AMP em soluções padrão seriais (etapa 1.7) e soluções de amostra (etapa 3.5) de acordo com o programa definido na etapa 3.6.
NOTA: No final do experimento, lave a coluna cromatográfica com 98% de fase móvel B para evitar entupimento. - Plote as curvas padrão de ATP, ADP e AMP usando software de análise gráfica e estatística, com concentrações padrão seriais no eixo x e áreas de pico no eixo y.
- Calcule o conteúdo de ATP, ADP e AMP nas amostras usando a equação da curva padrão da etapa 3.8.
4. Ensaio de deslocamento térmico celular (CETSA)
- Lise células HT22 normais por 20 min em uma placa de Petri usando lisado contendo inibidor de protease (lisado: inibidor de protease = 100: 1) pipetando repetidamente as células.
NOTA: Execute esta etapa em um banho de gelo para evitar a degradação de proteínas. - Coletar o lisado celular da etapa 4.1 e sonicar em um banho de gelo usando um aparelho ultrassônico de ruptura celular (potência: 300 W, ondas ultrassônicas por 3 s, intervalo de 7 s, tempo total: 3 min). Centrifugar a 10,304 × g, 4 °C durante 20 min e recolher o sobrenadante.
NOTA: Divida o sobrenadante em 14 porções: 7 grupos para coincubação com Sal e 7 grupos para coincubação com PBS como controle. Para o grupo tratado com Sal, adicione 100 μL de sobrenadante e 0,1 μL de 20 μM de Sal por amostra. Para o grupo controle, adicione 100 μL de sobrenadante e 0,1 μL de PBS por amostra. - Incube cada amostra à temperatura ambiente por 30 min e, em seguida, incube a 37 °C, 42 °C, 47 °C, 52 °C, 57 °C, 62 °C e 67 °C por 3 min usando um instrumento de controle de temperatura de aquecimento de metal.
- Centrifugar as amostras do passo 4.3 a 10,304 × g durante 20 min a 4 °C e recolher o sobrenadante com uma pipeta.
- Meça a concentração total de proteína do sobrenadante da etapa 4.4 usando um kit de ensaio de concentração de proteína BCA, seguindo as instruções do fabricante (consulte a Tabela de Materiais).
- Prepare o gel de separação a 10% usando um kit de preparação rápida de gel PAGE, seguindo as instruções do fabricante (consulte a Tabela de Materiais).
- Carregue 3 μL de marcador de proteína de cor pré-corado e 14 μL de amostras nos poços do gel de separação (quantidade final de proteína por poço: 20 μg).
- Execute o gel usando tampão de eletroforese por 1 h a 80-100 mV para obter proteínas separadas.
- Transfira as proteínas da etapa 4.8 para uma membrana de PVDF usando uma solução de transferência rápida de membrana e uma estrutura sanduíche (papel de filtro de algodão-PVDF membrana-proteína gel-papel de filtro-algodão) a 400 mA por 30 min.
- Bloqueie as membranas de PVDF da etapa 4.9 com solução de albumina de soro bovino (BSA) a 5% por 1-2 h em temperatura ambiente.
NOTA: Prepare a solução de BSA a 5% dissolvendo 5 mg de pó de BSA em 100 mL de solução de TBST contendo 100 mL de tampão TBS e 0,05% de Tween 20. - Incubar as membranas de PVDF da etapa 4.10 com 5 mL de anticorpo primário diluído a 4 °C durante a noite.
NOTA: Dilua o anticorpo primário em solução BSA (proporção de 1:1000). - Lave as membranas de PVDF três vezes com TBST por 5 minutos cada para remover anticorpos primários não ligados.
- Incubar as membranas da etapa 4.12 com anticorpo secundário acoplado à peroxidase de rábano diluído (HRP) por 2 h à temperatura ambiente em um agitador de descoloração.
NOTA: Dilua o anticorpo secundário acoplado a HRP em solução BSA (proporção de 1:10.000). - Lave as membranas três vezes com TBST por 5 min cada para remover o anticorpo secundário residual.
- Cubra as membranas da etapa 4.14 com o revelador de quimioluminescência ECL e, em seguida, obtenha imagens do sinal da proteína alvo usando um sistema de imagem.
NOTA: Execute esta etapa no escuro para evitar a extinção da fluorescência. - Analise e quantifique o valor de cinza das proteínas-alvo usando o software ImageJ (consulte a capacidade de Materiais).
Resultados
As curvas padrão para ATP, ADP e AMP detectadas por HPLC foram Y = 7006,5X - 222,99, Y = 5217,3X - 17,796 e Y = 9280,1X + 22,749, respectivamente (Figura 1A-C). Os teores de nucleotídeos medidos em cada grupo por HPLC foram calculados usando as curvas padrão (Figura 1D-I). Verificou-se que o CoCl2 reduziu significativamente os níveis de ATP e ADP nas células HT22 em comparação com o grupo controle (P < 0,01, Figura 1J,K). Além disso, a administração de dorsomorfina (Dor), um inibidor da AMPK, levou a uma redução acentuada nos níveis de ATP e ADP em comparação com o grupo tratado com CoCl2 (P < 0,01, Figura 1J, K). No entanto, o tratamento com Sal aumentou significativamente os níveis de ATP e ADP em relação ao grupo tratado com CoCl2 (P < 0,05, Figura 1J,K).
Uma análise mais aprofundada revelou que os níveis de AMP aumentaram significativamente no grupo tratado com CoCl2, enquanto o tratamento com Sal limitou efetivamente esse aumento (P < 0,01, Figura 1L). A função mitocondrial adequada é essencial para manter a homeostase intracelular de ATP, ADP e AMP, bem como as funções fisiológicas celulares normais. O estado funcional das mitocôndrias influencia diretamente a taxa de conversão e o equilíbrio de ATP, ADP e AMP. O dano ou disfunção mitocondrial pode prejudicar a síntese de ATP e reduzir as taxas de conversão de ADP e AMP, interrompendo assim o suprimento de energia celular e o equilíbrio metabólico.
Esses achados sugerem que o Sal pode aliviar a lesão hipóxica em células HT22 modulando a conversão de ATP, ADP e AMP. Além disso, a análise CETSA da ligação de Sal a proteínas associadas às mitocôndrias demonstrou um aumento na estabilidade térmica de AMPKα, p-AMPKα, Sirt1 e HIF-1α após o tratamento com Sal. Isso sugere que o Sal pode interagir com essas proteínas (Figura 2), consistente com achados de estudos anteriores 21,23,24.
DISPONIBILIDADE DE DADOS:
Todos os dados brutos são fornecidos (Arquivo Suplementar 1 e Arquivo Suplementar 2).

Figura 1: Efeito do Sal no conteúdo de nucleotídeos (ATP, ADP e AMP). (AC) Curvas padrão para ATP (A), ADP (B) e AMP (C). (DI) Curvas de HPLC representativas para a determinação do conteúdo de ATP, ADP e AMP em diferentes grupos de tratamento. (JL) Análise estatística do conteúdo de ATP, ADP e AMP em diferentes grupos de tratamento (controle, 250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal e 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). (n = 3, *P < 0,05, **P < 0,01). Clique aqui para ver uma versão maior desta figura.
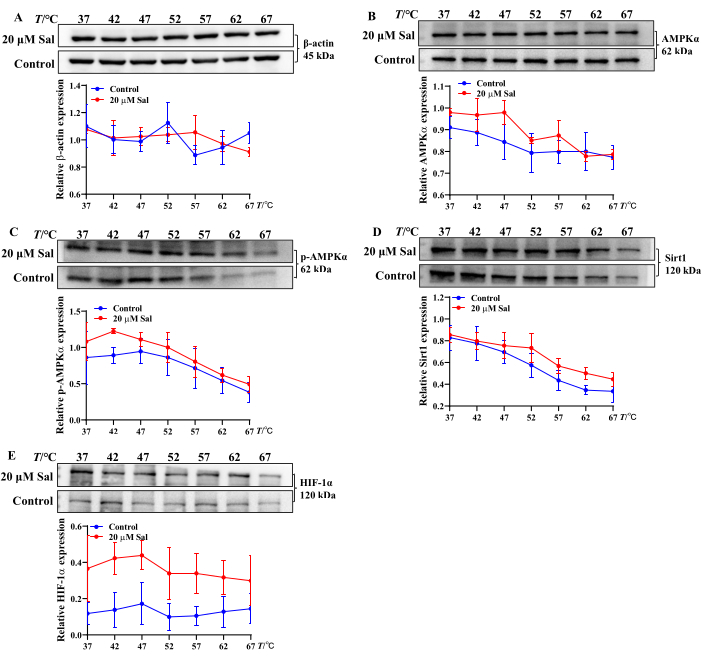
Figura 2: Avaliação das propriedades de ligação de Sal às proteínas associadas à via AMPK/Sirt1/HIF-1α usando o método CETSA. As bandas das proteínas β-Actina (A), AMPKα (B), p-AMPKα (C), Sirt1 (D) e HIF-1α (E) e as tendências de expressão em células HT22 foram avaliadas pelo CETSA (n = 3). As propriedades de ligação do Sal com diferentes proteínas foram analisadas usando software estatístico e gráfico em temperaturas variadas. Clique aqui para ver uma versão maior desta figura.
| Tempo (min) | Fase móvel | |
| Solvente A | Solvente B | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
Tabela 1: Procedimento de eluição de fase móvel.
Arquivo suplementar 1: Dados brutos para detecção de ATP, ADP e AMP por HPLC. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: Bandas de proteínas CETSA. Clique aqui para baixar este arquivo.
Discussão
As mitocôndrias são organelas-chave envolvidas na prevenção terapêutica do HHBI 23,24,25. Estudos anteriores do grupo confirmaram que o Sal regula a expressão das proteínas AMPK, Sirt1 e HIF-1α, melhorando a função mitocondrial neuronal e protegendo contra o HHBI21,24. No entanto, o efeito direto do Sal nos nucleotídeos em células hipóxicas requer uma investigação mais aprofundada. Além disso, avaliar o potencial de ligação de compostos e proteínas sob condições de temperatura variadas é essencial para entender suas interações.
Para abordar esses aspectos, o presente estudo examinou o efeito do Sal nos níveis mitocondriais de ATP, ADP e AMP em células HT22 usando HPLC, fornecendo informações diretas sobre seu papel no metabolismo energético mitocondrial. Com base em um estudo anterior18, 250 μM de CoCl2 foram selecionados para induzir hipóxia em células HT22. Os resultados demonstraram que o Sal aumentou significativamente os níveis de ATP e ADP enquanto reduzia o conteúdo de AMP em células HT22 hipóxicas (Figura 1). Combinados com descobertas anteriores do grupo, esses resultados confirmam ainda mais que o Sal exerce um efeito protetor nas mitocôndrias em neurônios hipóxicos.
A AMPK é uma proteína quinase altamente conservada em eucariotos que regula o metabolismo energético. Ele detecta mudanças nos níveis celulares de ATP, ADP e AMP para coordenar o metabolismo da glicose, a síntese de ácidos graxos e a biogênese mitocondrial fosforilando vários substratos26. A ativação da AMPK promove a produção de energia e suprime o gasto energético, particularmente em resposta à redução dos níveis de ATP intracelular e níveis elevados de AMP27. Além disso, a AMPK aumenta as reservas de ATP fosforilando a glucoamilase, alterando a catálise enzimática e gerando rapidamente ATP a partir do pool de fosforarginina-arginina28.
No presente estudo, Dor, um inibidor seletivo de AMPK fosforilado, foi usado para investigar os efeitos do Sal nos níveis de nucleotídeos29. A HPLC foi empregada para quantificar os níveis de ATP, ADP e AMP em células HT22 tratadas com CoCl2 expostas a Dor isoladamente ou em combinação com Sal. Os achados indicam que o Sal modula a relação ATP/ADP/AMP, exercendo efeitos neuroprotetores contra a hipóxia (Figura 1). O método de HPLC estabelecido fornece uma abordagem intuitiva, simples e eficiente para avaliar diretamente os efeitos de compostos bioativos em nucleotídeos no nível celular.
HIF-1α é um fator de transcrição ativado em resposta à estimulação hipóxica. Em condições hipóxicas, a estabilidade do HIF-1α aumenta significativamente, permitindo que ele se transloque do citoplasma para o núcleo, onde forma um heterodímero com HIF-1β30. Esse processo promove a expressão de genes envolvidos na angiogênese, metabolismo da glicose e glicólise 31,32,33. Além disso, a estabilidade do HIF-1α demonstrou estar altamente correlacionada com a função mitocondrial e os níveis intracelulares de O2 durante a fosforilação oxidativa31. No entanto, a disfunção mitocondrial induzida por hipóxia leva a um suprimento insuficiente de energia intracelular, que por sua vez ativa a via HIF-1α para regular a adaptação celular à hipóxia31,32.
Sirt1, um membro da família Sirtuin, é uma desacetilase dependente de NAD+ que reduz a estabilidade da proteína HIF-1α por desacetilação, limitando assim seu acúmulo nuclear32. Em condições hipóxicas, a diminuição dos níveis intracelulares de ATP leva ao aumento da atividade da AMPK, que influencia o transporte intracelular, a estabilidade e a atividade transcricional do HIF-1α e suas proteínas associadas por meio da fosforilação 31,32,33. Além disso, Sirt1 e AMPK modulam a interação entre HIF-1α e coativadores, regulando assim sua atividade transcricional e facilitando ainda mais a adaptação celular à hipóxia33. Nas células cerebrais lesadas por hipóxia, AMPK, Sirt1 e HIF-1α interagem para manter a homeostase energética intracelular e regular os processos metabólicos.
Métodos simples e eficientes para avaliar a termoestabilidade e o potencial de ligação de complexos composto-proteína in vitro incluem técnicas que avaliam a estabilidade de proteínas após a ligação do ligante. Está bem estabelecido que as interações composto-proteína aumentam a termoestabilidade das proteínas, tornando-as menos sensíveis à desnaturação induzida pela temperatura e resultando em um rendimento proteico relativamente estável. O ensaio de deslocamento térmico celular (CETSA) combinado com a análise de western blot, embora não revele o local exato de ligação, fornece uma abordagem eficiente e de baixo custo para estudar as interações medicamento-alvo e potenciais efeitos fora do alvo22,34. O CETSA é amplamente utilizado para validar e quantificar o envolvimento do alvo do medicamento em células e tecidos em diferentes espécies.
Neste estudo, o CETSA foi empregado para avaliar se o Sal interage com AMPKα, p-AMPKα, Sirt1 e HIF-1α no nível celular. Após o tratamento térmico, Sal aumentou a expressão dessas proteínas, sugerindo a formação de complexos estáveis Sal-AMPKα, Sal-p-AMPKα, Sal-Sirt1 e Sal-HIF-1α (Figura 2). Esses achados se alinham com resultados experimentais anteriores21,24. O CETSA-western blot serve, portanto, como uma abordagem robusta e eficiente para triagem em larga escala de interações composto-proteína e termoestabilidade in vitro.
Apesar dos conhecimentos obtidos sobre os mecanismos protetores do Sal no metabolismo energético mitocondrial usando técnicas de HPLC e CETSA, algumas limitações permanecem. O CETSA não fornece informações no nível de aminoácidos sobre como os compostos influenciam a termoestabilidade das proteínas. Um avanço potencial seria a integração do CETSA com tecnologias de imagem para identificar visualmente os locais de ligação ao composto dentro das proteínas, oferecendo uma compreensão mais clara de como os complexos composto-proteína resistem à desnaturação induzida pelo calor. Conseguir isso requer mais inovação científica e design experimental refinado. Além disso, complementar o CETSA com outras técnicas de interação molecular, como ressonância plasmônica de superfície localizada e fluorimetria de varredura diferencial, forneceria uma análise mais abrangente das interações composto-proteína35.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China (82274207 e 82474185), pelo Departamento de Ciência e Tecnologia da Província de Sichuan (2024NSFSC1845), pela Fundação de Ciências para Jovens do Departamento de Ciência e Tecnologia da Província de Sichuan (2023NSFSC1776), pelo Programa Chave de Pesquisa e Desenvolvimento de Ningxia (2023BEG02012), pelo Projeto de Apoio ao Talento Juvenil da Associação Chinesa de Medicina Chinesa para 2024-2026 (2024-QNRC2-B07) e pela Pesquisa Acadêmica Xinglin Projeto de Promoção da Universidade de TCM de Chengdu (XKTD2022013 e QJJJ2024027).
CONTRIBUIÇÃO DO AUTOR:
Xiaobo Wang, Yating Zhang, Ya Hou, Rui Li e Xianli Meng conceberam este projeto. Yating Zhang, Ya Hou e Tingting Kuang realizaram os experimentos e analisaram os dados. Yating Zhang e Hong Jiang escreveram o manuscrito. Xiaobo Wang e Xianli Meng revisaram o manuscrito. Todos os autores leram e aprovaram o manuscrito final.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
Referências
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108(2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532(2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77(2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094(2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146(2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762(2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568(2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404(2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529(2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617(2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278(2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843(2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82(2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318(2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858(2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182(2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127(2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287(2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados