Research Article
Механистическое представление о митохондриальной защите салидрозида через путь AMPK/Sirt1/HIF-1α в гипоксических клетках HT22
В этой статье
Резюме
В настоящем исследовании был выявлен уникальный механизм, с помощью которого салидрозид оказывает митохондриальное защитное действие на гипоксические клетки HT22, частично через путь AMPK/Sirt1/HIF-1α.
Аннотация
Было обнаружено, что салидрозид (Sal), активный ингредиент Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba, оказывает митохондриальное защитное действие, улучшая метаболизм и увеличивая энергоснабжение клеток мозга в условиях гипоксии. Однако механизм его действия до конца не выяснен. В настоящем исследовании впервые была использована высокоэффективная жидкостная хроматография для анализа влияния Sal на уровни нуклеотидов (АТФ, АДФ и АМФ). Анализ клеточного теплового сдвига (CETSA), широко используемый метод молекулярного взаимодействия для валидации и количественной оценки вовлечения мишени лекарственного препарата в клетках и тканях различных видов, был затем выбран для подтверждения сродства Sal к белкам, связанным с путями AMPK/Sirt1/HIF-1α. Результаты показали, что Sal повышает уровни АТФ и АДФ в гипоксических клетках HT22 при одновременном снижении уровня АМФ. Кроме того, Sal продемонстрировал стабильное связывание с белками AMPKα, p-AMPKα, Sirt1 и HIF-1α. В заключение следует отметить, что Sal может оказывать митохондриальное защитное действие, модулируя путь AMPK/Sirt1/HIF-1α для регуляции содержания нуклеотидов. Данное исследование является методологической основой для анализа содержания нуклеотидов в образцах клеток и способствует идентификации и открытию мишеней для соединений, полученных из традиционной китайской медицины.
Введение
Мозг очень чувствителен к кислороду из-за его высоких метаболических потребностей, ограниченной гликолитической способности и зависимости от окислительного фосфорилирования. В результате, воздействие среды с низким содержанием кислорода на больших высотах может легко привести к гипобарической гипоксической травме головного мозга (HHBI)1,2. Эпидемиологические исследования показывают, что когда люди, не акклиматизированные к большим высотам, быстро поднимаются в высокогорные районы, заболеваемость острой горной болезнью может достигать 75%, а в тяжелых случаях смертность составляет примерно 1%. Кроме того, при отсутствии медицинской помощи смертность от высотного отека мозга или легких может достигать 40%3,4.
HHBI проявляется широким спектром клинических симптомов. Легкие и умеренные случаи могут включать головные боли, головокружение и потерю памяти5, в то время как тяжелые случаи могут привести к когнитивным нарушениям, изменению сознания и потенциально смертельным исходам5. Профилактика и лечение HHBI в высокогорных районах стали ключевым направлением медицинских исследований. Профилактические стратегии в первую очередь включают адаптивные тренировки в условиях высокогорья, включая достаточный отдых, сбалансированное питание, правильное питание и соответствующие физические упражнения 6,7. Кроме того, фармакологические вмешательства, направленные на защиту клеток мозга и облегчение церебральной гипоксии, остаются центральными в текущих исследованиях HHBI.
Митохондрии служат основными центрами производства энергии в клетках, синтезируя аденозинтрифосфат (АТФ) для удовлетворения потребностей клеток в энергии. В условиях гипоксии выработка митохондриальной энергии снижается, что приводит к снижению уровня АТФ и нарушению функции клеток8. Гипоксическое повреждение также нарушает митохондриальную регуляцию гомеостаза Ca2+ и pH, вызывая апоптоз и некроз 9,10. Существует взаимоусиливающая связь между митохондриальной дисфункцией и гипоксическим повреждением головного мозга. С одной стороны, вызванное гипоксией митохондриальное поражение усугубляет дефицит кислорода, еще больше снижая клеточный энергетический метаболизм, создавая порочный круг. С другой стороны, митохондриальная дисфункция повышает внутриклеточный уровеньCa2+, активируя каскады апоптоза и приводя к гибеликлеток11. Хотя механизмы, лежащие в основе гипоксического повреждения головного мозга, остаются сложными и не до конца изученными, многочисленные исследования выявили нарушение нейронального митохондриального энергетического метаболизма как критический фактор в его патогенезе. Таким образом, дальнейшее изучение функции митохондрий может дать ценную информацию о потенциальных терапевтических мишенях для гипоксического повреждения головного мозга.
Салидрозид (Sal) является активным ингредиентом, экстрагируемым из растения плато Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba и широко используется в пищевых продуктах, продуктах для здоровья и фармацевтических препаратах14. Молекулярная формула Sal — C14H20O7, и он также известен как 2-(4-гидроксифенил)-этил β-D-глюкопиранозид. Обладает разнообразными фармакологическими свойствами, в том числе антигипоксическими, антиоксидантными, противоутомляющимися, противоопухолевыми, иммуномодулирующими, противовоспалительными, сердечно-сосудистыми и цереброваскулярными защитными эффектами 15,16,17. Среди них его антигипоксический эффект является одним из наиболее хорошо задокументированных. Недавние исследования все чаще подчеркивают значительные митохондриальные защитные эффекты Sal как потенциальный механизм его профилактического и терапевтического воздействия на повреждение головного мозга, вызванное плато, у мышей14,18. Тем не менее, точные молекулярные механизмы, с помощью которых Sal влияет на уровни АТФ, АДФ и АМФ, остаются плохо изученными.
АМФ-активируемая протеинкиназа (АМФК) действует как ключевой энергетический датчик, который помогает поддерживать клеточный энергетический гомеостаз. Активация АМФК стимулирует Сиртуин 1 (Sirt1), что приводит к повышению внутриклеточного уровня НАД+ 19. Исследования показали, что Sirt1 может регулировать индуцируемый гипоксией фактор 1-альфа (HIF-1α) для координации клеточного ответа на гипоксию20. Предыдущие исследования показали, что Sal ингибирует открытие переходной поры нейрональной митохондриальной проницаемости, регулирует HIF-1α-опосредованные митохондриальные энергетические процессы, ослабляет нейрональный апоптоз и поддерживает целостность гематоэнцефалического барьера, тем самым защищая крыс от повреждения головного мозга, вызванного плато14,21. Тем не менее, влияние Sal на АТФ и его метаболиты, АДФ и АМФ, остается неясным.
Чтобы исследовать это, впервые была использована высокоэффективная жидкостная хроматография (ВЭЖХ) для количественной оценки уровней этих трех нуклеотидов. Кроме того, был использован анализ клеточного теплового сдвига (CETSA), широко используемый биофизический метод, представленный в 2013 году для изучения лиганд-белковых взаимодействий в интактных клетках22. Этот метод обычно применяется для валидации и количественной оценки взаимодействия лекарственного препарата с мишенью в клетках и тканях различных видов. В частности, после совместной инкубации лизатов клеток-мишеней с препаратом при различных температурах в течение определенного периода времени, связанный с лекарством белок демонстрирует повышенную термическую стабильность, что делает его менее склонным к денатурации и осаждению. Осажденные несвязанные белки затем удаляют центрифугированием, а затем идентифицируют взаимодействия лекарственного препарата с мишенью с помощью вестерн-блоттинг-анализа надосадочной жидкости22. Для идентификации потенциальных молекулярных мишеней Sal был выбран CETSA для оценки его аффинности связывания с белками, связанными с путями AMPK/Sirt1/HIF-1α.
протокол
Коммерческие детали реагентов и оборудования, использованного в данном исследовании, приведены в Таблице материалов.
1. Приготовление раствора
- Приготовьте полную модифицированную среду Dulbecco Eagle (DMEM), добавив 10% фетальной бычьей сыворотки и 1% пенициллин-стрептомицин.
- Приготовьте 20 мМ раствор Sal, растворив 3 мг Sal в 500 мкл фосфатно-солевого буфера (PBS)21.
- Отфильтруйте 500 мл хроматографически чистого ацетонитрила (подвижная фаза А) с помощью органической мембраны толщиной 0,45 мкм.
- Приготовьте 1000 мл подвижной фазы В, добавив 3,5 мл реагента I на 1 л деионизированной воды. Отрегулируйте pH до 6,15 с помощью реагента II, следуя инструкциям набора для анализа содержания нуклеотидов (АТФ, АДФ и АМФ) (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Реагент I и реагент II включены в набор для анализа содержания нуклеотидов (АТФ, АДФ и АМФ). - Фильтруйте подвижную фазу B с помощью водной мембраны толщиной 0,22 мкм.
ПРИМЕЧАНИЕ: Мобильную фазу B следует использовать сразу после подготовки. Подвижные фазы А и В должны быть обработаны ультразвуком в течение 30 минут перед использованием для удаления пузырьков воздуха. - Стандартный стоковый раствор АТФ, АДФ и АМФ массой 1 мкМ с деионизированной водой с получением стандартных растворов серий 0,5 мкМ, 0,1 мкМ, 0,05 мкМ, 0,01 мкМ и 0,005 мкМ АТФ, АДФ и АМФ.
- Фильтруйте серию стандартных растворов с помощью микропористой фильтрующей мембраны игольчатого типа размером 0,22 мкм.
ПРИМЕЧАНИЕ: Коричневые инъекционные флаконы следует использовать для хранения серийных стандартных растворов. Подготовленный ряд стандартных растворов следует использовать как можно скорее.
2. Культура клеток
Примечание: Культура клеток HT22 и модель гипоксии, стимулированной CoCl2, были созданы в соответствии с предыдущим отчетом21.
- Культивирование клеток HT22 при 37 °C с 5%CO2 до достижения 80% слияния в чашке Петри. Расщепляйте клетки с 0,25% трипсином в течение 1 минуты.
- Затравите 2 × 105 клеток с этапа 2.1 в 6-луночные планшеты с полным DMEM (контрольная группа, не получающая медикаментозного лечения) или полным DMEM, содержащим препарат (250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal и 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). Инкубировать в течение 24 ч при 37 °C с 5%CO2.
ПРИМЕЧАНИЕ: В каждой группе было установлено по три параллельных выборки.
3. Анализ содержания нуклеотидов (АТФ, АДФ и АМФ)
- Добавьте 1 мл экстракционного реагента I в каждую лунку в 6-луночных планшетах с шага 2.2.
ПРИМЕЧАНИЕ: Экстракционный реагент I входит в набор для анализа содержания нуклеотидов (АТФ, АДФ и АМФ) (см. Таблицу материалов). - Лизировать клетки путем ультразвуковой обработки на ледяной бане с помощью ультразвукового аппарата для разрушения клеток (мощность: 300 Вт, ультразвуковые волны в течение 3 с, интервал 7 с, общее время: 3 мин).
- Лизированные клетки центрифугируют при давлении 10 304 × г в течение 10 мин при 4 °C с помощью высокоскоростной охлаждаемой центрифуги.
- Перенесите 0,75 мл надосадочной жидкости с шага 3.3 в пробирку объемом 2,0 мл. Добавьте 0,75 мл экстракционного реагента II, встряхните и перемешайте с помощью вихревого смесителя, а затем снова центрифугируйте при 10 304 × г в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: Экстракционный реагент II входит в набор для анализа содержания нуклеотидов (АТФ, АДФ и АМФ). - Пипетку из этапа 3.4 пипеткой отфильтруйте надосадочную жидкость с помощью микропористой фильтрующей мембраны игольчатого типа толщиной 0,22 мкм в коричневый флакон.
ПРИМЕЧАНИЕ: АТФ, АДФ и АМФ в извлеченном образце нестабильны. Все экспериментальные процедуры должны выполняться при низких температурах или на льду. Образцы должны быть обработаны и протестированы как можно скорее. - Откройте программное обеспечение для хроматографии и установите следующие параметры: объем впрыска: 10 μл; температура столба: 27 °C; расход: 0,8 мл/мин; длина волны обнаружения: 254 нм; Продолжительность обнаружения: 70 мин. Задайте процедуру градиентного элюирования в соответствии с таблицей 1.
- Нажмите кнопку «Выполнить » для автоматического ввода образца и определения содержания АТФ, АДФ и АМФ в последовательных стандартных растворах (шаг 1.7) и образцах растворов (шаг 3.5) в соответствии с программой, установленной на шаге 3.6.
ПРИМЕЧАНИЕ: В конце эксперимента промойте хроматографическую колонку 98% подвижной фазой B для предотвращения засорения. - Построение стандартных кривых АТФ, АДФ и АМФ с помощью программного обеспечения для построения графиков и статистического анализа с последовательными стандартными концентрациями по оси x и пиковыми областями по оси y.
- Рассчитайте содержание АТФ, АДФ и АМФ в образцах, используя уравнение стандартной кривой, приведенное на шаге 3.8.
4. Анализ клеточного теплового сдвига (CETSA)
- Лизируйте нормальные клетки HT22 в течение 20 минут в чашке Петри с использованием лизата, содержащего ингибитор протеазы (лизат: ингибитор протеазы = 100:1) путем многократного пипетирования клеток.
ПРИМЕЧАНИЕ: Выполните этот шаг на ледяной бане, чтобы предотвратить деградацию белка. - Соберите лизат клеток с шага 4.1 и произведите ультразвуковую обработку на ледяной бане с помощью ультразвукового аппарата для разрушения клеток (мощность: 300 Вт, ультразвуковые волны в течение 3 с, интервал 7 с, общее время: 3 мин). Центрифугируйте при 10 304 × г, 4 °C в течение 20 мин и соберите надосадочную жидкость.
ПРИМЕЧАНИЕ: Разделите надосадочную жидкость на 14 частей: 7 групп для коинкубации с Sal и 7 групп для коинкубации с PBS в качестве контроля. Для группы, обработанной Sal, добавьте 100 мкл надосадочной жидкости и 0,1 мкл 20 мкМ Sal на образец. Для контрольной группы добавьте 100 мкл надосадочной жидкости и 0,1 мкл PBS на образец. - Инкубируйте каждый образец при комнатной температуре в течение 30 минут, затем продолжайте инкубацию при 37 °C, 42 °C, 47 °C, 52 °C, 57 °C, 62 °C и 67 °C в течение 3 минут с помощью металлического нагревательного прибора для контроля температуры.
- Центрифугируйте образцы, начиная с шага 4.3, при 10 304 × г в течение 20 мин при 4 °C и соберите надосадочную жидкость с помощью пипетки.
- Измерьте общую концентрацию белка надосадочной жидкости на шаге 4.4 с помощью набора для анализа концентрации белка BCA, следуя инструкциям производителя (см. Таблицу материалов).
- Приготовьте 10% разделительный гель с помощью набора для быстрого приготовления геля PAGE, следуя инструкциям производителя (см. Таблицу материалов).
- Загрузите 3 мкл предварительно окрашенного маркера цветного белка и 14 мкл образцов в лунки разделительного геля (итоговое количество белка на лунку: 20 мкг).
- Прогоните гель с помощью буфера для электрофореза в течение 1 ч при 80-100 мВ для получения отделенных белков.
- Перенесите белки из этапа 4.8 на мембрану из ПВДФ с помощью раствора для быстрого переноса мембраны и сэндвич-структуры (хлопок-фильтровальная бумага-мембрана из ПВДФ-мембрана-гель-белок-фильтровальная бумага-хлопок) при давлении 400 мА в течение 30 минут.
- Заблокируйте мембраны PVDF с шага 4.9 5% раствором бычьего сывороточного альбумина (БСА) на 1-2 ч при комнатной температуре.
ПРИМЕЧАНИЕ: Приготовьте 5% раствор БСА, растворив 5 мг порошка БСА в 100 мл раствора TBST, содержащего 100 мл буфера TBS и 0,05% Tween 20. - Инкубируйте мембраны PVDF, начиная с шага 4.10, с 5 мл разведенного первичного антитела при 4 °C в течение ночи.
ПРИМЕЧАНИЕ: Разведите первичное антитело в растворе БСА (соотношение 1:1000). - Трижды промойте мембраны PVDF TBST в течение 5 мин каждая, чтобы удалить несвязанные первичные антитела.
- Инкубируйте мембраны на этапе 4.12 с разбавленным вторичным антителом, связанным с пероксидазой хрена (HRP), в течение 2 ч при комнатной температуре на шейкере для обесцвечивания.
ПРИМЕЧАНИЕ: Разведите вторичное антитело, связанное с HRP, в растворе BSA (соотношение 1:10 000). - Трижды промойте мембраны TBST в течение 5 минут каждая, чтобы удалить остаточные вторичные антитела.
- Покройте мембраны, указанные на шаге 4.14, усилителем хемилюминесценции ECL, затем визуализируйте сигнал целевого белка с помощью системы визуализации.
ПРИМЕЧАНИЕ: Выполняйте этот шаг в темноте, чтобы предотвратить гашение флуоресценции. - Анализируйте и количественно оценивайте серое значение целевых белков с помощью программного обеспечения ImageJ (см. раздел Материалы).
Результаты
Стандартные кривые для АТФ, АДФ и АМФ, обнаруженные с помощью ВЭЖХ, были Y = 7006,5X - 222,99, Y = 5217,3X - 17,796 и Y = 9280,1X + 22,749 соответственно (рис. 1A-C). Содержание нуклеотидов, измеренное в каждой группе с помощью ВЭЖХ, рассчитывали с помощью стандартных кривых (рис. 1D-I). Было обнаружено, что CoCl2 достоверно снижает уровни АТФ и АДФ в клетках HT22 по сравнению с контрольной группой (P < 0,01, рис. 1J, K). Кроме того, введение дорсоморфина (Dor), ингибитора АМФК, приводило к заметному снижению уровней АТФ и АДФ по сравнению с группой, получавшей CoCl2 (P < 0,01, рис. 1J, K). Тем не менее, лечение Sal значительно повышало уровни АТФ и АДФ по сравнению с группой, получавшей CoCl2 (P < 0,05, рисунок 1J, K).
Дальнейший анализ показал, что уровни АМФ значительно увеличились в группе, получавшей CoCl2, в то время как лечение Sal эффективно ограничивало этот всплеск (P < 0,01, рисунок 1L). Правильная функция митохондрий необходима для поддержания внутриклеточного гомеостаза АТФ, АДФ и АМФ, а также нормальных клеточных физиологических функций. Функциональное состояние митохондрий напрямую влияет на скорость преобразования и баланс АТФ, АДФ и АМФ. Повреждение или дисфункция митохондрий могут нарушить синтез АТФ и снизить скорость преобразования АДФ и АМФ, тем самым нарушая клеточное энергоснабжение и метаболический баланс.
Эти данные свидетельствуют о том, что Sal может облегчить гипоксическое повреждение в клетках HT22 за счет модуляции АТФ, АДФ и АМФ-конверсии. Кроме того, анализ CETSA связывания Sal с митохондриальными белками продемонстрировал повышение термической стабильности AMPKα, p-AMPKα, Sirt1 и HIF-1α после лечения Sal. Это говорит о том, что Sal может взаимодействовать с этими белками (рис. 2), что согласуется с результатами предыдущих исследований 21,23,24.
ДОСТУПНОСТЬ ДАННЫХ:
Все исходные данные предоставлены (Дополнительный файл 1 и Дополнительный файл 2).

Рисунок 1: Влияние Sal на содержание нуклеотидов (АТФ, АДФ и АМФ). (A-C) Стандартные кривые для АТФ (A), АДФ (B) и АМФ (C). (Д-И) Репрезентативные кривые ВЭЖХ для определения содержания АТФ, АДФ и АМФ в различных группах лечения. (Дж-Л) Статистический анализ содержания АТФ, АДФ и АМФ в различных группах лечения (контроль, 250 мкМ CoCl2, 250 мкМ CoCl2 + 10 мкМ Dor, 250 мкМ CoCl2 + 20 мкМ Sal и 250 мкМ CoCl2 + 10 мкМ Dor + 20 мкМ Sal). (n = 3, *P < 0,05, **P < 0,01). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
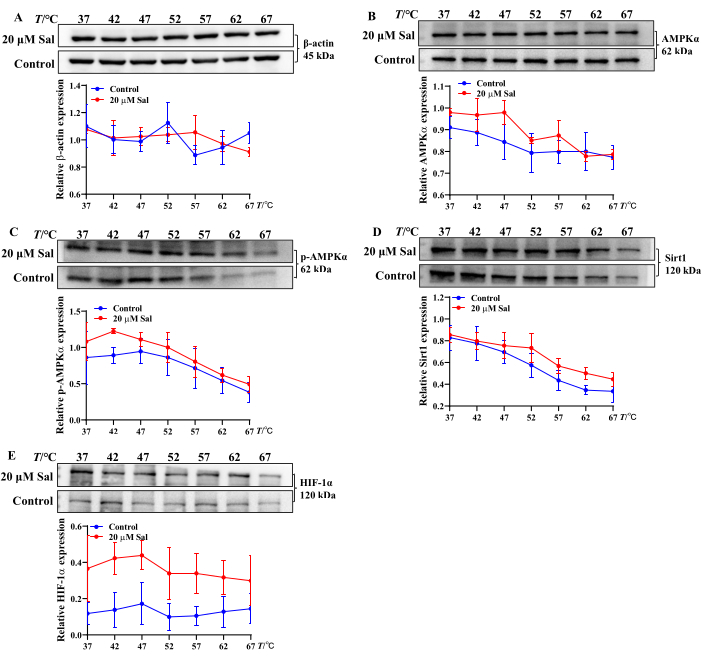
Рисунок 2: Оценка свойств связывания Sal с белками, ассоциированными с путями AMPK/Sirt1/HIF-1α, с использованием метода CETSA (n = 3) оценивали полосы белков β-актина (A), AMPKα (B), p-AMPKα (C), Sirt1 (D) и HIF-1α (E) и тренды экспрессии в клетках HT22 (n = 3). Связывающие свойства Sal с различными белками были проанализированы с помощью статистического и графического программного обеспечения при различных температурах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Время (мин) | Мобильная фаза | |
| Растворитель А | Растворитель В | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
Таблица 1: Процедура элюирования подвижной фазы.
Дополнительный файл 1: Исходные данные для определения АТФ, АДФ и АМФ методом ВЭЖХ. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Белковые полосы CETSA. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Митохондрии являются ключевыми органеллами, участвующими в терапевтической профилактике HHBI 23,24,25. Предыдущие исследования группы подтвердили, что Sal регулирует экспрессию белков AMPK, Sirt1 и HIF-1α, улучшая функцию нейронов в митохондриях и защищая от HHBI21,24. Тем не менее, прямое влияние Sal на нуклеотиды в гипоксических клетках требует дальнейшего изучения. Кроме того, оценка связывающего потенциала соединений и белков при различных температурных условиях имеет важное значение для понимания их взаимодействий.
Чтобы решить эти аспекты, в настоящем исследовании изучалось влияние Sal на уровни митохондриальных АТФ, АДФ и АМФ в клетках HT22 с использованием ВЭЖХ, что дает прямое представление о его роли в митохондриальном энергетическом метаболизме. На основании предыдущего исследования18 было отобрано 250 мкМ CoCl2 для индуцирования гипоксии в клетках HT22. Результаты показали, что Sal значительно повышает уровни АТФ и АДФ при одновременном снижении содержания АМФ в гипоксических клетках HT22 (рис. 1). В сочетании с предыдущими выводами группы, эти результаты еще раз подтверждают, что Sal оказывает защитное действие на митохондрии в гипоксических нейронах.
AMPK — это высококонсервативная протеинкиназа у эукариот, которая регулирует энергетический обмен. Он обнаруживает изменения в клеточных уровнях АТФ, АДФ и АМФ для координации метаболизма глюкозы, синтеза жирных кислот и биогенеза митохондрий путем фосфорилирования различных субстратов26. Активация АМФК способствует выработке энергии и подавляет расход энергии, особенно в ответ на снижение внутриклеточного уровня АТФ и повышенный уровеньАМФ27. Кроме того, АМФК увеличивает резервы АТФ за счет фосфорилирования глюкоамилазы, изменения ферментативного катализа и быстрой генерации АТФ из фосфоаргинин-аргининового пула28.
В настоящем исследовании Dor, селективный фосфорилированный ингибитор AMPK, был использован для изучения влияния Sal на уровни нуклеотидов29. ВЭЖХ использовали для количественного определения уровней АТФ, АДФ и АМФ в обработанных CoCl2 клетках HT22, подвергшихся воздействию Dor отдельно или в комбинации с Sal. Полученные данные указывают на то, что Sal модулирует соотношение АТФ/АДФ/АМФ, тем самым оказывая нейропротекторное действие против гипоксии (рис. 1). Признанный метод ВЭЖХ обеспечивает интуитивно понятный, простой и эффективный подход к непосредственной оценке воздействия биологически активных соединений на нуклеотиды на клеточном уровне.
HIF-1α является транскрипционным фактором, активируемым в ответ на гипоксическую стимуляцию. В условиях гипоксии стабильность HIF-1α значительно возрастает, что позволяет ему транслоцироваться из цитоплазмы в ядро, где он образует гетеродимер с HIF-1β30. Этот процесс способствует экспрессии генов, участвующих в ангиогенезе, метаболизме глюкозы и гликолизе 31,32,33. Кроме того, было показано, что стабильность HIF-1α сильно коррелирует с функцией митохондрий и внутриклеточными уровнямиO2 во время окислительного фосфорилирования31. Тем не менее, митохондриальная дисфункция, вызванная гипоксией, приводит к недостаточному внутриклеточному снабжению энергией, что, в свою очередь, активирует путь HIF-1α для регуляции клеточной адаптации к гипоксии31,32.
Sirt1, член семейства Sirtuin, представляет собой NAD+-зависимую деацетилазу, которая снижает стабильность белка HIF-1α путем деацетилирования, тем самым ограничивая его ядерное накопление32. В условиях гипоксии снижение внутриклеточного уровня АТФ приводит к повышению активности AMPK, которая влияет на внутриклеточный транспорт, стабильность и транскрипционную активность HIF-1α и связанных с ним белков посредством фосфорилирования 31,32,33. Кроме того, Sirt1 и AMPK модулируют взаимодействие между HIF-1α и коактиваторами, тем самым регулируя его транскрипционную активность и способствуя дальнейшей адаптации клеток кгипоксии. В поврежденных гипоксией клетках мозга AMPK, Sirt1 и HIF-1α взаимодействуют, поддерживая внутриклеточный энергетический гомеостаз и регулируя метаболические процессы.
Простые и эффективные методы оценки термостабильности и связывающего потенциала комплексов соединение-белки in vitro включают в себя методы, которые оценивают стабильность белков при связывании лиганда. Хорошо известно, что соединения с белками увеличивают термостабильность белков, делая их менее чувствительными к денатурации, вызванной температурой, и приводя к относительно стабильному выходу белка. Анализ клеточного теплового сдвига (CETSA) в сочетании с вестерн-блоттингом, хотя и не выявляет точного сайта связывания, обеспечивает недорогой и эффективный подход к изучению взаимодействий лекарственного препарата и потенциальных побочных эффектов22,34. CETSA широко используется для валидации и количественного определения взаимодействия лекарственного препарата с мишенью в клетках и тканях различных видов.
В этом исследовании CETSA был использован для оценки того, взаимодействует ли Sal с AMPKα, p-AMPKα, Sirt1 и HIF-1α на клеточном уровне. После термической обработки Sal увеличил экспрессию этих белков, что свидетельствует об образовании стабильных комплексов Sal-AMPKα, Sal-p-AMPKα, Sal-Sirt1 и Sal-HIF-1α (рис. 2). Эти выводы согласуются с предыдущими экспериментальными результатами21,24. Таким образом, CETSA-вестерн-блоттинг служит надежным и эффективным подходом для широкомасштабного скрининга соединений-белковых взаимодействий и термостабильности in vitro.
Несмотря на полученные знания о защитных механизмах SAL на метаболизм митохондриальной энергии с использованием методов ВЭЖХ и CETSA, некоторые ограничения остаются. CETSA не предоставляет информацию на уровне аминокислот о том, как соединения влияют на термостабильность белка. Потенциальным достижением может стать интеграция CETSA с технологиями визуализации для визуальной идентификации сайтов связывания соединений в белках, что обеспечит более четкое понимание того, как комплексы соединение-белки противостоят денатурации, вызванной нагреванием. Достижение этой цели требует дальнейших научных инноваций и усовершенствованного экспериментального плана. Кроме того, дополнение CETSA другими методами молекулярного взаимодействия, такими как локализованный поверхностный плазмонный резонанс и дифференциальная сканирующая флуориметрия, обеспечит более полный анализ соединений и белковых взаимодействий35.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (82274207 и 82474185), Департаментом науки и технологий провинции Сычуань (2024NSFSC1845), Научным фондом для молодежи Департамента науки и технологий провинции Сычуань (2023NSFSC1776), Ключевой программой исследований и разработок Нинся (2023BEG02012), Проектом поддержки молодых талантов Китайской ассоциации китайской медицины на 2024-2026 годы (2024-QNRC2-B07) и Научным исследованием Синлинь Проект продвижения Чэндуского университета ТКМ (XKTD2022013 и QJJJ2024027).
ВКЛАД АВТОРА:
Сяобо Ван, Ятин Чжан, Я Хоу, Руй Ли и Сяньли Мэн задумали этот проект. Ятин Чжан, Я Хоу и Тинтин Куан провели эксперименты и проанализировали данные. Рукопись написали Ятин Чжан и Хун Цзян. Сяобо Ван и Сяньли Мэн отредактировали рукопись. Все авторы прочитали и одобрили окончательную версию рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
Ссылки
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108 (2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532 (2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77 (2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094 (2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146 (2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762 (2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568 (2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404 (2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617 (2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278 (2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843 (2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82 (2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318 (2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858 (2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182 (2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127 (2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены