Research Article
红景天苷在缺氧 HT22 细胞 中通过 AMPK/Sirt1/HIF-1α 通路保护线粒体的机制见解
摘要
本研究确定了红景天苷对缺氧 HT22 细胞发挥线粒体保护作用的独特机制,部分通过 AMPK/Sirt1/HIF-1α 通路。
摘要
红景天苷 (Sal) 是 红景 天 (Hook. f. et Thoms.) 的一种活性成分。已发现 H. Ohba 在缺氧条件下通过改善新陈代谢和增强脑细胞的能量供应来发挥线粒体保护作用。然而,其作用机制尚未完全阐明。在本研究中,首先采用高效液相色谱法分析 Sal 对核苷酸 (ATP、ADP 和 AMP) 水平的影响。然后选择细胞热转移测定 (CETSA) 是一种广泛使用的分子相互作用方法,用于验证和量化不同物种细胞和组织中的药物靶标参与,以确认 Sal 对 AMPK/Sirt1/HIF-1α 通路相关蛋白的亲和力。结果显示,Sal 增加了缺氧 HT22 细胞中的 ATP 和 ADP 水平,同时降低了 AMP 水平。此外,Sal 与 AMPKα 、 p-AMPKα 、 Sirt1 和 HIF-1α 蛋白表现出稳定的结合。总之,Sal 可能通过调节 AMPK/Sirt1/HIF-1α 通路调节核苷酸含量来发挥线粒体保护作用。本研究为细胞样品中的核苷酸含量分析提供了方法学参考,有助于中药衍生化合物靶点的鉴定和发现。
引言
由于氧的代谢需求高、糖酵解能力有限以及对氧化磷酸化的依赖性,大脑对氧高度敏感。因此,暴露在高海拔的低氧环境中很容易导致低压低氧脑损伤 (HHBI)1,2。流行病学研究表明,当不适应高海拔的个体迅速上升到高海拔地区时,急性高山病的发生率可高达 75%,严重病例的死亡率约为 1%。此外,在没有医疗服务的情况下,高原脑水肿或肺水肿的死亡率可能高达 40%3,4。
HHBI 表现为广泛的临床症状。轻度至中度病例可能包括头痛、头晕和记忆力减退5,而严重病例可能导致认知障碍、意识改变和潜在的致命后果5。高海拔地区 HHBI 的防治已成为医学研究的重点。预防策略主要涉及高海拔环境中的适应性训练,包括充足的休息、均衡的饮食、适当的营养和适当的体育锻炼 6,7。此外,旨在保护脑细胞和缓解脑缺氧的药物干预仍然是当前 HHBI 研究的核心。
线粒体是细胞内的主要能量生产中心,合成三磷酸腺苷 (ATP) 以满足细胞能量需求。在缺氧条件下,线粒体能量产生下降,导致 ATP 水平降低和细胞功能受损8。缺氧损伤还会破坏线粒体对 Ca2+ 和 pH 稳态的调节,引发细胞凋亡和坏死 9,10。线粒体功能障碍和缺氧性脑损伤之间存在相辅相成的关系。一方面,缺氧诱导的线粒体损伤通过进一步减少细胞能量代谢加剧缺氧,从而形成恶性循环。另一方面,线粒体功能障碍会提高细胞内 Ca2+ 水平,激活凋亡级联反应并导致细胞死亡11。尽管缺氧性脑损伤的潜在机制仍然复杂且尚不完全清楚,但多项研究已确定神经元线粒体能量代谢受损是其发病机制的关键因素12,13。因此,进一步探索线粒体功能可能为缺氧性脑损伤的潜在治疗靶点提供有价值的见解。
红景天苷 (Sal) 是从高原植物红景天 (Hook. f. et Thoms.) H. Ohba 中提取的活性成分,广泛用于食品、保健品和药品14。Sal 的分子式为 C14H20O7,也称为 2-(4-羟基苯基)-乙基 β-D-吡喃葡萄糖苷。它具有多种药理特性,包括抗缺氧、抗氧化、抗疲劳、抗肿瘤、免疫调节、抗炎以及心脑血管保护作用 15,16,17。其中,它的抗缺氧作用是文献最齐全的之一。最近的研究越来越强调 Sal 的显着线粒体保护作用,作为其对小鼠平台诱导的脑损伤具有预防和治疗作用的潜在机制14,18。然而,Sal 影响 ATP、ADP 和 AMP 水平的确切分子机制仍然知之甚少。
AMP 活化蛋白激酶 (AMPK) 是帮助维持细胞能量稳态的关键能量传感器。AMPK 的激活刺激 Sirtuin 1 (Sirt1),导致细胞内 NAD+ 水平增加19。研究表明,Sirt1 可以调节缺氧诱导因子 1-α (HIF-1α) 以协调细胞对缺氧的反应20。先前的研究表明,Sal 抑制神经元线粒体通透性转换孔的打开,调节 HIF-1α 介导的线粒体能量过程,减弱神经元凋亡,维持血脑屏障完整性,从而保护大鼠免受平台诱导的脑损伤14,21。然而,Sal 对 ATP 及其代谢物 ADP 和 AMP 的影响仍不确定。
为了研究这一点,首先采用高效液相色谱 (HPLC) 来定量这三种核苷酸的水平。此外,还使用了细胞热位移测定 (CETSA),这是一种广泛使用的生物物理技术,于 2013 年推出,用于研究完整细胞中的配体-蛋白质相互作用22。该方法通常用于验证和量化不同物种细胞和组织中的药物靶标结合。具体来说,在不同温度下将靶细胞裂解物与药物共孵育一段时间后,药物结合蛋白表现出更高的热稳定性,使其不易变性和沉淀。然后 通过 离心去除沉淀的未结合蛋白,随后通过上清液的蛋白质印迹分析鉴定药物-靶标相互作用22。为了确定 Sal 的潜在分子靶点,选择 CETSA 以评估其与 AMPK/Sirt1/HIF-1α 通路相关蛋白的结合亲和力。
研究方案
材料 表中提供了本研究中使用的试剂和设备的商业细节。
1. 溶液制备
- 通过添加 10% 胎牛血清和 1% 青霉素-链霉素来制备完整的 Dulbecco 改良 Eagle 培养基 (DMEM)。
- 通过将 3 mg Sal 溶解在 500 μL 磷酸盐缓冲盐水 (PBS) 中来制备 20 mM Sal 溶液21。
- 使用 0.45 μm 有机膜过滤 500 mL 色谱纯乙腈(流动相 A)。
- 向 1 L 去离子水中加入 3.5 mL 试剂 I,制备 1000 mL 流动相 B。按照核苷酸(ATP、ADP 和 AMP)含量测定试剂盒的说明,用试剂 II 将 pH 调节至 6.15(参见 材料表)。
注:试剂 I 和试剂 II 包含在核苷酸(ATP、ADP 和 AMP)含量检测试剂盒中。 - 使用 0.22 μm 水性膜过滤流动相 B。
注:流动相 B 应在制备后立即使用。流动相 A 和 B 应在使用前超声处理 30 分钟以去除气泡。 - 用去离子水稀释 1 μM ATP、ADP 和 AMP 标准储备液,得到 0.5 μM、0.1 μM、0.05 μM、0.01 μM 和 0.005 μM ATP、ADP 和 AMP 系列标准溶液。
- 使用 0.22 μm 针状微孔滤膜过滤系列标准溶液。
注意:应使用棕色注射瓶储存系列标准溶液。配制好的系列标准溶液应尽快使用。
2. 细胞培养
注:HT22 细胞培养物和 CoCl2 刺激的缺氧模型是根据之前的报告21 建立的。
- 在 37 °C 和 5% CO2 下培养 HT22 细胞,直到在培养皿中达到 80% 汇合。用 0.25% 胰蛋白酶消化细胞 1 分钟。
- 将步骤 2.1 中的 2 × 105 个细胞接种到具有完整 DMEM(无药物治疗的对照组)或含有该药物的完整 DMEM(250 μM CoCl2、250 μM CoCl2 + 10 μM Dor、250 μM CoCl2 + 20 μM Sal 和 250 μM CoCl2 + 10 μM Dor + 20 μM Sal)的 6 孔板中。在 37 °C 和 5% CO2 下孵育 24 小时。
注:每组设置三个平行样品。
3. 核苷酸(ATP、ADP 和 AMP)含量测定
- 从步骤 2.2 开始,向 6 孔板中的每个孔中加入 1 mL 提取试剂 I。
注:提取试剂 I 包含在核苷酸(ATP、ADP 和 AMP)含量测定试剂盒中(参见 材料表)。 - 通过使用超声波细胞破碎仪(功率:300 W,超声波 3 秒,7 秒间隔,总时间:3 分钟)在冰浴上超声处理来裂解细胞。
- 使用高速冷冻离心机在 4 °C 下以 10,304 × g 离心裂解的细胞 10 分钟。
- 将步骤 3.3 中的 0.75 mL 上清液转移到 2.0 mL 试管中。加入 0.75 mL 提取试剂 II,使用涡旋混合器摇匀,然后在 4 °C 下再次以 10,304 × g 离心 10 分钟。
注:提取试剂 II 包含在核苷酸(ATP、ADP 和 AMP)含量测定试剂盒中。 - 移液步骤 3.4 中的上清液,并使用 0.22 μm 针型微孔滤膜将其过滤到棕色小瓶中。
注意:提取样品中的 ATP、ADP 和 AMP 不稳定。所有实验程序都应在低温或冰上进行。样品应尽快处理和测试。 - 打开色谱软件并设置以下参数:进样体积:10 μL;柱温:27 °C;流速:0.8 mL/min;检测波长:254 nm;检测持续时间:70 min。根据 表 1 设置梯度洗脱程序。
- 单击 执行 按钮,自动进样,并根据步骤 3.6 中设置的程序检测序列标准溶液(步骤 1.7)和样品溶液(步骤 3.5)中 ATP、ADP 和 AMP 的含量。
注:实验结束时,用 98% 流动相 B 清洗色谱柱,以防止堵塞。 - 使用绘图和统计分析软件绘制 ATP、ADP 和 AMP 的标准曲线,x 轴上是连续标准浓度,y 轴上是峰面积。
- 使用步骤 3.8 中的标准曲线方程计算样品中的 ATP、ADP 和 AMP 含量。
4. 细胞热转移测定 (CETSA)
- 通过反复移液细胞,使用含有蛋白酶抑制剂的裂解物(裂解物:蛋白酶抑制剂 = 100:1)在培养皿中裂解正常 HT22 细胞 20 分钟。
注:在冰浴上执行此步骤以防止蛋白质降解。 - 收集步骤 4.1 中的细胞裂解物,并使用超声波细胞破碎仪(功率:300 W,超声波 3 秒,7 秒间隔,总时间:3 分钟)在冰浴上超声处理。在 10,304 × g、4 °C 下离心 20 分钟并收集上清液。
注意:将上清液分成 14 份:7 组用于与 Sal 共孵育,7 组用于与 PBS 作为对照共孵育。对于 Sal 处理组,每个样品添加 100 μL 上清液和 0.1 μL 20 μM Sal。对于对照组,每个样品添加 100 μL 上清液和 0.1 μL PBS。 - 将每个样品在室温下孵育 30 分钟,然后使用金属加热温控仪在 37 °C、42 °C、47 °C、52 °C、57 °C、62 °C 和 67 °C 下进一步孵育 3 分钟。
- 将步骤 4.3 中的样品在 4 °C 下以 10,304 × g 离心 20 分钟,并使用移液管收集上清液。
- 按照制造商的说明,使用 BCA 蛋白浓度测定试剂盒测量步骤 4.4 中上清液的总蛋白浓度(参见 材料表)。
- 按照制造商的说明,使用 PAGE 凝胶快速制备试剂盒制备 10% 分离凝胶(参见 材料表)。
- 将 3 μL 预染色的彩色蛋白质标志物和 14 μL 样品加载到分离凝胶的孔中(每孔的最终蛋白质量:20 μg)。
- 使用电泳缓冲液在 80-100 mV 下运行凝胶 1 小时以获得分离的蛋白质。
- 使用快速膜转移溶液和夹心结构(棉 - 滤纸 - PVDF 膜 - 蛋白质凝胶 - 滤纸 - 棉)在 400 mA 下将步骤 4.8 中的蛋白质转移到 PVDF 膜上 30 分钟。
- 在室温下用 5% 牛血清白蛋白 (BSA) 溶液封闭步骤 4.9 中的 PVDF 膜 1-2 小时。
注:通过将 5 mg BSA 粉末溶解在 100 mL 含有 100 mL TBS 缓冲液和 0.05% Tween 20 的 TBST 溶液中来制备 5% BSA 溶液。 - 将步骤 4.10 中的 PVDF 膜与 5 mL 稀释的一抗在 4 °C 下孵育过夜。
注:在 BSA 溶液中稀释一抗(1:1000 比例)。 - 用 TBST 洗涤 PVDF 膜 3 次,每次 5 分钟,以去除未结合的一抗。
- 将步骤 4.12 中的膜与稀释的辣根过氧化物酶 (HRP) 偶联的二抗在室温下在脱色摇床上孵育 2 小时。
注:在 BSA 溶液中稀释 HRP 偶联的二抗(比例为 1:10,000)。 - 用 TBST 洗涤膜 3 次,每次 5 分钟,以去除残留的二抗。
- 用 ECL 化学发光显影剂覆盖步骤 4.14 中的膜,然后使用成像系统对目标蛋白质信号进行成像。
注:在黑暗中执行此步骤以防止荧光猝灭。 - 使用 ImageJ 软件分析和量化目标蛋白质的灰度值(参见材料的 T able)。
结果
HPLC 检测的 ATP、ADP 和 AMP 的标准曲线分别为 Y = 7006.5X - 222.99、Y = 5217.3X - 17.796 和 Y = 9280.1X + 22.749(图 1A-C)。使用标准曲线计算通过 HPLC 测量的每组中的核苷酸含量(图 1D-I)。发现与对照组相比,CoCl2 显着降低 HT22 细胞中的 ATP 和 ADP 水平 (P < 0.01,图 1J,K)。此外,与 CoCl2 处理组相比,AMPK 抑制剂 dorsomorphin (Dor) 的给药导致 ATP 和 ADP 水平显着降低 (P < 0.01,图 1J,K)。然而,相对于 CoCl2 处理组,Sal 处理显着增加了 ATP 和 ADP 水平 (P < 0.05,图 1J,K)。
进一步分析显示,CoCl2 处理组的 AMP 水平显着增加,而 Sal 治疗有效地限制了这种激增 (P < 0.01, 图 1L)。适当的线粒体功能对于维持细胞内 ATP、ADP 和 AMP 稳态以及正常的细胞生理功能至关重要。线粒体的功能状态直接影响 ATP、ADP 和 AMP 的转化率和平衡。线粒体损伤或功能障碍会损害 ATP 合成并降低 ADP 和 AMP 的转化率,从而破坏细胞能量供应和代谢平衡。
这些发现表明,Sal 可能通过调节 ATP 、 ADP 和 AMP 转化来减轻 HT22 细胞的缺氧损伤。此外,Sal 与线粒体相关蛋白结合的 CETSA 分析表明,Sal 处理后 AMPKα 、 p-AMPKα 、 Sirt1 和 HIF-1α 的热稳定性增加。这表明 Sal 可能与这些蛋白质相互作用(图 2),与之前的研究结果一致 21,23,24。
数据可用性:
提供所有原始数据(补充文件 1 和 补充文件 2)。

图 1:Sal 对核苷酸(ATP、ADP 和 AMP)含量的影响。(A-C) ATP (A)、ADP (B) 和 AMP (C) 的标准曲线。(D-I)用于测定不同处理组的 ATP、ADP 和 AMP 含量的代表性 HPLC 曲线。(J-L)不同处理组(对照组,250 μM CoCl2、250 μM CoCl2 + 10 μM Dor、250 μM CoCl2 + 20 μM Sal 和 250 μM CoCl2 + 10 μM Dor + 20 μM Sal)中 ATP、ADP 和 AMP 含量的统计分析)。(n = 3,*P < 0.05,**P < 0.01)。请单击此处查看此图的较大版本。
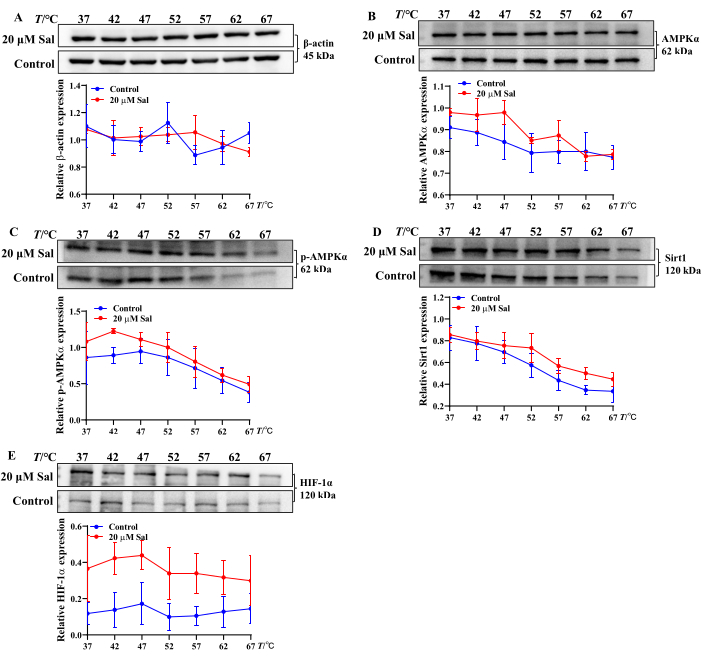
图 2:使用 CETSA 方法评估 Sal 与 AMPK/Sirt1/HIF-1α 通路相关蛋白的结合特性。 通过 CETSA 评估 HT22 细胞中 β-肌动蛋白 (A)、AMPKα (B)、p-AMPKα (C)、Sirt1 (D) 和 HIF-1α (E) 蛋白条带和表达趋势 (n = 3)。使用统计和绘图软件在不同温度下分析 Sal 与不同蛋白质的结合特性。 请单击此处查看此图的较大版本。
| 时间 (min) | 流动相 | |
| 溶剂 A | 溶剂 B | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
表 1:流动相洗脱程序。
补充文件 1:用于通过 HPLC 检测 ATP、ADP 和 AMP 的原始数据。请点击此处下载此文件。
补充文件 2:CETSA 蛋白条带。请点击此处下载此文件。
讨论
线粒体是参与 HHBI 治疗预防的关键细胞器 23,24,25。该小组之前的研究证实,Sal 调节 AMPK、Sirt1 和 HIF-1α 蛋白表达,增强神经元线粒体功能并预防 HHBI21,24。然而,Sal 对缺氧细胞中核苷酸的直接影响需要进一步研究。此外,评估化合物和蛋白质在不同温度条件下的结合电位对于了解它们的相互作用至关重要。
为了解决这些方面,本研究使用 HPLC 检查了 Sal 对 HT22 细胞中线粒体 ATP、ADP 和 AMP 水平的影响,直接了解其在线粒体能量代谢中的作用。根据之前的研究18,选择 250 μM 的 CoCl2 来诱导 HT22 细胞缺氧。结果表明,Sal 显着增加了 ATP 和 ADP 水平,同时降低了缺氧 HT22 细胞中的 AMP 含量(图 1)。结合该小组先前的发现,这些结果进一步证实 Sal 对缺氧神经元中的线粒体发挥保护作用。
AMPK 是真核生物中一种高度保守的蛋白激酶,可调节能量代谢。它感应细胞 ATP、ADP 和 AMP 水平的变化,通过磷酸化各种底物来协调葡萄糖代谢、脂肪酸合成和线粒体生物发生26。AMPK 的激活促进能量产生并抑制能量消耗,特别是响应细胞内 ATP 水平降低和 AMP 水平升高27。此外,AMPK 通过磷酸化葡糖淀粉酶、改变酶催化以及从磷酸精氨酸-精氨酸库快速生成 ATP 来增强 ATP储备 28。
在本研究中,选择性磷酸化 AMPK 抑制剂 Dor 用于研究 Sal 对核苷酸水平的影响29。HPLC 用于定量 CoCl2 处理的 HT22 细胞中单独暴露于 Dor 或与 Sal 联合暴露的 ATP 、 ADP 和 AMP 水平。研究结果表明,Sal 调节 ATP/ADP/AMP 比率,从而对缺氧发挥神经保护作用(图 1)。已建立的 HPLC 方法提供了一种直观、简单和有效的方法,用于在细胞水平上直接评估生物活性化合物对核苷酸的影响。
HIF-1α 是一种响应缺氧刺激而被激活的转录因子。在缺氧条件下,HIF-1α 的稳定性显著增加,使其能够从细胞质转移到细胞核,在那里它与 HIF-1β30 形成异二聚体。这个过程促进了参与血管生成、葡萄糖代谢和糖酵解的基因的表达 31,32,33。此外,HIF-1α 稳定性已被证明与氧化磷酸化过程中的线粒体功能和细胞内 O2 水平高度相关31。然而,缺氧诱导的线粒体功能障碍导致细胞内能量供应不足,进而激活 HIF-1α 通路以调节细胞对缺氧的适应31,32。
Sirt1 是 Sirtuin 家族的一员,是一种 NAD+ 依赖性脱乙酰酶,可通过脱乙酰化降低 HIF-1α 蛋白的稳定性,从而限制其核积累32。在低氧条件下,细胞内 ATP 水平降低导致 AMPK 活性增加,从而通过磷酸化影响 HIF-1α 及其相关蛋白的细胞内转运、稳定性和转录活性 31,32,33。此外,Sirt1 和 AMPK 调节 HIF-1α 与共激活因子之间的相互作用,从而调节其转录活性并进一步促进细胞对缺氧的适应33。在缺氧损伤的脑细胞中,AMPK、Sirt1 和 HIF-1α 相互作用以维持细胞内能量稳态并调节代谢过程。
在体外评估化合物-蛋白质复合物的热稳定性和结合潜力的简单有效的方法包括评估蛋白质在配体结合时稳定性的技术。众所周知,化合物-蛋白质相互作用增加了蛋白质的热稳定性,使它们对温度诱导的变性不太敏感,并导致相对稳定的蛋白质产量。细胞热转移测定 (CETSA) 与 western blot 分析相结合,虽然没有揭示确切的结合位点,但为研究药物-靶标相互作用和潜在的脱靶效应提供了一种低成本且有效的方法22,34。CETSA 广泛用于验证和量化不同物种细胞和组织中的药物靶标结合。
在本研究中,采用 CETSA 评估 Sal 是否在细胞水平上与 AMPKα 、 p-AMPKα 、 Sirt1 和 HIF-1α 相互作用。热处理后,Sal 增加了这些蛋白的表达,表明形成了稳定的 Sal-AMPKα、Sal-p-AMPKα、Sal-Sirt1 和 Sal-HIF-1α 复合物(图 2)。这些发现与之前的实验结果一致 21,24。因此,CETSA-western 印迹是一种在体外大规模筛选化合物-蛋白质相互作用和热稳定性的稳健而有效的方法。
尽管使用 HPLC 和 CETSA 技术深入了解了 Sal 对线粒体能量代谢的保护机制,但仍然存在某些局限性。CETSA 不提供氨基酸水平上有关化合物如何影响蛋白质热稳定性的信息。一个潜在的进步是将 CETSA 与成像技术相结合,以直观地识别蛋白质内的化合物结合位点,从而更清楚地了解化合物-蛋白质复合物如何抵抗热诱导的变性。要实现这一目标,需要进一步的科学创新和完善的实验设计。此外,用其他分子相互作用技术(如局部表面等离子体共振和差示扫描荧光测定法)补充 CETSA 将提供更全面的化合物-蛋白质相互作用分析35。
披露声明
作者没有什么可披露的。
致谢
这项工作得到了中国国家自然科学基金(82274207和82474185)、四川省科技厅(2024NSFSC1845)、四川省科技厅青年科学基金(2023NSFSC1776)、宁夏重点研发计划(2023BEG02012)、中国中医药学会2024-2026年青年人才支持项目(2024-QNRC2-B07)和杏林学者研究的支持。成都中医大学推广项目(XKTD2022013、QJJJ2024027)。
作者贡献:
王晓波、张雅婷、侯雅、李睿和孟宪丽构思了这个项目。Yating Zhang、Ya Hou 和 Tingting Kuang 进行了实验并分析了数据。张雅婷和洪江写了手稿。王小波和孟宪丽修改了手稿。所有作者都已阅读并批准了最终手稿。
材料
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
参考文献
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108 (2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532 (2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77 (2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094 (2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146 (2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762 (2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568 (2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404 (2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617 (2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278 (2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843 (2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82 (2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318 (2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858 (2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182 (2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127 (2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。