Research Article
Mechanistische Einblicke in den mitochondrialen Schutz von Salidrosid über den AMPK/Sirt1/HIF-1α-Signalweg in hypoxischen HT22-Zellen
In diesem Artikel
Zusammenfassung
In der vorliegenden Studie wurde ein einzigartiger Mechanismus identifiziert, durch den Salidrosid mitochondriale Schutzwirkungen auf hypoxische HT22-Zellen ausübt, teilweise über den AMPK/Sirt1/HIF-1α-Signalweg.
Zusammenfassung
Es wurde festgestellt, dass Salidrosid (Sal), ein Wirkstoff von Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba, mitochondriale Schutzwirkungen ausübt, indem er den Stoffwechsel verbessert und die Energieversorgung der Gehirnzellen unter hypoxischen Bedingungen erhöht. Der Wirkmechanismus ist jedoch noch nicht vollständig geklärt. In der vorliegenden Studie wurde zunächst die Hochleistungsflüssigkeitschromatographie eingesetzt, um die Auswirkungen von Sal auf die Nukleotidspiegel (ATP, ADP und AMP) zu analysieren. Der Cellular Thermal Shift Assay (CETSA), eine weit verbreitete molekulare Interaktionsmethode zur Validierung und Quantifizierung der Wirkstoffzielbindung in Zellen und Geweben verschiedener Spezies, wurde dann ausgewählt, um die Affinität von Sal zu Proteinen zu bestätigen, die mit dem AMPK/Sirt1/HIF-1α-Signalweg in Verbindung stehen. Die Ergebnisse zeigten, dass Sal die ATP- und ADP-Spiegel in hypoxischen HT22-Zellen erhöhte, während es die AMP-Spiegel senkte. Darüber hinaus zeigte Sal eine stabile Bindung an AMPKα-, p-AMPKα-, Sirt1- und HIF-1α-Proteine. Zusammenfassend lässt sich sagen, dass Sal mitochondriale Schutzwirkungen ausüben kann, indem es den AMPK/Sirt1/HIF-1α-Signalweg moduliert, um den Nukleotidgehalt zu regulieren. Diese Studie stellt eine methodische Referenz für die Analyse des Nukleotidgehalts in Zellproben dar und trägt zur Identifizierung und Entdeckung von Angriffspunkten für Verbindungen aus der traditionellen chinesischen Medizin bei.
Einleitung
Das Gehirn reagiert aufgrund seines hohen Stoffwechselbedarfs, seiner begrenzten glykolytischen Kapazität und seiner Abhängigkeit von oxidativer Phosphorylierung sehr empfindlich auf Sauerstoff. Infolgedessen kann die Exposition gegenüber einer sauerstoffarmen Umgebung in großen Höhen leicht zu einer hypobaren hypoxischen Hirnschädigung (HHBI) führen1,2. Epidemiologische Studien deuten darauf hin, dass die Inzidenz der akuten Bergkrankheit bis zu 75 % erreichen kann, wenn Personen, die nicht an große Höhen gewöhnt sind, schnell in hochgelegene Regionen aufsteigen, mit einer Sterblichkeitsrate von etwa 1 % für schwere Fälle. Darüber hinaus kann die Sterblichkeitsrate bei Hirn- oder Lungenödemen in großer Höhe bei bis zu 40 % liegen, wenn keine medizinische Versorgung vorhanden ist3,4.
Die HHBI zeigt ein breites Spektrum an klinischen Symptomen. Leichte bis mittelschwere Fälle können Kopfschmerzen, Schwindel und Gedächtnisverlust umfassen5, während schwere Fälle zu kognitiven Beeinträchtigungen, Bewusstseinsstörungen und potenziell tödlichen Ergebnissen führen können5. Die Prävention und Behandlung von HHBI in hochgelegenen Regionen ist zu einem Schwerpunkt der medizinischen Forschung geworden. Präventive Strategien umfassen in erster Linie adaptives Training in Höhenumgebungen, einschließlich ausreichender Ruhe, ausgewogener Ernährung, richtiger Ernährung und angemessener körperlicher Bewegung 6,7. Darüber hinaus stehen pharmakologische Interventionen zum Schutz der Gehirnzellen und zur Linderung der zerebralen Hypoxie im Mittelpunkt der aktuellen HHBI-Forschung.
Mitochondrien dienen als primäre Energieproduktionszentren in den Zellen und synthetisieren Adenosintriphosphat (ATP), um den zellulären Energiebedarf zu decken. Unter hypoxischen Bedingungen nimmt die mitochondriale Energieproduktion ab, was zu einem verringerten ATP-Spiegel und einer Beeinträchtigung der Zellfunktion führt8. Die hypoxische Schädigung stört auch die mitochondriale Regulation von Ca2+ und der pH-Homöostase und löst Apoptose und Nekroseaus 9,10. Es besteht eine sich gegenseitig verstärkende Beziehung zwischen mitochondrialer Dysfunktion und hypoxischer Hirnverletzung. Einerseits verschlimmert die durch Hypoxie induzierte mitochondriale Beeinträchtigung den Sauerstoffmangel, indem sie den zellulären Energiestoffwechsel weiter reduziert und einen Teufelskreis erzeugt. Auf der anderen Seite erhöht die mitochondriale Dysfunktion den intrazellulären Ca2+-Spiegel, aktiviert apoptotische Kaskaden und führt zum Zelltod11. Obwohl die Mechanismen, die der hypoxischen Hirnschädigung zugrunde liegen, nach wie vor komplex und nicht vollständig verstanden sind, haben mehrere Studien einen gestörten neuronalen mitochondrialen Energiestoffwechsel als kritischen Faktor für ihre Pathogenese identifiziert12,13. Daher kann die weitere Erforschung der mitochondrialen Funktion wertvolle Einblicke in potenzielle therapeutische Ziele für hypoxische Hirnverletzungen liefern.
Salidrosid (Sal) ist ein Wirkstoff, der aus der Plateaupflanze Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba gewonnen wird und häufig in Lebensmitteln, Gesundheitsprodukten und Pharmazeutika verwendetwird 14. Die Summenformel von Sal lautet C14H20O7 und ist auch als 2-(4-Hydroxyphenyl)-ethyl β-D-glucopyranosid bekannt. Es besitzt verschiedene pharmakologische Eigenschaften, darunter Anti-Hypoxie, Antioxidans, Anti-Müdigkeit, Anti-Tumor, immunmodulatorische, entzündungshemmende sowie kardiovaskuläre und zerebrovaskuläre Schutzwirkungen 15,16,17. Unter diesen ist seine Anti-Hypoxie-Wirkung eine der am besten dokumentierten. Neuere Studien haben zunehmend die signifikante mitochondriale Schutzwirkung von Sal als potenziellen Mechanismus für seine präventive und therapeutische Wirkung auf Plateau-induzierte Hirnverletzungen bei Mäusen hervorgehoben14,18. Die genauen molekularen Mechanismen, durch die Sal die ATP-, ADP- und AMP-Spiegel beeinflusst, sind jedoch nach wie vor wenig verstanden.
Die AMP-aktivierte Proteinkinase (AMPK) fungiert als wichtiger Energiesensor, der zur Aufrechterhaltung der zellulären Energiehomöostase beiträgt. Die Aktivierung von AMPK stimuliert Sirtuin 1 (Sirt1), was zu einem Anstieg des intrazellulären NAD+-Spiegels führt19. Studien haben gezeigt, dass Sirt1 den Hypoxie-induzierbaren Faktor 1-alpha (HIF-1α) regulieren kann, um die zelluläre Reaktion auf Hypoxie20 zu koordinieren. Frühere Forschungen haben gezeigt, dass Sal die Öffnung der neuronalen mitochondrialen Permeabilitätsübergangspore hemmt, HIF-1α-vermittelte mitochondriale Energieprozesse reguliert, die neuronale Apoptose abschwächt und die Integrität der Blut-Hirn-Schranke aufrechterhält, wodurch Ratten vor plateauinduzierten Hirnschäden geschütztwerden 14,21. Die Wirkung von Sal auf ATP und seine Metaboliten ADP und AMP bleibt jedoch ungewiss.
Um dies zu untersuchen, wurde zunächst die Hochleistungsflüssigkeitschromatographie (HPLC) eingesetzt, um die Spiegel dieser drei Nukleotide zu quantifizieren. Darüber hinaus wurde der Cellular Thermal Shift Assay (CETSA) eingesetzt, eine weit verbreitete biophysikalische Technik, die 2013 eingeführt wurde, um Liganden-Protein-Wechselwirkungen in intakten Zellenzu untersuchen 22. Diese Methode wird häufig eingesetzt, um die Wirkstoff-Ziel-Bindung in Zellen und Geweben verschiedener Spezies zu validieren und zu quantifizieren. Insbesondere nach der Co-Inkubation von Zielzelllysaten mit dem Wirkstoff bei unterschiedlichen Temperaturen für eine festgelegte Dauer weist das wirkstoffgebundene Protein eine erhöhte thermische Stabilität auf, wodurch es weniger anfällig für Denaturierung und Ausfällung ist. Die gefällten ungebundenen Proteine werden dann durch Zentrifugation entfernt, und anschließend werden Wirkstoff-Ziel-Wechselwirkungen durch Western-Blot-Analyse des Überstands22 identifiziert. Um potenzielle molekulare Ziele von Sal zu identifizieren, wurde CETSA ausgewählt, um seine Bindungsaffinität mit Proteinen, die mit dem AMPK/Sirt1/HIF-1α-Signalweg in Verbindung stehen, zu bewerten.
Protokoll
Die kommerziellen Details der Reagenzien und der in dieser Studie verwendeten Geräte sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Lösung
- Bereiten Sie das komplette modifizierte Eagle-Medium (DMEM) von Dulbecco zu, indem Sie 10 % fötales Rinderserum und 1 % Penicillin-Streptomycin hinzufügen.
- Bereiten Sie eine 20 mM Sal-Lösung vor, indem Sie 3 mg Sal in 500 μl phosphatgepufferter Kochsalzlösung (PBS) auflösen21.
- 500 mL chromatographisch reines Acetonitril (mobile Phase A) mit einer 0,45 μm organischen Membran filtrieren.
- Bereiten Sie 1000 mL der mobilen Phase B vor, indem Sie 3,5 mL Reagenz I zu 1 l deionisiertem Wasser hinzufügen. Stellen Sie den pH-Wert mit Reagenz II auf 6,15 ein und befolgen Sie dabei die Anweisungen des Assay-Kits für den Nukleotidgehalt (ATP, ADP und AMP) (siehe Materialtabelle).
HINWEIS: Reagenz I und Reagenz II sind im Assay-Kit für den Nukleotidgehalt (ATP, ADP und AMP) enthalten. - Filtrieren Sie die mobile Phase B mit einer 0,22 μm wässrigen Membran.
HINWEIS: Mobile Phase B sollte sofort nach der Zubereitung verwendet werden. Die mobilen Phasen A und B sollten vor der Verwendung 30 Minuten lang beschallt werden, um Luftblasen zu entfernen. - Verdünnen Sie eine 1 μM ATP-, ADP- und AMP-Standardlösung mit deionisiertem Wasser, um Standardlösungen der Serien 0,5 μM, 0,1 μM, 0,05 μM, 0,01 μM und 0,005 μM ATP, ADP und AMP zu erhalten.
- Filtrieren Sie die Serie der Standardlösungen mit einer 0,22 μm nadelförmigen mikroporösen Filtermembran.
HINWEIS: Für die Lagerung der serienmäßigen Standardlösungen sollten braune Injektionsflaschen verwendet werden. Die vorbereitete Serie von Standardlösungen sollte so schnell wie möglich verwendet werden.
2. Zellkultur
HINWEIS: Die HT22-Zellkultur und das CoCl 2-stimulierte Hypoxiemodell wurden gemäß einem früheren Berichtetabliert 21.
- Kultivieren Sie HT22-Zellen bei 37 °C mit 5 % CO2 , bis eine Konfluenz von 80 % in der Petrischale erreicht ist. Verdauen Sie die Zellen mit 0,25% Trypsin für 1 min.
- Seed 2 × 105 Zellen aus Schritt 2.1 in 6-Well-Platten mit vollständigem DMEM (Kontrollgruppe ohne medikamentöse Behandlung) oder vollständigem DMEM, das das Medikament enthält (250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal und 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). 24 h bei 37 °C mit 5 % CO2 inkubieren.
HINWEIS: In jeder Gruppe wurden drei parallele Stichproben eingerichtet.
3. Assay des Nukleotidgehalts (ATP, ADP und AMP)
- Geben Sie 1 ml Extraktionsreagenz I in jede Vertiefung in den 6-Well-Platten aus Schritt 2.2.
HINWEIS: Das Extraktionsreagenz I ist im Assay-Kit für den Nukleotidgehalt (ATP, ADP und AMP) enthalten (siehe Materialtabelle). - Lysieren Sie die Zellen durch Beschallung in einem Eisbad mit einem Ultraschall-Zellaufschlussgerät (Leistung: 300 W, Ultraschallwellen für 3 s, 7 s Intervall, Gesamtzeit: 3 min).
- Die lysierten Zellen werden bei 10.304 × g für 10 min bei 4 °C mit einer gekühlten Hochgeschwindigkeitszentrifuge zentrifugiert.
- 0,75 mL Überstand aus Schritt 3.3 in ein 2,0 mL Röhrchen überführen. 0,75 mL Extraktionsreagenz II zugeben, schütteln und mit einem Vortex-Mischer mischen und erneut bei 10.304 × g für 10 min bei 4 °C zentrifugieren.
HINWEIS: Das Extraktionsreagenz II ist im Assay-Kit für den Nukleotidgehalt (ATP, ADP und AMP) enthalten. - Der Überstand aus Schritt 3.4 wird pipettiert und mit einer mikroporösen 0,22-μm-Nadelfiltermembran in ein braunes Fläschchen filtriert.
HINWEIS: ATP, ADP und AMP in der extrahierten Probe sind nicht stabil. Alle experimentellen Eingriffe sollten bei niedrigen Temperaturen oder auf Eis durchgeführt werden. Die Proben sollten so schnell wie möglich verarbeitet und getestet werden. - Öffnen Sie die Chromatographie-Software und stellen Sie die folgenden Parameter ein: Injektionsvolumen: 10 μL; Temperatur der Säule: 27 °C; Durchflussrate: 0,8 mL/min; Detektionswellenlänge: 254 nm; Dauer der Detektion: 70 min. Stellen Sie das Verfahren für die Gradientenelution gemäß Tabelle 1 ein.
- Klicken Sie auf die Schaltfläche Ausführen , um die Probe automatisch zu injizieren und den Gehalt an ATP, ADP und AMP in seriellen Standardlösungen (Schritt 1.7) und Probenlösungen (Schritt 3.5) gemäß dem in Schritt 3.6 eingestellten Programm zu ermitteln.
HINWEIS: Waschen Sie die chromatographische Säule am Ende des Experiments mit 98 % mobiler Phase B, um ein Verstopfen zu vermeiden. - Zeichnen Sie die Standardkurven von ATP, ADP und AMP mithilfe von Grafik- und statistischer Analysesoftware mit seriellen Standardkonzentrationen auf der x-Achse und Peakbereichen auf der y-Achse.
- Berechnen Sie den ATP-, ADP- und AMP-Gehalt in den Proben mit der Standardkurvengleichung aus Schritt 3.8.
4. Zellulärer thermischer Shift-Assay (CETSA)
- Normale HT22-Zellen werden 20 Minuten lang in einer Petrischale mit Proteasehemmer-haltigem Lysat (Lysat: Proteasehemmer = 100:1) durch wiederholtes Pipettieren der Zellen lysiert.
HINWEIS: Führen Sie diesen Schritt in einem Eisbad durch, um einen Proteinabbau zu verhindern. - Sammeln Sie das Zelllysat aus Schritt 4.1 und beschallen Sie es in einem Eisbad mit einem Ultraschall-Zellaufschlussgerät (Leistung: 300 W, Ultraschallwellen für 3 s, 7 s Intervall, Gesamtzeit: 3 min). Bei 10.304 × g, 4 °C für 20 min zentrifugieren und den Überstand auffangen.
HINWEIS: Teilen Sie den Überstand in 14 Portionen auf: 7 Gruppen für die Koinkubation mit Sal und 7 Gruppen für die Koinkubation mit PBS als Kontrolle. Für die Sal-behandelte Gruppe sind 100 μl Überstand und 0,1 μl 20 μM Sal pro Probe zuzugeben. Für die Kontrollgruppe werden 100 μl Überstand und 0,1 μl PBS pro Probe zugegeben. - Inkubieren Sie jede Probe 30 Minuten lang bei Raumtemperatur und dann weiter bei 37 °C, 42 °C, 47 °C, 52 °C, 57 °C, 62 °C und 67 °C für 3 Minuten mit einem Heiztemperaturkontrollgerät aus Metall.
- Die Proben aus Schritt 4.3 werden bei 10.304 × g für 20 min bei 4 ΰC zentrifugiert und der Überstand mit einer Pipette entnommen.
- Die Gesamtproteinkonzentration des Überstands aus Schritt 4.4 ist mit einem BCA-Proteinkonzentrationsassay-Kit gemäß den Anweisungen des Herstellers zu messen (siehe Materialtabelle).
- Bereiten Sie ein 10%iges Trenngel mit einem PAGE-Gel-Schnellvorbereitungskit gemäß den Anweisungen des Herstellers vor (siehe Materialtabelle).
- Laden Sie 3 μl des vorgefärbten Farbproteinmarkers und 14 μl Proben in die Vertiefungen des Trenngels (endgültige Proteinmenge pro Vertiefung: 20 μg).
- Lassen Sie das Gel 1 h lang bei 80-100 mV mit Elektrophoresepuffer laufen, um getrennte Proteine zu erhalten.
- Die Proteine aus Schritt 4.8 werden mit einer schnellen Membrantransferlösung und einer Sandwichstruktur (Baumwolle-Filterpapier-PVDF-Membran-Protein-Gel-Filterpapier-Baumwolle) bei 400 mA für 30 min auf eine PVDF-Membran übertragen.
- Blockieren Sie die PVDF-Membranen aus Schritt 4.9 mit 5%iger Rinderserumalbumin-Lösung (BSA) für 1-2 h bei Raumtemperatur.
HINWEIS: Bereiten Sie eine 5%ige BSA-Lösung vor, indem Sie 5 mg BSA-Pulver in 100 ml TBST-Lösung auflösen, die 100 ml TBS-Puffer und 0,05 % Tween 20 enthält. - Die PVDF-Membranen aus Schritt 4.10 werden über Nacht mit 5 mL verdünntem Primärantikörper bei 4 °C inkubiert.
HINWEIS: Verdünnen Sie den Primärantikörper in BSA-Lösung (Verhältnis 1:1000). - Waschen Sie die PVDF-Membranen dreimal mit TBST für jeweils 5 Minuten, um ungebundene Primärantikörper zu entfernen.
- Die Membranen aus Schritt 4.12 werden mit verdünntem Meerrettichperoxidase (HRP)-gekoppeltem Sekundärantikörper 2 h bei Raumtemperatur auf einem Entfärbungsschüttler inkubiert.
HINWEIS: Verdünnen Sie den HRP-gekoppelten Sekundärantikörper in BSA-Lösung (Verhältnis 1:10.000). - Waschen Sie die Membranen dreimal für jeweils 5 Minuten mit TBST, um den verbleibenden Sekundärantikörper zu entfernen.
- Bedecken Sie die Membranen aus Schritt 4.14 mit einem ECL-Chemilumineszenz-Entwickler und bilden Sie dann das Zielproteinsignal mit einem bildgebenden System ab.
HINWEIS: Führen Sie diesen Schritt im Dunkeln durch, um eine Fluoreszenzlöschung zu verhindern. - Analysieren und quantifizieren Sie den Grauwert von Zielproteinen mit der ImageJ-Software (siehe T able of Materials).
Ergebnisse
Die Standardkurven für ATP, ADP und AMP, die durch HPLC nachgewiesen wurden, waren Y = 7006,5X - 222,99, Y = 5217,3X - 17,796 bzw. Y = 9280,1X + 22,749 (Abbildung 1A-C). Die mittels HPLC gemessenen Nukleotidgehalte in jeder Gruppe wurden anhand der Standardkurven berechnet (Abbildung 1D-I). Es zeigte sich, dass CoCl2 die ATP- und ADP-Spiegel in HT22-Zellen im Vergleich zur Kontrollgruppe signifikant reduzierte (P < 0,01, Abbildung 1J,K). Darüber hinaus führte die Verabreichung von Dorsomorphin (Dor), einem AMPK-Inhibitor, zu einer deutlichen Reduktion der ATP- und ADP-Spiegel im Vergleich zur CoCl-2-behandelten Gruppe (P < 0,01, Abbildung 1J,K). Die Behandlung mit Sal erhöhte jedoch die ATP- und ADP-Spiegel im Vergleich zur CoCl-2-behandelten Gruppe signifikant (P < 0,05, Abbildung 1J,K).
Weitere Analysen zeigten, dass die AMP-Spiegel in der mit CoCl2 behandelten Gruppe signifikant anstiegen, während die Sal-Behandlung diesen Anstieg wirksam begrenzt (P < 0,01, Abbildung 1L). Eine ordnungsgemäße mitochondriale Funktion ist für die Aufrechterhaltung der intrazellulären ATP-, ADP- und AMP-Homöostase sowie für die normalen zellphysiologischen Funktionen unerlässlich. Der funktionelle Zustand der Mitochondrien beeinflusst direkt die Umwandlungsrate und das Gleichgewicht von ATP, ADP und AMP. Mitochondriale Schäden oder Dysfunktionen können die ATP-Synthese beeinträchtigen und die Umwandlungsraten von ADP und AMP reduzieren, wodurch die zelluläre Energieversorgung und das metabolische Gleichgewicht gestört werden.
Diese Ergebnisse deuten darauf hin, dass Sal hypoxische Verletzungen in HT22-Zellen lindern kann, indem es die ATP-, ADP- und AMP-Umwandlung moduliert. Darüber hinaus zeigte die CETSA-Analyse der Sal-Bindung an Mitochondrien-assoziierte Proteine eine Erhöhung der thermischen Stabilität von AMPKα, p-AMPKα, Sirt1 und HIF-1α nach der Sal-Behandlung. Dies deutet darauf hin, dass Sal mit diesen Proteinen interagieren kann (Abbildung 2), was mit den Ergebnissen früherer Studien übereinstimmt 21,23,24.
DATENVERFÜGBARKEIT:
Alle Rohdaten werden zur Verfügung gestellt (Ergänzungsdatei 1 und Ergänzungsdatei 2).

Abbildung 1: Einfluss von Sal auf den Nukleotidgehalt (ATP, ADP und AMP). (A-C) Standardkurven für ATP (A), ADP (B) und AMP (C). (D-I) Repräsentative HPLC-Kurven zur Bestimmung des ATP-, ADP- und AMP-Gehalts über verschiedene Behandlungsgruppen hinweg. (J-L) Statistische Analyse des ATP-, ADP- und AMP-Gehalts in verschiedenen Behandlungsgruppen (Kontrolle, 250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal und 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). (n = 3, *P < 0,05, **P < 0,01). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
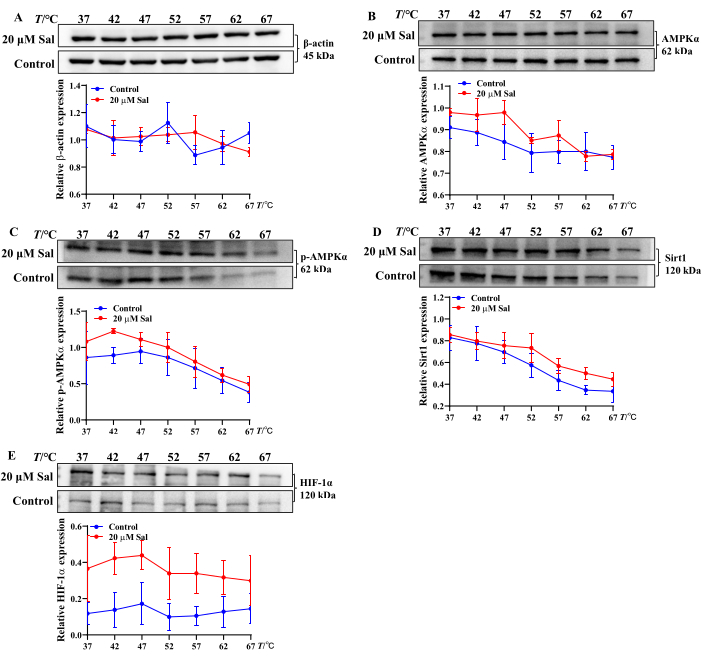
Abbildung 2: Bewertung der Sal-Bindungseigenschaften an AMPK/Sirt1/HIF-1α-Signalweg-assoziierte Proteine mit der CETSA-Methode. β-Aktin (A), AMPKα (B), p-AMPKα (C), Sirt1 (D) und HIF-1α (E) Proteinbanden und Expressionstrends in HT22-Zellen wurden mittels CETSA (n = 3) bewertet. Die Bindungseigenschaften von Sal an verschiedene Proteine wurden mit Hilfe von Statistik- und Grafiksoftware über unterschiedliche Temperaturen hinweg analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Zeit (min) | Mobile Phase | |
| Lösungsmittel A | Lösungsmittel B | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
Tabelle 1: Verfahren zur Elution in der mobilen Phase.
Ergänzende Datei 1: Rohdaten zum Nachweis von ATP, ADP und AMP mittels HPLC. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2: CETSA-Proteinbanden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Mitochondrien sind Schlüsselorganellen, die an der therapeutischen Prävention von HHBI beteiligt sind 23,24,25. Frühere Studien der Gruppe haben bestätigt, dass Sal die Expression von AMPK-, Sirt1- und HIF-1α-Proteinen reguliert, die neuronale Mitochondrienfunktion verbessert und vor HHBI schützt21,24. Die direkte Wirkung von Sal auf die Nukleotide in hypoxischen Zellen bedarf jedoch weiterer Untersuchungen. Darüber hinaus ist die Bewertung des Bindungspotenzials von Verbindungen und Proteinen unter unterschiedlichen Temperaturbedingungen für das Verständnis ihrer Wechselwirkungen unerlässlich.
Um diese Aspekte zu adressieren, untersuchte die vorliegende Studie die Wirkung von Sal auf die mitochondrialen ATP-, ADP- und AMP-Spiegel in HT22-Zellen mittels HPLC und gab einen direkten Einblick in seine Rolle im mitochondrialen Energiestoffwechsel. Basierend auf einer früheren Studie18 wurden 250 μM CoCl2 ausgewählt, um Hypoxie in HT22-Zellen zu induzieren. Die Ergebnisse zeigten, dass Sal die ATP- und ADP-Spiegel signifikant erhöhte und gleichzeitig den AMP-Gehalt in hypoxischen HT22-Zellen reduzierte (Abbildung 1). In Kombination mit früheren Ergebnissen aus der Gruppe bestätigen diese Ergebnisse weiter, dass Sal eine schützende Wirkung auf Mitochondrien in hypoxischen Neuronen ausübt.
AMPK ist eine hochkonservierte Proteinkinase in Eukaryoten, die den Energiestoffwechsel reguliert. Es erkennt Veränderungen der zellulären ATP-, ADP- und AMP-Spiegel, um den Glukosestoffwechsel, die Fettsäuresynthese und die mitochondriale Biogenese durch Phosphorylierung verschiedener Substrate zu koordinieren26. Die Aktivierung von AMPK fördert die Energieproduktion und unterdrückt den Energieverbrauch, insbesondere als Reaktion auf reduzierte intrazelluläre ATP-Spiegel und erhöhte AMP-Spiegel27. Darüber hinaus erhöht AMPK die ATP-Reserven durch Phosphorylierung der Glucoamylase, Veränderung der enzymatischen Katalyse und schnelle Erzeugung von ATP aus dem Phosphoarginin-Arginin-Pool28.
In der vorliegenden Studie wurde Dor, ein selektiver phosphorylierter AMPK-Inhibitor, verwendet, um die Auswirkungen von Sal auf die Nukleotidspiegelzu untersuchen 29. Die HPLC wurde zur Quantifizierung der ATP-, ADP- und AMP-Spiegel in CoCl2-behandelten HT22-Zellen eingesetzt, die Dor allein oder in Kombination mit Sal ausgesetzt waren. Die Ergebnisse deuten darauf hin, dass Sal das ATP/ADP/AMP-Verhältnis moduliert und dadurch eine neuroprotektive Wirkung gegen Hypoxie ausübt (Abbildung 1). Die etablierte HPLC-Methode bietet einen intuitiven, einfachen und effizienten Ansatz, um die Auswirkungen bioaktiver Verbindungen auf Nukleotide auf zellulärer Ebene direkt zu beurteilen.
HIF-1α ist ein Transkriptionsfaktor, der als Reaktion auf hypoxische Stimulation aktiviert wird. Unter hypoxischen Bedingungen nimmt die Stabilität von HIF-1α deutlich zu, so dass es aus dem Zytoplasma in den Zellkern translozieren kann, wo es mit HIF-1β30 ein Heterodimer bildet. Dieser Prozess fördert die Expression von Genen, die an der Angiogenese, dem Glukosestoffwechsel und der Glykolyse beteiligt sind 31,32,33. Darüber hinaus wurde gezeigt, dass die HIF-1α-Stabilität während der oxidativen Phosphorylierung stark mit der mitochondrialen Funktion und den intrazellulärenO2-Spiegeln korreliert31. Eine Hypoxie-induzierte mitochondriale Dysfunktion führt jedoch zu einer unzureichenden intrazellulären Energieversorgung, die wiederum den HIF-1α-Signalweg aktiviert, um die zelluläre Anpassung an Hypoxie zu regulieren31,32.
Sirt1, ein Mitglied der Sirtuin-Familie, ist eine NAD+-abhängige Deacetylase, die die Stabilität des HIF-1α-Proteins durch Deacetylierung verringert und dadurch die nukleare Akkumulation begrenzt32. Unter hypoxischen Bedingungen führen verminderte intrazelluläre ATP-Spiegel zu einer erhöhten AMPK-Aktivität, die den intrazellulären Transport, die Stabilität und die transkriptionelle Aktivität von HIF-1α und seinen assoziierten Proteinen durch Phosphorylierung beeinflusst 31,32,33. Darüber hinaus modulieren Sirt1 und AMPK die Interaktion zwischen HIF-1α und Koaktivatoren, wodurch seine transkriptionelle Aktivität reguliert und die zelluläre Anpassung an Hypoxie weiter erleichtertwird 33. In Hypoxie-geschädigten Gehirnzellen interagieren AMPK, Sirt1 und HIF-1α, um die intrazelluläre Energiehomöostase aufrechtzuerhalten und Stoffwechselprozesse zu regulieren.
Zu den einfachen und effizienten Methoden zur Bewertung der Thermostabilität und des Bindungspotenzials von Compound-Protein-Komplexen in vitro gehören Techniken zur Bewertung der Stabilität von Proteinen bei der Ligandenbindung. Es ist allgemein bekannt, dass Verbindung-Protein-Wechselwirkungen die Thermostabilität von Proteinen erhöhen, wodurch sie weniger empfindlich gegenüber temperaturinduzierter Denaturierung sind und zu einer relativ stabilen Proteinausbeute führen. Der Cellular Thermal Shift Assay (CETSA) in Kombination mit der Western-Blot-Analyse bietet zwar keine genaue Bindungsstelle, bietet aber einen kostengünstigen und effizienten Ansatz zur Untersuchung von Wirkstoff-Ziel-Wechselwirkungen und potenziellen Off-Target-Effekten22,34. CETSA wird häufig verwendet, um die Wirkstoff-Target-Bindung in Zellen und Geweben verschiedener Spezies zu validieren und zu quantifizieren.
In dieser Studie wurde CETSA eingesetzt, um zu beurteilen, ob Sal mit AMPKα, p-AMPKα, Sirt1 und HIF-1α auf zellulärer Ebene interagiert. Nach der Wärmebehandlung erhöhte Sal die Expression dieser Proteine, was auf die Bildung stabiler Sal-AMPKα-, Sal-p-AMPKα-, Sal-Sirt1- und Sal-HIF-1α-Komplexe hindeutet (Abbildung 2). Diese Ergebnisse stimmen mit früheren experimentellen Ergebnissen überein21,24. Der CETSA-Western Blot dient somit als robuster und effizienter Ansatz für das großflächige Screening von Compound-Protein-Wechselwirkungen und der Thermostabilität in vitro.
Trotz der mit HPLC- und CETSA-Techniken gewonnenen Erkenntnisse über die Schutzmechanismen von Sal auf den mitochondrialen Energiestoffwechsel bestehen gewisse Einschränkungen. CETSA liefert keine Informationen auf Aminosäureebene darüber, wie Verbindungen die Thermostabilität von Proteinen beeinflussen. Ein potenzieller Fortschritt wäre die Integration von CETSA in bildgebende Technologien, um Verbindungsbindungsstellen innerhalb von Proteinen visuell zu identifizieren und so ein klareres Verständnis dafür zu ermöglichen, wie Verbindung-Protein-Komplexe hitzeinduzierter Denaturierung widerstehen. Um dies zu erreichen, sind weitere wissenschaftliche Innovationen und ein verfeinertes Versuchsdesign erforderlich. Darüber hinaus würde die Ergänzung von CETSA durch andere molekulare Interaktionstechniken, wie z. B. die lokalisierte Oberflächenplasmonenresonanz und die dynamische Differentialfluorimetrie, eine umfassendere Analyse der Wechselwirkungen zwischen Verbindungen und Proteinen ermöglichen35.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde unterstützt von der National Natural Science Foundation of China (82274207 und 82474185), dem Science & Technology Department der Provinz Sichuan (2024NSFSC1845), der Science Foundation for Youths of Science & Technology Department der Provinz Sichuan (2023NSFSC1776), dem Key Research and Development Program von Ningxia (2023BEG02012), dem Youth Talent Support Project der China Association of Chinese Medicine für 2024-2026 (2024-QNRC2-B07) und dem Xinglin Scholar Research Förderprojekt der Chengdu University of TCM (XKTD2022013 und QJJJ2024027).
BEITRAG DES AUTORS:
Xiaobo Wang, Yating Zhang, Ya Hou, Rui Li und Xianli Meng haben dieses Projekt konzipiert. Yating Zhang, Ya Hou und Tingting Kuang führten die Experimente durch und analysierten die Daten. Yating Zhang und Hong Jiang schrieben das Manuskript. Xiaobo Wang und Xianli Meng überarbeiteten das Manuskript. Alle Autorinnen und Autoren haben das endgültige Manuskript gelesen und freigegeben.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
Referenzen
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108(2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532(2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77(2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094(2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146(2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762(2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568(2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404(2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529(2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617(2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278(2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843(2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82(2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318(2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858(2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182(2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127(2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287(2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten