Research Article
Información mecanicista sobre la protección mitocondrial de Salidroside a través de la vía AMPK/Sirt1/HIF-1α en células HT22 hipóxicas
En este artículo
Resumen
El presente estudio identificó un mecanismo único por el cual el salidrósido ejerce efectos protectores mitocondriales sobre las células HT22 hipóxicas, en parte a través de la vía AMPK/Sirt1/HIF-1α.
Resumen
Se ha descubierto que el salidrósido (Sal), un ingrediente activo de Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba, ejerce efectos protectores mitocondriales al mejorar el metabolismo y aumentar el suministro de energía de las células cerebrales en condiciones hipóxicas. Sin embargo, su mecanismo de acción no ha sido completamente aclarado. En el presente estudio, se empleó por primera vez la cromatografía líquida de alta resolución para analizar los efectos del Sal en los niveles de nucleótidos (ATP, ADP y AMP). A continuación, se eligió el ensayo de desplazamiento térmico celular (CETSA), un método de interacción molecular ampliamente utilizado para validar y cuantificar la participación de dianas farmacológicas en células y tejidos de diferentes especies, para confirmar la afinidad de Sal por las proteínas relacionadas con la vía AMPK/Sirt1/HIF-1α. Los resultados revelaron que Sal aumentó los niveles de ATP y ADP en las células HT22 hipóxicas, al tiempo que redujo los niveles de AMP. Además, Sal exhibió una unión estable a las proteínas AMPKα, p-AMPKα, Sirt1 y HIF-1α. En conclusión, Sal puede ejercer efectos protectores mitocondriales al modular la vía AMPK/Sirt1/HIF-1α para regular el contenido de nucleótidos. Este estudio proporciona una referencia metodológica para el análisis del contenido de nucleótidos en muestras celulares y contribuye a la identificación y descubrimiento de objetivos para compuestos derivados de la medicina tradicional china.
Introducción
El cerebro es muy sensible al oxígeno debido a sus altas demandas metabólicas, su limitada capacidad glucolítica y su dependencia de la fosforilación oxidativa. Como resultado, la exposición a un ambiente con poco oxígeno a grandes altitudes puede conducir fácilmente a una lesión cerebral hipóxica hipobárica (HHBI)1,2. Los estudios epidemiológicos indican que cuando los individuos no aclimatados a las grandes altitudes ascienden rápidamente a las regiones de gran altitud, la incidencia del mal agudo de montaña puede alcanzar hasta el 75%, con una tasa de mortalidad de aproximadamente el 1% para los casos graves. Además, en ausencia de atención médica, las tasas de mortalidad por edema cerebral o pulmonar a gran altitud pueden ser tan altas como el 40%3,4.
El HHBI se presenta con un amplio espectro de síntomas clínicos. Los casos leves a moderados pueden incluir dolores de cabeza, mareos y pérdida de memoria5, mientras que los casos graves pueden provocar deterioro cognitivo, alteración de la conciencia y resultados potencialmente fatales5. La prevención y el tratamiento del HHBI en las regiones de gran altitud se han convertido en un foco clave de la investigación médica. Las estrategias preventivas implican principalmente el entrenamiento adaptativo en entornos de gran altitud, incluyendo un descanso adecuado, una dieta bien balanceada, una nutrición adecuada y un ejercicio físico adecuado 6,7. Además, las intervenciones farmacológicas destinadas a proteger las células cerebrales y aliviar la hipoxia cerebral siguen siendo fundamentales para la investigación actual de la HHBI.
Las mitocondrias sirven como los principales centros de producción de energía dentro de las células, sintetizando trifosfato de adenosina (ATP) para satisfacer las demandas de energía celular. En condiciones hipóxicas, la producción de energía mitocondrial disminuye, lo que lleva a una reducción de los niveles de ATP y a un deterioro de la función celular. La lesión hipóxica también altera la regulación mitocondrial del Ca2+ y la homeostasis del pH, desencadenando la apoptosis y la necrosis 9,10. Existe una relación que se refuerza mutuamente entre la disfunción mitocondrial y la lesión cerebral hipóxica. Por un lado, el deterioro mitocondrial inducido por la hipoxia exacerba la deficiencia de oxígeno al reducir aún más el metabolismo energético celular, creando un círculo vicioso. Por otro lado, la disfunción mitocondrial eleva los niveles intracelulares de Ca2+, activando cascadas apoptóticas y conduciendo a la muerte celular11. Aunque los mecanismos subyacentes a la lesión cerebral hipóxica siguen siendo complejos y no se comprenden completamente, múltiples estudios han identificado el deterioro del metabolismo energético neuronal mitocondrial como un factor crítico en su patogénesis12,13. Por lo tanto, una mayor exploración de la función mitocondrial puede proporcionar información valiosa sobre posibles objetivos terapéuticos para la lesión cerebral hipóxica.
El salidrósido (Sal) es un ingrediente activo extraído de la planta de meseta, Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba, y es ampliamente utilizado en alimentos, productos de salud y productos farmacéuticos14. La fórmula molecular de Sal es C14H20O7, y también se conoce como 2-(4-hidroxifenil)-etilo β-D-glucopiranósido. Posee diversas propiedades farmacológicas, entre las que se destacan efectos antihipoxia, antioxidante, antifatiga, antitumoral, inmunomodulador, antiinflamatorio y protector cardiovascular y cerebrovascular 15,16,17. Entre estos, su efecto antihipoxia es uno de los mejor documentados. Estudios recientes han destacado cada vez más los importantes efectos protectores mitocondriales del Sal como un mecanismo potencial para sus efectos preventivos y terapéuticos sobre la lesión cerebral inducida por meseta en ratones14,18. Sin embargo, los mecanismos moleculares precisos por los cuales el Sal influye en los niveles de ATP, ADP y AMP siguen siendo poco conocidos.
La proteína quinasa activada por AMP (AMPK) actúa como un sensor de energía clave que ayuda a mantener la homeostasis de la energía celular. La activación de la AMPK estimula la sirtuina 1 (Sirt1), lo que conduce a un aumento de los niveles intracelulares de NAD+ 19. Los estudios han demostrado que Sirt1 puede regular el factor 1-alfa inducible por hipoxia (HIF-1α) para coordinar la respuesta celular a la hipoxia20. Investigaciones anteriores han demostrado que Sal inhibe la apertura del poro de transición de permeabilidad mitocondrial neuronal, regula los procesos de energía mitocondrial mediados por HIF-1α, atenúa la apoptosis neuronal y mantiene la integridad de la barrera hematoencefálica, protegiendo así a las ratas de la lesión cerebral inducida por la meseta14,21. Sin embargo, el efecto del Sal sobre el ATP y sus metabolitos, ADP y AMP, sigue siendo incierto.
Para investigar esto, primero se empleó la cromatografía líquida de alta resolución (HPLC) para cuantificar los niveles de estos tres nucleótidos. Además, se utilizó el ensayo de desplazamiento térmico celular (CETSA), una técnica biofísica ampliamente utilizada e introducida en 2013 para estudiar las interacciones ligando-proteína en células intactas22. Este método se aplica comúnmente para validar y cuantificar la participación de fármacos y dianas en células y tejidos de diferentes especies. Específicamente, después de co-incubar lisados de células diana con el fármaco a temperaturas variables durante un período determinado, la proteína unida al fármaco exhibe una mayor estabilidad térmica, lo que la hace menos propensa a la desnaturalización y la precipitación. A continuación, las proteínas precipitadas no unidas se eliminan mediante centrifugación, y las interacciones entre el fármaco y el objetivo se identifican posteriormente mediante el análisis de Western blot del sobrenadante22. Para identificar posibles dianas moleculares de Sal, se seleccionó CETSA para evaluar su afinidad de unión con las proteínas relacionadas con la vía AMPK/Sirt1/HIF-1α.
Protocolo
Los detalles comerciales de los reactivos y el equipo utilizado en este estudio se proporcionan en la Tabla de Materiales.
1. Preparación de la solución
- Prepare el medio Eagle modificado de Dulbecco (DMEM) añadiendo un 10% de suero fetal bovino y un 1% de penicilina-estreptomicina.
- Prepare una solución de 20 mM de sal disolviendo 3 mg de sal en 500 μl de solución salina tamponada con fosfato (PBS)21.
- Filtre 500 mL de acetonitrilo cromatográficamente puro (fase móvil A) utilizando una membrana orgánica de 0,45 μm.
- Prepare 1000 mL de fase móvil B añadiendo 3,5 mL de reactivo I a 1 L de agua desionizada. Ajuste el pH a 6,15 con el reactivo II, siguiendo las instrucciones del kit de ensayo de contenido de nucleótidos (ATP, ADP y AMP) (consulte la tabla de materiales).
NOTA: Los reactivos I y II están incluidos en el kit de ensayo de contenido de nucleótidos (ATP, ADP y AMP). - Filtre la fase móvil B con una membrana acuosa de 0,22 μm.
NOTA: La fase móvil B debe usarse inmediatamente después de la preparación. Las fases móviles A y B deben sonicarse durante 30 minutos antes de su uso para eliminar las burbujas de aire. - Diluya una solución madre estándar de ATP, ADP y AMP de 1 μM con agua desionizada para obtener soluciones estándar de las series ATP, ADP y AMP de 0,5 μM, 0,1 μM, 0,05 μM, 0,01 μM y 0,005 μM de ATP, ADP y AMP.
- Filtre la serie de soluciones estándar utilizando una membrana filtrante microporosa tipo aguja de 0,22 μm.
NOTA: Se deben usar frascos de inyección marrones para almacenar las soluciones estándar en serie. La serie preparada de soluciones estándar debe utilizarse lo antes posible.
2. Cultivo celular
NOTA: El cultivo celular HT22 y el modelo de hipoxia estimulada por CoCl2 se establecieron de acuerdo con un informe previo21.
- Cultivo de células HT22 a 37 °C con 5% de CO2 hasta alcanzar una confluencia del 80% en la placa de Petri. Digiere las células con tripsina al 0,25% durante 1 min.
- Siembre 2 × 105 células del paso 2.1 en placas de 6 pocillos con DMEM completo (grupo de control sin tratamiento farmacológico) o DMEM completo que contenga el fármaco (250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal y 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). Incubar durante 24 h a 37 °C con 5% de CO2.
NOTA: Se establecieron tres muestras paralelas en cada grupo.
3. Ensayo de contenido de nucleótidos (ATP, ADP y AMP)
- Agregue 1 mL de reactivo de extracción I a cada pocillo en las placas de 6 pocillos del paso 2.2.
NOTA: El reactivo de extracción I está incluido en el kit de ensayo de contenido de nucleótidos (ATP, ADP y AMP) (consulte la tabla de materiales). - Lisar las células sonicándolas en un baño de hielo utilizando un aparato ultrasónico de disrupción celular (potencia: 300 W, ondas ultrasónicas durante 3 s, intervalo de 7 s, tiempo total: 3 min).
- Centrifugar las células lisadas a 10.304 × g durante 10 min a 4 °C utilizando una centrífuga refrigerada de alta velocidad.
- Transfiera 0,75 mL de sobrenadante del paso 3.3 a un tubo de 2,0 mL. Añadir 0,75 mL de reactivo de extracción II, agitar y mezclar con un mezclador de vórtice y centrifugar de nuevo a 10.304 × g durante 10 min a 4 °C.
NOTA: El reactivo de extracción II está incluido en el kit de ensayo de contenido de nucleótidos (ATP, ADP y AMP). - Pipetear el sobrenadante del paso 3.4 y filtrarlo con una membrana filtrante microporosa de tipo aguja de 0,22 μm en un vial marrón.
NOTA: ATP, ADP y AMP en la muestra extraída no son estables. Todos los procedimientos experimentales deben realizarse a bajas temperaturas o sobre hielo. Las muestras deben procesarse y analizarse lo antes posible. - Abra el software de cromatografía y configure los siguientes parámetros: volumen de inyección: 10 μL; temperatura de la columna: 27 °C; caudal: 0,8 mL/min; longitud de onda de detección: 254 nm; Duración de la detección: 70 min. Ajuste el procedimiento de elución en gradiente de acuerdo con la Tabla 1.
- Haga clic en el botón ejecutar para inyectar automáticamente la muestra y detectar el contenido de ATP, ADP y AMP en soluciones estándar en serie (paso 1.7) y soluciones de muestra (paso 3.5) de acuerdo con el programa establecido en el paso 3.6.
NOTA: Al final del experimento, lave la columna cromatográfica con un 98% de fase móvil B para evitar obstrucciones. - Traza las curvas estándar de ATP, ADP y AMP utilizando software de análisis estadístico y gráficos, con concentraciones estándar en serie en el eje x y áreas de pico en el eje y.
- Calcule el contenido de ATP, ADP y AMP en las muestras utilizando la ecuación de la curva estándar del paso 3.8.
4. Ensayo de desplazamiento térmico celular (CETSA)
- Lisar células HT22 normales durante 20 minutos en una placa de Petri utilizando lisado que contenga inhibidores de la proteasa (lisado: inhibidor de la proteasa = 100:1) pipeteando repetidamente las células.
NOTA: Realice este paso en un baño de hielo para evitar la degradación de proteínas. - Recoja el lisado celular del paso 4.1 y sonique en un baño de hielo utilizando un aparato ultrasónico de disrupción celular (potencia: 300 W, ondas ultrasónicas durante 3 s, intervalo de 7 s, tiempo total: 3 min). Centrifugar a 10.304 × g, 4 °C durante 20 min y recoger el sobrenadante.
NOTA: Divida el sobrenadante en 14 porciones: 7 grupos para coincubación con Sal y 7 grupos para coincubación con PBS como control. Para el grupo tratado con sal, añadir 100 μL de sobrenadante y 0,1 μL de 20 μM de sal por muestra. Para el grupo de control, añadir 100 μL de sobrenadante y 0,1 μL de PBS por muestra. - Incubar cada muestra a temperatura ambiente durante 30 minutos, luego incubar a 37 °C, 42 °C, 47 °C, 52 °C, 57 °C, 62 °C y 67 °C durante 3 minutos utilizando un instrumento de control de temperatura de calentamiento de metal.
- Centrifugar las muestras del paso 4.3 a 10.304 × g durante 20 min a 4 °C y recoger el sobrenadante con una pipeta.
- Mida la concentración total de proteínas del sobrenadante a partir del paso 4.4 utilizando un kit de ensayo de concentración de proteínas BCA, siguiendo las instrucciones del fabricante (consulte la Tabla de materiales).
- Prepare el gel de separación al 10% con un kit de preparación rápida de gel PAGE, siguiendo las instrucciones del fabricante (consulte la tabla de materiales).
- Cargue 3 μL de marcador de proteína de color previamente teñido y 14 μL de muestras en los pocillos del gel de separación (cantidad final de proteína por pocillo: 20 μg).
- Ejecute el gel con tampón de electroforesis durante 1 h a 80-100 mV para obtener proteínas separadas.
- Transfiera las proteínas del paso 4.8 a una membrana de PVDF utilizando una solución de transferencia rápida de membrana y una estructura sándwich (algodón-papel de filtro-membrana de PVDF-gel de proteínas-papel de filtro de algodón) a 400 mA durante 30 min.
- Bloquee las membranas de PVDF del paso 4.9 con una solución de albúmina sérica bovina (BSA) al 5% durante 1-2 h a temperatura ambiente.
NOTA: Prepare la solución de BSA al 5% disolviendo 5 mg de polvo de BSA en 100 ml de solución de TBST que contenga 100 ml de tampón TBS y 0,05% de Tween 20. - Incubar las membranas de PVDF del paso 4.10 con 5 mL de anticuerpo primario diluido a 4 °C durante la noche.
NOTA: Diluya el anticuerpo primario en la solución BSA (proporción 1:1000). - Lave las membranas de PVDF tres veces con TBST durante 5 minutos cada una para eliminar los anticuerpos primarios no unidos.
- Incubar las membranas del paso 4.12 con anticuerpo secundario acoplado a peroxidasa de rábano picante diluido (HRP) durante 2 h a temperatura ambiente en un agitador de decoloración.
NOTA: Diluir el anticuerpo secundario acoplado a HRP en una solución de BSA (proporción 1:10.000). - Lave las membranas tres veces con TBST durante 5 minutos cada una para eliminar el anticuerpo secundario residual.
- Cubra las membranas del paso 4.14 con un revelador de quimioluminiscencia ECL y, a continuación, obtenga una imagen de la señal de la proteína objetivo mediante un sistema de imágenes.
NOTA: Realice este paso en la oscuridad para evitar el apagado de la fluorescencia. - Analice y cuantifique el valor de gris de las proteínas diana utilizando el software ImageJ (véase T able of Materials).
Resultados
Las curvas estándar para ATP, ADP y AMP detectadas por HPLC fueron Y = 7006.5X - 222.99, Y = 5217.3X - 17.796 e Y = 9280.1X + 22.749, respectivamente (Figura 1A-C). Los contenidos de nucleótidos medidos en cada grupo por HPLC se calcularon utilizando las curvas estándar (Figura 1D-I). Se encontró que CoCl2 redujo significativamente los niveles de ATP y ADP en las células HT22 en comparación con el grupo control (P < 0.01, Figura 1J,K). Además, la administración de dorsomorfina (Dor), un inhibidor de la AMPK, condujo a una marcada reducción de los niveles de ATP y ADP en comparación con el grupo tratado con CoCl2 (P < 0,01, Figura 1J,K). Sin embargo, el tratamiento con Sal aumentó significativamente los niveles de ATP y ADP en relación con el grupo tratado con CoCl2 (P < 0,05, Figura 1J,K).
Un análisis posterior reveló que los niveles de AMP aumentaron significativamente en el grupo tratado con CoCl2, mientras que el tratamiento con Sal limitó eficazmente este aumento (P < 0,01, Figura 1L). La función mitocondrial adecuada es esencial para mantener la homeostasis intracelular de ATP, ADP y AMP, así como las funciones fisiológicas celulares normales. El estado funcional de las mitocondrias influye directamente en la tasa de conversión y el equilibrio de ATP, ADP y AMP. El daño o la disfunción mitocondrial pueden afectar la síntesis de ATP y reducir las tasas de conversión de ADP y AMP, interrumpiendo así el suministro de energía celular y el equilibrio metabólico.
Estos hallazgos sugieren que Sal puede aliviar la lesión hipóxica en las células HT22 mediante la modulación de la conversión de ATP, ADP y AMP. Además, el análisis de CETSA de la unión de Sal a las proteínas asociadas a las mitocondrias demostró un aumento en la estabilidad térmica de AMPKα, p-AMPKα, Sirt1 y HIF-1α después del tratamiento con Sal. Esto sugiere que el Sal puede interactuar con estas proteínas (Figura 2), lo que concuerda con los hallazgos de estudios previos 21,23,24.
DISPONIBILIDAD DE DATOS:
Se proporcionan todos los datos brutos (Fichero Complementario 1 y Fichero Complementario 2).

Figura 1: Efecto del Sal en el contenido de nucleótidos (ATP, ADP y AMP). (A-C) Curvas estándar para ATP (A), ADP (B) y AMP (C). (D-I) Curvas representativas de HPLC para la determinación del contenido de ATP, ADP y AMP en diferentes grupos de tratamiento. (J-L) Análisis estadístico del contenido de ATP, ADP y AMP en diferentes grupos de tratamiento (control, 250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal y 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). (n = 3, *P < 0,05, **P < 0,01). Haga clic aquí para ver una versión más grande de esta figura.
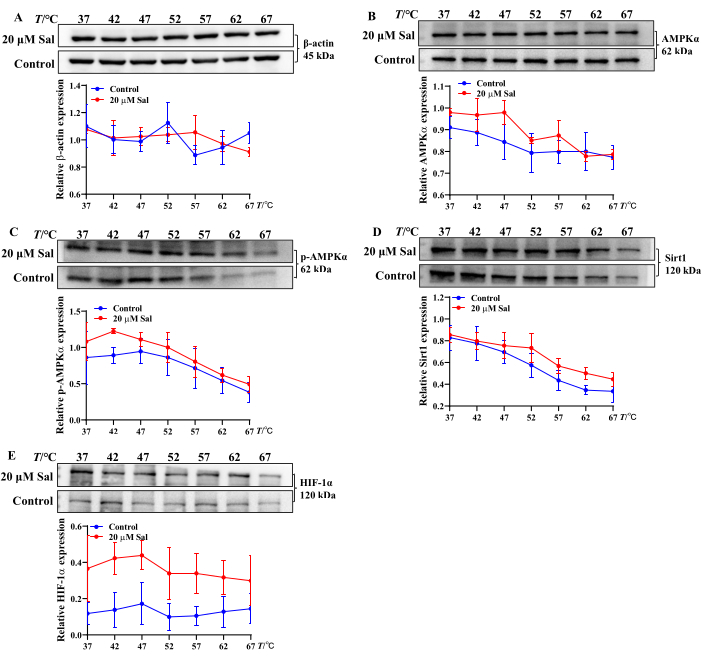
Figura 2: Evaluación de las propiedades de unión de Sal a las proteínas asociadas a la vía AMPK/Sirt1/HIF-1α utilizando el método CETSA Las bandas de proteínas β-Actina (A), AMPKα (B), p-AMPKα (C), Sirt1 (D) y HIF-1α (E) y las tendencias de expresión en células HT22 fueron evaluadas por CETSA (n = 3). Las propiedades de unión de Sal con diferentes proteínas se analizaron utilizando software estadístico y gráfico a diferentes temperaturas. Haga clic aquí para ver una versión más grande de esta figura.
| Tiempo (min) | Fase móvil | |
| Disolvente A | Disolvente B | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
Tabla 1: Procedimiento de elución de fase móvil.
Fichero complementario 1: Datos brutos para la detección de ATP, ADP y AMP por HPLC. Haga clic aquí para descargar este archivo.
Ficha complementaria 2: Bandas proteicas CETSA. Haga clic aquí para descargar este archivo.
Discusión
Las mitocondrias son orgánulos clave implicados en la prevención terapéutica del HHBI 23,24,25. Estudios previos del grupo han confirmado que Sal regula la expresión de las proteínas AMPK, Sirt1 y HIF-1α, mejorando la función mitocondrial neuronal y protegiendo contra el HHBI21,24. Sin embargo, el efecto directo de la sal sobre los nucleótidos en las células hipóxicas requiere más investigación. Además, la evaluación del potencial de unión de compuestos y proteínas en condiciones de temperatura variables es esencial para comprender sus interacciones.
Para abordar estos aspectos, el presente estudio examinó el efecto de Sal en los niveles mitocondriales de ATP, ADP y AMP en células HT22 mediante HPLC, proporcionando información directa sobre su papel en el metabolismo energético mitocondrial. Sobre la base de un estudio previo18, se seleccionaron 250 μM de CoCl2 para inducir hipoxia en las células HT22. Los resultados demostraron que Sal aumentó significativamente los niveles de ATP y ADP al tiempo que redujo el contenido de AMP en las células HT22 hipóxicas (Figura 1). Combinados con los hallazgos previos del grupo, estos resultados confirman aún más que la Sal ejerce un efecto protector sobre las mitocondrias en las neuronas hipóxicas.
La AMPK es una proteína quinasa altamente conservada en eucariotas que regula el metabolismo energético. Detecta cambios en los niveles celulares de ATP, ADP y AMP para coordinar el metabolismo de la glucosa, la síntesis de ácidos grasos y la biogénesis mitocondrial mediante la fosforilaciónde varios sustratos. La activación de la AMPK promueve la producción de energía y suprime el gasto energético, especialmente en respuesta a la reducción de los niveles de ATP intracelular y a los niveles elevados de AMP27. Además, la AMPK aumenta las reservas de ATP mediante la fosforilación de la glucoamilasa, la alteración de la catálisis enzimática y la generación rápida de ATP a partir del pool de fosforginina-arginina28.
En el presente estudio, se utilizó Dor, un inhibidor selectivo de AMPK fosforilado, para investigar los efectos de Sal sobre los niveles de nucleótidos29. La HPLC se empleó para cuantificar los niveles de ATP, ADP y AMP en células HT22 tratadas con CoCl2 expuestas a Dor solo o en combinación con Sal. Los hallazgos indican que el Sal modula la relación ATP/ADP/AMP, ejerciendo así efectos neuroprotectores frente a la hipoxia (Figura 1). El método de HPLC establecido proporciona un enfoque intuitivo, simple y eficiente para evaluar directamente los efectos de los compuestos bioactivos en los nucleótidos a nivel celular.
HIF-1α es un factor de transcripción activado en respuesta a la estimulación hipóxica. En condiciones hipóxicas, la estabilidad de HIF-1α aumenta significativamente, lo que le permite translocarse desde el citoplasma al núcleo, donde forma un heterodímero con HIF-1β30. Este proceso promueve la expresión de genes involucrados en la angiogénesis, el metabolismo de la glucosa y la glucólisis 31,32,33. Además, se ha demostrado que la estabilidad de HIF-1α está altamente correlacionada con la función mitocondrial y los niveles intracelulares deO2 durante la fosforilación oxidativa31. Sin embargo, la disfunción mitocondrial inducida por hipoxia conduce a un suministro insuficiente de energía intracelular, que a su vez activa la vía HIF-1α para regular la adaptación celular a la hipoxia31,32.
Sirt1, miembro de la familia Sirtuin, es una desacetilasa dependiente de NAD+ que reduce la estabilidad de la proteína HIF-1α por desacetilación, limitando así su acumulación nuclear32. En condiciones hipóxicas, la disminución de los niveles intracelulares de ATP conduce a un aumento de la actividad de AMPK, que influye en el transporte intracelular, la estabilidad y la actividad transcripcional de HIF-1α y sus proteínas asociadas a través de la fosforilación 31,32,33. Además, Sirt1 y AMPK modulan la interacción entre HIF-1α y los coactivadores, regulando así su actividad transcripcional y facilitando aún más la adaptación celular a la hipoxia33. En las células cerebrales lesionadas por hipoxia, AMPK, Sirt1 y HIF-1α interactúan para mantener la homeostasis de la energía intracelular y regular los procesos metabólicos.
Los métodos simples y eficientes para evaluar la termoestabilidad y el potencial de unión de complejos compuestos-proteínas in vitro incluyen técnicas que evalúan la estabilidad de las proteínas tras la unión del ligando. Está bien establecido que las interacciones compuesto-proteína aumentan la termoestabilidad de las proteínas, haciéndolas menos sensibles a la desnaturalización inducida por la temperatura y dando como resultado un rendimiento proteico relativamente estable. El ensayo de desplazamiento térmico celular (CETSA) combinado con el análisis de Western blot, aunque no revela el sitio de unión exacto, proporciona un enfoque eficiente y de bajo costo para estudiar las interacciones entre el fármaco y el objetivo y los posibles efectos fuera del objetivo22,34. CETSA se utiliza ampliamente para validar y cuantificar la participación de fármacos diana en células y tejidos de diferentes especies.
En este estudio, se empleó CETSA para evaluar si Sal interactúa con AMPKα, p-AMPKα, Sirt1 y HIF-1α a nivel celular. Después del tratamiento térmico, Sal aumentó la expresión de estas proteínas, lo que sugiere la formación de complejos estables Sal-AMPKα, Sal-p-AMPKα, Sal-Sirt1 y Sal-HIF-1α (Figura 2). Estos hallazgos se alinean con resultados experimentales previos21,24. Por lo tanto, el Western blot de CETSA sirve como un enfoque sólido y eficiente para el cribado a gran escala de las interacciones compuesto-proteína y la termoestabilidad in vitro.
A pesar de los conocimientos adquiridos sobre los mecanismos protectores de la sal en el metabolismo energético mitocondrial utilizando técnicas de HPLC y CETSA, siguen existiendo ciertas limitaciones. CETSA no proporciona información a nivel de aminoácidos sobre cómo los compuestos influyen en la termoestabilidad de las proteínas. Un avance potencial sería la integración de CETSA con tecnologías de imagen para identificar visualmente los sitios de unión a compuestos dentro de las proteínas, ofreciendo una comprensión más clara de cómo los complejos de compuestos y proteínas resisten la desnaturalización inducida por el calor. Lograr esto requiere más innovación científica y un diseño experimental refinado. Además, complementar CETSA con otras técnicas de interacción molecular, como la resonancia de plasmones de superficie localizada y la fluorimetría diferencial de barrido, proporcionaría un análisis más completo de las interacciones compuesto-proteína35.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (82274207 y 82474185), el Departamento de Ciencia y Tecnología de la provincia de Sichuan (2024NSFSC1845), la Fundación de Ciencias para Jóvenes del Departamento de Ciencia y Tecnología de la provincia de Sichuan (2023NSFSC1776), el Programa Clave de Investigación y Desarrollo de Ningxia (2023BEG02012), el Proyecto de Apoyo al Talento Juvenil de la Asociación China de Medicina China para 2024-2026 (2024-QNRC2-B07) y el Xinglin Scholar Research Proyecto de Promoción de la Universidad de Chengdu de TCM (XKTD2022013 y QJJJ2024027).
CONTRIBUCIÓN DEL AUTOR:
Xiaobo Wang, Yating Zhang, Ya Hou, Rui Li y Xianli Meng concibieron este proyecto. Yating Zhang, Ya Hou y Tingting Kuang realizaron los experimentos y analizaron los datos. Yating Zhang y Hong Jiang escribieron el manuscrito. Xiaobo Wang y Xianli Meng revisaron el manuscrito. Todos los autores han leído y aprobado el manuscrito final.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
Referencias
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108(2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532(2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77(2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094(2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146(2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762(2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568(2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404(2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529(2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617(2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278(2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843(2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82(2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318(2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858(2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182(2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127(2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287(2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados