Research Article
低酸素HT22細胞におけるAMPK/Sirt1/HIF-1α経路 を介した サリドロシドのミトコンドリア保護に関するメカニズムの洞察
要約
本研究は、サリドロシドがAMPK/Sirt1/HIF-1α経路を介して、部分的に低酸素HT22細胞に対してミトコンドリア保護効果を発揮するユニークなメカニズムを同定した。
要約
Rhodiola crenulata (Hook. f. et Thoms.) H. Ohbaの有効成分であるサリドロシド(Sal)は、低酸素条件下での脳細胞の代謝改善とエネルギー供給の増強により、ミトコンドリア保護効果を発揮することがわかっています。しかし、その作用機序は完全には解明されていません。本研究では、塩基(ATP、ADP、AMP)レベルに対するSalの影響を分析するために、最初に高速液体クロマトグラフィーが採用されました。次に、異なる種にわたる細胞および組織における薬物標的の関与を検証および定量化するために広く使用されている分子間相互作用法である細胞熱シフトアッセイ(CETSA)を選択し、AMPK/Sirt1/HIF-1α経路関連タンパク質に対するSalの親和性を確認しました。その結果、Salは低酸素HT22細胞のATPおよびADPレベルを増加させ、AMPレベルを低下させることが明らかになりました。さらに、SalはAMPKα、p-AMPKα、Sirt1、およびHIF-1αタンパク質に安定して結合することを示しました。結論として、SalはAMPK/Sirt1/HIF-1α経路を調節してヌクレオチド含量を調節することにより、ミトコンドリア保護効果を発揮する可能性があります。この研究は、細胞サンプル中のヌクレオチド含有量分析の方法論的参照を提供し、伝統的な漢方薬に由来する化合物の標的の同定と発見に貢献します。
概要
脳は、その高い代謝要求、限られた解糖能力、および酸化的リン酸化への依存性のために、酸素に対して非常に敏感です。その結果、高地で低酸素環境にさらされると、低気圧低酸素性脳損傷(HHBI)1,2を容易に引き起こす可能性があります。疫学研究によると、高地に慣れていない個人が高地に急速に上昇すると、急性高山病の発生率は最大75%に達し、重症の場合の致死率は約1%になることが示されています。さらに、医療がない場合、高地の脳または肺水腫の死亡率は40%にもなる可能性があります3,4。
HHBIは、幅広い臨床症状を呈します。軽度から中等度の症例には、頭痛、めまい、記憶喪失などが含まれます5、重症の場合は認知障害、意識の変化、および潜在的に致命的な結果をもたらす可能性があります5。高地地域におけるHHBIの予防と治療は、医学研究の重要な焦点となっています。予防戦略には、主に高地環境での適応トレーニングが含まれ、これには十分な休息、バランスの取れた食事、適切な栄養、適切な運動が含まれます6,7。さらに、脳細胞を保護し、脳低酸素症を緩和することを目的とした薬理学的介入は、現在のHHBI研究の中心であり続けています。
ミトコンドリアは、細胞内の主要なエネルギー生産センターとして機能し、アデノシン三リン酸(ATP)を合成して細胞のエネルギー需要を満たします。低酸素条件下では、ミトコンドリアのエネルギー産生が減少し、ATPレベルの低下と細胞機能の障害につながります8。低酸素損傷はまた、Ca2+およびpH恒常性のミトコンドリア調節を妨害し、アポトーシスおよび壊死を引き起こす9,10。ミトコンドリアの機能障害と低酸素性脳損傷との間には、相互に補強し合う関係があります。一方では、低酸素症によるミトコンドリアの障害は、細胞のエネルギー代謝をさらに低下させることで酸素欠乏を悪化させ、悪循環を引き起こします。一方、ミトコンドリアの機能障害は細胞内Ca2+レベルを上昇させ、アポトーシスカスケードを活性化して細胞死を引き起こします11。低酸素性脳損傷の根底にあるメカニズムは依然として複雑で、完全には理解されていませんが、複数の研究により、ニューロンのミトコンドリアエネルギー代謝の障害がその病因の重要な要因として特定されています12,13。したがって、ミトコンドリア機能のさらなる調査は、低酸素性脳損傷の潜在的な治療標的に関する貴重な洞察を提供する可能性があります。
サリドロシド(Sal)は、高原植物Rhodiola crenulata(Hook.f.et Thoms.)H.Ohbaから抽出された有効成分であり、食品健康製品や医薬品に広く使用されています14。Salの分子式はC14H20O7であり、2-(4-ヒドロキシフェニル)-エチルβ-D-グルコピラノシドとしても知られています。それは、抗低酸素症、抗酸化剤、抗疲労剤、抗腫瘍剤、免疫調節剤、抗炎症剤、ならびに心血管および脳血管保護作用15,16,17を含む多様な薬理学的特性を有する。これらの中で、その抗低酸素効果は最もよく文書化されたものの1つです。最近の研究では、マウスのプラトー誘発性脳損傷に対するその予防的および治療的効果の潜在的なメカニズムとして、Salの有意なミトコンドリア保護効果がますます強調されています14,18。しかし、SalがATP、ADP、およびAMPレベルに影響を与える正確な分子メカニズムは、まだ十分に理解されていません。
AMP活性化プロテインキナーゼ(AMPK)は、細胞のエネルギー恒常性を維持するための重要なエネルギーセンサーとして機能します。AMPKの活性化はSirtuin 1(Sirt1)を刺激し、細胞内NAD+レベル19の増加につながります。研究によると、Sirt1は低酸素誘導因子1-α(HIF-1α)を調節して、低酸素20に対する細胞応答を調整できることが示されています。これまでの研究で、Salがニューロンのミトコンドリア透過性遷移孔の開口部を阻害し、HIF-1αを介したミトコンドリアのエネルギープロセスを調節し、ニューロンのアポトーシスを弱め、血液脳関門の完全性を維持し、それによってラットをプラトー誘発性脳損傷から保護することが実証されています14,21。しかし、ATPとその代謝産物であるADPおよびAMPに対するSalの影響は依然として不明です。
これを調べるために、まず高速液体クロマトグラフィー(HPLC)を使用して、これら3つのヌクレオチドのレベルを定量化しました。さらに、2013年に導入された生物物理学的手法で、無傷の細胞におけるリガンド-タンパク質相互作用を研究するために広く用いられている細胞熱シフトアッセイ(CETSA)が利用されました22。この方法は、通常、異なる種にわたる細胞や組織における薬物標的の関与を検証および定量化するために適用されます。具体的には、標的細胞ライセートを薬物とさまざまな温度で一定時間共インキュベートした後、薬物結合タンパク質は熱安定性が向上し、変性や沈殿しにくくなります。次いで、沈殿した未結合タンパク質を遠心分離 により 除去し、続いて上清22のウェスタンブロット分析を通じて薬物-標的相互作用を同定する。Salの潜在的な分子標的を特定するために、CETSAを選択し、AMPK/Sirt1/HIF-1α経路関連タンパク質との結合親和性を評価しました。
プロトコル
この研究で使用された試薬と機器の商業的な詳細は、 資料表に記載されています。
1. 溶液の調製
- 10%の胎児のウシ血清と1%のペニシリン-ストレプトマイシンを添加することにより、完全なダルベッコの修飾イーグル培地(DMEM)を準備します。
- 3mgのSalを500μLのリン酸緩衝生理食塩水(PBS)21に溶解することにより、20mMのSal溶液を調製する。
- 0.45 μm の有機メンブレンを使用して、クロマトグラフィーで純粋なアセトニトリル 500 mL (移動相 A) をろ過します。
- 1 L の脱イオン水に 3.5 mL の試薬 I を添加して、1000 mL の移動相 B を調製します。ヌクレオチド(ATP、ADP、AMP)含有量アッセイキットの指示に従って、試薬IIでpHを6.15に調整します( 材料の表を参照)。
注:試薬Iと試薬IIは、ヌクレオチド(ATP、ADP、およびAMP)含有量アッセイキットに含まれています。 - 移動相 B を 0.22 μm 水膜でろ過します。
注:移動相Bは、調製後すぐに使用する必要があります。移動相AおよびBは、気泡を除去するために使用前に30分間超音波処理する必要があります。 - 1 μM ATP、ADP、および AMP 標準ストック溶液を脱イオン水で希釈すると、0.5 μM、0.1 μM、0.05 μM、0.01 μM、および 0.005 μM ATP、ADP、および AMP シリーズの標準溶液が得られます。
- 0.22μmの針型微多孔質フィルターメンブレンを使用して、一連の標準溶液をろ過します。
注:茶色の注射ボトルは、シリアル標準溶液の保管に使用する必要があります。調製した一連の標準溶液は、できるだけ早く使用する必要があります。
2. 細胞培養
注:HT22細胞培養およびCoCl2刺激低酸素モデルは、以前の報告21に従って確立された。
- HT22細胞を5%のCO2 で37°Cで、ペトリ皿内で80%のコンフルエントに達するまで培養します。0.25%トリプシンで細胞を1分間消化します。
- ステップ 2.1 の 2 × 105 細胞を、完全な DMEM (薬物処理なしの対照群) または薬物を含む完全な DMEM (250 μM CoCl2、250 μM CoCl2 + 10 μM Dor、250 μM CoCl2 + 20 μM Sal、および 250 μM CoCl2 + 10 μM Dor + 20 μM Sal) を充填した 6 ウェルプレートに播種します。5% CO2 で 37 °C で 24 時間インキュベートします。
注:各グループに3つの並列サンプルを設定しました。
3. ヌクレオチド(ATP、ADP、AMP)含量測定法
- ステップ 2.2 の 6 ウェルプレートの各ウェルに 1 mL の抽出試薬 I を添加します。
注:抽出試薬Iは、ヌクレオチド(ATP、ADP、およびAMP)含有量アッセイキットに含まれています( 材料の表を参照)。 - 超音波細胞破壊装置(電力:300W、超音波3秒、7秒間隔、合計時間:3分)を使用して氷浴で超音波処理することにより、細胞を溶解する。
- 高速冷蔵遠心分離機を使用して、溶解した細胞を10,304 × g で4°Cで10分間遠心分離します。
- ステップ3.3の上清0.75mLを2.0mLチューブに移します。0.75 mLの抽出試薬IIを添加し、ボルテックスミキサーを用いて振とう混合し、再度10,304 × g で4°Cで10分間遠心分離します。
注:抽出試薬IIは、ヌクレオチド(ATP、ADP、およびAMP)含有量アッセイキットに含まれています。 - ステップ3.4から上清をピペットで移動し、0.22 μmの針型微多孔質フィルターメンブレンを使用して茶色のバイアルにろ過します。
注:抽出されたサンプル中のATP、ADP、およびAMPは安定していません。すべての実験手順は、低温または氷上で実行する必要があります。サンプルはできるだけ早く処理およびテストする必要があります。 - クロマトグラフィーソフトウェアを開き、次のパラメータを設定します:注入量:10μL;カラム温度:27°C;流速:0.8mL/分;検出波長:254 nm;検出時間:70分グラジエント溶出手順は 、表1に従って設定します。
- 実行ボタンをクリックすると、ステップ3.6で設定したプログラムに従って、サンプルが自動的に注入され、シリアルスタンダード溶液(ステップ1.7)およびサンプル溶液(ステップ3.5)のATP、ADP、およびAMPの含有量が検出されます。
注:実験の最後に、クロマトグラフィーカラムを98%移動相Bで洗浄し、目詰まりを防ぎます。 - グラフ作成および統計解析ソフトウェアを使用して、ATP、ADP、および AMP の標準曲線を、x 軸に連続標準濃度、y 軸にピーク面積をプロットします。
- ステップ3.8の標準曲線式を使用して、サンプル中のATP、ADP、およびAMP含有量を計算します。
4. 細胞熱シフトアッセイ(CETSA)
- プロテアーゼ阻害剤含有ライセート(ライセート:プロテアーゼ阻害剤=100:1)を用いて、正常なHT22細胞をペトリ皿内で20分間、ピペッティングを繰り返して溶解します。
注意: タンパク質の分解を防ぐために、アイスバスでこの手順を実行します。 - ステップ4.1から細胞溶解物を採取し、超音波細胞破壊装置(電力:300W、超音波3秒、7秒間隔、合計時間:3分)を用いて氷浴で超音波処理する。10,304 × g、4°Cで20分間遠心分離し、上清を回収します。
注:上清を14の部分に分けます:Salとの共インキュベーション用の7つのグループと、コントロールとしてPBSとの共インキュベーション用の7つのグループ。Sal処理群では、サンプルあたり100 μLの上清と0.1 μLの20 μM Salを添加します。対照群では、サンプルあたり100 μLの上清と0.1 μLのPBSを追加します。 - 各サンプルを室温で30分間インキュベートし、さらに金属製の加熱温度制御装置を使用して、37°C、42°C、47°C、52°C、57°C、62°C、および67°Cで3分間インキュベートします。
- ステップ 4.3 のサンプルを 10,304 × g で 4 °C で 20 分間遠心分離し、ピペットを使用して上清を回収します。
- 製造元の指示に従って、BCAタンパク質濃度アッセイキットを使用して、ステップ4.4から上清の総タンパク質濃度を測定します( 材料の表を参照)。
- 製造元の指示に従って、PAGEゲル迅速調製キットを使用して10%分離ゲルを調製します( 材料表を参照)。
- 染色済みカラータンパク質マーカー3 μLとサンプル14 μLを分離ゲルのウェルにロードします(ウェルあたりの最終タンパク質量:20 μg)。
- 電気泳動バッファーを使用してゲルを80-100 mVで1時間泳動し、分離されたタンパク質を得ます。
- ステップ4.8のタンパク質を、迅速な膜転写溶液とサンドイッチ構造(綿-濾紙-PVDF膜-タンパク質ゲル-濾紙-綿)を使用して、400mAで30分間PVDF膜に移します。
- ステップ4.9のPVDFメンブレンを5%ウシ血清アルブミン(BSA)溶液で室温で1〜2時間ブロックします。
注:100mLのTBS緩衝液と0.05%Tween 20を含む100mLのTBST溶液に5mgのBSA粉末を溶解して、5%BSA溶液を調製します。 - ステップ4.10のPVDFメンブレンを、希釈した一次抗体5 mLと4°Cで一晩インキュベートします。
注:一次抗体をBSA溶液(1:1000の比率)で希釈します。 - PVDFメンブレンをTBSTで3回、それぞれ5分間洗浄し、結合していない一次抗体を除去します。
- ステップ4.12のメンブレンを希釈した西洋ワサビペルオキシダーゼ(HRP)共役二次抗体と室温で2時間、脱色シェーカーでインキュベートします。
注:HRP結合二次抗体をBSA溶液(1:10,000の比率)で希釈します。 - メンブレンをTBSTで3回、各5分間洗浄し、残留した二次抗体を除去します。
- ステップ4.14のメンブレンをECL化学発光現像液で覆い、イメージングシステムを使用して標的タンパク質シグナルをイメージングします。
注意: この手順は、蛍光消光を防ぐために暗闇で行ってください。 - ImageJソフトウェアを使用して、標的タンパク質のグレー値を分析および定量化します(材料の使用を参照)。
結果
HPLCで検出したATP、ADP、およびAMPの標準曲線は、それぞれY = 7006.5X - 222.99、Y = 5217.3X - 17.796、Y = 9280.1X + 22.749でした(図1A-C)。HPLCで各グループで測定したヌクレオチド含量は、標準曲線を用いて計算しました(図1D-I)。その結果、CoCl2は、対照群と比較して、HT22細胞のATPおよびADPレベルを有意に低下させることがわかった(P < 0.01、図1J、K)。さらに、AMPK阻害剤であるドルソモルフィン(Dor)の投与は、CoCl2治療群と比較してATPおよびADPレベルの顕著な低下をもたらしました(P < 0.01、図1J、K)。しかし、Salによる治療は、CoCl2処理群と比較してATPおよびADPレベルを有意に増加させました(P < 0.05、図1J、K)。
さらなる解析により、CoCl2 処理群では AMP レベルが有意に増加したのに対し、Sal 処理ではこの急増が効果的に制限されることが明らかになりました (P < 0.01、 図 1L)。適切なミトコンドリア機能は、細胞内のATP、ADP、およびAMPの恒常性、および正常な細胞生理機能を維持するために不可欠です。ミトコンドリアの機能状態は、ATP、ADP、およびAMPの変換率とバランスに直接影響します。ミトコンドリアの損傷または機能不全は、ATP合成を損ない、ADPとAMPの変換率を低下させ、それによって細胞のエネルギー供給と代謝バランスを乱す可能性があります。
これらの知見は、SalがATP、ADP、およびAMP変換を調節することにより、HT22細胞の低酸素損傷を緩和する可能性があることを示唆しています。さらに、ミトコンドリア関連タンパク質へのSal結合のCETSA分析では、Sal処理後のAMPKα、p-AMPKα、Sirt1、およびHIF-1αの熱安定性の増加が示されました。これは、Salがこれらのタンパク質と相互作用する可能性があることを示唆しており(図2)、以前の研究21,23,24の結果と一致しています。
データの可用性:
すべての生データが提供されます(補足ファイル1 および 補足ファイル2)。

図1:ヌクレオチド(ATP、ADP、AMP)含有量に対するSalの影響(A-C)ATP(A)、ADP(B)、およびAMP(C)の標準曲線。(D-I)異なる処理群にわたるATP、ADP、およびAMP含有量を決定するための代表的なHPLC曲線。(J-L)さまざまな治療群におけるATP、ADP、およびAMP含有量の統計解析(コントロール、250 μM CoCl2、250 μM CoCl2 + 10 μM Dor、250 μM CoCl2 + 20 μM Sal、および250 μM CoCl2 + 10 μM Dor + 20 μM Sal)。(n = 3, *P < 0.05, **P < 0.01)この図の拡大版を表示するには、ここをクリックしてください。
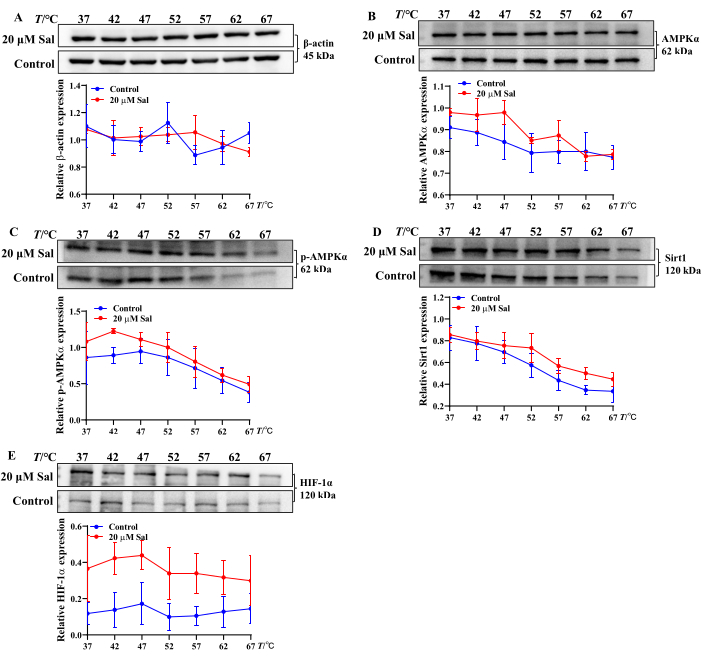
図2:CETSA法を用いたAMPK/Sirt1/HIF-1α経路関連タンパク質へのSal結合特性の評価 β-アクチン(A)、AMPKα(B)、p-AMPKα(C)、Sirt1(D)、およびHIF-1α(E)タンパク質バンドおよびHT22細胞の発現傾向をCETSA(n = 3)によって評価した。Salとさまざまなタンパク質との結合特性は、統計ソフトウェアとグラフ作成ソフトウェアを使用して、さまざまな温度で分析しました。 この図の拡大版を表示するには、ここをクリックしてください。
| 時間 (分) | 移動相 | |
| 溶剤A | 溶剤B | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
表1:移動相溶出手順。
補足ファイル1:HPLCでATP、ADP、AMPを検出するための生データ。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:CETSAタンパク質バンド。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ミトコンドリアは、HHBI 23,24,25の治療的予防に関与する重要な細胞小器官です。同グループによるこれまでの研究では、SalがAMPK、Sirt1、HIF-1αタンパク質の発現を制御し、ニューロンのミトコンドリア機能を強化し、HHBIから保護することが確認されています21,24。ただし、低酸素細胞のヌクレオチドに対するSalの直接的な影響については、さらなる調査が必要です。さらに、さまざまな温度条件下での化合物とタンパク質の結合電位を評価することは、それらの相互作用を理解するために不可欠です。
これらの側面に対処するために、本研究では、HPLCを使用してHT22細胞のミトコンドリアATP、ADP、およびAMPレベルに対するSalの影響を調べ、ミトコンドリアエネルギー代謝におけるその役割についての直接的な洞察を提供しました。以前の研究18に基づいて、HT22細胞に低酸素を誘導するために250μMのCoCl2 が選択されました。その結果、Salは低酸素HT22細胞のAMP含量を減少させながら、ATPおよびADPレベルを有意に増加させることが示されました(図1)。これらの結果は、グループの以前の知見と組み合わせると、Salが低酸素ニューロンのミトコンドリアに保護効果を発揮することをさらに確認しています。
AMPKは、真核生物の高度に保存されたプロテインキナーゼであり、エネルギー代謝を調節します。細胞のATP、ADP、およびAMPレベルの変化を感知し、さまざまな基質をリン酸化することにより、グルコース代謝、脂肪酸合成、およびミトコンドリア生合成を調整します26。AMPKの活性化は、特に細胞内ATPレベルの低下とAMPレベルの上昇に反応して、エネルギー生産を促進し、エネルギー消費を抑制します27。さらに、AMPKは、グルコアミラーゼをリン酸化し、酵素触媒を変化させ、ホスホアルギニン-アルギニンプールからATPを迅速に生成することにより、ATPの予備力を高めます28。
本研究では、選択的リン酸化AMPK阻害剤であるDorを使用して、塩基がヌクレオチドレベル29に及ぼす影響を調査しました。HPLCを使用して、Dor単独またはSalと組み合わせて曝露されたCoCl2処理HT22細胞のATP、ADP、およびAMPレベルを定量化しました。この知見は、SalがATP/ADP/AMP比を調節し、それによって低酸素症に対する神経保護効果を発揮することを示しています(図1)。確立されたHPLC法は、細胞レベルでヌクレオチドに対する生理活性化合物の影響を直接評価するための直感的でシンプルかつ効率的なアプローチを提供します。
HIF-1αは、低酸素刺激に応答して活性化される転写因子です。低酸素条件下では、HIF-1αの安定性は著しく向上し、細胞質から核に移り、そこでHIF-1β30とヘテロ二量体を形成することができる。このプロセスは、血管新生、グルコース代謝、および解糖に関与する遺伝子の発現を促進する31,32,33。さらに、HIF-1αの安定性は、酸化的リン酸化中のミトコンドリア機能および細胞内O2レベルと高い相関があることが示されている31。しかし、低酸素症によるミトコンドリア機能障害は、細胞内エネルギー供給の不足につながり、その結果、HIF-1α経路が活性化され、低酸素症への細胞適応が調節されます31,32。
Sirt1は、Sirtuinファミリーの一員であり、NAD+依存性脱アセチル化によってHIF-1αタンパク質の安定性を低下させ、それによってその核蓄積を制限する32。低酸素条件下では、細胞内ATPレベルの低下はAMPK活性の増加につながり、これはリン酸化31,32,33を介してHIF-1αおよびその関連タンパク質の細胞内輸送、安定性、および転写活性に影響を与える。さらに、Sirt1とAMPKはHIF-1αとコアクチベーターとの間の相互作用を調節し、それによってその転写活性を調節し、低酸素症33への細胞適応をさらに促進します。低酸素症で損傷した脳細胞では、AMPK、Sirt1、およびHIF-1αが相互作用して細胞内エネルギーの恒常性を維持し、代謝プロセスを調節します。
in vitroで化合物-タンパク質複合体の耐熱性と結合電位を評価するためのシンプルで効率的な方法には、リガンド結合時のタンパク質の安定性を評価する技術が含まれます。化合物とタンパク質の相互作用によりタンパク質の熱安定性が増し、温度による変性に対する感受性が低下し、比較的安定したタンパク質収量が得られることは十分に確立されています。細胞熱シフトアッセイ(CETSA)とウェスタンブロット分析を組み合わせると、正確な結合部位は明らかにされませんが、薬物と標的の相互作用と潜在的なオフターゲット効果を研究するための低コストで効率的なアプローチを提供します22,34。CETSAは、異なる種にわたる細胞や組織における薬物標的の関与を検証および定量するために広く使用されています。
この研究では、CETSAを使用して、Salが細胞レベルでAMPKα、p-AMPKα、Sirt1、およびHIF-1αと相互作用するかどうかを評価しました。加熱処理後、Salはこれらのタンパク質の発現を増加させ、安定したSal-AMPKα、Sal-p-AMPKα、Sal-Sirt1、およびSal-HIF-1α複合体の形成を示唆しています(図2)。これらの知見は、以前の実験結果21,24と一致している。したがって、CETSAウェスタンブロットは、化合物-タンパク質相互作用およびin vitroでの熱安定性の大規模なスクリーニングのための堅牢で効率的なアプローチとして機能します。
HPLCおよびCETSA技術を使用して、ミトコンドリアエネルギー代謝に対するSalの保護メカニズムに関する洞察が得られましたが、特定の制限が残っています。CETSAは、化合物がタンパク質の耐熱性にどのように影響するかについて、アミノ酸レベルでの情報は提供していません。CETSAとイメージング技術を統合して、タンパク質内の化合物結合部位を視覚的に同定し、化合物-タンパク質複合体が熱誘起変性にどのように抵抗するかをより明確に理解できるようになることが、潜在的な進歩となるでしょう。これを達成するためには、さらなる科学的革新と洗練された実験デザインが必要です。さらに、CETSAを局在表面プラズモン共鳴や示差走査蛍光法などの他の分子相互作用技術で補完することで、化合物-タンパク質相互作用のより包括的な分析が可能になるだろう35。
開示事項
著者は何も開示していません。
謝辞
この研究は、中国国家自然科学基金会(82274207および82474185)、四川省科学技術部(2024NSFSC1845)、四川省科学技術青年科学基金会(2023NSFSC1776)、寧夏回族自治区の主要研究開発プログラム(2023BEG02012)、中国中医薬協会の2024-2026年青年人材支援プロジェクト(2024-QNRC2-B07)、およびXinglin Scholar Researchの支援を受けた成都TCM大学の推進プロジェクト(XKTD2022013およびQJJJ2024027)。
著者の貢献:
Xiaobo Wang、Yating Zhang、Ya Hou、Rui Li、Xianli Mengがこのプロジェクトを考案しました。Yating Zhang、Ya Hou、Tingting Kuangが実験を行い、データを分析しました。Yating ZhangとHong Jiangが原稿を書きました。Xiaobo WangとXianli Mengが原稿を改訂しました。すべての著者が最終原稿を読み、承認しました。
資料
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
参考文献
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108 (2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532 (2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77 (2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094 (2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146 (2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762 (2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568 (2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404 (2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617 (2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278 (2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843 (2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82 (2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318 (2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858 (2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182 (2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127 (2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved