Research Article
رؤى ميكانيكية لحماية الميتوكوندريا في ساليدروسيد عبر مسار AMPK / Sirt1 / HIF-1α في خلايا HT22 الناقصة
In This Article
Summary
حددت الدراسة الحالية آلية فريدة يمارس بها الساليدروسيد تأثيرات وقائية للميتوكوندريا على خلايا HT22 ناقصة التأكسج ، جزئيا من خلال مسار AMPK / Sirt1 / HIF-1α.
Abstract
ساليدروسيد (سال), عنصر نشط رهوديولا كرينولاتا (هوك. و. وآخرون تومس.) H. أوهبا وقد وجد أن يمارس آثار وقائية الميتوكوندريا عن طريق تحسين التمثيل الغذائي وتعزيز إمدادات الطاقة لخلايا الدماغ في ظل ظروف نقص الأكسجة. ومع ذلك، لم يتم توضيح آلية عملها بشكل كامل. في هذه الدراسة ، تم استخدام الكروماتوغرافيا السائلة عالية الأداء لأول مرة لتحليل تأثيرات Sal على مستويات النيوكليوتيدات (ATP و ADP و AMP). تم اختيار مقايسة التحول الحراري الخلوي (CETSA) ، وهي طريقة تفاعل جزيئي مستخدمة على نطاق واسع للتحقق من صحة وقياس مشاركة هدف الدواء في الخلايا والأنسجة عبر الأنواع المختلفة ، لتأكيد تقارب Sal للبروتينات المرتبطة بمسار AMPK / Sirt1 / HIF-1α. كشفت النتائج أن Sal زاد من مستويات ATP و ADP في خلايا HT22 التي تعاني من نقص الأكسجين مع تقليل مستويات AMP. علاوة على ذلك ، أظهر Sal ارتباطا مستقرا ببروتينات AMPKα و p-AMPKα و Sirt1 و HIF-1α. في الختام ، قد يمارس Sal تأثيرات وقائية للميتوكوندريا عن طريق تعديل مسار AMPK / Sirt1 / HIF-1α لتنظيم محتوى النيوكليوتيدات. توفر هذه الدراسة مرجعا منهجيا لتحليل محتوى النيوكليوتيدات في عينات الخلايا وتساهم في تحديد واكتشاف أهداف المركبات المشتقة من الطب الصيني التقليدي.
Introduction
الدماغ حساس للغاية للأكسجين بسبب متطلباته الأيضية العالية ، وقدرته المحدودة على تحلل السكر ، والاعتماد على الفسفرة المؤكسدة. نتيجة لذلك ، يمكن أن يؤدي التعرض لبيئة منخفضة الأكسجين على ارتفاعات عالية بسهولة إلى إصابة الدماغ الناجمة عن نقص الأكسجين (HHBI) 1،2. وتشير الدراسات الوبائية إلى أنه عندما يصعد الأفراد غير المتأقلمين مع الارتفاعات العالية بسرعة إلى المناطق المرتفعة، يمكن أن يصل معدل الإصابة بمرض الجبال الحاد إلى 75٪، مع معدل وفيات يبلغ حوالي 1٪ في الحالات الشديدة. علاوة على ذلك ، في حالة عدم وجود رعاية طبية ، يمكن أن تصل معدلات الوفيات الناجمة عن الوذمة الدماغية أو الرئوية على ارتفاعات عالية إلى 40٪ 3،4.
يظهر HHBI مع مجموعة واسعة من الأعراض السريرية. قد تشمل الحالات الخفيفة إلى المتوسطة الصداع والدوخة وفقدان الذاكرة5 ، بينما يمكن أن تؤدي الحالات الشديدة إلى ضعف إدراكي وتغير الوعي ونتائج مميتةمحتملة 5. أصبحت الوقاية من HHBI وعلاجه في المناطق المرتفعة محورا رئيسيا للبحث الطبي. تتضمن الاستراتيجيات الوقائية في المقام الأول التدريب التكيفي في البيئات المرتفعة ، بما في ذلك الراحة الكافية ، واتباع نظام غذائي متوازن ، والتغذية السليمة ، والتمارين البدنية المناسبة6،7. بالإضافة إلى ذلك ، تظل التدخلات الدوائية التي تهدف إلى حماية خلايا الدماغ والتخفيف من نقص الأكسجة الدماغي مركزية لأبحاث HHBI الحالية.
تعمل الميتوكوندريا كمراكز لإنتاج الطاقة الأولية داخل الخلايا ، حيث تقوم بتصنيع أدينوسين ثلاثي الفوسفات (ATP) لتلبية متطلبات الطاقة الخلوية. في ظل ظروف نقص الأكسجين ، ينخفض إنتاج طاقة الميتوكوندريا ، مما يؤدي إلى انخفاض مستويات ATP وضعف وظيفة الخلية8. تؤدي إصابة نقص الأكسجين أيضا إلى تعطيل تنظيم الميتوكوندريا لتوازن Ca2+ ودرجة الحموضة ، مما يؤدي إلى موت الخلايا المبرمج والنخر9،10. هناك علاقة يعزز بعضها البعض بين الخلل الوظيفي في الميتوكوندريا وإصابة الدماغ الناجمة عن نقص الأكسجين. من ناحية أخرى ، يؤدي ضعف الميتوكوندريا الناجم عن نقص الأكسجة إلى تفاقم نقص الأكسجين عن طريق تقليل عملية التمثيل الغذائي للطاقة الخلوية ، مما يخلق حلقة مفرغة. من ناحية أخرى ، يرفع الخلل الوظيفي في الميتوكوندريا مستويات Ca2+ داخل الخلايا ، مما ينشط شلالات موت الخلايا المبرمج ويؤدي إلى موت الخلايا11. على الرغم من أن الآليات الكامنة وراء إصابة الدماغ الناجمة عن نقص الأكسجين لا تزال معقدة وغير مفهومة تماما ، فقد حددت دراسات متعددة ضعف استقلاب طاقة الميتوكوندريا العصبية كعامل حاسم في التسبب فيالتسبب في 12،13. لذلك ، قد يوفر المزيد من الاستكشاف لوظيفة الميتوكوندريا رؤى قيمة حول الأهداف العلاجية المحتملة لإصابات الدماغ الناجمة عن نقص الأكسجين.
Salidroside (Sal) هو عنصر نشط مستخرج من نبات الهضبة Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba ويستخدم على نطاق واسع في منتجات الصحة الغذائية والمستحضرات الصيدلانية14. الصيغة الجزيئية ل Sal هي C14H20O7 ، وتعرف أيضا باسم 2- (4-hydroxyphenyl) -ethyl β-D-glucopyranoside. يمتلك خصائص دوائية متنوعة ، بما في ذلك مضادات نقص الأكسجة ، ومضادات الأكسدة ، ومكافحة التعب ، ومضادة للأورام ، والمناعية ، ومضادة للالتهابات ، وتأثيرات وقائية للقلب والأوعية الدموية والأوعية الدمويةالدماغية 15،16،17. من بين هؤلاء ، يعد تأثيره المضاد لنقص الأكسجة أحد أكثر التأثيرات توثيقا جيدا. سلطت الدراسات الحديثة الضوء بشكل متزايد على التأثيرات الوقائية الكبيرة للميتوكوندريا ل Sal كآلية محتملة لآثاره الوقائية والعلاجية على إصابات الدماغ الناجمة عن الهضبة في الفئران14،18. ومع ذلك ، فإن الآليات الجزيئية الدقيقة التي يؤثر بها Sal على مستويات ATP و ADP و AMP لا تزال غير مفهومة جيدا.
يعمل بروتين كيناز المنشط ب AMP (AMPK) كمستشعر رئيسي للطاقة يساعد في الحفاظ على توازن الطاقة الخلوية. يحفز تنشيط AMPK Sirtuin 1 (Sirt1) ، مما يؤدي إلى زيادة مستويات NAD + داخل الخلايا19. أظهرت الدراسات أن Sirt1 يمكن أن ينظم العامل المحفز لنقص الأكسجة 1-alpha (HIF-1α) لتنسيق الاستجابة الخلوية لنقص الأكسجة20. أظهرت الأبحاث السابقة أن Sal يمنع فتح المسام الانتقالية لنفاذية الميتوكوندريا العصبية ، وينظم عمليات طاقة الميتوكوندريا بوساطة HIF-1α ، ويخفف من موت الخلايا المبرمج العصبي ، ويحافظ على سلامة الحاجز الدموي الدماغي ، وبالتالي يحمي الفئران من إصابة الدماغ الناجمة عنالهضبة 14،21. ومع ذلك ، فإن تأثير Sal على ATP ومستقلباته ، ADP و AMP ، لا يزال غير مؤكد.
للتحقيق في ذلك ، تم استخدام الكروماتوغرافيا السائلة عالية الأداء (HPLC) لأول مرة لتحديد مستويات هذه النيوكليوتيدات الثلاثة. بالإضافة إلى ذلك ، تم استخدام مقايسة التحول الحراري الخلوي (CETSA) ، وهي تقنية فيزيائية حيوية مستخدمة على نطاق واسع تم تقديمها في عام 2013 لدراسة تفاعلات البروتين الترابط في الخلاياالسليمة 22. يتم تطبيق هذه الطريقة بشكل شائع للتحقق من صحة وتحديد مشاركة الدواء المستهدفة في الخلايا والأنسجة عبر الأنواع المختلفة. على وجه التحديد ، بعد احتضان التحلل الخلوي المستهدف المشترك مع الدواء في درجات حرارة متفاوتة لفترة محددة ، يظهر البروتين المرتبط بالدواء ثباتا حراريا متزايدا ، مما يجعله أقل عرضة للتمسخ وهطول الأمطار. ثم تتم إزالة البروتينات غير المرتبطة المترسبة عن طريق الطرد المركزي ، ويتم تحديد التفاعلات المستهدفة للأدوية لاحقا من خلال تحليل اللطخة الغربية للطافي22. لتحديد الأهداف الجزيئية المحتملة ل Sal ، تم اختيار CETSA لتقييم تقاربها المرتبط بالبروتينات المرتبطة بمسار AMPK / Sirt1 / HIF-1α.
Protocol
وترد التفاصيل التجارية للكواشف والمعدات المستخدمة في هذه الدراسة في جدول المواد.
1. إعداد الحل
- قم بإعداد وسط النسر المعدل (DMEM) الكامل من Dulbecco عن طريق إضافة 10٪ مصل بقري للجنين و 1٪ بنسلين ستربتومايسين.
- تحضير محلول 20 ملي Sal عن طريق إذابة 3 ملغ من Sal في 500 ميكرولتر من محلول ملحي مخزن بالفوسفات (PBS)21.
- قم بتصفية 500 مل من الأسيتونيتريل النقي كروماتوجرافي (المرحلة أ المتنقلة) باستخدام غشاء عضوي 0.45 ميكرومتر.
- قم بإعداد 1000 مل من المرحلة المتنقلة B بإضافة 3.5 مل من الكاشف الأول إلى 1 لتر من الماء منزوع الأيونات. اضبط الرقم الهيدروجيني على 6.15 باستخدام الكاشف II ، باتباع تعليمات مجموعة فحص محتوى النيوكليوتيدات (ATP و ADP و AMP) (انظر جدول المواد).
ملاحظة: يتم تضمين الكاشف الأول والكاشف الثاني في مجموعة مقايسة محتوى النيوكليوتيدات (ATP وADP وAMP). - تصفية المرحلة المتنقلة B باستخدام غشاء مائي 0.22 ميكرومتر.
ملاحظة: يجب استخدام المرحلة B المتنقلة مباشرة بعد التحضير. يجب أن تكون المرحلتين المتنقلة A و B صوتنة لمدة 30 دقيقة قبل الاستخدام لإزالة فقاعات الهواء. - قم بتخفيف محلول مخزون قياسي ATP و ADP و AMP بحجم 1 ميكرومتر بالماء منزوع الأيونات للحصول على حلول قياسية من سلسلة ATP و ADP و AMP 0.5 ميكرومتر و 0.5 ميكرومتر و 0.05 ميكرومتر و 0.005 ميكرومتر.
- قم بتصفية سلسلة المحاليل القياسية باستخدام غشاء مرشح صغير يسهل اختراقه من نوع الإبرة 0.22 ميكرومتر.
ملاحظة: يجب استخدام زجاجات الحقن البنية لتخزين المحاليل القياسية التسلسلية. يجب استخدام السلسلة المعدة من الحلول القياسية في أسرع وقت ممكن.
2. زراعة الخلايا
ملاحظة: تم إنشاء ثقافة خلايا HT22 ونموذج نقص الأكسجة المحفز ب CoCl2 وفقا لتقرير سابق21.
- استزراع خلايا HT22 عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 حتى يتم الوصول إلى التقاء 80٪ في طبق بتري. هضم الخلايا مع 0.25٪ التربسين لمدة 1 دقيقة.
- البذور 2 × 105 خلايا من الخطوة 2.1 إلى ألواح 6 آبار مع DMEM كامل (مجموعة التحكم بدون علاج دوائي ) أو DMEM كامل يحتوي على الدواء (250 ميكرومتر CoCl2 ، 250 ميكرومتر CoCl2 + 10 ميكرومتر Dor ، 250 ميكرومتر CoCl2 + 20 ميكرومتر Sal ، و 250 ميكرومتر CoCl2 + 10 ميكرومتر Sal). احتضان لمدة 24 ساعة عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
ملاحظة: تم إعداد ثلاث عينات متوازية في كل مجموعة.
3. فحص محتوى النيوكليوتيدات (ATP و ADP و AMP)
- أضف 1 مل من كاشف الاستخراج I إلى كل بئر في الألواح المكونة من 6 آبار من الخطوة 2.2.
ملاحظة: يتم تضمين كاشف الاستخراج I في مجموعة فحص محتوى النيوكليوتيدات (ATP و ADP و AMP) (انظر جدول المواد). - قم بتحليل الخلايا عن طريق صوتنة على حمام جليدي باستخدام جهاز تعطيل الخلايا بالموجات فوق الصوتية (الطاقة: 300 واط ، الموجات فوق الصوتية لمدة 3 ثوان ، فاصل 7 ثوان ، الوقت الإجمالي: 3 دقائق).
- الطرد المركزي للخلايا المحللة عند 10,304 × جم لمدة 10 دقائق عند 4 درجات مئوية باستخدام جهاز طرد مركزي مبرد عالي السرعة.
- انقل 0.75 مل من المادة المطفية من الخطوة 3.3 إلى أنبوب سعة 2.0 مل. أضف 0.75 مل من كاشف الاستخراج II ، ورجه واخلطه باستخدام خلاط دوامة ، وجهاز الطرد المركزي مرة أخرى عند 10,304 × جم لمدة 10 دقائق عند 4 درجات مئوية.
ملاحظة: يتم تضمين كاشف الاستخراج II في مجموعة مقايسة محتوى النيوكليوتيدات (ATP وADP وAMP). - قم بتصفية المادة الطافية من الخطوة 3.4 وقم بتصفيتها باستخدام غشاء مرشح صغير يسهل اختراقه من نوع إبرة 0.22 ميكرومتر في قارورة بنية.
ملاحظة: ATP و ADP و AMP في العينة المستخرجة غير مستقرة. يجب إجراء جميع الإجراءات التجريبية في درجات حرارة منخفضة أو على الجليد. يجب معالجة العينات واختبارها في أسرع وقت ممكن. - افتح برنامج الكروماتوغرافيا وقم بتعيين المعلمات التالية: حجم الحقن: 10 ميكرولتر ؛ درجة حرارة العمود: 27 درجة مئوية ؛ معدل التدفق: 0.8 مل / دقيقة ؛ الطول الموجي للكشف: 254 نانومتر ؛ مدة الكشف: 70 دقيقة. اضبط إجراء شطف التدرج وفقا للجدول 1.
- انقر فوق الزر تنفيذ لحقن العينة تلقائيا واكتشاف محتوى ATP وADP وAMP في الحلول القياسية التسلسلية (الخطوة 1.7) وحلول العينة (الخطوة 3.5) وفقا للبرنامج المحدد في الخطوة 3.6.
ملاحظة: في نهاية التجربة ، اغسل العمود الكروماتوغرافي بالمرحلة B المتنقلة بنسبة 98٪ لمنع الانسداد. - ارسم المنحنيات القياسية ل ATP و ADP و AMP باستخدام برامج الرسوم البيانية والتحليل الإحصائي ، مع تركيزات قياسية تسلسلية على المحور x ومناطق الذروة على المحور y.
- احسب محتوى ATP وADP وAMP في العينات باستخدام معادلة المنحنى القياسية من الخطوة 3.8.
4. مقايسة التحول الحراري الخلوي (CETSA)
- قم بعمل لحالة خلايا HT22 الطبيعية لمدة 20 دقيقة في طبق بتري باستخدام محللات تحتوي على مثبطات البروتياز (المحللة: مثبط البروتياز = 100: 1) عن طريق سحب الخلايا بشكل متكرر.
ملاحظة: قم بتنفيذ هذه الخطوة في حمام جليدي لمنع تدهور البروتين. - اجمع محللة الخلية من الخطوة 4.1 وصوتنة على حمام جليدي باستخدام جهاز تعطيل الخلايا بالموجات فوق الصوتية (الطاقة: 300 واط ، الموجات فوق الصوتية لمدة 3 ثوان ، فاصل 7 ثوان ، الوقت الإجمالي: 3 دقائق). جهاز طرد مركزي عند 10،304 × جم ، 4 درجات مئوية لمدة 20 دقيقة وجمع الطاف.
ملاحظة: قسم المادة الطافية إلى 14 جزءا: 7 مجموعات للتكسير مع Sal و 7 مجموعات للتكعيب مع PBS كعنصر تحكم. بالنسبة للمجموعة المعالجة ب Sal ، أضف 100 ميكرولتر من المادة الطافية و 0.1 ميكرولتر من 20 ميكرومتر سالي لكل عينة. بالنسبة للمجموعة الضابطة ، أضف 100 ميكرولتر من المادة الطافية و 0.1 ميكرولتر من PBS لكل عينة. - احتضان كل عينة في درجة حرارة الغرفة لمدة 30 دقيقة ، ثم احتضانها عند 37 درجة مئوية ، و 42 درجة مئوية ، و 47 درجة مئوية ، و 52 درجة مئوية ، و 57 درجة مئوية ، و 62 درجة مئوية ، و 67 درجة مئوية لمدة 3 دقائق باستخدام أداة التحكم في درجة حرارة تسخين المعادن.
- قم بالطرد المركزي للعينات من الخطوة 4.3 عند 10,304 × جم لمدة 20 دقيقة عند 4 درجات مئوية وجمع المادة الطافية باستخدام ماصة.
- قم بقياس إجمالي تركيز البروتين للطافي من الخطوة 4.4 باستخدام مجموعة مقايسة تركيز بروتين BCA ، باتباع تعليمات الشركة المصنعة (انظر جدول المواد).
- قم بإعداد جل فصل بنسبة 10٪ باستخدام مجموعة التحضير السريع للهلام PAGE ، باتباع تعليمات الشركة المصنعة (انظر جدول المواد).
- قم بتحميل 3 ميكرولتر من علامة البروتين الملون الملطخة مسبقا و 14 ميكرولتر من العينات في آبار هلام الفصل (كمية البروتين النهائية لكل بئر: 20 ميكروغرام).
- قم بتشغيل الجل باستخدام المخزن المؤقت للرحلان الكهربائي لمدة 1 ساعة عند 80-100 مللي فولت للحصول على بروتينات منفصلة.
- انقل البروتينات من الخطوة 4.8 إلى غشاء PVDF باستخدام محلول نقل الغشاء السريع وهيكل شطيرة (ورق ترشيح قطني - غشاء PVDF - هلام بروتين - ورق مرشح - قطن) عند 400 مللي أمبير لمدة 30 دقيقة.
- قم بسد أغشية PVDF من الخطوة 4.9 باستخدام محلول ألبومين مصل البقر (BSA) بنسبة 5٪ لمدة 1-2 ساعة في درجة حرارة الغرفة.
ملاحظة: قم بإعداد محلول BSA بنسبة 5٪ عن طريق إذابة 5 مجم من مسحوق BSA في 100 مل من محلول TBST الذي يحتوي على 100 مل من محلول TBS و 0.05٪ Tween 20. - احتضان أغشية PVDF من الخطوة 4.10 بجسم مضاد أولي مخفف سعة 5 مل عند 4 درجات مئوية طوال الليل.
ملاحظة: تمييع الجسم المضاد الأساسي في محلول BSA (نسبة 1: 1000). - اغسل أغشية PVDF ثلاث مرات باستخدام TBST لمدة 5 دقائق لكل منها لإزالة الأجسام المضادة الأولية غير المرتبطة.
- احتضان الأغشية من الخطوة 4.12 بجسم مضاد ثانوي مقترن ببيروكسيداز الفجل المخفف (HRP) لمدة ساعتين في درجة حرارة الغرفة على شاكر إزالة اللون.
ملاحظة: تمييع الجسم المضاد الثانوي المقترن ب HRP في محلول BSA (نسبة 1: 10،000). - اغسل الأغشية ثلاث مرات باستخدام TBST لمدة 5 دقائق لكل منها لإزالة الأجسام المضادة الثانوية المتبقية.
- قم بتغطية الأغشية من الخطوة 4.14 باستخدام مطور التلألؤ الكيميائي ECL ، ثم قم بتصوير إشارة البروتين المستهدف باستخدام نظام التصوير.
ملاحظة: قم بتنفيذ هذه الخطوة في الظلام لمنع تبريد الفلورة. - تحليل وقياس القيمة الرمادية للبروتينات المستهدفة باستخدام برنامج ImageJ (انظر T able of Materials).
النتائج
كانت المنحنيات القياسية ل ATP و ADP و AMP التي اكتشفها HPLC هي Y = 7006.5X - 222.99 ، Y = 5217.3X - 17.796 ، و Y = 9280.1X + 22.749 ، على التوالي (الشكل 1A-C). تم حساب محتويات النيوكليوتيدات المقاسة في كل مجموعة بواسطة HPLC باستخدام المنحنيات القياسية (الشكل 1D-I). وجد أن CoCl2 قلل بشكل كبير من مستويات ATP و ADP في خلايا HT22 مقارنة بالمجموعة الضابطة (P < 0.01 ، الشكل 1J ، K). علاوة على ذلك ، أدى إعطاء دورسومورفين (Dor) ، وهو مثبط AMPK ، إلى انخفاض ملحوظ في مستويات ATP و ADP مقارنة بالمجموعة المعالجة ب CoCl2 (P < 0.01 ، الشكل 1J ، K). ومع ذلك ، أدى العلاج ب Sal إلى زيادة مستويات ATP و ADP بشكل كبير بالنسبة للمجموعة المعالجة ب CoCl2 (P < 0.05 ، الشكل 1J ، K).
كشف مزيد من التحليل أن مستويات AMP زادت بشكل كبير في المجموعة المعالجة ب CoCl2 ، في حين أن علاج Sal يحد بشكل فعال من هذه الزيادة (P < 0.01 ، الشكل 1L). وظيفة الميتوكوندريا المناسبة ضرورية للحفاظ على توازن ATP و ADP و AMP داخل الخلايا ، بالإضافة إلى الوظائف الفسيولوجية الخلوية الطبيعية. تؤثر الحالة الوظيفية للميتوكوندريا بشكل مباشر على معدل التحويل والتوازن بين ATP و ADP و AMP. يمكن أن يؤدي تلف الميتوكوندريا أو الخلل الوظيفي إلى إضعاف تخليق ATP وتقليل معدلات تحويل ADP و AMP ، وبالتالي تعطيل إمدادات الطاقة الخلوية وتوازن التمثيل الغذائي.
تشير هذه النتائج إلى أن Sal قد يخفف من إصابة نقص الأكسجين في خلايا HT22 عن طريق تعديل تحويل ATP و ADP و AMP. بالإضافة إلى ذلك ، أظهر تحليل CETSA لارتباط Sal بالبروتينات المرتبطة بالميتوكوندريا زيادة في الاستقرار الحراري ل AMPKα و p-AMPKα و Sirt1 و HIF-1α بعد معالجة Sal. يشير هذا إلى أن Sal قد يتفاعل مع هذه البروتينات (الشكل 2) ، بما يتفق مع نتائج الدراسات السابقة21،23،24.
توافر البيانات:
يتم توفير جميع البيانات الأولية (الملف التكميلي 1 والملف التكميلي 2).

الشكل 1: تأثير Sal على محتوى النيوكليوتيدات (ATP و ADP و AMP). (A-C) المنحنيات القياسية ل ATP (A) و ADP (B) و AMP (C). (D-I) منحنيات HPLC التمثيلية لتحديد محتوى ATP و ADP و AMP عبر مجموعات العلاج المختلفة. (J-L) التحليل الإحصائي لمحتوى ATP و ADP و AMP في مجموعات معالجة مختلفة (التحكم ، 250 ميكرومتر CoCl2 ، 250 ميكرومتر CoCl2 + 10 ميكرومتر Dor ، 250 ميكرومتر CoCl2 + 20 ميكرومتر Sal ، و 250 ميكرومتر CoCl2 + 10 ميكرومتر Dor + 20 ميكرومتر Sal). (ن = 3 ، * ص < 0.05 ، ** ص < 0.01). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
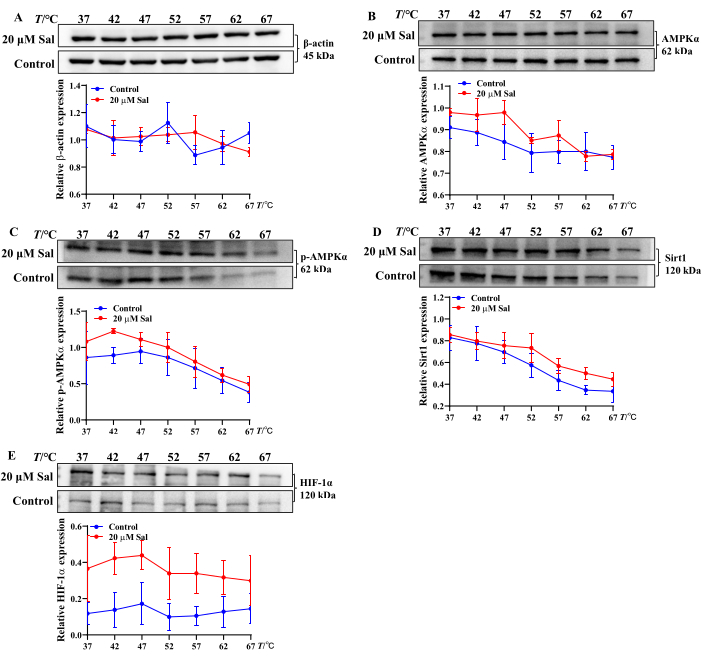
الشكل 2: تقييم خصائص ربط Sal بالبروتينات المرتبطة بمسار AMPK / Sirt1 / HIF-1α باستخدام طريقة CETSA. تم تقييم نطاقات بروتين β-Actin (A) و AMPKα (B) و p-AMPKα (C) و Sirt1 (D) و HIF-1α (E) واتجاهات التعبير في خلايا HT22 بواسطة CETSA (ن = 3). تم تحليل خصائص ربط Sal ببروتينات مختلفة باستخدام برامج إحصائية ورسوم بيانية عبر درجات حرارة متفاوتة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الوقت (دقيقة) | المرحلة المتنقلة | |
| المذيب أ | المذيب ب | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
الجدول 1: إجراء شطف المرحلة المتنقلة.
الملف التكميلي 1: البيانات الأولية للكشف عن ATP وADP وAMP بواسطة HPLC. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 2: نطاقات البروتين CETSA. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
الميتوكوندريا هي عضيات رئيسية تشارك في الوقاية العلاجية من HHBI23،24،25. أكدت الدراسات السابقة التي أجرتها المجموعة أن Sal ينظم تعبير بروتين AMPK و Sirt1 و HIF-1α ، مما يعزز وظيفة الميتوكوندريا العصبية ويحمي من HHBI21،24. ومع ذلك ، فإن التأثير المباشر ل Sal على النيوكليوتيدات في الخلايا الناقصة للأكسجين يتطلب مزيدا من التحقيق. بالإضافة إلى ذلك ، يعد تقييم إمكانات الارتباط للمركبات والبروتينات في ظل ظروف درجات حرارة متفاوتة أمرا ضروريا لفهم تفاعلاتها.
لمعالجة هذه الجوانب ، فحصت الدراسة الحالية تأثير Sal على مستويات ATP و ADP و AMP في الميتوكوندريا في خلايا HT22 باستخدام HPLC ، مما يوفر نظرة ثاقبة مباشرة لدوره في استقلاب طاقة الميتوكوندريا. بناء على دراسة سابقة، تم اختيار 18 ، 250 ميكرومتر من CoCl2 للحث على نقص الأكسجة في خلايا HT22. أظهرت النتائج أن Sal زاد بشكل كبير من مستويات ATP و ADP مع تقليل محتوى AMP في خلايا HT22 ناقصة التأكسج (الشكل 1). إلى جانب النتائج السابقة من المجموعة ، تؤكد هذه النتائج أيضا أن Sal له تأثير وقائي على الميتوكوندريا في الخلايا العصبية التي تعاني من نقص الأكسجين.
AMPK هو بروتين كيناز محفوظ للغاية في حقيقيات النوى ينظم عملية التمثيل الغذائي للطاقة. يستشعر التغيرات في مستويات ATP و ADP و AMP الخلوية لتنسيق استقلاب الجلوكوز ، وتخليق الأحماض الدهنية ، والتكوين الحيوي للميتوكوندريا عن طريق فسفرة ركائز مختلفة26. يعزز تنشيط AMPK إنتاج الطاقة ويثبط إنفاق الطاقة ، لا سيما استجابة لانخفاض مستويات ATP داخل الخلايا ومستويات AMPالمرتفعة 27. بالإضافة إلى ذلك ، يعزز AMPK احتياطيات ATP عن طريق فسفرة الجلوكو أميليز ، وتغيير التحفيز الأنزيمي ، وتوليد ATP بسرعة من تجمع الفوسفورجينينوالأرجينين 28.
في هذه الدراسة ، تم استخدام Dor ، وهو مثبط AMPK انتقائي فسفوري ، للتحقيق في تأثيرات Sal على مستوياتالنيوكليوتيدات 29. تم استخدام HPLC لتحديد مستويات ATP و ADP و AMP في خلايا HT22 المعالجة ب CoCl2 المعرضة ل Dor بمفردها أو بالاشتراك مع Sal. تشير النتائج إلى أن Sal يعدل نسبة ATP / ADP / AMP ، وبالتالي ممارسة تأثيرات وقائية عصبية ضد نقص الأكسجة (الشكل 1). توفر طريقة HPLC المعمول بها نهجا بديهيا وبسيطا وفعالا لتقييم تأثيرات المركبات النشطة بيولوجيا بشكل مباشر على النيوكليوتيدات على المستوى الخلوي.
HIF-1α هو عامل نسخ يتم تنشيطه استجابة لتحفيز نقص الأكسجة. في ظل ظروف نقص الأكسجين ، يزداد استقرار HIF-1α بشكل كبير ، مما يسمح له بالانتقال من السيتوبلازم إلى النواة ، حيث يشكل مغاير مع HIF-1β30. تعزز هذه العملية التعبير عن الجينات المشاركة في تكوين الأوعية الدموية واستقلاب الجلوكوز وتحلل السكر31،32،33. بالإضافة إلى ذلك ، ثبت أن استقرار HIF-1α يرتبط ارتباطا وثيقا بوظيفة الميتوكوندريا ومستويات O2 داخل الخلايا أثناء الفسفرة المؤكسدة31. ومع ذلك ، يؤدي الخلل الوظيفي في الميتوكوندريا الناجم عن نقص الأكسجة إلى عدم كفاية إمدادات الطاقة داخل الخلايا ، والتي بدورها تنشط مسار HIF-1α لتنظيم التكيف الخلوي مع نقص الأكسجة31،32.
Sirt1 ، وهو عضو في عائلة Sirtuin ، هو deacetylase يعتمد على NAD + يقلل من استقرار بروتين HIF-1α عن طريق إزالة الأسيتيل ، وبالتالي يحد من تراكمه النووي32. في ظل ظروف نقص الأكسجين ، يؤدي انخفاض مستويات ATP داخل الخلايا إلى زيادة نشاط AMPK ، مما يؤثر على النقل داخل الخلايا والاستقرار ونشاط النسخ ل HIF-1α والبروتينات المرتبطة به من خلال الفسفرة31،32،33. بالإضافة إلى ذلك ، يعدل Sirt1 و AMPK التفاعل بين HIF-1α والمنشطات المساعدة ، وبالتالي تنظيم نشاط النسخ وتسهيل التكيف الخلوي مع نقص الأكسجة33. في خلايا الدماغ المصابة بنقص الأكسجة ، تتفاعل AMPK و Sirt1 و HIF-1α للحفاظ على توازن الطاقة داخل الخلايا وتنظيم عمليات التمثيل الغذائي.
تتضمن الطرق البسيطة والفعالة لتقييم الثبات الحراري وإمكانات الارتباط لمجمعات البروتين المركب في المختبر تقنيات تقيم استقرار البروتينات عند ربط الترابط. من الثابت أن تفاعلات البروتين المركب تزيد من الثبات الحراري للبروتينات ، مما يجعلها أقل حساسية للتمسخ الناجم عن درجة الحرارة وينتج عنه إنتاج بروتين مستقر نسبيا. يوفر اختبار التحول الحراري الخلوي (CETSA) جنبا إلى جنب مع تحليل اللطخة الغربية ، على الرغم من عدم الكشف عن موقع الارتباط الدقيق ، نهجا منخفض التكلفة وفعالا لدراسة التفاعلات الدوائية المستهدفة والتأثيرات المحتملة خارج الهدف22،34. يستخدم CETSA على نطاق واسع للتحقق من صحة المشاركة المستهدفة للأدوية وتحديدها في الخلايا والأنسجة عبر الأنواع المختلفة.
في هذه الدراسة ، تم استخدام CETSA لتقييم ما إذا كان Sal يتفاعل مع AMPKα و p-AMPKα و Sirt1 و HIF-1α على المستوى الخلوي. بعد المعالجة الحرارية ، زاد Sal من التعبير عن هذه البروتينات ، مما يشير إلى تكوين مجمعات Sal-AMPKα و Sal-p-AMPKα و Sal-Sirt1 و Sal-HIF-1α المستقرة (الشكل 2). تتوافق هذه النتائج مع النتائج التجريبية السابقة21،24. وبالتالي ، فإن CETSA-western blot بمثابة نهج قوي وفعال للفحص على نطاق واسع لتفاعلات البروتين المركب والثبات الحراري في المختبر.
على الرغم من الأفكار المكتسبة حول آليات الحماية ل Sal على استقلاب طاقة الميتوكوندريا باستخدام تقنيات HPLC و CETSA ، لا تزال هناك قيود معينة. لا تقدم CETSA معلومات على مستوى الأحماض الأمينية فيما يتعلق بكيفية تأثير المركبات على الثبات الحراري للبروتين. قد يكون التقدم المحتمل هو دمج CETSA مع تقنيات التصوير لتحديد مواقع ربط المركبات داخل البروتينات بصريا ، مما يوفر فهما أوضح لكيفية مقاومة مجمعات البروتين المركب للتمسخ الناجم عن الحرارة. يتطلب تحقيق ذلك مزيدا من الابتكار العلمي والتصميم التجريبي المكرر. بالإضافة إلى ذلك ، فإن استكمال CETSA بتقنيات التفاعل الجزيئي الأخرى ، مثل رنين البلازمون السطحي الموضعي وقياس فلور المسح التفاضلي ، من شأنه أن يوفر تحليلا أكثر شمولا لتفاعلات البروتين المركب35.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (82274207 و 82474185) ، وإدارة العلوم والتكنولوجيا في مقاطعة سيتشوان (2024NSFSC1845) ، ومؤسسة العلوم لشباب إدارة العلوم والتكنولوجيا في مقاطعة سيتشوان (2023NSFSC1776) ، وبرنامج البحث والتطوير الرئيسي في نينغشيا (2023BEG02012) ، ومشروع دعم المواهب الشابة التابع للجمعية الصينية للطب الصيني لعام 2024-2026 (2024-QNRC2-B07) وأبحاث Xinglin Scholar مشروع الترويج لجامعة تشنغدو للطب الصيني التقليدي (XKTD2022013 و QJJJ2024027).
مساهمة المؤلف:
صمم هذا المشروع Xiaobo Wang و Yating Zhang و Ya Huu و Rui Li و Xianli Meng. أجرى Yating Zhang و Ya Hou و Tingting Kuang التجارب وقاموا بتحليل البيانات. كتب ياتينغ تشانغ وهونغ جيانغ المخطوطة. قام شياو بو وانغ وشيانلي منغ بمراجعة المخطوطة. لقد قرأ جميع المؤلفين المخطوطة النهائية ووافقوا عليها.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
References
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108 (2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532 (2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77 (2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094 (2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146 (2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762 (2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568 (2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404 (2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617 (2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278 (2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843 (2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82 (2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318 (2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858 (2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182 (2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127 (2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved