Research Article
Aperçu mécaniste de la protection mitochondriale du salidroside via la voie AMPK/Sirt1/HIF-1α dans les cellules hypoxiques HT22
Dans cet article
Résumé
La présente étude a identifié un mécanisme unique par lequel le salidroside exerce des effets protecteurs mitochondriaux sur les cellules hypoxiques HT22, en partie par la voie AMPK/Sirt1/HIF-1α.
Résumé
On a constaté que le salidroside (Sal), un ingrédient actif de Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba, exerce des effets protecteurs mitochondriaux en améliorant le métabolisme et en augmentant l’apport énergétique des cellules cérébrales dans des conditions hypoxiques. Cependant, son mécanisme d’action n’a pas été entièrement clarifié. Dans la présente étude, la chromatographie liquide à haute performance a d’abord été utilisée pour analyser les effets du Sal sur les niveaux de nucléotides (ATP, ADP et AMP). Le test CETSA (Cellular Thermal Shift Assay), une méthode d’interaction moléculaire largement utilisée pour valider et quantifier l’engagement des cibles médicamenteuses dans les cellules et les tissus de différentes espèces, a ensuite été choisi pour confirmer l’affinité de Sal pour les protéines liées à la voie AMPK/Sirt1/HIF-1α. Les résultats ont révélé que Sal augmentait les niveaux d’ATP et d’ADP dans les cellules hypoxiques HT22 tout en réduisant les niveaux d’AMP. De plus, Sal a montré une liaison stable aux protéines AMPKα, p-AMPKα, Sirt1 et HIF-1α. En conclusion, Sal peut exercer des effets protecteurs mitochondriaux en modulant la voie AMPK/Sirt1/HIF-1α pour réguler le contenu nucléotidique. Cette étude fournit une référence méthodologique pour l’analyse du contenu nucléotidique dans des échantillons cellulaires et contribue à l’identification et à la découverte de cibles pour des composés issus de la médecine traditionnelle chinoise.
Introduction
Le cerveau est très sensible à l’oxygène en raison de ses exigences métaboliques élevées, de sa capacité glycolytique limitée et de sa dépendance à la phosphorylation oxydative. Par conséquent, l’exposition à un environnement pauvre en oxygène à haute altitude peut facilement entraîner des lésions cérébrales hypobares et hypoxiques (HHBI)1,2. Des études épidémiologiques indiquent que lorsque des individus non acclimatés à la haute altitude montent rapidement vers des régions de haute altitude, l’incidence du mal aigu des montagnes peut atteindre jusqu’à 75 %, avec un taux de mortalité d’environ 1 % pour les cas graves. De plus, en l’absence de soins médicaux, les taux de mortalité par œdème cérébral ou pulmonaire de haute altitude peuvent atteindre 40 %3,4.
L’HHBI se manifeste par un large éventail de symptômes cliniques. Les cas légers à modérés peuvent inclure des maux de tête, des étourdissements et des pertes de mémoire5, tandis que les cas graves peuvent entraîner des troubles cognitifs, une altération de la conscience et des issues potentiellement mortelles5. La prévention et le traitement de l’HHBI dans les régions d’altitude sont devenus un axe clé de la recherche médicale. Les stratégies préventives impliquent principalement un entraînement adaptatif dans des environnements de haute altitude, y compris un repos adéquat, une alimentation équilibrée, une bonne nutrition et un exercice physique approprié 6,7. De plus, les interventions pharmacologiques visant à protéger les cellules cérébrales et à soulager l’hypoxie cérébrale restent au cœur de la recherche actuelle sur les HHBI.
Les mitochondries servent de centres de production d’énergie primaire dans les cellules, synthétisant l’adénosine triphosphate (ATP) pour répondre aux demandes d’énergie cellulaire. Dans des conditions hypoxiques, la production d’énergie mitochondriale diminue, ce qui entraîne une réduction des niveaux d’ATP et une altération de la fonction cellulaire8. La lésion hypoxique perturbe également la régulation mitochondriale de Ca2+ et l’homéostasie du pH, déclenchant l’apoptose et la nécrose 9,10. Il existe une relation de renforcement mutuel entre le dysfonctionnement mitochondrial et les lésions cérébrales hypoxiques. D’une part, l’insuffisance mitochondriale induite par l’hypoxie exacerbe le manque d’oxygène en réduisant davantage le métabolisme énergétique cellulaire, créant ainsi un cercle vicieux. D’autre part, le dysfonctionnement mitochondrial élève les niveaux intracellulaires de Ca2+, activant les cascades apoptotiques et conduisant à la mort cellulaire11. Bien que les mécanismes sous-jacents aux lésions cérébrales hypoxiques restent complexes et ne soient pas entièrement compris, de nombreuses études ont identifié une altération du métabolisme énergétique mitochondrial neuronal comme un facteur critique de sa pathogenèse12,13. Par conséquent, une exploration plus approfondie de la fonction mitochondriale pourrait fournir des informations précieuses sur les cibles thérapeutiques potentielles des lésions cérébrales hypoxiques.
Le salidroside (Sal) est un ingrédient actif extrait de la plante de plateau Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba et est largement utilisé dans les produits alimentaires, de santé et pharmaceutiques14. La formule moléculaire de Sal est C14H20O7, et il est également connu sous le nom de 2-(4-hydroxyphényl)-éthyle β-D-glucopyranoside. Il possède diverses propriétés pharmacologiques, notamment des effets protecteurs anti-hypoxie, antioxydants, anti-fatigue, antitumoraux, immunomodulateurs, anti-inflammatoires et cardiovasculaires et cérébrovasculaires 15,16,17. Parmi ceux-ci, son effet anti-hypoxie est l’un des plus documentés. Des études récentes ont de plus en plus mis en évidence les effets protecteurs mitochondriaux significatifs de Sal en tant que mécanisme potentiel de ses effets préventifs et thérapeutiques sur les lésions cérébrales induites par le plateau chez la souris14,18. Cependant, les mécanismes moléculaires précis par lesquels Sal influence les niveaux d’ATP, d’ADP et d’AMP restent mal compris.
La protéine kinase activée par l’AMP (AMPK) agit comme un capteur d’énergie clé qui aide à maintenir l’homéostasie de l’énergie cellulaire. L’activation de l’AMPK stimule la sirtuine 1 (Sirt1), entraînant une augmentation des niveaux intracellulaires de NAD+ 19. Des études ont montré que Sirt1 peut réguler le facteur 1-alpha inductible par l’hypoxie (HIF-1α) pour coordonner la réponse cellulaire à l’hypoxie20. Des recherches antérieures ont démontré que Sal inhibe l’ouverture du pore de transition de perméabilité mitochondriale neuronale, régule les processus énergétiques mitochondriaux médiés par HIF-1α, atténue l’apoptose neuronale et maintient l’intégrité de la barrière hémato-encéphalique, protégeant ainsi les rats contre les lésions cérébrales induites par le plateau14,21. Cependant, l’effet de Sal sur l’ATP et ses métabolites, l’ADP et l’AMP, reste incertain.
Pour étudier cela, la chromatographie liquide à haute performance (HPLC) a d’abord été utilisée pour quantifier les niveaux de ces trois nucléotides. De plus, le test de décalage thermique cellulaire (CETSA), une technique biophysique largement utilisée introduite en 2013 pour étudier les interactions ligand-protéine dans les cellules intactes22, a été utilisé. Cette méthode est couramment appliquée pour valider et quantifier l’engagement médicament-cible dans les cellules et les tissus de différentes espèces. Plus précisément, après avoir co-incubé des lysats de cellules cibles avec le médicament à des températures variables pendant une durée déterminée, la protéine liée au médicament présente une stabilité thermique accrue, ce qui la rend moins sujette à la dénaturation et à la précipitation. Les protéines non liées précipitées sont ensuite éliminées par centrifugation, et les interactions médicament-cible sont ensuite identifiées par l’analyse par transfert Western du surnageant22. Afin d’identifier des cibles moléculaires potentielles de Sal, CETSA a été sélectionné pour évaluer son affinité de liaison avec les protéines liées à la voie AMPK/Sirt1/HIF-1α.
Protocole
Les détails commerciaux des réactifs et de l’équipement utilisés dans cette étude sont fournis dans la table des matériaux.
1. Préparation de la solution
- Préparez le milieu Eagle modifié de Dulbecco (DMEM) complet en ajoutant 10 % de sérum de veau fœtal et 1 % de pénicilline-streptomycine.
- Préparez une solution de 20 mM de Sal en dissolvant 3 mg de Sal dans 500 μL de solution saline tamponnée au phosphate (PBS)21.
- Filtrer 500 mL d’acétonitrile pur par chromatographie (phase A mobile) à l’aide d’une membrane organique de 0,45 μm.
- Préparez 1000 mL de phase B mobile en ajoutant 3,5 mL de réactif I à 1 L d’eau déminéralisée. Ajustez le pH à 6,15 avec le réactif II, en suivant les instructions du kit de dosage de la teneur en nucléotides (ATP, ADP et AMP) (voir la table des matériaux).
REMARQUE : Les réactifs I et II sont inclus dans le kit de dosage de la teneur en nucléotides (ATP, ADP et AMP). - Filtrer la phase B mobile à l’aide d’une membrane aqueuse de 0,22 μm.
REMARQUE : La phase mobile B doit être utilisée immédiatement après la préparation. Les phases mobiles A et B doivent être soniquées pendant 30 minutes avant utilisation pour éliminer les bulles d’air. - Diluer une solution mère étalon de 1 μM ATP, ADP et AMP avec de l’eau désionisée pour obtenir des solutions étalons des séries ATP, ADP et AMP de 0,5 μM, 0,1 μM, 0,05 μM, 0,01 μM et 0,005 μM.
- Filtrez la série de solutions standard à l’aide d’une membrane filtrante microporeuse de type aiguille de 0,22 μm.
REMARQUE : Des flacons d’injection bruns doivent être utilisés pour stocker les solutions étalons en série. La série préparée de solutions standard doit être utilisée dès que possible.
2. Culture cellulaire
REMARQUE : La culture cellulaire HT22 et le modèle d’hypoxie stimulée par le CoCl2 ont été établis selon un rapport précédent21.
- Cultivez des cellules HT22 à 37 °C avec 5 % de CO2 jusqu’à ce que 80 % de confluence soit atteinte dans la boîte de Pétri. Digérer les cellules avec de la trypsine à 0,25 % pendant 1 min.
- Ensemencez 2 × 10cellules de 5 cellules de l’étape 2.1 dans des plaques à 6 puits avec du DMEM complet (groupe témoin sans traitement médicamenteux) ou du DMEM complet contenant le médicament (250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal et 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). Incuber pendant 24 h à 37 °C avec 5 % de CO2.
REMARQUE : Trois échantillons parallèles ont été mis en place dans chaque groupe.
3. Dosage de la teneur en nucléotides (ATP, ADP et AMP)
- Ajouter 1 mL de réactif d’extraction I dans chaque puits des plaques à 6 puits de l’étape 2.2.
REMARQUE : Le réactif d’extraction I est inclus dans le kit de dosage de la teneur en nucléotides (ATP, ADP et AMP) (voir la table des matériaux). - Lyser les cellules par soniquation sur un bain de glace à l’aide d’un appareil de perturbation de cellule à ultrasons (puissance : 300 W, ondes ultrasonores pendant 3 s, intervalle de 7 s, durée totale : 3 min).
- Centrifuger les cellules lysées à 10 304 × g pendant 10 min à 4 °C à l’aide d’une centrifugeuse réfrigérée à grande vitesse.
- Transvaser 0,75 mL de surnageant de l’étape 3.3 dans un tube de 2,0 mL. Ajouter 0,75 mL de réactif d’extraction II, agiter et mélanger à l’aide d’un mélangeur vortex, puis centrifuger à nouveau à 10 304 × g pendant 10 min à 4 °C.
REMARQUE : Le réactif d’extraction II est inclus dans le kit de dosage de la teneur en nucléotides (ATP, ADP et AMP). - Pipeter le surnageant à partir de l’étape 3.4 et le filtrer à l’aide d’une membrane filtrante microporeuse de type aiguille de 0,22 μm dans un flacon brun.
REMARQUE : L’ATP, L’ADP et l’AMP dans l’échantillon extrait ne sont pas stables. Toutes les procédures expérimentales doivent être effectuées à basse température ou sur de la glace. Les échantillons doivent être traités et analysés dès que possible. - Ouvrez le logiciel de chromatographie et réglez les paramètres suivants : volume d’injection : 10 μL ; température de la colonne : 27 °C ; débit : 0,8 mL/min ; longueur d’onde de détection : 254 nm ; Durée de détection : 70 min. Réglez la procédure d’élution du gradient conformément au tableau 1.
- Cliquez sur le bouton Exécuter pour injecter automatiquement l’échantillon et détecter le contenu de l’ATP, de l’ADP et de l’AMP dans les solutions standard en série (étape 1.7) et les solutions d’échantillon (étape 3.5) conformément au programme défini à l’étape 3.6.
REMARQUE : À la fin de l’expérience, laver la colonne chromatographique avec 98 % de phase B mobile pour éviter le colmatage. - Tracez les courbes standard de l’ATP, de l’ADP et de l’AMP à l’aide d’un logiciel de graphique et d’analyse statistique, avec des concentrations standard en série sur l’axe des x et des zones de pics sur l’axe des y.
- Calculez la teneur en ATP, en ADP et en AMP dans les échantillons à l’aide de l’équation de la courbe standard de l’étape 3.8.
4. Essai de décalage thermique cellulaire (CETSA)
- Lyser des cellules HT22 normales pendant 20 minutes dans une boîte de Pétri à l’aide d’un lysat contenant un inhibiteur de protéase (lysat : inhibiteur de protéase = 100:1) en pipetant les cellules à plusieurs reprises.
REMARQUE : Effectuez cette étape sur un bain de glace pour éviter la dégradation des protéines. - Prélever le lysat cellulaire à partir de l’étape 4.1 et le sonicate dans un bain de glace à l’aide d’un appareil de rupture cellulaire à ultrasons (puissance : 300 W, ondes ultrasonores pendant 3 s, intervalle de 7 s, temps total : 3 min). Centrifuger à 10 304 × g, 4 °C pendant 20 min et recueillir le surnageant.
REMARQUE : Divisez le surnageant en 14 portions : 7 groupes pour la coïncidation avec Sal et 7 groupes pour la coïncidation avec PBS comme contrôle. Pour le groupe traité au Sal, ajouter 100 μL de surnageant et 0,1 μL de 20 μM de Sal par échantillon. Pour le groupe témoin, ajouter 100 μL de surnageant et 0,1 μL de PBS par échantillon. - Incuber chaque échantillon à température ambiante pendant 30 min, puis incuber à 37 °C, 42 °C, 47 °C, 52 °C, 57 °C, 62 °C et 67 °C pendant 3 min à l’aide d’un appareil de contrôle de la température de chauffage en métal.
- Centrifuger les échantillons de l’étape 4.3 à 10 304 × g pendant 20 min à 4 °C et prélever le surnageant à l’aide d’une pipette.
- Mesurer la concentration totale en protéines du surnageant à partir de l’étape 4.4 à l’aide d’une trousse de dosage de la concentration en protéines BCA, en suivant les instructions du fabricant (voir le tableau des matières).
- Préparez le gel de séparation à 10 % à l’aide d’un kit de préparation rapide de gel PAGE, en suivant les instructions du fabricant (voir le tableau des matériaux).
- Chargez 3 μL de marqueur de protéine de couleur pré-coloré et 14 μL d’échantillons dans les puits du gel de séparation (quantité finale de protéines par puits : 20 μg).
- Faites fonctionner le gel à l’aide d’un tampon d’électrophorèse pendant 1 h à 80-100 mV pour obtenir des protéines séparées.
- Transférez les protéines de l’étape 4.8 sur une membrane PVDF à l’aide d’une solution de transfert membranaire rapide et d’une structure sandwich (coton-papier filtre-membrane PVDF-gel protéique-papier filtre-coton) à 400 mA pendant 30 min.
- Bloquez les membranes PVDF à partir de l’étape 4.9 avec une solution d’albumine sérique bovine (BSA) à 5 % pendant 1 à 2 h à température ambiante.
REMARQUE : Préparez une solution de BSA à 5 % en dissolvant 5 mg de poudre de BSA dans 100 mL de solution de TBST contenant 100 mL de tampon TBS et 0,05 % de Tween 20. - Incuber les membranes PVDF à partir de l’étape 4.10 avec 5 mL d’anticorps primaire dilué à 4 °C pendant la nuit.
REMARQUE : Diluer l’anticorps primaire dans une solution de BSA (rapport 1:1000). - Lavez les membranes PVDF trois fois avec du TBST pendant 5 minutes chacune pour éliminer les anticorps primaires non liés.
- Incuber les membranes à partir de l’étape 4.12 avec un anticorps secondaire couplé à la peroxydase de raifort dilué (HRP) pendant 2 h à température ambiante sur un agitateur de décoloration.
REMARQUE : Diluer l’anticorps secondaire couplé à la HRP dans une solution de BSA (rapport 1:10 000). - Lavez les membranes trois fois avec du TBST pendant 5 minutes chacune pour éliminer les anticorps secondaires résiduels.
- Couvrez les membranes à partir de l’étape 4.14 avec un révélateur de chimiluminescence ECL, puis imagez le signal de la protéine cible à l’aide d’un système d’imagerie.
REMARQUE : Effectuez cette étape dans l’obscurité pour éviter l’extinction de la fluorescence. - Analysez et quantifiez la valeur de gris des protéines cibles à l’aide du logiciel ImageJ (voir T able des matériaux).
Résultats
Les courbes standard pour l’ATP, l’ADP et l’AMP détectées par HPLC étaient Y = 7006,5X - 222,99, Y = 5217,3X - 17,796 et Y = 9280,1X + 22,749, respectivement (Figure 1A-C). Les teneurs en nucléotides mesurées dans chaque groupe par HPLC ont été calculées à l’aide des courbes standard (Figure 1D-I). Il a été constaté que le CoCl2 réduisait significativement les niveaux d’ATP et d’ADP dans les cellules HT22 par rapport au groupe témoin (P < 0,01, Figure 1J,K). De plus, l’administration de dorsomorphine (Dor), un inhibiteur de l’AMPK, a entraîné une réduction marquée des taux d’ATP et d’ADP par rapport au groupe traité par CoCl2 (P < 0,01, Figure 1J,K). Cependant, le traitement par Sal a significativement augmenté les taux d’ATP et d’ADP par rapport au groupe traité par CoCl2 (P < 0,05, Figure 1J,K).
Une analyse plus approfondie a révélé que les niveaux d’AMP ont augmenté de manière significative dans le groupe traité par CoCl2, tandis que le traitement par Sal a efficacement limité cette augmentation (P < 0,01, Figure 1L). Une bonne fonction mitochondriale est essentielle au maintien de l’homéostasie intracellulaire de l’ATP, de l’ADP et de l’AMP, ainsi que des fonctions physiologiques cellulaires normales. L’état fonctionnel des mitochondries influence directement le taux de conversion et l’équilibre de l’ATP, de l’ADP et de l’AMP. Les dommages ou le dysfonctionnement des mitochondries peuvent altérer la synthèse de l’ATP et réduire les taux de conversion de l’ADP et de l’AMP, perturbant ainsi l’approvisionnement en énergie cellulaire et l’équilibre métabolique.
Ces résultats suggèrent que Sal peut atténuer les lésions hypoxiques dans les cellules HT22 en modulant la conversion de l’ATP, de l’ADP et de l’AMP. De plus, l’analyse CETSA de la liaison de Sal aux protéines associées aux mitochondries a démontré une augmentation de la stabilité thermique d’AMPKα, de p-AMPKα, de Sirt1 et de HIF-1α après un traitement par Sal. Cela suggère que Sal peut interagir avec ces protéines (Figure 2), ce qui est cohérent avec les résultats d’études antérieures 21,23,24.
DISPONIBILITÉ DES DONNÉES :
Toutes les données brutes sont fournies (Fichier supplémentaire 1 et Fichier supplémentaire 2).

Figure 1 : Effet du Sal sur la teneur en nucléotides (ATP, ADP et AMP). (A-C) Courbes standard pour l’ATP (A), l’ADP (B) et l’AMP (C). (D-I) Courbes HPLC représentatives pour la détermination de la teneur en ATP, ADP et AMP dans différents groupes de traitement. (J-L) Analyse statistique de la teneur en ATP, ADP et AMP dans différents groupes de traitement (contrôle, 250 μM CoCl2, 250 μM CoCl2 + 10 μM Dor, 250 μM CoCl2 + 20 μM Sal et 250 μM CoCl2 + 10 μM Dor + 20 μM Sal). (n = 3, *P < 0,05, **P < 0,01). Veuillez cliquer ici pour voir une version agrandie de cette figure.
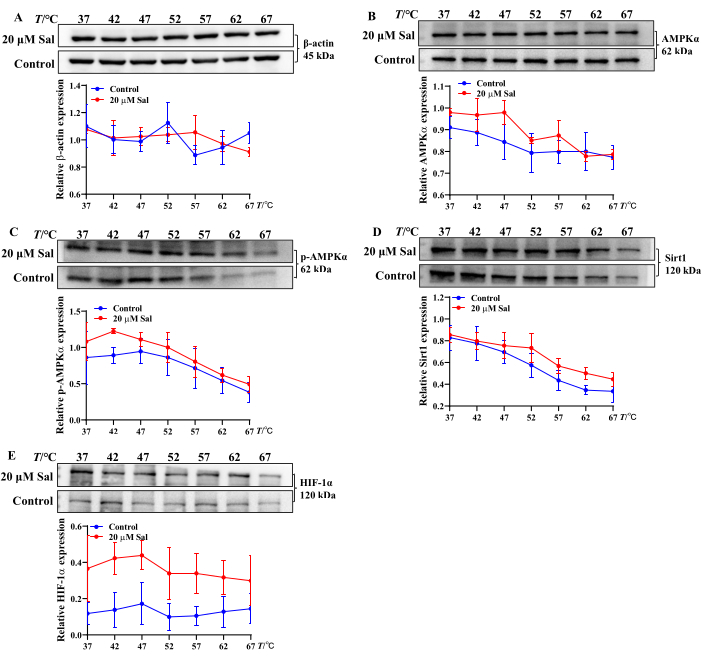
Figure 2 : Évaluation des propriétés de liaison de Sal aux protéines associées à la voie AMPK/Sirt1/HIF-1α à l’aide de la méthode CETSA. Les bandes protéiques β-actine (A), AMPKα (B), p-AMPKα (C), Sirt1 (D) et HIF-1α (E) et les tendances d’expression dans les cellules HT22 ont été évaluées par CETSA (n = 3). Les propriétés de liaison de Sal avec différentes protéines ont été analysées à l’aide de logiciels statistiques et graphiques à différentes températures. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Temps (min) | Phase mobile | |
| Solvant A | Solvant B | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
Tableau 1 : Procédure d’élution en phase mobile.
Fichier supplémentaire 1 : Données brutes pour la détection de l’ATP, de l’ADP et de l’AMP par HPLC. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 2 : Bandes protéiques CETSA. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les mitochondries sont des organites clés impliqués dans la prévention thérapeutique de l’HHBI 23,24,25. Des études antérieures du groupe ont confirmé que Sal régule l’expression des protéines AMPK, Sirt1 et HIF-1α, améliorant ainsi la fonction mitochondriale neuronale et protégeant contre HHBI21,24. Cependant, l’effet direct de Sal sur les nucléotides dans les cellules hypoxiques nécessite des recherches plus approfondies. De plus, l’évaluation du potentiel de liaison des composés et des protéines dans des conditions de température variables est essentielle pour comprendre leurs interactions.
Pour aborder ces aspects, la présente étude a examiné l’effet de Sal sur les niveaux mitochondriaux d’ATP, d’ADP et d’AMP dans les cellules HT22 à l’aide de la HPLC, fournissant un aperçu direct de son rôle dans le métabolisme énergétique mitochondrial. Sur la base d’une étude précédente18, 250 μM de CoCl2 ont été sélectionnés pour induire l’hypoxie dans les cellules HT22. Les résultats ont démontré que Sal augmentait significativement les niveaux d’ATP et d’ADP tout en réduisant la teneur en AMP dans les cellules hypoxiques HT22 (Figure 1). Combinés aux résultats antérieurs du groupe, ces résultats confirment que Sal exerce un effet protecteur sur les mitochondries dans les neurones hypoxiques.
L’AMPK est une protéine kinase hautement conservée chez les eucaryotes qui régule le métabolisme énergétique. Il détecte les changements dans les niveaux cellulaires d’ATP, d’ADP et d’AMP pour coordonner le métabolisme du glucose, la synthèse des acides gras et la biogenèse mitochondriale en phosphorylant divers substrats26. L’activation de l’AMPK favorise la production d’énergie et supprime la dépense énergétique, en particulier en réponse à la réduction des niveaux d’ATP intracellulaires et aux niveaux élevés d’AMP27. De plus, l’AMPK augmente les réserves d’ATP en phosphorylant la glucoamylase, en modifiant la catalyse enzymatique et en générant rapidement de l’ATP à partir du pool phosphoarginine-arginine28.
Dans la présente étude, Dor, un inhibiteur sélectif de l’AMPK phosphorylé, a été utilisé pour étudier les effets de Sal sur les niveaux de nucléotides29. La HPLC a été utilisée pour quantifier les niveaux d’ATP, d’ADP et d’AMP dans les cellules HT22 traitées au CoCl2 exposées au Dor seul ou en combinaison avec Sal. Les résultats indiquent que Sal module le rapport ATP/ADP/AMP, exerçant ainsi des effets neuroprotecteurs contre l’hypoxie (Figure 1). La méthode HPLC établie offre une approche intuitive, simple et efficace pour évaluer directement les effets des composés bioactifs sur les nucléotides au niveau cellulaire.
HIF-1α est un facteur de transcription activé en réponse à une stimulation hypoxique. Dans des conditions hypoxiques, la stabilité de HIF-1α augmente considérablement, ce qui lui permet de se déplacer du cytoplasme au noyau, où il forme un hétérodimère avec HIF-1β30. Ce processus favorise l’expression des gènes impliqués dans l’angiogenèse, le métabolisme du glucose et la glycolyse 31,32,33. De plus, il a été démontré que la stabilité de HIF-1α est fortement corrélée avec la fonction mitochondriale et les niveaux intracellulaires d’O2 pendant la phosphorylation oxydative31. Cependant, le dysfonctionnement mitochondrial induit par l’hypoxie conduit à un apport énergétique intracellulaire insuffisant, qui à son tour active la voie HIF-1α pour réguler l’adaptation cellulaire à l’hypoxie31,32.
Sirt1, membre de la famille des sirtuines, est une désacétylase dépendante du NAD+ qui réduit la stabilité de la protéine HIF-1α par désacétylation, limitant ainsi son accumulation nucléaire32. Dans des conditions hypoxiques, la diminution des niveaux d’ATP intracellulaire entraîne une augmentation de l’activité de l’AMPK, qui influence le transport intracellulaire, la stabilité et l’activité transcriptionnelle de HIF-1α et de ses protéines associées par phosphorylation 31,32,33. De plus, Sirt1 et AMPK modulent l’interaction entre HIF-1α et les coactivateurs, régulant ainsi son activité transcriptionnelle et facilitant davantage l’adaptation cellulaire à l’hypoxie33. Dans les cellules cérébrales endommagées par l’hypoxie, AMPK, Sirt1 et HIF-1α interagissent pour maintenir l’homéostasie énergétique intracellulaire et réguler les processus métaboliques.
Des méthodes simples et efficaces pour évaluer la thermostabilité et le potentiel de liaison des complexes composés-protéines in vitro comprennent des techniques qui évaluent la stabilité des protéines lors de la liaison des ligands. Il est bien établi que les interactions composé-protéine augmentent la thermostabilité des protéines, ce qui les rend moins sensibles à la dénaturation induite par la température et se traduit par un rendement protéique relativement stable. Le test de décalage thermique cellulaire (CETSA) combiné à l’analyse par transfert Western, bien qu’il ne révèle pas le site de liaison exact, offre une approche peu coûteuse et efficace pour étudier les interactions médicament-cible et les effets hors cible potentiels22,34. CETSA est largement utilisé pour valider et quantifier l’engagement des cibles médicamenteuses dans les cellules et les tissus de différentes espèces.
Dans cette étude, CETSA a été utilisé pour évaluer si Sal interagit avec AMPKα, p-AMPKα, Sirt1 et HIF-1α au niveau cellulaire. Après le traitement thermique, Sal a augmenté l’expression de ces protéines, suggérant la formation de complexes stables Sal-AMPKα, Sal-p-AMPKα, Sal-Sirt1 et Sal-HIF-1α (Figure 2). Ces résultats s’alignent sur les résultats expérimentaux précédents21,24. CETSA-western blot constitue donc une approche robuste et efficace pour le criblage à grande échelle des interactions composés-protéines et de la thermostabilité in vitro.
Malgré les connaissances acquises sur les mécanismes de protection de Sal sur le métabolisme énergétique mitochondrial à l’aide des techniques HPLC et CETSA, certaines limites subsistent. CETSA ne fournit pas d’informations au niveau des acides aminés sur la façon dont les composés influencent la thermostabilité des protéines. Une avancée potentielle serait l’intégration de CETSA aux technologies d’imagerie pour identifier visuellement les sites de liaison des composés dans les protéines, offrant une compréhension plus claire de la façon dont les complexes composés-protéines résistent à la dénaturation induite par la chaleur. Pour y parvenir, il faut davantage d’innovation scientifique et une conception expérimentale affinée. De plus, le fait de compléter CETSA par d’autres techniques d’interaction moléculaire, telles que la résonance plasmonique de surface localisée et la fluorimétrie différentielle à balayage, permettrait d’obtenir une analyse plus complète des interactions composé-protéine35.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (82274207 et 82474185), le Département des sciences et de la technologie de la province du Sichuan (2024NSFSC1845), la Fondation scientifique pour les jeunes du Département des sciences et de la technologie de la province du Sichuan (2023NSFSC1776), le Programme clé de recherche et de développement du Ningxia (2023BEG02012), le Projet de soutien aux jeunes talents de l’Association chinoise de médecine chinoise pour 2024-2026 (2024-QNRC2-B07) et le Xinglin Scholar Research Projet de promotion de l’Université de Chengdu de MTC (XKTD2022013 et QJJJ2024027).
CONTRIBUTION DE L’AUTEUR :
Ce projet est conçu par Xiaobo Wang, Yating Zhang, Ya Hou, Rui Li et Xianli Meng. Yating Zhang, Ya Hou et Tingting Kuang ont réalisé les expériences et analysé les données. Yating Zhang et Hong Jiang ont écrit le manuscrit. Xiaobo Wang et Xianli Meng ont révisé le manuscrit. Tous les auteurs ont lu et approuvé le manuscrit final.
matériels
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
Références
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108(2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532(2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77(2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094(2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146(2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762(2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568(2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404(2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529(2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617(2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278(2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843(2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82(2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318(2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858(2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182(2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127(2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287(2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon