Research Article
תובנות מכניסטיות לגבי ההגנה המיטוכונדריאלית של Salidroside באמצעות מסלול AMPK/Sirt1/HIF-1α בתאי HT22 היפוקסיים
In This Article
Summary
המחקר הנוכחי זיהה מנגנון ייחודי שבאמצעותו סלידרוסיד מפעיל השפעות הגנה מיטוכונדריאליות על תאי HT22 היפוקסיים, בין השאר באמצעות מסלול AMPK/Sirt1/HIF-1α.
Abstract
נמצא כי להלידרוזיד (Sal), מרכיב פעיל של Rhodiola crenulata (Hook. f. et Thoms.) נמצא כי H. Ohba מפעיל השפעות מגנות על המיטוכונדריה על-ידי שיפור חילוף החומרים ושיפור אספקת האנרגיה של תאי המוח בתנאים היפוקסיים. עם זאת, מנגנון הפעולה שלו לא הובהר במלואו. במחקר הנוכחי, נעשה שימוש לראשונה בכרומטוגרפיה נוזלית בעלת ביצועים גבוהים כדי לנתח את ההשפעות של Sal על רמות הנוקלאוטידים (ATP, ADP ו-AMP). בדיקת ההסטה התרמית התאית (CETSA), שיטת אינטראקציה מולקולרית בשימוש נרחב לאימות וכימות מעורבות מטרת תרופות בתאים ורקמות על פני מינים שונים, נבחרה לאחר מכן כדי לאשר את הזיקה של Sal לחלבונים הקשורים למסלול AMPK/Sirt1/HIF-1α. התוצאות חשפו כי Sal העלה את רמות ה-ATP וה-ADP בתאי HT22 היפוקסיים תוך הפחתת רמות ה-AMP. יתר על כן, Sal הפגין קשירה יציבה לחלבוני AMPKα, p-AMPKα, Sirt1 ו-HIF-1α. לסיכום, סאל עשוי להפעיל השפעות הגנה מיטוכונדריאליות על ידי אפנון מסלול AMPK/Sirt1/HIF-1α כדי לווסת את תכולת הנוקלאוטידים. מחקר זה מספק התייחסות מתודולוגית לניתוח תכולת נוקלאוטידים בדגימות תאים ותורם לזיהוי וגילוי מטרות לתרכובות שמקורן ברפואה הסינית המסורתית.
Introduction
המוח רגיש מאוד לחמצן בשל הדרישות המטבוליות הגבוהות שלו, היכולת הגליקוליטית המוגבלת והתלות בזרחון חמצוני. כתוצאה מכך, חשיפה לסביבה דלת חמצן בגבהים גבוהים עלולה להוביל בקלות לפגיעה מוחית היפוברית (HHBI)1,2. מחקרים אפידמיולוגיים מצביעים על כך שכאשר אנשים שאינם מתאקלמים בגבהים גבוהים עולים במהירות לאזורים גבוהים, שכיחות מחלת הרים חריפה יכולה להגיע עד 75%, עם שיעור תמותה של כ-1% במקרים קשים. יתר על כן, בהיעדר טיפול רפואי, שיעורי התמותה מבצקת מוחית או ריאתית בגובה רב יכולים להגיע עד 40%3,4.
HHBI מציג קשת רחבה של תסמינים קליניים. מקרים קלים עד בינוניים עשויים לכלול כאבי ראש, סחרחורת ואובדן זיכרון5, בעוד שמקרים חמורים עלולים לגרום לפגיעה קוגניטיבית, שינוי בהכרה ותוצאות שעלולות להיות קטלניות5. מניעה וטיפול ב-HHBI באזורים בגובה רב הפכו למוקד מרכזי של המחקר הרפואי. אסטרטגיות מניעה כוללות בעיקר אימונים אדפטיביים בסביבות גבוהות, כולל מנוחה מספקת, תזונה מאוזנת, תזונה נכונה ופעילות גופנית מתאימה 6,7. בנוסף, התערבויות פרמקולוגיות שמטרתן להגן על תאי המוח ולהקל על היפוקסיה מוחית נותרו מרכזיות במחקר הנוכחי של HHBI.
המיטוכונדריה משמשים כמרכזי ייצור האנרגיה העיקריים בתוך התאים, ומסנתזים אדנוזין טריפוספט (ATP) כדי לעמוד בדרישות האנרגיה התאית. בתנאים היפוקסיים, ייצור האנרגיה המיטוכונדריאלית יורד, מה שמוביל לירידה ברמות ה-ATP ולפגיעה בתפקוד התאים8. הפגיעה ההיפוקסית משבשת גם את הוויסות המיטוכונדריאלי של הומאוסטזיס Ca2+ ו-pH, ומעוררת אפופטוזיס ונמק 9,10. קיים קשר מחזק הדדי בין תפקוד לקוי של המיטוכונדריה לבין פגיעה מוחית היפוקסית. מצד אחד, פגיעה במיטוכונדריה הנגרמת על ידי היפוקסיה מחמירה את המחסור בחמצן על ידי הפחתה נוספת של חילוף החומרים באנרגיה תאית, ויוצרת מעגל קסמים. מצד שני, תפקוד לקוי של המיטוכונדריה מעלה את רמות ה-Ca2+ התוך-תאי, מפעיל מפלים אפופטוטיים ומוביל למוות תאי11. למרות שהמנגנונים העומדים בבסיס פגיעה מוחית היפוקסית נותרו מורכבים ולא מובנים במלואם, מחקרים רבים זיהו פגיעה בחילוף החומרים של אנרגיה מיטוכונדריאלית עצבית כגורם קריטי בפתוגנזה שלה12,13. לכן, חקירה נוספת של תפקוד המיטוכונדריה עשויה לספק תובנות חשובות לגבי מטרות טיפוליות פוטנציאליות לפגיעה מוחית היפוקסית.
סלידרוזיד (Sal) הוא מרכיב פעיל המופק מצמח המישור Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba ונמצא בשימוש נרחב במוצרי בריאות מזון ותרופות14. הנוסחה המולקולרית של Sal היא C14H20O7, והיא ידועה גם בשם 2-(4-hydroxyphenyl)-ethyl β-D-glucopyranoside. יש לו תכונות פרמקולוגיות מגוונות, כולל אנטי היפוקסיה, נוגד חמצון, אנטי עייפות, אנטי גידולים, אימונומודולטוריים, אנטי דלקתיים והשפעות הגנה קרדיווסקולריותוכלי דם מוחיים 15,16,17. בין אלה, השפעתו נגד היפוקסיה היא אחת המתועדות ביותר. מחקרים אחרונים הדגישו יותר ויותר את ההשפעות המגנות המיטוכונדריאליות המשמעותיות של Sal כמנגנון פוטנציאלי להשפעות המניעה והטיפוליות שלו על פגיעה מוחית הנגרמת על ידי מישור בעכברים14,18. עם זאת, המנגנונים המולקולריים המדויקים שבאמצעותם Sal משפיע על רמות ATP, ADP ו-AMP נותרו לא מובנים היטב.
חלבון קינאז המופעל על ידי AMP (AMPK) פועל כחיישן אנרגיה מרכזי המסייע בשמירה על הומאוסטזיס של אנרגיה תאית. הפעלת AMPK מגרה את Sirtuin 1 (Sirt1), מה שמוביל לעלייה ברמות NAD+ תוך-תאיות19. מחקרים הראו כי Sirt1 יכול לווסת את גורם 1-אלפא המעורר היפוקסיה (HIF-1α) כדי לתאם את התגובה התאית להיפוקסיה20. מחקרים קודמים הראו כי Sal מעכב את פתיחת נקבוביות המעבר של חדירות המיטוכונדריה העצבית, מווסת תהליכי אנרגיה מיטוכונדריאלית בתיווך HIF-1α, מחליש אפופטוזיס עצבי ושומר על שלמות מחסום הדם-מוח, ובכך מגן על חולדות מפני פגיעה מוחית הנגרמת על ידי מישור14,21. עם זאת, ההשפעה של Sal על ATP והמטבוליטים שלו, ADP ו-AMP, נותרה לא ודאית.
כדי לחקור זאת, נעשה שימוש לראשונה בכרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC) כדי לכמת את הרמות של שלושת הנוקלאוטידים הללו. בנוסף, נעשה שימוש בבדיקת השינוי התרמי התאי (CETSA), טכניקה ביופיזיקלית בשימוש נרחב שהוצגה בשנת 2013 כדי לחקור אינטראקציות ליגנד-חלבון בתאים שלמים22. שיטה זו מיושמת בדרך כלל כדי לאמת ולכמת את מעורבות מטרת התרופה בתאים וברקמות על פני מינים שונים. באופן ספציפי, לאחר דגירה משותפת של תאי מטרה עם התרופה בטמפרטורות משתנות למשך זמן מוגדר, החלבון הקשור לתרופה מפגין יציבות תרמית מוגברת, מה שהופך אותו פחות נוטה לדנטורציה ומשקעים. החלבונים הלא קשורים המשקעים מוסרים לאחר מכן באמצעות צנטריפוגה, ואינטראקציות בין תרופות למטרה מזוהות לאחר מכן באמצעות ניתוח כתמים מערביים של הסופרנטנט22. כדי לזהות מטרות מולקולריות פוטנציאליות של Sal, CETSA נבחרה כדי להעריך את זיקת הקישור שלה לחלבונים הקשורים למסלול AMPK/Sirt1/HIF-1α.
Protocol
הפרטים המסחריים של הריאגנטים והציוד המשמש במחקר זה מסופקים בטבלת החומרים.
1. הכנת פתרון
- הכינו את מדיום הנשר המותאם (DMEM) של Dulbecco על ידי הוספת 10% סרום בקר עוברי ו-1% פניצילין-סטרפטומיצין.
- הכן תמיסת Sal של 20 מ"מ על ידי המסת 3 מ"ג של Sal ב-500 מיקרוליטר של מי מלח עם חוצץ פוספט (PBS)21.
- סנן 500 מ"ל של אצטוניטריל טהור כרומטוגרפית (שלב נייד A) באמצעות ממברנה אורגנית של 0.45 מיקרומטר.
- הכן 1000 מ"ל של שלב B נייד על ידי הוספת 3.5 מ"ל של מגיב I ל-1 ליטר מים נטולי יונים. התאם את ה-pH ל-6.15 עם מגיב II, בהתאם להוראות ערכת בדיקת תוכן הנוקלאוטיד (ATP, ADP ו-AMP) (ראה טבלת חומרים).
הערה: מגיב I ומגיב II כלולים בערכת בדיקת תוכן הנוקלאוטידים (ATP, ADP ו-AMP). - סנן שלב נייד B באמצעות ממברנה מימית של 0.22 מיקרומטר.
הערה: יש להשתמש בשלב B נייד מיד לאחר ההכנה. יש לבצע סוניקציה של שלבים ניידים A ו-B למשך 30 דקות לפני השימוש כדי להסיר בועות אוויר. - יש לדלל תמיסת מלאי סטנדרטית של 1 μM ATP, ADP ו-AMP עם מים דה-יונים כדי להשיג פתרונות סטנדרטיים של סדרות ATP, ADP ו-AMP של 0.5 μM, 0.1 μM, 0.05 μM, 0.01 μM ו-0.005 μM.
- סנן את סדרת התמיסות הסטנדרטיות באמצעות ממברנת מסנן מיקרו-נקבובית מסוג מחט של 0.22 מיקרומטר.
הערה: יש להשתמש בבקבוקי הזרקה חומים לאחסון הפתרונות הסטנדרטיים הסדרתיים. יש להשתמש בסדרת הפתרונות הסטנדרטיים המוכנה בהקדם האפשרי.
2. תרבית תאים
הערה: תרבית תאים HT22 ומודל ההיפוקסיה המגורה CoCl2 הוקמו על פי דוח קודם21.
- תרבית תאי HT22 ב-37 מעלות צלזיוס עם 5% CO2 עד שמגיעים למפגש של 80% בצלחת הפטרי. עכל את התאים עם 0.25% טריפסין למשך דקה.
- זרע 2 × 105 תאים משלב 2.1 לצלחות של 6 בארות עם DMEM מלא (קבוצת ביקורת ללא טיפול תרופתי) או DMEM מלא המכיל את התרופה (250 מיקרומטר CoCl2, 250 מיקרומטר CoCl2 + 10 מיקרומטר דור, 250 מיקרומטר CoCl2 + 20 מיקרומטר סאל, ו -250 מיקרומטר CoCl2 + 10 מיקרומטר דור + 20 מיקרומטר סאל). דגירה למשך 24 שעות בטמפרטורה של 37 מעלות צלזיוס עם 5%CO2.
הערה: שלוש דגימות מקבילות הוקמו בכל קבוצה.
3. בדיקת תוכן נוקלאוטידים (ATP, ADP ו-AMP)
- הוסף 1 מ"ל של מגיב מיצוי I לכל באר בצלחות 6 הבארות משלב 2.2.
הערה: מגיב מיצוי I כלול בערכת בדיקת תוכן הנוקלאוטידים (ATP, ADP ו-AMP) (ראה טבלת חומרים). - ליזה את התאים על ידי סוניקציה על אמבט קרח באמצעות מנגנון שיבוש תאים קולי (הספק: 300 וואט, גלים קוליים למשך 3 שניות, מרווח של 7 שניות, זמן כולל: 3 דקות).
- צנטריפוגה של התאים הליזים ב-10,304 × גרם למשך 10 דקות ב-4 מעלות צלזיוס באמצעות צנטריפוגה מקוררת במהירות גבוהה.
- העבירו 0.75 מ"ל של סופרנטנט משלב 3.3 לצינור של 2.0 מ"ל. מוסיפים 0.75 מ"ל של מגיב מיצוי II, מנערים ומערבבים בעזרת מערבל מערבולת, וצנטריפוגה שוב ב-10,304 × גרם למשך 10 דקות ב-4 מעלות צלזיוס.
הערה: מגיב מיצוי II כלול בערכת בדיקת תוכן הנוקלאוטידים (ATP, ADP ו-AMP). - פיפט את הסופרנטנט משלב 3.4 וסנן אותו באמצעות קרום מסנן מיקרופורי מסוג מחט של 0.22 מיקרומטר לתוך בקבוקון חום.
הערה: ATP, ADP ו-AMP בדגימה שחולצה אינם יציבים. יש לבצע את כל ההליכים הניסיוניים בטמפרטורות נמוכות או על קרח. יש לעבד ולבדוק דגימות בהקדם האפשרי. - פתח את תוכנת הכרומטוגרפיה והגדר את הפרמטרים הבאים: נפח הזרקה: 10 מיקרוליטר; טמפרטורת עמודה: 27 מעלות צלזיוס; קצב זרימה: 0.8 מ"ל לדקה; אורך גל זיהוי: 254 ננומטר; משך הזיהוי: 70 דקות. הגדר את הליך שיפוע השיפוע לפי טבלה 1.
- לחץ על כפתור הביצוע כדי להזריק אוטומטית את הדגימה ולזהות את התוכן של ATP, ADP ו-AMP בפתרונות סטנדרטיים טוריים (שלב 1.7) ופתרונות לדוגמה (שלב 3.5) בהתאם לתוכנית שהוגדרה בשלב 3.6.
הערה: בסוף הניסוי יש לשטוף את העמודה הכרומטוגרפית עם 98% שלב B נייד כדי למנוע סתימה. - שרטטו את העקומות הסטנדרטיות של ATP, ADP ו-AMP באמצעות תוכנות גרפים וניתוח סטטיסטי, עם ריכוזים סטנדרטיים סדרתיים על ציר ה-x ואזורי שיא על ציר ה-y.
- חשב את תוכן ה-ATP, ADP ו-AMP בדגימות באמצעות משוואת העקומה הסטנדרטית משלב 3.8.
4. בדיקת הסטה תרמית סלולרית (CETSA)
- תאי HT22 רגילים במשך 20 דקות בצלחת פטרי באמצעות ליזאט המכיל מעכב פרוטאז (ליזאט: מעכב פרוטאז = 100:1) על ידי פיפטינג חוזר ונשנה של התאים.
הערה: בצע שלב זה על אמבט קרח כדי למנוע פירוק חלבון. - אסוף את הליזאט של התא משלב 4.1 וסוניקט על אמבט קרח באמצעות מנגנון שיבוש תאים קולי (הספק: 300 וואט, גלים קוליים למשך 3 שניות, מרווח של 7 שניות, זמן כולל: 3 דקות). צנטריפוגה בטמפרטורה של 10,304 × גרם, 4 מעלות צלזיוס למשך 20 דקות ואוספים את הסופרנטנט.
הערה: חלקו את הסופרנטנט ל-14 מנות: 7 קבוצות לדגירת מטבעות עם סאל ו-7 קבוצות לדגירת מטבעות עם PBS כבקרה. עבור הקבוצה שטופלה בסאל, הוסף 100 מיקרוליטר של סופרנטנט ו-0.1 מיקרוליטר של 20 מיקרומטר סאל לדגימה. עבור קבוצת הביקורת, הוסף 100 מיקרוליטר של סופרנטנט ו-0.1 מיקרוליטר של PBS לכל דגימה. - דגרו כל דגימה בטמפרטורת החדר למשך 30 דקות, ולאחר מכן דגרו עוד ב-37 מעלות צלזיוס, 42 מעלות צלזיוס, 47 מעלות צלזיוס, 52 מעלות צלזיוס, 57 מעלות צלזיוס, 62 מעלות צלזיוס ו-67 מעלות צלזיוס למשך 3 דקות באמצעות מכשיר בקרת טמפרטורת חימום מתכת.
- צנטריפוגה את הדגימות משלב 4.3 ב-10,304 × גרם למשך 20 דקות ב-4 מעלות צלזיוס ואוספים את הסופרנטנט באמצעות פיפטה.
- מדדו את ריכוז החלבון הכולל של הסופרנטנט משלב 4.4 באמצעות ערכת בדיקת ריכוז חלבון BCA, בהתאם להוראות היצרן (ראו טבלת חומרים).
- הכינו ג'ל הפרדה של 10% באמצעות ערכת הכנה מהירה של ג'ל PAGE, בהתאם להוראות היצרן (ראו טבלת חומרים).
- טען 3 מיקרוליטר של סמן חלבון צבעוני מוכתם מראש ו-14 מיקרוליטר דגימות לבארות של ג'ל ההפרדה (כמות חלבון סופית לבאר: 20 מיקרוגרם).
- הפעל את הג'ל באמצעות מאגר אלקטרופורזה למשך שעה אחת ב-80-100 mV כדי להשיג חלבונים מופרדים.
- העבירו את החלבונים משלב 4.8 לקרום PVDF באמצעות תמיסת העברת ממברנה מהירה ומבנה סנדוויץ' (נייר פילטר כותנה-PVDF ממברנה-חלבון ג'ל-פילטר נייר-כותנה) ב-400 mA למשך 30 דקות.
- חסום את ממברנות ה-PVDF משלב 4.9 עם תמיסת אלבומין בסרום בקר (BSA) של 5% למשך 1-2 שעות בטמפרטורת החדר.
הערה: הכן תמיסת BSA של 5% על ידי המסת 5 מ"ג אבקת BSA ב-100 מ"ל של תמיסת TBST המכילה 100 מ"ל של מאגר TBS ו-0.05% Tween 20. - דגרו את ממברנות ה-PVDF משלב 4.10 עם נוגדן ראשוני מדולל של 5 מ"ל ב-4 מעלות צלזיוס למשך הלילה.
הערה: יש לדלל את הנוגדן העיקרי בתמיסת BSA (יחס של 1:1000). - שטפו את ממברנות ה-PVDF שלוש פעמים עם TBST למשך 5 דקות כל אחת כדי להסיר נוגדנים ראשוניים לא קשורים.
- דגרו את הממברנות משלב 4.12 עם נוגדן משני מדולל מצמד חזרת פרוקסידאז (HRP) למשך שעתיים בטמפרטורת החדר על שייקר להסרת צבע.
הערה: יש לדלל את הנוגדן המשני המחובר ל-HRP בתמיסת BSA (יחס של 1:10,000). - שטפו את הממברנות שלוש פעמים עם TBST למשך 5 דקות כל אחת כדי להסיר שאריות נוגדנים משניים.
- כסו את הממברנות משלב 4.14 עם מפתח כימילומינסנציה ECL, ולאחר מכן דמו את אות חלבון המטרה באמצעות מערכת הדמיה.
הערה: בצע שלב זה בחושך כדי למנוע כיבוי פלואורסצנטי. - לנתח ולכמת את הערך האפור של חלבוני מטרה באמצעות תוכנת ImageJ (ראה T able של חומרים).
תוצאות
העקומות הסטנדרטיות עבור ATP, ADP ו-AMP שזוהו על ידי HPLC היו Y = 7006.5X - 222.99, Y = 5217.3X - 17.796 ו-Y = 9280.1X + 22.749, בהתאמה (איור 1A-C). תכולת הנוקלאוטידים שנמדדה בכל קבוצה על ידי HPLC חושבה באמצעות העקומות הסטנדרטיות (איור 1D-I). נמצא כי CoCl2 הפחית משמעותית את רמות ה-ATP וה-ADP בתאי HT22 בהשוואה לקבוצת הביקורת (P < 0.01, איור 1J,K). יתר על כן, מתן דורסומורפין (דור), מעכב AMPK, הוביל לירידה ניכרת ברמות ה-ATP וה-ADP בהשוואה לקבוצה שטופלה ב-CoCl2 (P < 0.01, איור 1J,K). עם זאת, טיפול בסאל העלה משמעותית את רמות ה-ATP וה-ADP ביחס לקבוצה שטופלה ב-CoCl2 (P < 0.05, איור 1J,K).
ניתוח נוסף גילה שרמות AMP עלו באופן משמעותי בקבוצה שטופלה ב-CoCl2, בעוד שטיפול ב-Sal הגביל ביעילות את העלייה הזו (P < 0.01, איור 1L). תפקוד תקין של המיטוכונדריה חיוני לשמירה על הומאוסטזיס תוך-תאי של ATP, ADP ו-AMP, כמו גם על תפקודים פיזיולוגיים תאיים תקינים. המצב התפקודי של המיטוכונדריה משפיע ישירות על קצב ההמרה והאיזון של ATP, ADP ו-AMP. נזק או תפקוד לקוי של המיטוכונדריה עלולים לפגוע בסינתזת ATP ולהפחית את שיעורי ההמרה של ADP ו-AMP, ובכך לשבש את אספקת האנרגיה התאית ואת האיזון המטבולי.
ממצאים אלה מצביעים על כך ש-Sal עשוי להקל על פגיעה היפוקסית בתאי HT22 על ידי אפנון המרת ATP, ADP ו-AMP. בנוסף, ניתוח CETSA של קשירת Sal לחלבונים הקשורים למיטוכונדריה הראה עלייה ביציבות התרמית של AMPKα, p-AMPKα, Sirt1 ו-HIF-1α לאחר טיפול ב-Sal. זה מצביע על כך ש-Sal עשוי לקיים אינטראקציה עם חלבונים אלה (איור 2), בהתאם לממצאים ממחקרים קודמים 21,23,24.
זמינות נתונים:
כל הנתונים הגולמיים מסופקים (קובץ משלים 1 וקובץ משלים 2).

איור 1: השפעת Sal על תכולת נוקלאוטידים (ATP, ADP ו-AMP). (A-C) עקומות סטנדרטיות עבור ATP (A), ADP (B) ו-AMP (C). (ד-י) עקומות HPLC מייצגות לקביעת תכולת ATP, ADP ו-AMP על פני קבוצות טיפול שונות. (י-ל) ניתוח סטטיסטי של תכולת ATP, ADP ו-AMP בקבוצות טיפול שונות (ביקורת, 250 מיקרומטר CoCl2, 250 מיקרומטר CoCl2 + 10 מיקרומטר דור, 250 מיקרומטר CoCl2 + 20 מיקרומטר סאל, ו-250 מיקרומטר CoCl2 + 10 מיקרומטר דור + 20 מיקרומטר סאל). (n = 3, *P < 0.05, **P < 0.01). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
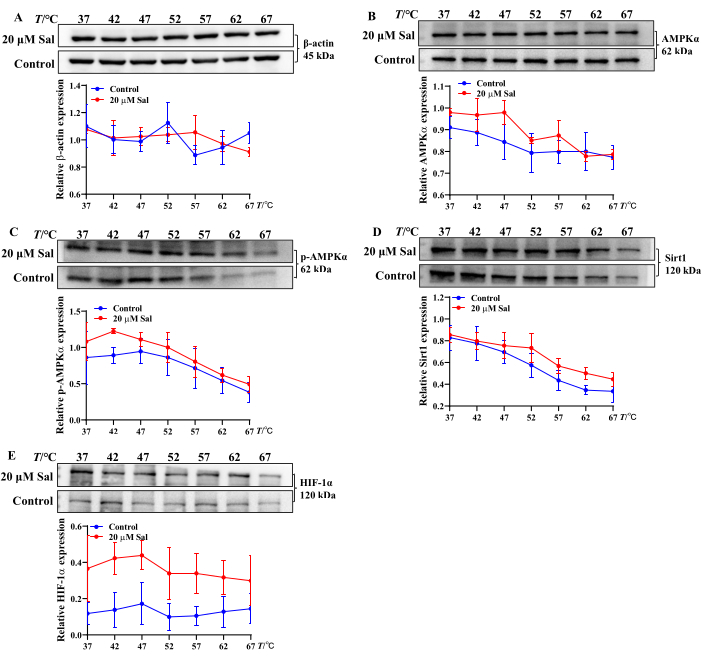
איור 2: הערכת מאפייני קשירת Sal לחלבונים הקשורים למסלול AMPK/Sirt1/HIF-1α באמצעות שיטת KETSA. β-אקטין (A), AMPKα (B), p-AMPKα (C), Sirt1 (D) ו-HIF-1α (E) ומגמות ביטוי בתאי HT22 הוערכו על ידי CETSA (n = 3). תכונות הקישור של Sal עם חלבונים שונים נותחו באמצעות תוכנות סטטיסטיות וגרפים בטמפרטורות משתנות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| זמן (דקות) | שלב נייד | |
| ממס א | ממס B | |
| 0 | 2% | 98% |
| 10 | 2% | 98% |
| 15 | 70% | 30% |
| 50 | 70% | 30% |
| 55 | 2% | 98% |
| 70 | 2% | 98% |
טבלה 1: נוהל שטיפת שלב נייד.
קובץ משלים 1: נתונים גולמיים לזיהוי ATP, ADP ו-AMP על ידי HPLC. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 2: רצועות חלבון KETSA. אנא לחץ כאן להורדת קובץ זה.
Discussion
מיטוכונדריה הם אברוני מפתח המעורבים במניעה טיפולית של HHBI 23,24,25. מחקרים קודמים של הקבוצה אישרו כי Sal מווסת את ביטוי החלבונים AMPK, Sirt1 ו-HIF-1α, משפר את תפקוד המיטוכונדריה העצבי ומגן מפני HHBI21,24. עם זאת, ההשפעה הישירה של Sal על נוקלאוטידים בתאים היפוקסיים דורשת חקירה נוספת. בנוסף, הערכת פוטנציאל הקישור של תרכובות וחלבונים בתנאי טמפרטורה משתנים חיונית להבנת האינטראקציות ביניהם.
כדי לטפל בהיבטים אלה, המחקר הנוכחי בחן את ההשפעה של Sal על רמות ATP, ADP ו-AMP מיטוכונדריאלי בתאי HT22 באמצעות HPLC, ומספק תובנה ישירה לגבי תפקידו בחילוף החומרים של האנרגיה המיטוכונדריאלית. בהתבסס על מחקר קודם18, 250 מיקרומטר של CoCl2 נבחרו כדי לגרום להיפוקסיה בתאי HT22. התוצאות הראו ש-Sal העלה באופן משמעותי את רמות ה-ATP וה-ADP תוך הפחתת תכולת ה-AMP בתאי HT22 היפוקסיים (איור 1). בשילוב עם ממצאים קודמים מהקבוצה, תוצאות אלה מאשרות עוד יותר כי לסאל יש השפעה מגנה על המיטוכונדריה בתאי עצב היפוקסיים.
AMPK הוא חלבון קינאז שמור מאוד באיקריוטים המווסת את חילוף החומרים האנרגטי. הוא חש שינויים ברמות ATP, ADP ו-AMP בתא כדי לתאם את חילוף החומרים של גלוקוז, סינתזת חומצות שומן וביוגנזה מיטוכונדריאלית על ידי זרחון מצעים שונים26. הפעלת AMPK מקדמת ייצור אנרגיה ומדכאת את הוצאת האנרגיה, במיוחד בתגובה לרמות ATP תוך-תאיות מופחתות ורמות AMP גבוהות27. בנוסף, AMPK משפר את עתודות ה-ATP על ידי זרחון גלוקועמילאז, שינוי קטליזה אנזימטית וייצור מהיר של ATP ממאגר הפוספוארגינין-ארגינין28.
במחקר הנוכחי נעשה שימוש בדור, מעכב AMPK זרחני סלקטיבי, כדי לחקור את ההשפעות של Sal על רמות הנוקלאוטידים29. HPLC שימש לכימות רמות ATP, ADP ו-AMP בתאי HT22 שטופלו ב-CoCl2 שנחשפו ל-Dor לבד או בשילוב עם Sal. הממצאים מצביעים על כך ש-Sal מווסת את היחס ATP/ADP/AMP, ובכך מפעיל השפעות נוירו-פרוטקטיביות מפני היפוקסיה (איור 1). שיטת HPLC המבוססת מספקת גישה אינטואיטיבית, פשוטה ויעילה להערכה ישירה של ההשפעות של תרכובות ביו-אקטיביות על נוקלאוטידים ברמה התאית.
HIF-1α הוא גורם שעתוק המופעל בתגובה לגירוי היפוקסי. בתנאים היפוקסיים, היציבות של HIF-1α עולה משמעותית, ומאפשרת לו לעבור מהציטופלזמה לגרעין, שם הוא יוצר הטרודימר עם HIF-1β30. תהליך זה מקדם את ביטוי הגנים המעורבים באנגיוגנזה, מטבוליזם של גלוקוז וגליקוליזה 31,32,33. בנוסף, הוכח כי יציבות HIF-1α נמצאת בקורלציה גבוהה עם תפקוד המיטוכונדריה ורמות O2 תוך תאיות במהלך זרחון חמצוני31. עם זאת, תפקוד לקוי של המיטוכונדריה הנגרמת על ידי היפוקסיה מוביל לאספקת אנרגיה תוך-תאית לא מספקת, אשר בתורו מפעילה את מסלול HIF-1α לוויסות הסתגלות תאית להיפוקסיה31,32.
Sirt1, בן למשפחת Sirtuin, הוא דאצטילאז תלוי NAD+ המפחית את יציבות חלבון HIF-1α על ידי דה-אצטילציה, ובכך מגביל את הצטברות הגרעין שלו32. בתנאים היפוקסיים, ירידה ברמות ה-ATP התוך תאיות מובילה לפעילות מוגברת של AMPK, המשפיעה על ההובלה התוך-תאית, היציבות ופעילות השעתוק של HIF-1α והחלבונים הקשורים אליו באמצעות זרחון 31,32,33. בנוסף, Sirt1 ו-AMPK מווסתים את האינטראקציה בין HIF-1α לקו-אקטיבטורים, ובכך מווסתים את פעילות השעתוק שלו ומקלים עוד יותר על הסתגלות תאית להיפוקסיה33. בתאי מוח שנפגעו מהיפוקסיה, AMPK, Sirt1 ו-HIF-1α מתקשרים כדי לשמור על הומאוסטזיס אנרגיה תוך תאית ולווסת תהליכים מטבוליים.
שיטות פשוטות ויעילות להערכת היציבות התרמית ופוטנציאל הקישור של קומפלקסים של תרכובת-חלבון במבחנה כוללות טכניקות המעריכות את יציבות החלבונים בעת קשירת ליגנד. ידוע היטב כי אינטראקציות תרכובת-חלבון מגבירות את היציבות התרמית של חלבונים, מה שהופך אותם לפחות רגישים לדנטורציית טמפרטורה וכתוצאה מכך תפוקת חלבון יציבה יחסית. בדיקת ההסטה התרמית התאית (CETSA) בשילוב עם ניתוח כתמים מערביים, למרות שאינה חושפת את אתר הקישור המדויק, מספקת גישה בעלות נמוכה ויעילה לחקר אינטראקציות בין תרופות למטרה והשפעות פוטנציאליות מחוץ למטרה22,34. CETSA נמצא בשימוש נרחב כדי לאמת ולכמת מעורבות מטרה של תרופות בתאים וברקמות על פני מינים שונים.
במחקר זה, נעשה שימוש ב-CETSA כדי להעריך אם Sal מקיים אינטראקציה עם AMPKα, p-AMPKα, Sirt1 ו-HIF-1α ברמה התאית. לאחר טיפול בחום, Sal הגדיל את הביטוי של חלבונים אלה, מה שמרמז על היווצרות קומפלקסים יציבים של Sal-AMPKα, Sal-p-AMPKα, Sal-Sirt1 ו-Sal-HIF-1α (איור 2). ממצאים אלה עולים בקנה אחד עם תוצאות ניסויים קודמות21,24. CETSA-western blot משמש אפוא כגישה חזקה ויעילה לסינון בקנה מידה גדול של אינטראקציות תרכובת-חלבון ויציבות תרמית במבחנה.
למרות התובנות שהתקבלו לגבי מנגנוני ההגנה של סאל על חילוף החומרים של אנרגיה מיטוכונדריאלית באמצעות טכניקות HPLC ו-KETSA, נותרו מגבלות מסוימות. CETSA אינו מספק מידע ברמת חומצות האמינו לגבי האופן שבו תרכובות משפיעות על יציבות החום של החלבון. התקדמות פוטנציאלית תהיה שילוב של CETSA עם טכנולוגיות הדמיה לזיהוי חזותי של אתרי קשירת תרכובות בתוך חלבונים, המציע הבנה ברורה יותר של האופן שבו קומפלקסים של חלבונים מתנגדים לדנטורציה הנגרמת על ידי חום. השגת מטרה זו דורשת חדשנות מדעית נוספת ותכנון ניסויים מעודן. בנוסף, השלמת CETSA עם טכניקות אינטראקציה מולקולרית אחרות, כגון תהודה מקומית של פלזמון פני השטח ופלואוריום סריקה דיפרנציאלי, תספק ניתוח מקיף יותר של אינטראקציות תרכובת-חלבון35.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (82274207 ו-82474185), מחלקת המדע והטכנולוגיה של מחוז סצ'ואן (2024NSFSC1845), קרן המדע לנוער של מחלקת המדע והטכנולוגיה של מחוז סצ'ואן (2023NSFSC1776), תוכנית המחקר והפיתוח המרכזית של נינגשיה (2023BEG02012), פרויקט התמיכה בכישרונות נוער של האגודה הסינית לרפואה סינית לשנים 2024-2026 (2024-QNRC2-B07) ומחקר שינגלין פרויקט קידום של אוניברסיטת צ'נגדו לרפואה סינית מסורתית (XKTD2022013 ו-QJJJ2024027).
תרומת המחבר:
שיאובו וואנג, יאטינג ג'אנג, יה הו, רוי לי ושיאנלי מנג הגו את הפרויקט הזה. יטינג ג'אנג, יה הו וטינגטינג קואנג ביצעו את הניסויים וניתחו את הנתונים. יאטינג ג'אנג והונג ג'יאנג כתבו את כתב היד. שיאובו וואנג ושיאנלי מנג תיקנו את כתב היד. כל המחברים קראו ואישרו את כתב היד הסופי.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Aladdin | A104440 | |
| 0.22 µm aqueous membrane | Jinteng | JTMF0445 | |
| 0.22 µm needle type microporous filter membrane | Jinteng | JTSFM013001 | |
| 0.45 µm organic membrane | Jinteng | JTMF0448 | |
| Agilent OpenLab software | Agilent | Version 2.X | |
| Antibody-AMPKα | Cell Signaling Technology | #2532 | |
| Antibody-HIF-1α | Cell Signaling Technology | #41560 | |
| Antibody-p-AMPKα | Cell Signaling Technology | #50081 | |
| Antibody-Sirt1 | Cell Signaling Technology | #2028 | |
| Antibody-β-actin | Cell Signaling Technology | #4970 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine serum albumin | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW127-02 | |
| Broad-spectrum phosphatase inhibitor (100×) | Boster Biological Technology | AR1183 | |
| Chromatographic column | Agilent | SB-C18 | |
| CoCl2 | Sigma | 15862 | |
| Decolorization shaker | Kylin-Bell | TS-2 | |
| Dorsomorphin | MedChemExpress (MCE) | HY-13418A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Goat Anti-rabbit IgG H&L (TRITC) | ZenBioScience Co., Ltd. | 511202 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| HRP conjugated affinipure goat anti-rabbit IgG(H+L) | Boster Biological Technology Co., Ltd. | BA1054 | |
| HT22 cells | Guangzhou Jennio Biotech Co., Ltd. | JNO-02001 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| Image J software | National Institutes of Health | v1.8.0 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Nucleotide (ATP, ADP, and AMP) content assay kit | Beijing Solarbio Science & Technology Co., Ltd. | BC5114 | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Penicillin-streptomycin | NCM Biotech | C125C5 | |
| Phosphate buffered saline (1×) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5x) | Boster Biological Technology | AR1112 | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| Salidroside | Chengdu Herbpurify Co., Ltd. | RFS-H0400191102 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1×) | HyClone | J210045 | |
| Tween 20 | Shanghai Canspec Scientific Instruments Co., Ltd. | PM12012 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Visionworks imaging system | Analytik Jena | UVP ChemStudio | |
| Vortex mixer | Kylin-Bell | XW-80A |
References
- Marutani, E., Ichinose, F. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12 (1), 3108(2021).
- Chen, X., Ma, W., Li, Y. Current situation of Chinese and Western medicine research on hypoxic brain injury at high altitude. Jilin Medical J. 43 (11), 3099-3101 (2022).
- Huo, Y., Zhao, A., Li, X., Li, J., Wang, R. Animal models of acute plateau disease. Chinese Pharmacol Bull. 37 (01), 26-30 (2021).
- Netzer, N., Strohl, K., Faulhaber, M., Gatterer, H., Burtscher, M. Hypoxia-related altitude illnesses. J Travel Med. 20 (4), 247-255 (2013).
- Lefferts, W. K., et al. Effect of hypoxia on cerebrovascular and cognitive function during moderate intensity exercise. Physiol Behav. 165, 108-118 (2016).
- Burtscher, J., Mallet, R. T., Burtscher, M., Millet, G. P. Conditioning the brain: From exercise to hypoxia. Exerc Sport Sci Rev. 49 (4), 291-292 (2021).
- Koester-Hegmann, C., et al. High-altitude cognitive impairment is prevented by enriched environment including exercise via VEGF signaling. Front Cell Neurosci. 12, 532(2019).
- Coimbra-Costa, D., Alva, N., Duran, M., Carbonell, T., Rama, R. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain. Redox Biol. 12, 216-225 (2017).
- Nair, S., et al. Neuroprotection offered by mesenchymal stem cells in perinatal brain injury: Role of mitochondria, inflammation, and reactive oxygen species. J Neurochem. 158 (1), 59-73 (2021).
- Rodríguez, M., Valez, V., Cimarra, C., Blasina, F., Radi, R. Hypoxic-Ischemic encephalopathy and mitochondrial dysfunction: facts, unknowns, and challenges. Antioxid Redox Sign. 33 (4), 247-262 (2020).
- Li, T., et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice. Cell Death Dis. 11 (1), 77(2020).
- March-Diaz, R., et al. Hypoxia compromises the mitochondrial metabolism of Alzheimer's disease microglia via HIF1. Nature Aging. 1 (4), 385-399 (2021).
- Aabdien, A., Mallard, C., Hagberg, H. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury. FEBS Lett. 592 (5), 812-830 (2018).
- Bai, X. L., Deng, X. L., Wu, G. J., Li, W. J., Jin, S. Rhodiola and salidroside in the treatment of metabolic disorders. Mini-Rev Med Chem. 19 (19), 1611-1626 (2019).
- Ji, R., et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN. Arch Biochem Biophys. 715, 109094(2022).
- You, L., Zhang, D., Geng, H., Sun, F., Lei, M. Salidroside protects endothelial cells against LPS-induced inflammatory injury by inhibiting NLRP3 and enhancing autophagy. BMC Complement Med. 21 (1), 146(2021).
- Yang, S. X., et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice. Phytomedicine. 114, 154762(2023).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568(2023).
- Yang, H., et al. Black soybean peptide mediates the AMPK/SIRT1/NF-κB signaling pathway to alleviate Alzheimer's-related neuroinflammation in lead-exposed HT22 cells. Int J Biol Macromol. 286, 138404(2025).
- Yoon, H., Shin, S. H., Shin, D. H., Chun, Y. S., Park, J. W. Differential roles of Sirt1 in HIF-1α and HIF-2α mediated hypoxic responses. Biochem Bioph Res Co. 444 (1), 36-43 (2014).
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529(2024).
- Jafari, R., et al. The cellular thermal shift assay for evaluating drug target interactions in cells. Nat Protoc. 9 (9), 2100-2122 (2014).
- Tang, Y., et al. Salidroside attenuates CoCl2-simulated hypoxia injury in PC12 cells partly by mitochondrial protection. Eur J Pharmacol. 912, 174617(2021).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J Ethnopharmacol. 293, 115278(2022).
- Kristián, T. Metabolic stages, mitochondria and calcium in hypoxic/ischemic brain damage. Cell Calcium. 36 (3-4), 221-233 (2004).
- Carling, D. AMPK signalling in health and disease. Curr Opin Cell Biol. 45, 31-37 (2017).
- Steinberg, G. R., Hardie, D. G. New insights into activation and function of the AMPK. Nat Rev. Mol Cell Bio. 24 (4), 255-272 (2023).
- Zhang, N., et al. Restoration of energy homeostasis under oxidative stress: Duo synergistic AMPK pathways regulating arginine kinases. PLoS Genet. 19 (8), e1010843(2023).
- Wang, Y., et al. Irisin ameliorates neuroinflammation and neuronal apoptosis through integrin αVβ5/AMPK signaling pathway after intracerebral hemorrhage in mice. J Neuroinflamm. 19 (1), 82(2022).
- Liu, H., Li, Y., Xiong, J. The role of hypoxia-inducible factor-1 alpha in renal disease. Molecules. 27 (21), 7318(2022).
- Wu, H., et al. Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming. Nat Commun. 14 (1), 6858(2023).
- Joo, H. Y., et al. NADH elevation during chronic hypoxia leads to VHL-mediated HIF-1α degradation via SIRT1 inhibition. Cell Biosci. 13 (1), 182(2023).
- Ham, P. B., Raju, R. Mitochondrial function in hypoxic ischemic injury and influence of aging. Prog Neurobiol. 157, 92-116 (2017).
- Dal Cortivo, G., Barracchia, C. G., Marino, V., D'Onofrio, M., Dell'Orco, D. Alterations in calmodulin-cardiac ryanodine receptor molecular recognition in congenital arrhythmias. Cell Mol Life Sci. 79 (2), 127(2022).
- Wang, Z. Q., et al. Cyclovirobuxine D inhibits triple-negative breast cancer via YAP/TAZ suppression and activation of the FOXO3a/PINK1-Parkin pathway-induced mitophagy. Phytomedicine. 136, 156287(2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved